修回日期: 2006-10-02
接受日期: 2006-10-18
在线出版日期: 2006-12-18
目的: 探讨胃癌患者中耐药基因P-糖蛋白(P-gp)、DNA拓扑异构酶Ⅱ(TopoⅡ)和谷胱苷肽-S转移酶(GST-π)的表达特点及对预后的影响.
方法: 免疫组化方法检测130例胃癌组织中的P-gp, TopoⅡ及GST-π, 分析其与临床病理特征的关系, 并随访部分患者以研究其表达与预后的相关性.
结果: 在130例胃癌患者中, P-gp, TopoⅡ和GST-π表达的阳性率分别为24.62%, 81.54%和75.38%. 这3种耐药基因中, P-gp和GST-π与病变大小相关, 病变直径>5 cm患者中, 其阳性率显著高于直径<5 cm患者(χ2 = 4.56, P = 0.033; χ2 = 5.545, P = 0.020), 有淋巴结转移患者P-gp的阳性表达率高于无淋巴结转移组(χ2 = 5.84, P = 0.016), 有血管侵犯患者P-gp和GST-π阳性表达率高于无血管侵犯患者(χ2 = 17.69, P<0.001; χ2 = 5.40, P = 0.020), P-gp和GST-π表达为++~+++患者2年生存率明显低于-~+患者(χ2 = 3.964, P = 0.047; χ2 = 4.2576, P = 0.039); TopoⅡ的表达与病理类型及分化程度有关, 在印戒细胞癌中表达率低于其他类型(χ2 = 7.29, P = 0.007), 且在低分化组中强阳性表达率明显低于中高分化组(χ2 = 7.79, P = 0.005).
结论: P-gp和GST-π的表达不仅与胃癌的生物学行为有关, 同时也可作为判断胃癌患者预后的指标之一. 耐药基因在胃癌中的表达程度及特点不同, 因而有必要对其进行联合检测以判断耐药及预后情况.
引文著录: 关云艳, 欧希龙, 郭庆明, 颜芳. P-gp, ToPoⅡ和GST-π在胃癌组织中的表达及与预后的关系. 世界华人消化杂志 2006; 14(35): 3371-3376
Revised: October 2, 2006
Accepted: October 18, 2006
Published online: December 18, 2006
AIM: To investigate the expression characteristics of P-glycoprotein (P-gp), topoisomerase Ⅱ (TopoⅡ) and glutathione S-transferase π (GST-π) in gastric carcinoma as well as their effects on the prognosis of patients.
METHODS: The expression of P-gp, TopoⅡ and GST-π in 130 patients with gastric carcinoma were detected by immunohistochemistry and some patients were followed up for more than two years to analyze the relationship between the expression of P-gp, TopoⅡ and GST-π and the clinical prognosis of patients.
RESULTS: The positive rate of P-gp, TopoⅡ and GST-π expression in gastric carcinoma were 23.85%, 80.77% and 75.38% respectively. The expression of P-gp and GST-π were associated with tumor size, and the positive rates of P-gp and GST-π in patients with tumor size more than 5 cm in diameter were significantly higher than those in ones with tumor size less than 5 cm in diameter (χ2 = 4.56, P = 0.033; χ2 = 5.545, P = 0.020). P-gp and GST-π expression were also correlated with the vessel invasion (invasion vs non-invasion: χ2 = 17.69, P < 0.001; χ2 = 5.40, P = 0.020) and 2-year survival rate (++~+++ vs -~+: χ2 = 3.964, P = 0.047; χ2 = 4.2576, P = 0.039). The positive rate of P-gp expression was markedly higher in patients with lymph node metastasis than that in ones without metastasis (χ2 = 5.84, P = 0.016). The expression of TopoⅡ was associated with the types and differentiations of histology. The positive rate of TopoⅡ in patients with signet-ring cell carcinoma was obviously lower than that in ones with other kinds of carcinoma (χ2 = 7.29, P = 0.007), and it was apparently lower in lowly-differentiated carcinoma than that in highly- and moderately-differentiated ones (χ2 = 7.79, P = 0.005).
CONCLUSION: The expression of P-gp and GST-π can be regarded as prognostic factors in gastric carcinoma. Combined detection is necessary for evaluating the degree of drug resistance and prognosis of patients.
- Citation: Guan YY, Ou XL, Guo QM, Yan F. Expression of P-glycoprotein, topoisomeraseⅡ and glutathione S-transferase π in gastric carcinoma and their correlations with clinical prognosis. Shijie Huaren Xiaohua Zazhi 2006; 14(35): 3371-3376
- URL: https://www.wjgnet.com/1009-3079/full/v14/i35/3371.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i35.3371
在我国, 胃癌是导致死亡人数最多的恶性肿瘤[1]. 对于此病的治疗, 化疗具有清除术后癌细胞的残留及防止复发的作用, 但目前应用的多种药物及多种方案的总体疗效并不理想, 原因在于癌细胞对某些药物具有内在耐药性. 另外, 据美国癌症协会统计资料表明, 90%肿瘤患者的死亡不同程度地受到耐药的影响. 可见, 肿瘤耐药已成为当今肿瘤治疗中亟待解决的问题. 目前, 由于耐药基因在肿瘤组织的表达上研究结果不一致, 故应进一步行反复多样本的研究. 为此, 我们应用免疫组化方法检测了130例胃癌手术标本中的耐药基因的蛋白表达情况, 并分析了其与该肿瘤病理特征之间的关系及对预后的影响.
选自东南大学附属中大医院2001-04/2004-04期间进行手术的胃癌患者共130例, 均有完整的临床及病理资料, 所有患者术前均未行化疗或其他针对肿瘤的治疗. 对部分患者进行了2年以上的随访. 由于临床分期、病理分化程度均对预后有较大的影响, 故为尽可能减少混杂偏倚, 在研究耐药基因蛋白表达情况与预后的关系时, 选择病理为低分化、临床分期为Ⅲ、Ⅳ期的患者52例进行了随访, 这些患者术后根据检测结果选用以5-氟尿嘧啶(5-FU)为基础的联合化疗, 第一年为3个疗程, 第二年为两个疗程, 个体间的每一疗程及间隔时间相同, 如患者未死亡则持续2年. 总体患者中男101例, 女29例, 年龄32-85(平均56.22)岁; 病变直径≥5 cm者60例, <5 cm者70例; 根据TNM临床分期标准, Ⅰ期20例, Ⅱ期26例, Ⅲ期81例, Ⅳ期3例; 有淋巴结转移的87例, 无转移的43例; 侵犯血管形成癌栓者42例, 未侵犯血管者88例, 病理类型显示, 乳头状腺癌和管状腺癌分别为53例、62例(其中低分化者59例), 黏液腺癌2例, 印戒细胞癌13例. 随访的患者中男39例, 女13例, 年龄39-85(平均59.34)岁; 病变直径≥5 cm者32例, <5 cm者20例; 临床分期中Ⅲ期50例, Ⅳ期2例; 有淋巴结转移的50例; 有癌栓者23例, 未侵犯血管者29例.
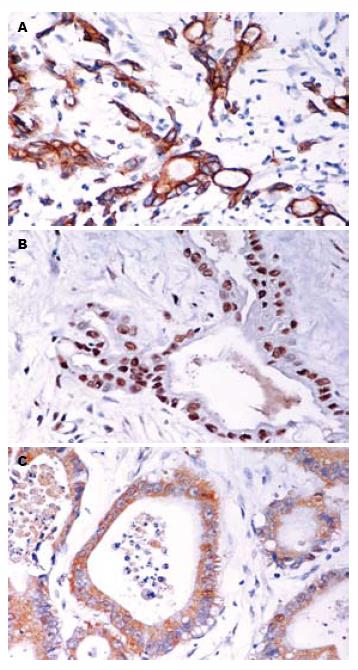
所有标本经40 g/L甲醛固定, 石蜡包埋, 制成4 μm的连续切片, P-gp, TopoⅡ和GST-π一抗试剂盒均购自福州迈新生物工程技术公司, 为即用型抗体. 免疫组化步骤: 二甲苯脱蜡、梯度酒精至水, 30 mL/L双氧水灭活内源性过氧化酶, 磷酸盐缓冲液(PBS)振洗(采用专业微波炉进行抗原微波热修复), 正常山羊血清封闭, 一抗冰箱过夜, 二抗、三抗各1 h, DAB显色, 复染核、脱水、透明, 中性树胶封片. 用PBS代替一抗作阴性对照, 已知结肠癌阳性片作阳性对照. 结果判断在光学显微镜下观察, 以细胞结构中存在粗细一致的棕黄色颗粒为阳性, 其中P-gp阳性颗粒分布于细胞膜或同时在胞质和胞膜上表达(图1A); TopoⅡ阳性颗粒分布于胞核(图1B); GST-π阳性颗粒分布于胞质和/或胞核(图1C). 双盲法随机观察5个不同高倍视野, 各计数500个细胞, P-gp和GST-π判断标准如下: 根据染色的细胞数量及染色强度分为阴性(-), 无阳性细胞染色或阳性细胞数低于10%; 弱阳性(+), 阳性细胞在10%-25%之间; 中度阳性(++), 阳性细胞25%-75%; 强阳性(+++), 阳性细胞>75%. 这两种蛋白表达为中度阳性以上时提示存在耐药. TopoⅡ判断标准: 阳性细胞数<25%为Ⅰ级; 阳性细胞数25%-50%为Ⅱ级; 阳性细胞数50%-75%为Ⅲ级; 阳性细胞数>75%为Ⅳ级. 此蛋白表达为Ⅰ级时说明细胞有耐药性.
统计学处理 应用SAS 8.2统计软件对计数资料进行χ2检验, P<0.05表示差异有统计学意义, 并用寿命表法统计术后生存率.
130例胃癌手术标本中, P-gp阳性32例(24.62%); TopoⅡ阳性106例(81.54%); GST-π阳性98例(75.38%). P-gp的表达与病变大小、淋巴结转移及血管侵犯有关, 其阳性表达率在病变直径≥5 cm组中高于直径<5 cm组(χ2 = 4.56, P = 0.033); 有淋巴结转移的阳性表达率高于无淋巴结转移组(χ2 = 5.84, P = 0.016); 在有血管侵犯组中高于无血管侵犯组(χ2 = 17.69, P<0.001); 而与性别、组织分型、分化程度及TNM分期无关. TopoⅡ的表达与病理类型及分化程度有关, 在印戒细胞癌中表达率低于其他类型(χ2 = 7.29, P = 0.007); 且在低分化组中强阳性表达率明显低于中高分化组(χ2 = 7.79, P = 0.005). GST-π的表达与病变大小、血管侵犯相关, 病变直径≥5 cm的中度及强阳性表达率明显高于直径<5 cm组(χ2 = 5.45, P = 0.020); 同样, 有血管侵犯的阳性率也明显高于无血管侵犯组(χ2 = 5.40, P = 0.020); 其与性别、组织分型、分化程度、淋巴结转移及TNM分期无关(表1).
| 分组 | P-gp | P值 | TopoⅡ | P值 | GST-π | P值 | |||||||||
| - | + | ++ | +++ | Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | - | + | ++ | +++ | ||||
| 性别 | P>0.05 | P>0.05 | P>0.05 | ||||||||||||
| 男 | 79 | 7 | 9 | 6 | 18 | 29 | 28 | 26 | 25 | 13 | 25 | 38 | |||
| 女 | 19 | 4 | 4 | 2 | 6 | 8 | 5 | 10 | 7 | 4 | 6 | 12 | |||
| 病变直径 | P<0.05 | P>0.05 | P<0.05 | ||||||||||||
| ≥5 cm | 40 | 6 | 9 | 5 | 9 | 14 | 18 | 19 | 10 | 6 | 17 | 27 | |||
| <5 cm | 58 | 5 | 4 | 3 | 15 | 23 | 15 | 17 | 22 | 11 | 14 | 23 | |||
| 组织分型 | P>0.05 | P<0.05 | P>0.05 | ||||||||||||
| 管状腺癌 | 47 | 6 | 7 | 2 | 7 | 15 | 18 | 22 | 10 | 12 | 16 | 24 | |||
| 乳头状腺癌 | 37 | 5 | 6 | 5 | 10 | 19 | 12 | 12 | 16 | 5 | 12 | 20 | |||
| 印戒细胞癌 | 12 | 0 | 0 | 1 | 6 | 2 | 3 | 2 | 5 | 0 | 2 | 6 | |||
| 分化程度 | P>0.05 | P<0.05 | P>0.05 | ||||||||||||
| 低 | 48 | 7 | 8 | 6 | 16 | 23 | 18 | 12 | 18 | 6 | 18 | 27 | |||
| 中或高 | 50 | 4 | 5 | 2 | 8 | 14 | 15 | 24 | 14 | 11 | 13 | 23 | |||
| 淋巴结转移 | P<0.05 | P>0.05 | P>0.05 | ||||||||||||
| 有 | 60 | 8 | 12 | 7 | 16 | 25 | 24 | 22 | 23 | 8 | 19 | 37 | |||
| 无 | 38 | 3 | 1 | 1 | 8 | 12 | 9 | 14 | 9 | 9 | 12 | 13 | |||
| 侵犯血管 | P<0.05 | P>0.05 | P<0.05 | ||||||||||||
| 有 | 22 | 4 | 12 | 4 | 7 | 12 | 13 | 10 | 5 | 4 | 13 | 20 | |||
| 无 | 76 | 7 | 1 | 4 | 17 | 25 | 20 | 26 | 27 | 13 | 18 | 30 | |||
| TNM分期 | P>0.05 | P>0.05 | P>0.05 | ||||||||||||
| Ⅰ, Ⅱ | 37 | 5 | 3 | 1 | 9 | 13 | 10 | 14 | 10 | 11 | 12 | 13 | |||
| Ⅲ, Ⅳ | 61 | 6 | 10 | 7 | 15 | 24 | 23 | 22 | 22 | 6 | 19 | 37 | |||
随访患者52例, 其中2例失访, 总的2年生存率为56.97%. P-gp和GST-π的阳性表达++~+++时为耐药组, 其术后2年生存率低于非耐药组(前者χ2 = 3.964, P = 0.047; 后者χ2 = 4.2576, P = 0.039). TopoⅡ表达呈Ⅰ级时为耐药组, Ⅱ-Ⅳ级为非耐药组, 胃癌术后生存率在这两组中的差别无统计学意义(表2).
| 类别 | n | 第1年内失访例数 | 第1年内死亡例数 | 第2年内失访例数 | 第2年内死亡例数 | 2年累积生存率(%) | P值 |
| P-gp | P<0.05 | ||||||
| -~+ | 38 | 1 | 4 | 1 | 8 | 64.98 | |
| ++~+++ | 14 | 0 | 4 | 0 | 5 | 35.71 | |
| TopoⅡ | P>0.05 | ||||||
| Ⅰ级 | 11 | 0 | 1 | 0 | 2 | 72.72 | |
| Ⅱ~Ⅳ级 | 41 | 1 | 7 | 1 | 11 | 52.64 | |
| GST-π | P<0.05 | ||||||
| -~+ | 16 | 0 | 2 | 1 | 1 | 77.78 | |
| ++~+++ | 36 | 1 | 6 | 0 | 12 | 47.89 |
肿瘤的多药耐药(MDR)可涉及到临床常用的多种抗肿瘤药物, 是肿瘤成功化疗的严重障碍之一, 因而有关这方面的研究越来越受到重视. 近年来已发现多种耐药相关基因及蛋白, 但研究较多的是多药耐药基因(MDR-1)及其表达产物P-糖蛋白(P-gp)、拓扑异构酶Ⅱ(TopoⅡ)和谷胱甘肽-S-转移酶(GST-π).
P-gp是MDR-1基因的蛋白产物, 该蛋白在细胞膜上可形成单一药物通道, 具有"药泵"功能, 当药物进入细胞后, P-gp结合药物分子, 同时其ATP结合位点结合并水解ATP释放能量, 使细胞内药物主动转运至细胞外, 也可使药物在细胞内重分布[2], 此外还可抑制FAS(CD95)诱导的Caspase-3和Caspase-8的激活而抑制细胞的凋亡[3], 导致细胞产生耐药. 通常P-gp在结肠癌、肾细胞癌、肾上腺癌中化疗前即有高水平表达, 而在其他肿瘤中常在产生获得性耐药时有较高表达[4]. 王翠莲et al[5]认为, P-gp在未化疗的胃癌中表达较高, 达56.00%, 其阳性判断标准是该蛋白在胞质的表达. 而研究认为, P-gp单纯在细胞质的表达并不影响细胞对药物的敏感性[6], 所以, 本组实验的阳性判断标准为该蛋白在细胞膜上或同时在胞质的表达, 结果显示, 该蛋白在胃癌中表达率低(23.85%), 但其表达与病变大小、淋巴结转移、血管侵犯呈正相关. 在P-gp与预后的关系上, Sagol et al[7]检测了P-gp在胰腺癌中的表达, 认为该蛋白的表达不影响生存率及中位生存期. 而Kato et al[8]研究结果正相反. 我们的结果显示中、强度阳性表达者2年生存率明显下降, 与后者一致. 考虑原因之一可能在于P-gp可抑制细胞凋亡, 而细胞凋亡的减少在肿瘤的发生、生长过程中起重要作用[9-11]. 此外, 以往认为该蛋白可使细胞对多种脂溶性药物包括生物碱类、蒽环类及鬼臼类产生不同程度的耐药, 近来Takechi et al[12]利用mRNA差异展示分析了对5-FU耐药的胃癌细胞株的多种基因表达情况, 显示MDR-1表达明显升高. 谭晖et al[13]证实P-gp蛋白的高表达阻碍了5-FU诱导的细胞凋亡, 说明P-gp也可介导肿瘤细胞对5-FU的耐药, 降低了肿瘤细胞对化疗药物的敏感性, 从而导致术后生存率的下降. 其二是P-gp在向细胞外泵出物质时会引起肿瘤细胞膜边缘的波动, 提高肿瘤细胞的游走、着床能力[14], 后来该研究人员又证实在高表达P-gp的多药耐药细胞中, 基质金属蛋白酶包括MMP-1, MMP-2和MMP-9的数量和活性均明显增加[15], 而且P-gp表达的同时又可增加CD44的表达[16], 这些因素共同作用促进了肿瘤细胞的侵袭能力, 从而使肿瘤易于转移和复发.
TopoⅡ是一种能调节核酸空间结构动态变化, 控制核酸生理功能的关键酶, 参与基因重组、转录和DNA修复等. 如该酶数量减少或活性降低可导致以其为靶点的药物诱导的DNA稳定断裂复合物形成减少, 因而与多种肿瘤的多药耐药关系密切. TopoⅡ mRNA的表达与细胞增殖周期中的S期具有显著相关性[17-19]. 以TopoⅡ为靶点的药物包括喜树碱、蒽环类及鬼臼毒素类[20]. 我们的检测结果显示, TopoⅡ阳性率为(80.77%), 而且其表达与病理分型及组织分化程度有关, 在印戒细胞癌中表达率低, 在低分化组明显低于中、高分化组. 但与预后无明显相关, 这与报道TopoⅡ的表达可降低患者的无瘤生存率[21]不一致, 原因可能与肿瘤异质性有关, 也可能是由于本次观察预后的样本较少所致. 但也有研究认为, TopoⅡ不能作为肿瘤患者预后的指标[22], 至于两者有无确切关系还有待进一步研究.
GST-π在细胞的解毒功能上起重要作用, 他可催化亲电物质与谷胱甘肽结合, 其本身又可与亲脂性细胞毒药物结合增加其水溶性、促进其代谢, 另外还可促进DNA的修复, 从而使细胞产生耐药. Suganuma et al[23]利用cDNA微阵技术进一步证实了该基因参与介导了胃癌的多药耐药, 此种耐药细胞对顺铂、环磷酰胺、氮芥、甲氨喋呤、喜树碱、苯丁酸氮芥、阿霉素等药物疗效不佳[24-25]. 另外, Suzuki et al[26]通过研究结肠癌细胞内与MMC激活或失活有关的基因及生化特征的改变, 发现GST-π也参与了MMC的灭活作用. Zhu et al[27]报道在食道癌及癌前病变中GST-π的表达明显增高, 且随着不典型增生程度的递进而增加. 但也有学者利用RT-PCR检测大肠癌患者外周血GST-π mRNA表达, 虽阳性率较其他各组高, 但没有明显差别. 认为尚不能作为肿瘤早期诊断的依据[28]. 尽管如此, 一些研究证实, GST-π与肿瘤的进展及患者的预后有关[29-30]. 本次检测结果显示, GST-π阳性率为75.38%, 其表达与病变大小、血管侵犯呈正相关, 且中、强度表达阳性的患者预后差. 分析原因考虑为GST-π在某些环境压力情况下可激活转录因子c-Jun, 后者为激活蛋白-1(AP-1)的一个组分, 而GST-π以及与细胞增殖、分化相关基因的启动子中均含有AP-1结合位点[31], 因而在新合成GST-π单体的同时可上调基质金属蛋白酶的表达[32], 而后者的增加则有利于促进肿瘤的侵袭力, 从而促进了疾病的进展并降低了术后生存时间.
总之, P-gp, TopoⅡ和GST-π 3者引起的耐药机制各不相同, 本实验结果也进一步证实了这3种耐药基因在胃癌的表达与其生物学特征具有相关性. 在本次随访病例的选择上, 基本去除了对预后有较大影响的因素, 术后采用以5-FU为基础的个体化的联合化疗方案, 因5-FU对胃癌的疗效已为人们所共识, 且陈亚军et al[33]以MTT法体外测定胃癌对十余种化疗药物敏感性, 结果也进一步证实此种药物体外敏感率高. P-gp和GST-π的中、强度阳性表达之所以降低生存率, 除文中分析的一些原因外可能还存在其他机制, 有待进一步研究. 由于3者在胃癌的表达特征不同, 故需联合检测有助于综合判断病情、合理选择用药以及正确评估预后情况.
胃癌是严重危害国人健康和生命的恶性肿瘤. 化疗是治疗该病的主要方法之一, 但肿瘤细胞的多药耐药性的存在明显降低了化疗的效果. 目前认为, 在介导胃癌耐药的诸多基因及蛋白中, 多药耐药基因(MDR-1)及其表达产物P-糖蛋白(P-gp)、拓扑异构酶Ⅱ(TopoⅡ)和谷胱甘肽-s-转移酶(GST-π)起主要作用. 本文研究这3者的表达与临床病理及预后的关系.
国外研究显示, P-gp和CD44可通过相互作用促进了肿瘤细胞的迁移及侵袭能力, 有学者利用耐药癌细胞株研究时发现, 此两种蛋白有共免疫沉淀现象; 且将CD44s转染肿瘤细胞后可诱导MDR-1的表达, 并产生功能性的P-gp, 而利用RNA干扰抑制P-gp的表达则降低了细胞的迁移能力, 此点可能是P-gp影响预后的重要原因之一.
本文重点报道了介导胃癌耐药机制中的3种蛋白的表达特征与术后生存率之间的关系, 并结合文献重点分析了这些耐药基因对预后产生影响的一些可能原因.
P-gp, TopoⅡ, GST-π3者介导耐药的机制不同, 并且在胃癌的表达特征不同, 因而联合检测除了为临床选择化疗方案提供基础资料外, 还有助于综合判断病情以及正确评估预后情况.
肿瘤的多药耐药(MDR): 是指肿瘤细胞对一种抗肿瘤药物耐药的同时对其他结构和作用机制不同的抗肿瘤药物也产生了耐药性.
本文研究了耐药基因在胃癌组织中的表达及其与胃癌病理学科特征和预后的关系, 科学性与可读性高, 提供了有意义的信息.
电编: 张敏 编辑: 王晓瑜
| 2. | Arancia G, Molinari A, Calcabrini A, Meschini S, Cianfriglia M. Intracellular P-glycoprotein in multidrug resistant tumor cells. Ital J Anat Embryol. 2001;106:59-68. [PubMed] |
| 3. | Ruefli AA, Tainton KM, Darcy PK, Smyth MJ, Johnstone RW. P-glycoprotein inhibits caspase-8 activation but not formation of the death inducing signal complex (disc) following Fas ligation. Cell Death Differ. 2002;9:1266-1272. [PubMed] |
| 4. | Tsuruo T, Naito M, Tomida A, Fujita N, Mashima T, Sakamoto H, Haga N. Molecular targeting therapy of cancer: drug resistance, apoptosis and survival signal. Cancer Sci. 2003;94:15-21. [PubMed] |
| 7. | Sagol O, Yavuzsen T, Oztop I, Ulukus C, Ylmaz U, Alakavuklar M, Karademir S, Obuz F, Astarcoglu H, Astarcoglu I. The effect of apoptotic activity, survivin, Ki-67, and P-glycoprotein expression on prognosis in pancreatic carcinoma. Pancreas. 2005;30:343-348. [PubMed] |
| 8. | Kato A, Miyazaki M, Ambiru S, Yoshitomi H, Ito H, Nakagawa K, Shimizu H, Yokosuka O, Nakajima N. Multidrug resistance gene (MDR-1) expression as a useful prognostic factor in patients with human hepatocellular carcinoma after surgical resection. J Surg Oncol. 2001;78:110-115. [PubMed] |
| 9. | Xu AG, Li SG, Liu JH, Gan AH. Function of apoptosis and expression of the proteins Bcl-2, p53 and C-myc in the development of gastric cancer. World J Gastroenterol. 2001;7:403-406. [PubMed] |
| 10. | Schmitt CA. Senescence, apoptosis and therapy-cutting the lifelines of cancer. Nat Rev Cancer. 2003;3:286-295. [PubMed] |
| 11. | Brown JM, Attardi LD. The role of apoptosis in cancer development and treatment response. Nat Rev Cancer. 2005;5:231-237. [PubMed] |
| 12. | Takechi T, Koizumi K, Tsujimoto H, Fukushima M. Screening of differentially expressed genes in 5-fluorouracil-resistant human gastrointestinal tumor cells. Jpn J Cancer Res. 2001;92:696-703. [PubMed] |
| 13. | 谭 晖, 李 琴, 张 志伟, 周 秀田, 曾 希, 曹 建国. 5-Fu抗结肠癌作用与细胞凋亡及P-gp蛋白表达的关系. 南华大学学报(医学版). 2005;33:311-313, 370. |
| 14. | Yang JM, Vassil A, Hait WN. Involvement of phosphatidylinositol-3-kinase in membrane ruffling induced by P-glycoprotein substrates in multidrug-resistant carcinoma cells. Biochem Pharmacol. 2002;63:959-966. [PubMed] |
| 15. | Yang JM, Xu Z, Wu H, Zhu H, Wu X, Hait WN. Overexpression of extracellular matrix metalloproteinase inducer in multidrug resistant cancer cells. Mol Cancer Res. 2003;1:420-427. [PubMed] |
| 16. | Miletti-Gonzalez KE, Chen S, Muthukumaran N, Saglimbeni GN, Wu X, Yang J, Apolito K, Shih WJ, Hait WN, Rodriguez-Rodriguez L. The CD44 receptor interacts with P-glycoprotein to promote cell migration and invasion in cancer. Cancer Res. 2005;65:6660-6667. [PubMed] |
| 17. | Gupta D, Shidham V, Holden J, Layfield L. Prognostic value of immunohistochemical expression of topoisomerase alpha II, MIB-1, p53, E-cadherin, retinoblastoma gene protein product, and HER-2/neu in adrenal and extra-adrenal pheochromocytomas. Appl Immunohistochem Mol Morphol. 2000;8:267-274. [PubMed] |
| 18. | Costa MJ, Hansen CL, Holden JA, Guinee D Jr. Topoisomerase II alpha: prognostic predictor and cell cycle marker in surface epithelial neoplasms of the ovary and peritoneum. Int J Gynecol Pathol. 2000;19:248-257. [PubMed] |
| 19. | Park SH, Suh YL. Expression of cyclin A and topoisomerase IIalpha of oligodendrogliomas is correlated with tumour grade, MIB-1 labelling index and survival. Histopathology. 2003;42:395-402. [PubMed] |
| 20. | Topcu Z. DNA topoisomerases as targets for anticancer drugs. J Clin Pharm Ther. 2001;26:405-416. [PubMed] |
| 21. | Korkolopoulou P, Patsouris E, Konstantinidou AE, Christodoulou P, Thomas-Tsagli E, Kouzelis K, Angelidakis D, Rologis D, Davaris P. Mitosin and DNA topoisomerase IIalpha: two novel proliferation markers in the prognostication of diffuse astrocytoma patient survival. Appl Immunohistochem Mol Morphol. 2001;9:207-214. [PubMed] |
| 22. | 张 青俊, 张 凡, 徐 国刚, 尚 小领, 张 九龄. 72例喉癌患者耐药基因与临床预后关系的初步探讨. 河北北方学院学报(医学版). 2006;23:20-24. |
| 23. | Suganuma K, Kubota T, Saikawa Y, Abe S, Otani Y, Furukawa T, Kumai K, Hasegawa H, Watanabe M, Kitajima M. Possible chemoresistance-related genes for gastric cancer detected by cDNA microarray. Cancer Sci. 2003;94:355-359. [PubMed] |
| 24. | Goto S, Kamada K, Soh Y, Ihara Y, Kondo T. Significance of nuclear glutathione S-transferase pi in resistance to anti-cancer drugs. Jpn J Cancer Res. 2002;93:1047-1056. [PubMed] |
| 25. | Balendiran GK, Dabur R, Fraser D. The role of glutathione in cancer. Cell Biochem Funct. 2004;22:343-352. [PubMed] |
| 26. | Suzuki K, Yamamoto W, Park JS, Hanaoka H, Okamoto R, Kirihara Y, Yorishima T, Okamura T, Kumazaki T, Nishiyama M. Regulatory network of mitomycin C action in human colon cancer cells. Jpn J Cancer Res. 1999;90:571-577. [PubMed] |
| 27. | Zhu X, Zhang SH, Zhang KH, Li BM, Chen J. Value of endoscopic methylene blue and Lugol's iodine double staining and detection of GST-Pi and telomerase in the early diagnosis of esophageal carcinoma. World J Gastroenterol. 2005;11:6090-6095. [PubMed] |
| 29. | Jayasurya A, Yap WM, Tan NG, Tan BK, Bay BH. Glutathione S-transferase pi expression in nasopharyngeal cancer. Arch Otolaryngol Head Neck Surg. 2002;128:1396-1399. [PubMed] |
| 30. | Stoehlmacher J, Park DJ, Zhang W, Groshen S, Tsao-Wei DD, Yu MC, Lenz HJ. Association between glutathione S-transferase P1, T1, and M1 genetic polymorphism and survival of patients with metastatic colorectal cancer. J Natl Cancer Inst. 2002;94:936-942. [PubMed] |
| 31. | Wilhelm D, Bender K, Knebel A, Angel P. The level of intracellular glutathione is a key regulator for the induction of stress-activated signal transduction pathways including Jun N-terminal protein kinases and p38 kinase by alkylating agents. Mol Cell Biol. 1997;17:4792-4800. [PubMed] |
| 32. | Reunanen N, Westermarck J, Hakkinen L, Holmstrom TH, Elo I, Eriksson JE, Kahari VM. Enhancement of fibroblast collagenase (matrix metalloproteinase-1) gene expression by ceramide is mediated by extracellular signal-regulated and stress-activated protein kinase pathways. J Biol Chem. 1998;273:5137-5145. [PubMed] |