修回日期: 2006-08-20
接受日期: 2006-09-29
在线出版日期: 2006-11-08
目的: 探讨腺病毒介导KDR启动子驱动的双自杀基因体系对人胃癌细胞SCG7901的靶向杀伤作用.
方法: 应用重组腺病毒AdEasy-KDR-CDglyTK体外感染实验组SCG7901细胞株和对照组HepG2细胞株, 并给予不同浓度的前药GCV(ganciclovir)和/或5-FC(5-fluorocytosine), 观察该体系对SCG7901细胞杀伤效应及其旁观者效应.
结果: 携带双自杀基因和报告基因(GFP)的重组腺病毒载体, 感染复数为100时, 95%以上的受感染SCG7901和HepG2细胞中有GFP表达. 已转染腺病毒的SCG7901和未转染SCG7901的细胞在细胞生长方面无显著性差异(t = 0.224, P = 0.823). 已转染腺病毒的HepG2细胞和未转染HepG2的细胞在细胞生长方面也无显著性差异(t = 0.120, P = 0.904). 在前药应用下, 已转染腺病毒的SCG7901和HepG2细胞表现出对前药不同的敏感性, SCG7901细胞对前药具有较高的敏感性(F = 109.43, P = 0.000). 融合基因的疗效优于单一自杀基因(F = 162.22, P = 0.000). 将感染腺病毒细胞与未感染细胞以不同比例混和培养, 观察到该体系明显的旁观者效应.
结论: KDR基因启动子可以调控融合基因体系选择性地杀伤人胃癌SCG7901细胞, 并存在旁观者效应.
引文著录: 李强, 黄宗海, 俞金龙, 苏国强, 厉周, 周光军. KDR启动子驱动双自杀基因靶向杀伤人胃癌细胞的作用. 世界华人消化杂志 2006; 14(31): 2997-3001
Revised: August 20, 2006
Accepted: September 29, 2006
Published online: November 8, 2006
AIM: To study effect of adenovirus (Ad)-mediated fusion gene system driven by KDR promoter on the proliferation of human gastric adenocarcinoma cell line SGC7901.
METHODS: SCG7901 cells (with KDR expression) and HepG2 cells (without KDR expression) were both transfected with AdEasy-KDR-CDglyTK vector, followed by treatment of the prodrugs 5-fluorocytosine (5-FC) and/or ganciclovir (GCV) at different concentrations. The killing and bystander effects on both kinds of cells were evaluated.
RESULTS: The green fluorescent protein (GFP) was observed in 95% of the infected SCG7901 and HepG2 cells when the multiple of infection (MOI) was 100. No significant difference was found in the characteristics of growth between the transfected and non-transfected SCG7901 cells (t = 0.224, P = 0.823). In the same time, there was also no significant difference between the transfected and non-transfected HepG2 cells (t = 0.120, P = 0.904). The infected cells exhibited different sensitivities to the two kinds of prodrugs: SCG7901 cells infected with Ad were highly sensitive to the prodrugs (F = 109.43, P = 0.000), while the infected HepG2 cells were not. In addition, the killing effect of CDglyTK fusion gene on the target cells was notably stronger than that of either single suicide gene (F = 162.22, P = 0.000), and a considerable bystander effect was also observed.
CONCLUSION: CDglyTK fusion gene system driven by KDR promoter can selectively kill SCG7901 cells, and there exists an obvious bystander effect during this process.
- Citation: Li Q, Huang ZH, Yu JL, Su GQ, Li Z, Zhou GJ. Adenovirus-mediated double suicide gene driven by KDR promoter selectively kills human gastric adneocarcinoma cell line SGC7901. Shijie Huaren Xiaohua Zazhi 2006; 14(31): 2997-3001
- URL: https://www.wjgnet.com/1009-3079/full/v14/i31/2997.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i31.2997
胃癌的基因治疗逐渐成为近几年研究热点, 其中自杀基因治疗是一种颇具临床应用潜力的治疗策略. 血管内皮细胞生长因子(VEGF)及其受体(KDR)在肿瘤血管形成过程中起着关键作用, 二者高表达于肿瘤新生血管内皮细胞及恶性程度高的肿瘤细胞[1-3]. 本研究旨在探讨腺病毒介导以KDR为启动子的CDglyTK双自杀基因系统对胃癌细胞杀伤效应及其旁观者效应, 阐述其在胃癌治疗中的应用价值.
重组腺病毒AdEasy-KDR-CDglyTK为珠江医院普外科构建, 胃癌细胞株SCG7901购自中山大学动物试验中心细胞库, 肝癌细胞株HepG2引自南方医科大学肿瘤研究所, DMEM、小牛血清及TRIzol Reagent试剂盒为Gibco公司产品; 转染试剂PolyFect为QIAGEN公司提供; CD-TK引物序列为: 上游P1: 5'AAGCTTAGGCTAGCAATGTCG3', 下游P2: 5'TTAGTTAGCCTCCCCCATCTC3', 由上海英俊生物有限公司合成; GCV为Roche Pharma(Switzerland)公司产品, 5-FC购自Sigma公司.
1.2.1 重组腺病毒对SCG7901, HepG2细胞感染率的测定: 以2×105个细胞数接种于6孔培养板, 待细胞丰度达约90%, 加入不同感染复数(MOI)的腺病毒, 继续在37 ℃, 50 mL/L CO2孵箱内培养, 3 d后在荧光显微镜下计数GFP阳性细胞百分比.
1.2.2 RT-PCR检测转基因细胞CDglyTK基因转录表达: 细胞总RNA的提取按照TRIzol Reagent试剂盒说明进行, 然后按照逆转录试剂盒说明合成cDNA, 应用CDglyTK的上下游引物进行PCR反应, 1%琼脂糖凝胶电泳, 紫外灯下观察结果并拍照.
1.2.3 KDR启动子融合基因腺病毒对SCG7901细胞生长曲线的影响: 取对数生长期已转基因的SCG7901细胞, 制成4×103/mL的细胞悬液, 接种于96孔板培养细胞, 每板接种6孔. 对照组SCG7901细胞同浓度平行接种6孔. 另设空白孔调零. 应用四甲唑蓝(MTT)法检测, 每天测1板, 实验重复3次.
1.2.4 不同浓度的GCV, 5-FC对胃癌SCG7901/CD-TK细胞的作用: SCG7901细胞以1×104/孔接种于96孔培养板中, 次日丰度达约80%, 用100 MOI的重组腺病毒感染之. 培养24 h后弃去培养液, 将SCG7901/CD-TK和SCG7901分别加入不同浓度的GCV, 使终浓度分别为20, 40, 60, 80, 100, 200 mg/L, 或加入不同浓度的5-FC使终浓度分别为100, 250, 500, 1000, 2000, 4000 mg/L. 以不加药的未转染细胞作对照, 每实验组设3个复孔, 培养72 h后MTT法测各孔吸光度(A值), 计算细胞生长抑制率 = (1-实验组检A值/对照组A值)×100%. 半数抑制浓度(IC50, 50% inhibitory concentration) IC50 (mg/L) = Log-1[Xm-I(∑P-0.5)].
1.2.5 不同前药对Ad-KDR-CDglyTK感染的SCG7901细胞和HepG2细胞的作用: 在96孔板中以1×104/孔接种SCG7901细胞和HepG2细胞, 次日丰度达约80%, 用100 MOI的重组腺病毒感染. 培养24 h后, 分别加入GCV 60 g/L, 5-FC 1000 g/L以及联合应用GCV 60 g/L+5-FC 1000 g/L, 每个前药设3个复孔, 并设不加前药的对照孔和只有培养液的空白孔. 培养72 h后, 用MTT方法检测细胞生长抑制率.
1.2.6 旁观者效应: 分别取对数的转基因和未转基因细胞, 以不同比例进行混合, 以1×104个细胞/孔接种于96孔培养板中, 48 h后于不同组分别加入GCV 60 g/L, 5-FU 1000 g/L以及两者的混合液. 72 h以后以MTT法检测细胞的存活率.
统计学处理 应用SPSS 10.0软件进行处理, 采取独立样本t检验和单向方差分析(组间多重比较应用S-N-K法).
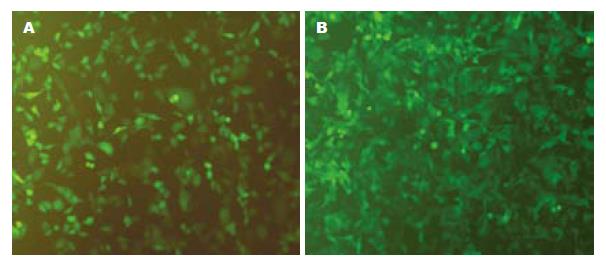
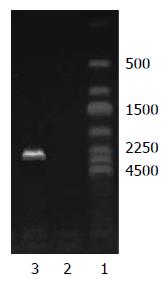
采用不同MOI的重组腺病毒分别感染SCG7901和HepG2细胞, 96 h后观察发现, 细胞的感染率随腺病毒滴度的增加而递增, 当MOI = 1时, 仅少数细胞有荧光; 当MOI = 100时, 95%以上的GFP表达; MOI = 200时, 几乎所有的细胞均被感染. 重组腺病毒对两种细胞具有相似的感染效率(图1). RT-PCR检测结果: 感染Ad-KDR-CdglyTK的SCG7901/CD-TK细胞内可见约2.5 kb阳性条带, 而HepG2/CD-TK细胞内未检测到目的融和基因(CdglyTK)在mRNA水平的表达(图2).
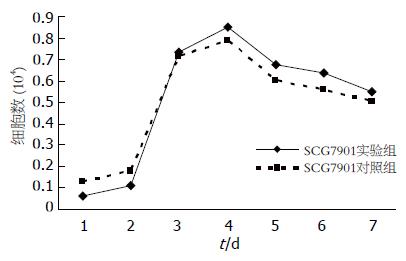
已转基因SCG7901细胞(实验组)和SCG7901细胞(对照组)具有类似的生长状态(图3), 结果显示, 两者无统计学意义(F = 0.048, P = 0.823>0.05).
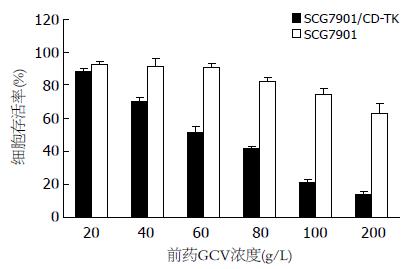
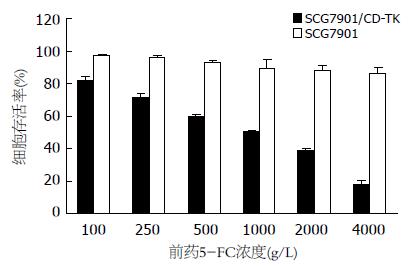
由图4, 图5可见GCV对SCG7901/CD-TK细胞有明显的剂量依赖性细胞毒作用, 根据量效关系计算其半数抑制浓度. IC50为61.89 mg/L, 而GCV对SCG7901细胞IC50为397.8 mg/L, 两者差异有统计学意义(P<0.01). 同样, 5-FC对SCG7901/CD-TK细胞的IC50为806.48 mg/L, 而对SCG7901细胞生长影响不大.
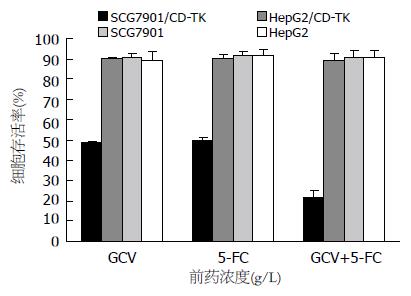
以MOI = 100的重组腺病毒Ad-KDR-CDglyTK感染两种细胞, 加入前药终浓度为: GCV 60 mg/L, 5-FC 1.0 g/L. SCG7901细胞仅有约21.5%±3.15%存活, 而HepG2细胞存活率仍有89.13%±3.41%(P<0.01). 同时发现, 单用浓度60 mg/L的GCV时, SCG7901细胞的存活率为48.46%±0.75%. 单用浓度为1.0 g/L的5-FC时, 生存率为49.50%±1.87%. 两者联合应用时, 其生存率为21.50%±3.15%(P均<0.01, 图6).
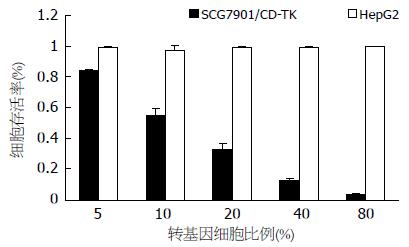
将感染腺病毒的细胞与未感染的细胞以不同比例混合培养, 观察到该体系明显的旁观者效应(图7), 当转基因细胞的比率为40%时, SCG7901有11%的存活, 而HepG2细胞的存活率仍在96%, 两者比较均有显著性意义(P<0.01).
自Folkman提出肿瘤的生长具有血管形成依赖以来, 对实体瘤的血管形成及其相关微循环的研究及抗肿瘤血管生成已成为当今肿瘤研究的热点之一[4]. 实体肿瘤的生长和转移离不开肿瘤血管的形成, 新生血管一方面提供肿瘤细胞生长所需的氧和养分, 促进肿瘤细胞分裂增殖, 另一方面肿瘤细胞通过新生血管的微循环浸润周围脏器, 发生远处转移. 因此以肿瘤血管为靶点, 采用各种途径抑制肿瘤血管的形成, 切断肿瘤的供养, 即能有效抑制肿瘤生长和转移[5]. 已有许多实验证明, 胃癌、大肠癌等实体瘤与新生血管形成关系密切, 在肿瘤原发灶及远处转移灶中可检测到高水平表达的血管内皮生长因子(VEGF)及其受体(KDR), 因此其在多种肿瘤中分布, 并与肿瘤的恶性转归明显相关, KDR在肿瘤血管及肿瘤组织细胞中均高表达, 且正常组织表达甚微或不表达. 因此构建了KDR启动子驱动的双自杀基因体系, 既保证了目的基因转染的靶向性, 又达到针对肿瘤细胞及其血管内皮细胞双重靶向的目的.
为探讨KDR启动子驱动的自杀基因体系特异性的杀伤作用, 将含目的基因的腺病毒感染表达KDR的胃癌细胞SCG7901和不表达KDR的HepG2, 并分别给以不同浓度的前药5-FC和GCV, 结果发现, 感染Ad-KDR-CDglyTK的细胞株细胞生存率存在差异: 感染Ad-KDR-CDglyTK的细胞株SCG7901随前药浓度的增加其生存率递减, 而不表达KDR的细胞HepG2生存率则几乎不受影响. 这充分表明KDR基因启动子调控的自杀基因体系的细胞特异性.
本系统应用的CD/5-FC和TK/GCV是目前研究最为深入的两种自杀基因系统, 他们确切的肿瘤杀伤作用已得到证实[6-7]. 尽管如此, 单自杀基因治疗仍存在细胞及组织特异性单一和易产生治疗的耐药性, 因此, 利用各体系不同的作用机制及对各组织不同的敏感性, 本实验构建了CDglyTK融合基因, 通过二者的互补大大提高疗效, 克服自杀基因疗法的肿瘤细胞类型依赖性和最大限度减少肿瘤细胞耐药性. 研究进一步证实, 相同浓度的两种前药优于任一单前药的疗效.
目前, 关于旁观者效应机制的研究主要是单自杀基因系统, 其机制涉及到细胞凋亡、缝隙连接、细胞介质等有关学说. 有关双自杀基因体系的报告不多. 本实验应用KDR启动子驱动双自杀基因靶向杀伤人胃癌细胞的研究, 观察到其对胃癌细胞靶向杀伤的旁观者效应, 该作用特点正好可以弥补体内转基因不足的缺点, 以保证该基因治疗的效果.
可见, 本研究构建的重组腺病毒可高效感染目的细胞, 并且其双自杀基因体系对人胃癌细胞有杀伤作用并存在旁观者效应, CDglyTK基因的应用避免了单自杀基因的不足, KDR基因启动子的引入保证了该治疗的靶向性. 因此, 本实验为双自杀基因靶向治疗胃癌的进一步研究提供了实验依据, 其旁观者效应的机制有待进一步探讨.
为了提高自杀基因的靶向性, 利用肿瘤细胞特异的启动子来调控目的基因, 从而使目的基因在特定的肿瘤组织中表达. 已有许多实验证明, 胃癌、大肠癌等实体瘤与新生血管形成关系密切, 在肿瘤原发灶及远处转移灶中可检测到高水平表达的血管内皮生长因子(VEGF)及其受体(KDR), 而正常组织表达甚微或不表达. 基于此, KDR可作为肿瘤生物治疗的理想靶点.
以KDR为启动子调控的CD-TK双自杀基因重组腺病毒载体, 转导自杀基因选择性杀伤胃癌细胞和癌组织周围的血管内皮细胞, 一方面通过KDR为启动子介导双自杀基因选择性杀伤肿瘤细胞及肿瘤血管内皮细胞, 另一方面通过选择性杀伤肿瘤细胞, 抑制肿瘤细胞分裂增殖, 减少VEGF的分泌. 通过二者的协同作用达到抑制肿瘤原发灶生长, 阻断VEGF和KDR的结合, 抑制由VEGF引起的KDR的磷酸化及其后的信号传导通路, 从而抑制肿瘤血管生成, 削减肿瘤发生远处转移.
本实验的创新点在于: (1)以胃癌微血管为治疗靶点, 采用KDR为启动子, 靶向杀伤肿瘤血管内皮细胞及肿瘤细胞; (2)该疗法不仅杀伤原发灶肿瘤细胞, 还可抑制肿瘤新生血管形, 切断瘤体供养, 使原发灶缺血坏死, 并能抑制远处转移灶的形成; (3)可利用自杀基因治疗的"旁观者效应"放大疗效; (4)利用双自杀基因的协同效应提高疗效并肿瘤的抗药性; (5)采用GFP为报告基因, 检测快速, 方便.
在KDR启动子驱动下, 目的基因可以特异性表达于肿瘤细胞及其血管内皮细胞内. 利用KDR启动子对肿瘤新生血管内皮细胞及肿瘤细胞的靶向作用, 驱动CD/5-FC和HSV-TK/GCV两套自杀基因系统特异性杀伤肿瘤细胞及新生血管内皮细胞, 为进一步开展胃癌的靶向治疗研究奠定基础.
1双自杀基因疗法: 是利用基因工程的技术将两种自杀基因整合在一起, 通过载体转导入肿瘤细胞, 使其在肿瘤细胞内表达融合基因产物, 此产物具有两种自杀基因编码的酶的活性, 然后给予双药物前体治疗, 从而对两类不同的药物前体敏感, 而发挥双功能的杀伤作用. 目前双自杀基因多位CD-TK融合基因. 2自杀基因疗法: 是利用转基因的技术, 将哺乳类动物细胞中的自杀基因转导入肿瘤细胞内, 该基因表达的产物可以将无毒的药物前体转化为有毒的药物, 从而影响肿瘤细胞的遗传物质合成, 引起肿瘤细胞的死亡.
本文结果显示, 感染Ad-KDR-cdglyTK的SCG7901细胞随前药浓度的增加而生存率明显下降, 而不表达KDR的对照组细胞则无明显变化, 说明KDR基因启动子可调控融合基因体系靶向性地杀伤胃癌SCG7901细胞, 并存在旁观者效应. 本文内容较新, 研究课题重要, 对胃癌的基因治疗提供了有意义的信息, 科学性、创造性与可读性均较好.
编辑: 潘伯荣 电编:张敏
| 1. | Bocci G, Man S, Green SK, Francia G, Ebos JM, du Manoir JM, Weinerman A, Emmenegger U, Ma L, Thorpe P. Increased plasma vascular endothelial growth factor (VEGF) as a surrogate marker for optimal therapeutic dosing of VEGF receptor-2 monoclonal antibodies. Cancer Res. 2004;64:6616-6625. [PubMed] |
| 2. | Heidenreich R, Machein M, Nicolaus A, Hilbig A, Wild C, Clauss M, Plate KH, Breier G. Inhibition of solid tumor growth by gene transfer of VEGF receptor-1 mutants. Int J Cancer. 2004;111:348-357. [PubMed] |
| 3. | Schmitz V, Kornek M, Hilbert T, Dzienisowicz C, Raskopf E, Rabe C, Sauerbruch T, Qian C, Caselmann WH. Treatment of metastatic colorectal carcinomas by systemic inhibition of vascular endothelial growth factor signaling in mice. World J Gastroenterol. 2005;11:4332-4336. [PubMed] |
| 4. | Stevens A, Soden J, Brenchley PE, Ralph S, Ray DW. Haplotype analysis of the polymorphic human vascular endothelial growth factor gene promoter. Cancer Res. 2003;63:812-816. [PubMed] |
| 5. | Knowles HJ, Tian YM, Mole DR, Harris AL. Novel mechanism of action for hydralazine: induction of hypoxia-inducible factor-1alpha, vascular endothelial growth factor, and angiogenesis by inhibition of prolyl hydroxylases. Circ Res. 2004;95:162-169. [PubMed] |
| 6. | Boucher PD, Im MM, Freytag SO, Shewach DS. A novel mechanism of synergistic cytotoxicity with 5-fluorocytosine and ganciclovir in double suicide gene therapy. Cancer Res. 2006;66:3230-3237. [PubMed] |
| 7. | Wu DH, Liu L, Chen LH. Antitumor effects and radiosensitization of cytosine deaminase and thymidine kinase fusion suicide gene on colorectal carcinoma cells. World J Gastroenterol. 2005;11:3051-3055. [PubMed] |