修回日期: 2006-08-20
接受日期: 2006-09-12
在线出版日期: 2006-11-08
目的: 探讨Apoptin基因对人胃癌细胞BGC-823的抑制作用及其参与胞内细胞信号转导的机制.
方法: 应用脂质体转染法将重组质粒pVAX1-Apoptin体外转染BGC-823细胞, 运用噻唑兰(methyl thiazolyl tetrazolium, MTT)分析法检测重组质粒对BGC-823肿瘤细胞的抑制作用; 通过AO/EB染色法对pVAX1-Apoptin转染的肿瘤细胞进行形态学观察; 运用流式细胞术检测细胞线粒体跨膜电位(△Ψm); 通过免疫印迹检测细胞色素c(cytochrome c, Cyto c)释放; 应用底物显色法检测Caspase-3/9活性.
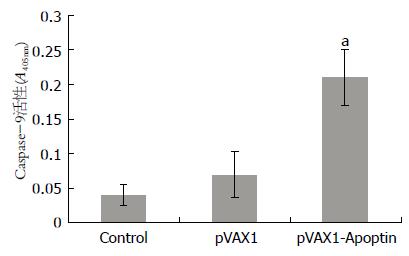
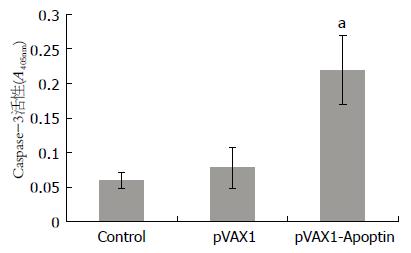
结果: pVAX1-Apoptin转染比pVAX1具有更强的抑瘤效应(10 μg质粒转染72 h后, 23.37% vs 99.61%, P<0.01), 并且肿瘤细胞的死亡方式以凋亡为主. 实验结果显示, pVAX1-Apoptin转染导致细胞线粒体跨膜电位下降, 与pVAX1转染BGC-823细胞相比有显著差异(46.7%±7.26% vs 70.66%±5.98%, P<0.01); 同时伴随细胞色素c的释放. 另外, pVAX1-Apoptin和pVAX1转染细胞的Caspase-3/9活性具有显著差异(Caspase-9: 0.181±0.032 vs 0.079±0.013, P<0.01; Caspase-3: 0.242±0.041 vs 0.058±0.023, P<0.01).
结论: pVAX1-Apoptin转染BGC-823肿瘤细胞导致线粒体跨膜电位下降, 并刺激释放细胞色素c, 从而激活Caspase-9. 经细胞色素c激活的Caspase-9进而活化凋亡通路下游关键作用因子, 并对BGC-823肿瘤细胞产生抑制效应.
引文著录: 李霄, 金宁一, 连海, 陈立刚, 孙丽丽, 李萍. Apoptin基因对人胃癌细胞BGC-823的抑制效应及与凋亡信号转导的关系. 世界华人消化杂志 2006; 14(31): 2991-2996
Revised: August 20, 2006
Accepted: September 12, 2006
Published online: November 8, 2006
AIM: To investigate the anti-tumor effects of Apo-ptin gene on human gastric carcinoma BGC-823, and to explore the mechanism of apoptin in the participation of signal transduction pathway.
METHODS: Recombinant plasmid pVAX1-Apoptin was transfected into BGC-823 cells by application of liposome in vitro. The anti-tumor effect on BGC-823 cells was measured through methyl thiazolyl tetrazolium (MTT) assay, and the morphological changes of pVAX1-Apoptin-transfected cells were observed by AO/EB staining. Furthermore, the mitochondrial trans-membrane potential (ΔΨm) was analyzed by flow cytometry and the release of cytochrome c (Cyto c) was detected by Western blot assay. Colorimetric assay was used to analyze the activities of Caspase-3/9.
RESULTS: pVAX1-Apoptin caused a more powerful cytotoxic effect than pVAX1 did (72 h after 10-μg plasmid transfection, 23.37% vs 99.61%, P < 0.01), and apoptosis was a dominant death style in the pVAX1-Apoptin-transfected cells. Furthermore, in pVAX1-Apoptin-transfected cells, an increase of cytosolic cytochrome c content co-occurred with a loss of trans-membrane potential (compared with pVAX1-transfected BGC-823 cells, 46.70% ± 7.26% vs 70.66% ± 5.98%, P < 0.01). In addition, a significant difference was found between pVAX1-Apoptin- and pVAX1-transfected cells in Caspase-9 and Caspase-3 activities (Caspase-9: 0.181 ± 0.032 vs 0.079 ± 0.013, P < 0.01; Caspase-3: 0.242 ± 0.041 vs 0.058 ± 0.023, P < 0.01).
CONCLUSION: In BGC-823 cells, pVAX1-Apoptin induced collapse of the mitochondrial trans-membrane potential can exert a feedback effect to elicit cytochrome c release, and then lead to the activation. Cytochrome c-dependent Caspase-9 activation stimulates the key downstream factors of apoptotic pathway, exhibiting an inhibitory effect on BGC-823 cells.
- Citation: Li X, Jin NY, Lian H, Chen LG, Sun LL, Li P. Anti-tumor effects of Apoptin gene on human gastric carcinoma BGC-823 and its correlation with apoptotic signal transduction. Shijie Huaren Xiaohua Zazhi 2006; 14(31): 2991-2996
- URL: https://www.wjgnet.com/1009-3079/full/v14/i31/2991.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i31.2991
凋亡素(Apoptin)是鸡贫血病病毒(chicken anemia virus, CAV)VP3基因的编码产物, 具有特异性诱导人黑色素瘤、肉瘤、淋巴瘤等多种恶性转化细胞发生凋亡的作用, 而对正常细胞没有影响[1-3]. 虽然Apoptin区分恶性细胞和正常细胞的机制尚不清楚, 但有研究表明, 其凋亡诱导作用与Apoptin的细胞定位有关, 正常细胞中Apoptin主要分布于细胞质中, 而在恶性转化细胞中则主要定位于细胞核[4]. 另外, Apoptin的凋亡诱导功能不依赖P53分子, 而且Bcl-2, Bag-1, Bcr-abl等凋亡抑制分子不仅对Apoptin的功能没有影响, 反而会增强其作用[5-9]. 因此, 与依赖上述途径的放化疗等传统疗法相比, 存在凋亡基因突变或含有凋亡抑制分子的肿瘤细胞对Apoptin仍然敏感. 而且Apoptin基因较小(366 bp), 可以插入多种载体, 具有成为新的肿瘤基因治疗研究策略的潜力[10-12]. 为探索Apoptin基因在肿瘤基因治疗中的应用, 本研究以人胃癌细胞BGC-823为研究对象, 探讨了Apoptin基因的抑瘤作用及对凋亡信号转导的影响.
脂质体Lipofectamine购自Invitrogen公司; RPMI 1640培养液, 胎牛血清购自Gibco公司; Rho123, MTT购自Sigma公司; 小鼠抗人Cyto c单抗, 碱性磷酸酶标记抗小鼠IgG购自Santa Cruz公司; 胞质分离试剂盒和Caspase-3/9检测试剂盒购自BioVision公司; NBT/BCIP购自Promega公司; pVAX1, pVAX1-Apoptin质粒由本室保存; 人胃癌细胞BGC-823购自中科院上海生命科学研究院生物化学与细胞生物学研究所; 流式细胞仪为美国B-D公司产品; 荧光显微镜及成像系统为日本Olympus产品.
1.2.1 细胞培养和质粒转染: BGC-823细胞在RPMI 1640培养液(含100 mL/L胎牛血清, 100 U/L青霉素, 100 U/L链霉素)中, 于37 ℃, 50 mL/L CO2条件下, 培养至细胞80%融合, 用25 g/L胰蛋白酶消化后制备单细胞悬液, 调整细胞浓度至1×108个/L, 分别接种于96孔(150 μL/孔)和6孔(2 mL/孔)细胞培养板, 于37 ℃, 50 mL/L CO2条件下培养24 h后, 通过脂质体介导法分别将10 μg重组质粒pVAX1-Apoptin和载体质粒pVAX1转染BGC-823细胞, 同时设空白细胞对照.
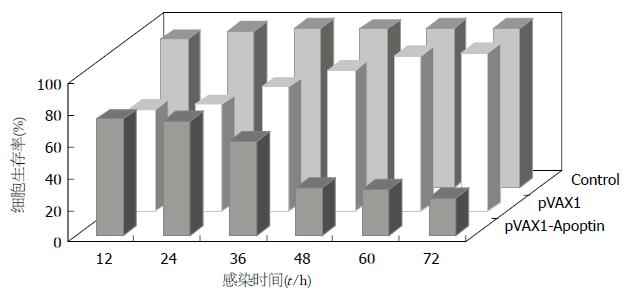
1.2.2 MTT检测细胞存活率: 质粒转染的BGC-823细胞培养12, 24, 48, 60和72 h后, 于96孔细胞培养板中加入20 μL/孔MTT(5 g/L), 于37 ℃, 50 mL/L CO2条件下继续培养4 h, 吸去培养液, 加入二甲基亚砜(200 μL/孔), 待紫色结晶充分溶解后, 于490 nm波长检测光吸收值(A), 通过公式[13]计算细胞生存率, 细胞生存率 = 实验孔平均A值/对照孔平均A值×100%.
1.2.3 AO/EB染色观察细胞形态: 收集质粒转染48 h的细胞1×106个, 细胞计数并调整细胞浓度至1×109个/L. 取上述细胞悬液25 μL, 加入2 μL AO/EB溶液(AO, EB的PBS溶液, 浓度均为100 mg/L), 振荡混匀, 取10 μL上述细胞置于显微载玻片上, 加盖玻片, 置于荧光显微镜下观察细胞形态.
1.2.4 流式细胞仪检测△Ψm变化: 收集质粒转染48 h的细胞1×106个, PBS洗涤1次, 加入Rho123 (2 mg/L), 于37 ℃条件下避光作用30 min, PBS洗涤3次后用流式细胞仪检测荧光阳性细胞百分数.
1.2.5 Western blot检测细胞色素c: 收集质粒转染48 h的BGC-823细胞, 应用胞质分离试剂盒对其胞质成份进行分离和浓缩, 并用核酸蛋白检测仪对其中蛋白组份进行定量. 取50 μg胞质蛋白进行SDS-PAGE电泳, 并电转移至硝酸纤维素膜. 经5%脱脂乳封闭后, 先后与小鼠抗人Cyto c单抗和碱性磷酸酶标记抗小鼠IgG于37 ℃条件下作用2 h, 并于NBT/BCIP溶液中显色.
1.2.6 Caspase-3/9活性测定: 收集质粒转染48 h的BGC-823细胞1×106个, 于细胞裂解液中冰浴10 min后, 于10 000 g, 4 ℃条件下离心1 min, 应用核酸蛋白检测仪对上清中的蛋白质成份进行定量, 并应用Caspase-3/9检测试剂对含有100 μg蛋白质的上清液进行Caspase活性检测(405 nm).
统计学处理 实验所得数据均采用学生氏t检验进行处理, P<0.05视为差异显著.
重组质粒pVAX1-Apoptin对BGC-823细胞具有显著的抑制作用(P<0.01), 转染72 h后生存率仅为23.37%. 由于脂质体的细胞毒性作用, 载体质粒实验组在转染后呈现一定抑制作用, 但随后逐渐恢复旺盛生长, 72 h后生存率为99.61%. 综合考虑pVAX1-Apoptin抑制作用的时间依赖关系和脂质体的细胞毒性对实验结果的影响, 本研究在细胞水平实验过程中均采用48 h为指标检测时间点(图1).
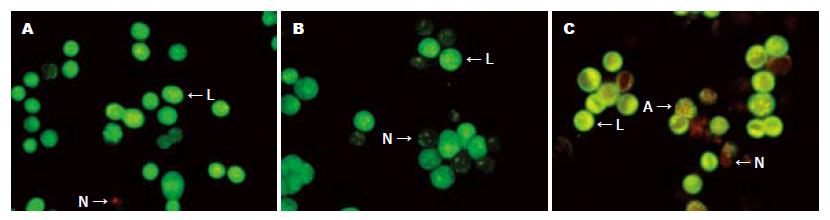
应用AO/EB染色法鉴定细胞状态时, 正常细胞的细胞膜完整, 只被AO染色呈现均匀的绿色荧光(图2A); pVAX1转染的BGC-823细胞因胞膜遭到破坏, 被EB染色后呈现桔红色的坏死形态(图2B); pVAX1-Apoptin转染的BGC-823细胞发生凋亡, 其膜完整性遭到破坏, 染色质凝聚, 因此细胞膜被AO染色呈现绿色荧光的同时, 核酸物质被EB染色呈现桔红色荧光, 表现出典型的凋亡特征(图2C).
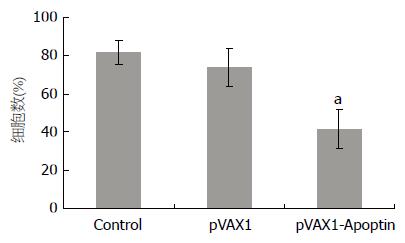
△Ψm下调说明线粒体结构、功能和活性发生改变. 如图3所示, 与空白细胞对照组和pVAX1转染组相比, pVAX1-Apoptin转染显著下调△Ψm(P<0.01). pVAX1转染组△Ψm虽较对照组低, 可能是由脂质体破坏细胞胞膜结构完整性所致, 与对照组相比没有显著差异.
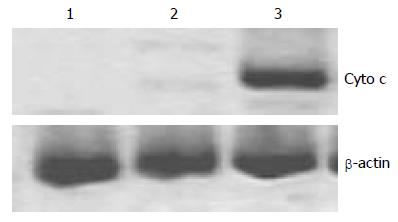
pVAX1-Apoptin转染可明显增加BGC-823细胞质中Ctyo c含量, 而对照组则检测不到, pVAX1实验组细胞线粒体遭到脂质体破坏后可能有少量Cyto c释放到胞质中(图4).
胃癌是常见的恶性肿瘤, 已成为全球瞩目的人类杀手, 每年将导致60万人失去生命, 中日韩胃癌患者已占全球的2/3. 1950年代以来我国胃癌发病率上升了109.4%, 死亡率有日益升高的趋势, 每年有15-18万人死于胃癌, 占所有恶性肿瘤死亡率的23%, 并且每年新增胃癌患者人数在18-20万间. 传统手术治疗只能去除恶性肿瘤的原发病灶, 不能杜绝其再生与增殖; 放化疗虽能有效杀伤肿瘤细胞, 但往往伴随严重的毒副作用. 随着分子生物学和基因工程技术的发展, 特别是治疗性疫苗概念的提出, 为肿瘤的基因治疗提供了新的发展空间. 目前, 肿瘤基因治疗药物的应用前景已不仅取决于其杀伤肿瘤细胞的有效性, 而更加侧重于制剂的抑瘤特异性[14]. Apoptin能够特异性诱导包括肝癌、淋巴瘤、胆管癌、黑色素瘤、乳腺癌、肺癌、结肠癌等人源肿瘤发生凋亡, 而对成纤维细胞、角质化细胞、平滑肌细胞等正常没有影响[15]. Apoptin识别恶性转化细胞的确切机制有待进一步探讨, 但有研究表明Bcl-2家族成员能够促进Apoptin的功能而不是抑制其作用, 说明Apoptin诱导肿瘤细胞凋亡的途径与经典凋亡通路存在差别[6,16-17]. 临床前和临床研究表明, 利用腺病毒表达P53可有效抑制实体肿瘤的生长, 并且P53达到抑瘤剂量时并不对正常细胞构成威胁[18-21]. 然而, 表达外源P53的方法似乎只对P53功能缺陷的肿瘤细胞产生明显作用, 而对P53功能健全的肿瘤细胞没有显著影响[5]. Apoptin所发挥的凋亡诱导作用不依赖P53功能, 因此使其在肿瘤基因治疗领域具有潜在应用价值. 本研究以真核表达质粒pVAX1为载体, 通过脂质体介导法将Apoptin基因导入人胃癌细胞BGC-823, 探讨了Apoptin基因对BGC-823细胞的抑制作用. 实验结果表明, 虽然脂质体对胃癌细胞BGC-823细胞呈现一定细胞毒性作用, 但24 h后肿瘤细胞便可逐渐恢复旺盛生长, 而Apoptin却可持续发挥作用, 转染72 h后pVAX1-Apoptin实验组肿瘤细胞生存率与pVAX1转染实验组相比显著降低, 说明体外转染真核表达质粒pVAX1-Apoptin能够有效杀伤BGC-823肿瘤细胞. 形态学观察表明, 重组质粒pVAX1-Apoptin主要通过诱导BGC-823细胞发生凋亡发挥其抑瘤作用. 细胞凋亡是机体清除恶性变细胞的一种主动的、程序化的生理过程, 而线粒体功能的变化则是细胞凋亡信号转导过程的关键环节[22]. 在细胞凋亡过程中, 胞膜、胞质和线粒体等细胞结构中的信号分子被凋亡信号所激活, 通过参与氧化还原反应、能量代谢和Bcl-2家族分子表达的调控等方式激活下游凋亡程序[23-24]. 线粒体在接受上述信号分子刺激后, 向胞质内释放Cyto c等凋亡信号因子, 最终使细胞发生凋亡[25]. Cyto c在启动细胞凋亡和维持线粒体氧化还原平衡过程中起重要作用, 在被释放入胞质并与Apaf-1结合后Cyto c能够同Caspase-9形成复合物并使之活化, 继而激活Caspase-3等下游Caspase, 完成凋亡诱导过程[26-32]. 本研究通过流式细胞术、Western blot和底物显色等方法, 探讨了Apoptin对BGC-823肿瘤细胞△Ψm, Cyto c和Caspase-3/9等线粒体凋亡途径信号转导关键控制点的影响. 结果显示, 导入Apoptin基因能够下调BGC-823 △Ψm, 促进线粒体Cyto c向胞质的释放, 激活Caspase-3/9. 结合Apoptin对体外培养BGC-823细胞抑制作用研究结果, 我们认为Apoptin作用于线粒体, 造成ROS和Cyto c的释放, 并依次激活Csapase-9和Caspase-3, 最终通过线粒体凋亡途径诱导BGC-823细胞凋亡, 从而实现对BGC-823细胞的抑制作用.
总之, Apoptin具有不依赖P53的凋亡诱导功能, 不受Bcl-2等凋亡抑制因子限制及无以伦比的特异性等多种其他肿瘤基因治疗策略不具备的优势, 使其具有广泛应用于包括胃癌在内的多种肿瘤治疗研究的潜力.
癌症是威胁人类健康的主要疾病之一, 其发生是一个具有极复杂生物生命变化发生机制的过程. 肿瘤患者数量庞大, 缺乏有效的治疗手段, 预后差. 目前对恶性肿瘤的治疗多采用手术治疗辅以放化疗的方法, 但其效果不尽人意, 且有严重副作用. 基因治疗有别于上述传统方法, 他着眼于调动机体自身的抗癌能力, 通过增强固有的抗肿瘤机制达到抑制肿瘤细胞及根治肿瘤的目的, 因此被认为是最有希望最终攻克癌症的疗法.
细胞凋亡是机体清除变异和恶变细胞的一种主动程序化生理过程. 许多刺激因子诱导细胞凋亡依赖P53信号转导途径, 但很多肿瘤在其发生过程中常伴随P53突变, 从而影响治疗效果. 通过基因工程技术导入P53的肿瘤基因治疗药物已经面世并且取得了一定成功. 然而, 在缺乏导向载体的情况下, 这种基因介入方式必然会对正常组织细胞造成损伤. 研究表明, 来源于鸡贫血病病毒的Apoptin基因可有效抑制多种肿瘤, 具有以非P53依赖性途径特异性诱导人肿瘤细胞或转化细胞, 而非正常细胞发生凋亡的作用, 且其凋亡诱导作用不受Bcl-2的抑制, 是一种理想的特异性肿瘤基因治疗效应基因.
本研究将表达Apoptin的质粒重组体体外导入人胃癌细胞BGC-823, 结果表明pVAX1-Apoptin通过作用于线粒途径相关细胞信号分子诱导肿瘤细胞凋亡, 有效抑制肿瘤细胞的生长.
质粒载体安全性高, 制备工艺成熟, 成本低廉, 是基因治疗的理想载体之一; Apoptin具有特异性, 可减少对健康组织细胞的损伤, pVAX1-Apoptin具有做为抗肿瘤制剂应用于临床研究和药物开发的潜力.
我国胃癌发病率、死亡率有日益升高的趋势, 本研究为肿瘤的基因治疗提供了新的发展空间. 文章设计合理, 结果科学结论较明确, 实验证据较充足, 讨论条理分明, 有较系统的理论分析, 参考文献引用较新, 较好地反映国内外肿瘤基因治疗基础研究的先进水平.
编辑: 王晓瑜 电编:张敏
| 1. | Danen-Van Oorschot AA, Fischer DF, Grimbergen JM, Klein B, Zhuang S, Falkenburg JH, Backendorf C, Quax PH, Van der Eb AJ, Noteborn MH. Apoptin induces apoptosis in human transformed and malignant cells but not in normal cells. Proc Natl Acad Sci USA. 1997;94:5843-5847. [PubMed] |
| 2. | Jeurissen SH, Wagenaar F, Pol JM, van der Eb AJ, Noteborn MH. Chicken anemia virus causes apoptosis of thymocytes after in vivo infection and of cell lines after in vitro infection. J Virol. 1992;66:7383-7388. [PubMed] |
| 3. | Rohn JL, Noteborn MH. The viral death effector Apoptin reveals tumor-specific processes. Apoptosis. 2004;9:315-322. [PubMed] |
| 4. | Maddika S, Mendoza FJ, Hauff K, Zamzow CR, Paranjothy T, Los M. Cancer-selective therapy of the future: apoptin and its mechanism of action. Cancer Biol Ther. 2006;5:10-19. [PubMed] |
| 5. | Zhuang SM, Shvarts A, van Ormondt H, Jochemsen AG, van der Eb AJ, Noteborn MH. Apoptin, a protein derived from chicken anemia virus, induces p53-independent apoptosis in human osteosarcoma cells. Cancer Res. 1995;55:486-489. [PubMed] |
| 6. | Zhuang SM, Shvarts A, Jochemsen AG, van Oorschot AA, van der Eb AJ, Noteborn MH. Differential sensitivity to Ad5 E1B-21kD and Bcl-2 proteins of apoptin-induced versus p53-induced apoptosis. Carcinogenesis. 1995;16:2939-2944. [PubMed] |
| 7. | Danen-Van Oorschot AA, Zhang Y, Erkeland SJ, Fischer DF, van der Eb AJ, Noteborn MH. The effect of Bcl-2 on Apoptin in 'normal' vs transformed human cells. Leukemia. 1999;13 Suppl 1:S75-77. [PubMed] |
| 8. | Burek M, Maddika S, Burek CJ, Daniel PT, Schulze-Osthoff K, Los M. Apoptin-induced cell death is modulated by Bcl-2 family members and is Apaf-1 dependent. Oncogene. 2006;25:2213-2222. [PubMed] |
| 9. | Danen-Van Oorschot AA, van der Eb AJ, Noteborn MH. BCL-2 stimulates Apoptin-induced apoptosis. Adv Exp Med Biol. 1999;457:245-249. [PubMed] |
| 10. | van der Eb MM, Pietersen AM, Speetjens FM, Kuppen PJ, van de Velde CJ, Noteborn MH, Hoeben RC. Gene therapy with apoptin induces regression of xenografted human hepatomas. Cancer Gene Ther. 2002;9:53-61. [PubMed] |
| 11. | Olijslagers S, Dege AY, Dinsart C, Voorhoeve M, Rommelaere J, Noteborn MH, Cornelis JJ. Potentiation of a recombinant oncolytic parvovirus by expression of Apoptin. Cancer Gene Ther. 2001;8:958-965. [PubMed] |
| 12. | Pietersen AM, van der Eb MM, Rademaker HJ, van den Wollenberg DJ, Rabelink MJ, Kuppen PJ, van Dierendonck JH, van Ormondt H, Masman D, van de Velde CJ. Specific tumor-cell killing with adenovirus vectors containing the apoptin gene. Gene Ther. 1999;6:882-892. [PubMed] |
| 13. | Steinwaerder DS, Carlson CA, Lieber A. Human papilloma virus E6 and E7 proteins support DNA replication of adenoviruses deleted for the E1A and E1B genes. Mol Ther. 2001;4:211-216. [PubMed] |
| 14. | Fischer U, Schulze-Osthoff K. New approaches and therapeutics targeting apoptosis in disease. Pharmacol Rev. 2005;57:187-215. [PubMed] |
| 15. | Oro C, Jans DA. The tumour specific pro-apoptotic factor apoptin (Vp3) from chicken anaemia virus. Curr Drug Targets. 2004;5:179-190. [PubMed] |
| 16. | Schoop RA, Kooistra K, Baatenburg De Jong RJ, Noteborn MH. Bcl-xL inhibits p53- but not apoptin-induced apoptosis in head and neck squamous cell carcinoma cell line. Int J Cancer. 2004;109:38-42. [PubMed] |
| 17. | Noteborn MH, Zhang YH, van der Eb AJ. Apoptin specifically causes apoptosis in tumor cells and after UV-treatment in untransformed cells from cancer-prone individuals: a review. Mutat Res. 1998;400:447-455. [PubMed] |
| 18. | Polyak K, Waldman T, He TC, Kinzler KW, Vogelstein B. Genetic determinants of p53-induced apoptosis and growth arrest. Genes Dev. 1996;10:1945-1952. [PubMed] |
| 19. | Nielsen LL, Maneval DC. P53 tumor suppressor gene therapy for cancer. Cancer Gene Ther. 1998;5:52-63. [PubMed] |
| 20. | Zhang WW, Alemany R, Wang J, Koch PE, Ordonez NG, Roth JA. Safety evaluation of Ad5CMV-p53 in vitro and in vivo. Hum Gene Ther. 1995;6:155-164. [PubMed] |
| 21. | Roth JA, Nguyen D, Lawrence DD, Kemp BL, Carrasco CH, Ferson DZ, Hong WK, Komaki R, Lee JJ, Nesbitt JC. Retrovirus-mediated wild-type p53 gene transfer to tumors of patients with lung cancer. Nat Med. 1996;2:985-991. [PubMed] |
| 22. | Rossi D, Gaidano G. Messengers of cell death: apoptotic signaling in health and disease. Haematologica. 2003;88:212-218. [PubMed] |
| 23. | Zhou BB, Bartek J. Targeting the checkpoint kinases: chemosensitization versus chemoprotection. Nat Rev Cancer. 2004;4:216-225. [PubMed] |
| 24. | Ozawa T. Mitochondrial genome mutation in cell death and aging. J Bioenerg Biomembr. 1999;31:377-390. [PubMed] |
| 25. | Gilmore KJ, Quinn HE, Wilson MR. Pinocytic loading of cytochrome c into intact cells specifically induces caspase-dependent permeabilization of mitochondria: evidence for a cytochrome c feedback loop. Cell Death Differ. 2001;8:631-639. [PubMed] |
| 26. | Sehra S, Dent AL. Caspase function and the immune system. Crit Rev Immunol. 2006;26:133-148. [PubMed] |
| 27. | Siegel RM. Caspases at the crossroads of immune-cell life and death. Nat Rev Immunol. 2006;6:308-317. [PubMed] |
| 28. | Kowluru RA. Diabetic retinopathy: mitochondrial dysfunction and retinal capillary cell death. Antioxid Redox Signal. 2005;7:1581-1587. [PubMed] |
| 29. | Chen LH, Hsu CY, Weng CF. Involvement of P53 and Bax/Bad triggering apoptosis in thioacetamide-induced hepatic epithelial cells. World J Gastroenterol. 2006;12:5175-5181. [PubMed] |
| 30. | Pusl T, Beuers U. Ursodeoxycholic acid treatment of vanishing bile duct syndromes. World J Gastroenterol. 2006;12:3487-3495. [PubMed] |
| 31. | Kouroumalis E, Notas G. Pathogenesis of primary biliary cirrhosis: a unifying model. World J Gastroenterol. 2006;12:2320-2327. [PubMed] |
| 32. | Prosser CC, Yen RD, Wu J. Molecular therapy for hepatic injury and fibrosis: where are we? World J Gastroenterol. 2006;12:509-515. [PubMed] |