修回日期: 2006-07-28
接受日期: 2006-08-10
在线出版日期: 2006-09-28
目的: 观察蛙皮素(BBS)和生长抑素(SS)对人低分化胃癌细胞株BGC-823的生长调控作用, 测定细胞内环磷酸腺苷(cAMP)含量、蛋白激酶C(PKC)活性及PKC亚型的表达, 探讨受体后信息传导途径.
方法: BGC-823细胞在含100 mL/L小牛血清的RPMI 1640培养液中, 于37℃, 50 mL/L CO2条件下培养, 分别加入不同浓度的BBS或SS, 应用MTT法观察细胞的增殖程度. 应用放射免疫分析方法测定细胞内cAMP含量, 应用[γ-32p]ATP掺入外源性底物的方法测定PKC活性, 应用Western blot方法分析PKC亚型α, β1, β2及ε的表达.
结果: BBS能促进BGC-823细胞的生长, 且与剂量呈正相关(r = 0.878, P<0.05), 这种促生长作用可被其受体拮抗剂所拮抗; BBS能促进细胞内cAMP的产生(r = 0.68, P<0.01)及增加PKC活性, PKCα表达明显增加, 而β1, β2及ε则无明显表达; SS能显著抑制BGC-823细胞的生长, 呈剂量依赖关系(r = -0.831, P<0.01); SS能显著抑制BBS的促细胞生长作用, 但无明显的剂量依赖关系; SS可使细胞PKC活性明显下降, 呈剂量依赖关系(r = -0.74, P<0.01).
结论: 经特异性受体介导, BBS能促进胃癌细胞BGC-823的生长; 其受体后信息传递途径可能涉及cAMP-PKA系统及DG-PKC系统, PKCα在BBS的受体后信息传递中可能起重要作用; SS可能通过降低PKC活性抑制BGC-823细胞的生长, 同时可抑制BBS的促胃癌细胞生长作用.
引文著录: 徐秀英, 赵金满, 姜若兰, 宗志宏. 蛙皮素和生长抑素对人胃癌BGC-823细胞生长的影响及受体后信息传递. 世界华人消化杂志 2006; 14(27): 2684-2690
Revised: July 28, 2006
Accepted: August 10, 2006
Published online: September 28, 2006
AIM: To observe the effects of bombesin and somatostatin on the proliferation of human lowly-differentiated gastric cancer cell line BGC-823, and to determine the intracellular concentration of cyclic adenosine monophos-phate (cAMP), the activity of proteinkinase C (PKC) and the expression of PKC isoforms α, β1, β2 and ε.
METHODS: BGC-823 cells were cultured in RPMI 1640 medium containing 100 mL/L FCS in the atmosphere of 50 mL/L carbon dioxide at 37℃, and then bombesin or/and somatostatin with different concentrations was added. The viability and proliferation were determined by Mosmann's method (MTT assay); the intracellular cAMP concentrations were detected by radioimmunoassay (RIA); the activity of PKC was determined by incorporation of [γ-32p]-ATP with exogenous substrate; and the expression of PKC isoforms was analyzed by Western blot.
RESULTS: Bombesin promoted the growth of BGC-823 cells in a dose-dependent manner (r = 0.878, P < 0.05), which was inhibited significantly by its antagonist; it also increased the level of intracellular cAMP (r = 0.68, P < 0.01) and the activity of PKC in a dose-dependent manner. Western blot showed overexpression of PKCα, while the expression of PKCβ1, β2 and ε were not detected. However, somatostatin inhibited the growth of BGC-823 cells in a dose-dependent manner (r = -0.831, P < 0.01), and it also inhibited the growth-promoting effect of bombesin without obvious dose-dependent ways and the activity of PKC in a dose-dependent way (r = -0.74, P < 0.01).
CONCLUSION: Bombesin can promote the growth of BGC-823 cells by the mediation of specific receptor, it can increase the intracellular cAMP level and PKC activity, illuminating that cAMP-PKA and DG-PKC system may be involved in the signal transduction and PKCα may play an important role. Somatostatin can significantly inhibit the growth of BGC-823 cells and the growth-promoting effects of bombesin through down-regulating the activity of PKC.
- Citation: Xu XY, Zhao JM, Jiang RL, Zong ZH. Effects of bombesin and somatostatin on proliferation of human gastric cancer cell line BGC-823 and their postreceptor signal transduction. Shijie Huaren Xiaohua Zazhi 2006; 14(27): 2684-2690
- URL: https://www.wjgnet.com/1009-3079/full/v14/i27/2684.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i27.2684
蛙皮素(bombesin, BBS)是由14个氨基酸组成的多肽, 于1970年首先从两种蛙类的皮肤提取物中分离出来. 1978年, 从猪胃的非窦黏膜分离出胃泌素释放肽(gastrin releasing peptide, GRP), 其C末端与BBS相同, 目前认为GRP是BBS在哺乳动物中的对应物. Monstein et al[1]的研究结果显示, GRP和GRP受体mRNA在人的食道、胃肠道和胰腺均有广泛表达; BBS/GRP具有刺激胃泌素释放和胃酸分泌等生理作用, 同时, 对很多组织都有营养作用. 近年来的研究表明, GRP及其受体mRNA和蛋白在肺癌、前列腺癌、乳腺癌及结肠癌等多种肿瘤组织中均有过度表达, GRP在体内外对多种起源的肿瘤组织均有促分裂作用[2]; 人胃癌细胞株AGS上有高亲和力的受体亚型-1的表达, 细胞毒BBS类似物AN-215可抑制AGS裸鼠移植瘤的生长[3]; 但这种调节作用的机制尚不清楚. 环磷酸腺苷-蛋白激酶A (cAMP-PKA)与二酰基甘油-蛋白激酶C (DG-PKC)两套信号系统是多个跨膜信号系统中最具代表性的信号传导通路. 近年来, PKC在肿瘤发生、发展中的作用引起人们广泛兴趣, 但BBS对人胃癌细胞PKC活性及PKC亚型表达影响的研究报告极少. 生长抑素(somatostatin, SS)是由14个氨基酸残基组成的多肽, 近年来研究发现, SS能影响细胞的增殖能力, SS及其类似物对实体瘤及正常组织均有抗增殖能力[3-4], 但作用机制尚不清楚. 我们旨在观察BBS、其受体拮抗剂[Leu13-ψ (CH2NH)-Leu14]-bombesin及SS对人胃癌细胞BGC-823生长的影响, 并通过测定细胞内cAMP含量, PKC活性及PKC亚型α, β1, β2和ε的表达, 进一步观察BBS及SS对cAMP-PKA及DG-PKC两套信号通路的调控作用.
CO2培养箱为美国Fisher, Scientific 1168751H型; 倒置相差显微镜为日本产Nikon TMS; 美国产Beckman J6-HC型低温离心机、DU-640型紫外可见光分光光度计、LS-6500型液体内烁计数仪、LE-80型低温超速离心机; 美国产超声粉碎仪、硝酸纤维素膜; 北京核仪器厂产FT-613型125I-γ自动计数仪; 英国UVP公司DGS8000凝胶成像及分析系统; Bio-Rad450型酶标仪. BBS及其拮抗剂[Leu13-ψ(CH2NH)-Leu14], SS-14, Triton X-100, 异丁基甲基黄嘌呤(IBMX)及EGTA均购自Sigma公司, 125I-cAMP放免试剂盒为美国DiaSorin Inc产品, 塞唑蓝(MTT)为瑞士Fluka公司产品; 抗PKCα, β1, β2及ε抗体均为Santa Cruz公司产品; [γ-32p]ATP为北京福瑞公司产品; RPMI 1640粉为美国Gibco产品; 胰蛋白酶(Trypsin)为Sigma公司产品.
1.2.1 细胞培养: 人胃癌细胞株BGC-823细胞由中国医科大学肿瘤研究所陆平惠赠. 细胞在含100 mL/L小牛血清的RPMI 1640培养液中, 于37℃, 50 mL/L CO2条件下培养, 细胞贴壁生长良好, 每3 d传代一次.
1.2.2 细胞生长的检测: 采用MTT法将对数生长期的人胃癌细胞, 经2.5 g/L胰蛋白酶消化脱壁; 用含100 mL/L小牛血清的RPMI 1640培养液配成细胞悬液, 接种于96孔培养板, 每孔103 细胞/0.1 mL, 三孔重复; 培养12 h, 使细胞贴壁生长; 弃去培养液, 换以无血清RPMI 1640 0.1 mL/孔培养24 h, 使细胞处于静止状态; 弃去原培养液, 实验组加入不同浓度的BBS或BBS加拮抗剂或SS或SS加BBS, 对照组加入等量的培养液, 空白组不含细胞; 培养48 h后, 加MTT 20 μL (5 g/L), 培养4 h; 弃上清, 加入二甲基亚砜100 μL, 待其沉淀产物完全溶解; 于Bio-Rad 450型酶标仪上, 用570 nm波长, 测定各孔吸光度(A)值.
1.2.3 cAMP的检测: cAMP的提取: 取对数生长期细胞, 于细胞悬液1.44 mL中(含细胞1.2×107)加入10 mmol/L IBMX 0.18 mL, 在37℃水溶中培育10 min, 将此悬液分为两等分, 实验组加入终浓度为10-6 mol/L蛙皮素90 μL, 对照组加入90 μL, 50 g/L RPMI 1640, 37℃培育, 于培育后1, 3, 5, 8 min分别取出0.15 mL悬液(含细胞106)加入70.6 mL/L三氯醋酸0.85 mL, 充分震荡、混匀, 于4℃, 2000 g离心10 min, 取上清0.5 mL, 用水饱和乙醚1 mL, 将上清洗涤3次后, 弃上清乙醚相, 将水相移入玻璃瓶内, 75℃水溶蒸干, -20℃水箱贮存待测. 取对数生长期细胞0.9 mL(含细胞8×106), 加入0.1 mL IBMX, 37℃水溶培育10 min, 于4℃, 760 g离心5 min, 沉淀加入3.6 mL 50 g/L RPMI 1640混匀, 分别取出0.45 mL(含细胞106)加入10-5-10-9 mol/L不同浓度BBS 50 mL或BBS拮抗或SS, 37℃水溶5 min, 4℃, 760 g离心, 沉淀加0.15 mL, 50 g/L RPMI 1640及70.6 mL/L三氯醋酸0.85 mL, 充分混匀, 取上清0.5 mL, 用水饱和乙醚洗涤上清3次后, 将水相于75℃水溶蒸干, -20℃冰箱保存待测. cAMP测定: (1)样品乙酰化, 将上述样品加入250 μL醋酸钠缓冲液重新溶解, 再加入12.5 μL乙酰化试剂立即混匀; (2)加样; (3)轻轻振荡, 20-25℃孵育3 h; (4)用力混合Precipating复合物(GAR-PPT)除总放管外, 向所有试管加入500 μL; (5)轻轻振荡, 20-25℃孵育15-25 min; (6)于20-25℃, 760 g离心20 min; (7)除TC管外, 所有试管弃上清, 并将试管倒置在滤纸上2 min, 以除去可能残留的上清; (8)用125I-γ自动计数仪, 计数每管的cpm数, 每管计数60 s. cAMP的计算: 以各标准品为横坐标, B/B0为纵坐标, 绘标准曲线, 然后根据标准曲线, 算出各样品的cAMP含量. PKC活性的测定: (1)PKC的提取: 取对数生长期的细胞, 调整细胞数达1010/L以上, 加入10-6 mol/L BBS作用不同时间, 或加入不同浓度的BBS及其拮抗剂或加入SS, 37℃水溶后用预冷的PBS洗2次, 加入Buffer A 1 mL (20 mmol/L Tris/HCl, pH 7.5, 0.25 mol/L surose, 10 mmol/L EGTA, 20 mmol/L EDTA), 用超声粉碎仪粉碎, 每管粉碎5次, 每次20 s, 然后100 000 g 4℃离心1 h, 上清为胞质部分, 其沉淀加Buffer B 0.6 mL(含Triton X-100的Buffer A). 用超声粉碎仪打碎混匀, 每次20 s, 共2次, 4℃过夜, 然后于100 000 g 4℃离心1 h, 上清为细胞膜成分; (2)PKC活性的测定: 参考Takai法, 以鱼精蛋白为底物, 反应体积250 μL, 含有10 g/L protamine, 0.5 mol/L Tris/HCl pH 7.5, 2.5×10-4 mol/L ATP, 0.25 mmol/L醋酸镁, 0.75 mmol/L 2-颈基乙醇, 0.5 Ci[γ-32p] ATP, 样品设立蛋白浓度梯度(10, 20, 40, 80 μL)反应以加入[γ-32p] ATP开始, 30℃水溶反应30 min, 以3 mL预冷10 g/L三氯醋酸中止反应, 微孔滤膜抽滤, 将滤膜放入有10 mL蒸馏水的液闪瓶中, 于Beckman液闪仪中测定放射活性. 酶活性表示为30℃时每克蛋白每分钟催化多少nmol γ-32p掺入底物蛋白. 蛋白定量采用Lowry法, 牛血清白蛋白为标准蛋白; PKC亚型的测定: 采用Western blot分析PKC亚型α, β1, β2及ε的表达. 用凝胶成像及分析系统对实验结果进行照相及分析.
统计学处理 实验结果用均数±标准差(mean±SD)表示, 组间差异比较用t检验, 采用直线相关回归分析判断线性关系.
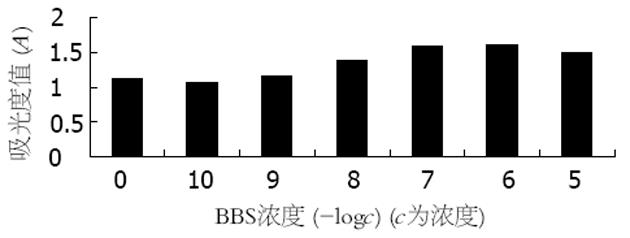
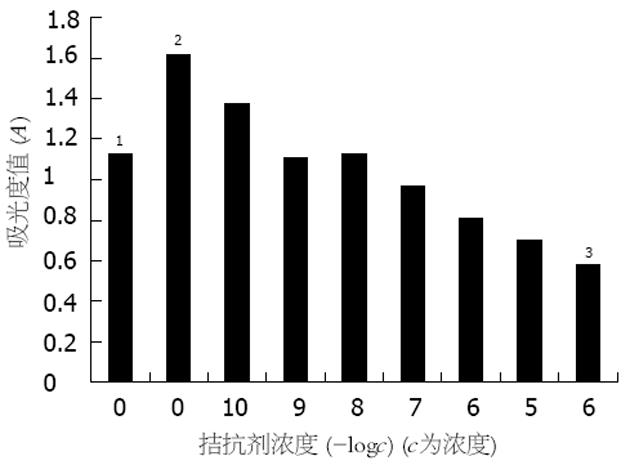
不同浓度的BBS (10-8-10-5 mol/L)能显著促进人胃癌细胞的生长, 这一促生长作用与BBS浓度呈正相关(r = 0.878, P<0.05, 图1). BBS受体拮抗剂能抑制BBS对胃癌细胞的促生长作用, 其抑制作用随着拮抗剂浓度的加大而更为明显, 提示BBS的促生长作用是通过特异性受体所介导(图2).
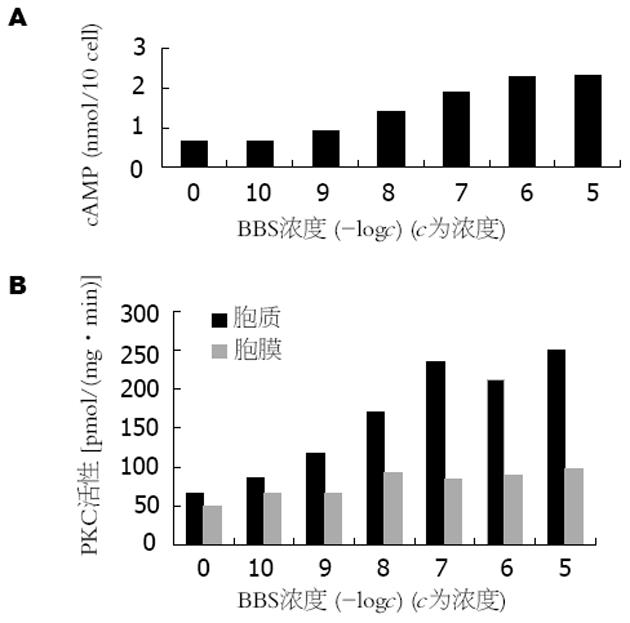
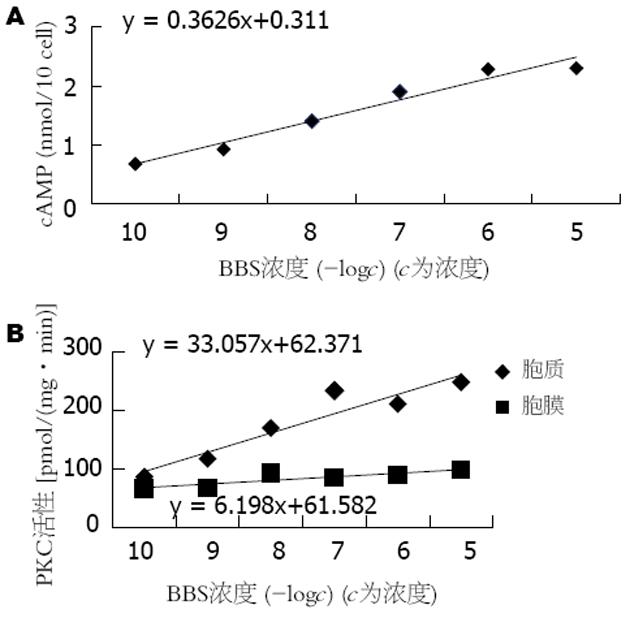
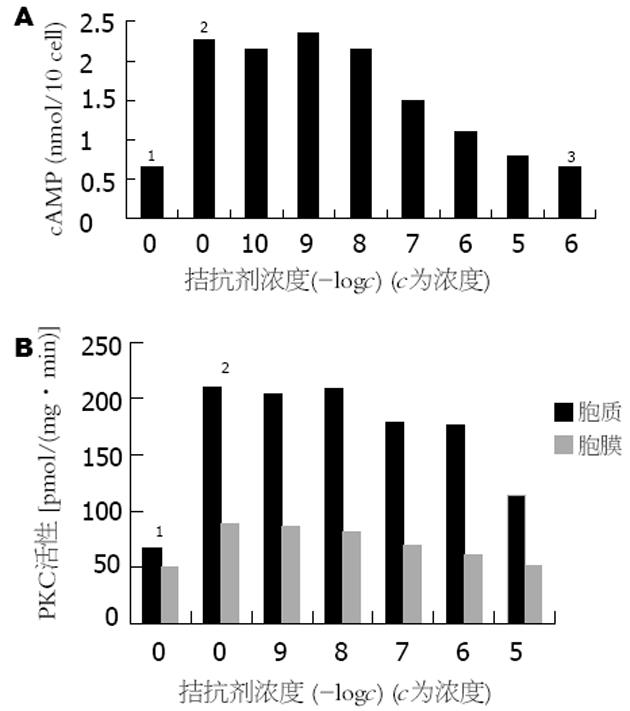
不同浓度的BBS 10-5-10-8 mol/L能显著促进细胞内cAMP的生成, cAMP生成量与BBS浓度的对数呈正相关(r = 0.68, P<0.01, 图3A,图4A);不同浓度的BBS能增加BGC-823细胞的PKC活性, 呈剂量依赖关系(图3B); 10-6 mol/L BBS可使BGC-823细胞PKC活性增加, 1 min时即出现PKC活性增加, 5 min时作用最明显, 尤以膜活性增加明显(图4B); 不同浓度的BBS受体拮抗剂可以拮抗BBS的促cAMP生成作用, 随着拮抗剂浓度增加, 其拮抗作用也更明显, 呈剂量依赖关系(图5A); BBS受体拮抗剂可抑制BBS对BGC-823细胞PKC活性的激活作用, 10-5-10-7 mol/L拮抗剂能明显降低胞质及胞膜PKC活性(图5B); 不同浓度(10-8-10-5 mol/L)的BBS可使PKCα表达明显增强, β1, β2及PKCε在各种BBS浓度时均无表达(图6).
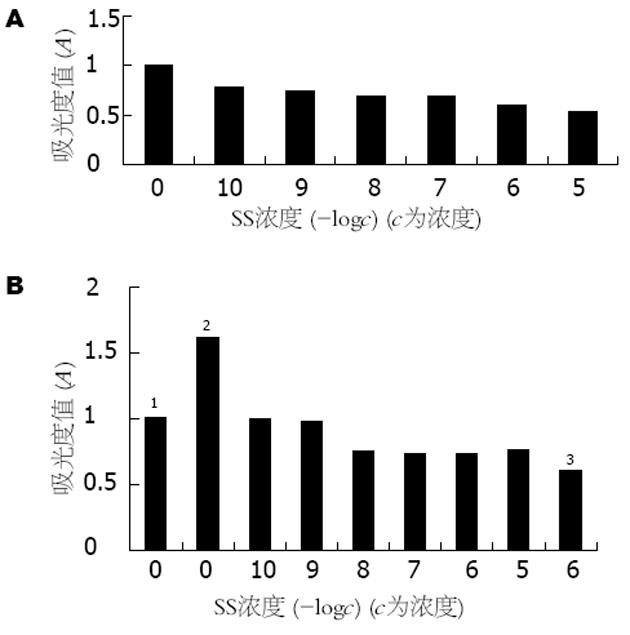
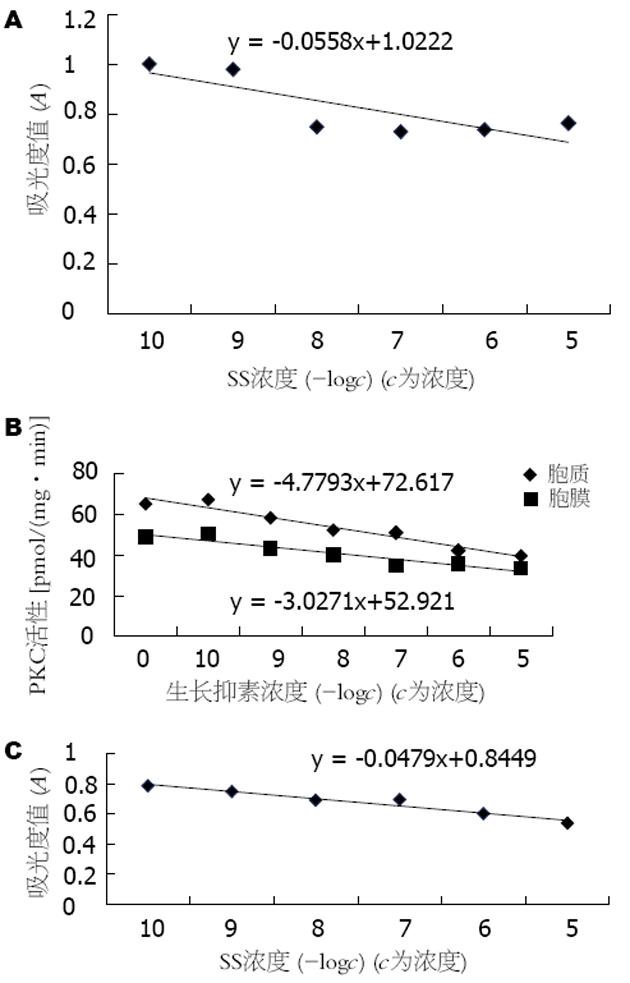
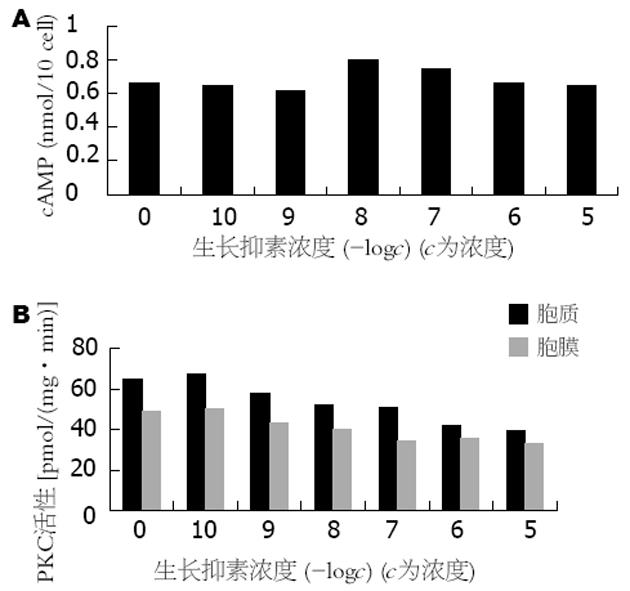
10-8-10-5 mol/L的SS均能显著抑制人低分化胃癌细胞株BGC-823细胞的生长, 而且随着SS浓度的增加, 抑制作用也更明显, 呈剂量依赖关系(图7A, 8A). 10-5-10-7 mol/L的SS能显著抑制BBS的促细胞生长作用, 但无明显的剂量依赖关系(图7B, 图8B). 10-10-10-5 mol/L的SS对BGC-823细胞内cAMP的生成无明显影响(图9A). 10-7-10-5 mol/L的SS可使细胞PKC活性明显下降, 尤以胞膜下降显著. 随着SS浓度加大, 抑制作用也更加明显, 呈剂量依赖关系(图9B, 图8C).
BBS/GRP是具有广泛生物学作用的重要胃肠肽, 近年来的研究表明, GRP在体内外对多种起源的肿瘤组织均有促生长作用[2,5-6], 人胃癌细胞株AGS上有高亲和力的BBS受体亚型-1的表达, 细胞毒BBS类似物AN-215可抑制AGS裸鼠移植瘤的生长[3], Lu et al[7]报道, 在60例胃癌组织中, 11.7%表达GRP, 黏液腺癌和印戒细胞癌GRP的表达率显著高于其他类型的胃癌, 且与淋巴结转移相关, 提示GRP与胃癌的发生、发展及转移有重要的关系. 我们的实验结果表明, BBS能显著促进人胃癌细胞株BGC-823细胞的生长, 而且呈剂量依赖关系, 这种促生长作用可被特异的BBS受体拮抗剂所抑制, 证明这一促生长作用是通过特异性受体所介导. 关于BBS促肿瘤细胞生长的细胞内机制, 国内外研究很少, 而且结果不一致. Kanashiro et al[8]认为, BBS/GRP拮抗剂可抑制胶质细胞瘤U-118MG裸鼠移植瘤的生长, 其受体后机制涉及抑制PKCα表达及抗凋亡蛋白bcl-2的表达; 而GRP促进DLD-1人结肠癌细胞生长, 其受体后信息传递系通过磷脂稀肌醇-3激酶[6]. 细胞增生可通过多个信号传导通路刺激, 他们以协同或结合方式传递环境信号, 各信号途径相互影响、相互制约、相互联系, 共同协调地发挥调控作用. 其中cAMP-PKA及DG-PKC系统在细胞生长调控中起着十分重要的作用. PKC是磷脂酰肌醇通路中的重要激酶, PKC通常以无活性形式存在于胞质中. 在胞外信号与受体结合后, 通过G蛋白活性磷脂酶C(PLC)使膜上肌醇磷脂转换, 产生三磷酸肌醇(IP3)和二酯酰甘油(DG), IP3使胞内Ca2+增加, DG则使PKC移位到膜上. 在膜磷酯和一定浓度的Ca2+存在时, PKC即被激活, PKC被激活后, 可促进一系列与DNA蛋白质合成有关的环节而使细胞增殖. 近年来, PKC在肿瘤发生、发展中的作用日益受到重视, 已发现多种肿瘤组织中PKC含量高于正常, 人胃癌组织中PKC活性显著高于周围正常组织. Uchida et al[9]测定了胃癌组织和邻近正常胃黏膜组织的PKC活性, 结果表明, 当肿瘤小无淋巴结转移, 浸润浅, 分化较好时, PKC活性降低, 提示在胃癌早期, PKC活性呈降下调节. 在肠化生、不典型增生及胃癌的发生过程中, 存在PKC表达水平的增高[10], 提示PKC作为信号传导者, 在胃癌生长中可能起重要作用. PKC目前已发现多个亚类同工酶, 这些亚型分布具有一定的组织或细胞特异性, 在同一细胞的不同生长状态, 亚型的表达也各不相同, 某一信号传导途径可能仅涉及一个PKC亚型. Kanashiro et al[11]研究发现, 胃泌素拮抗剂RC-3940-Ⅱ可抑制H-69人小细胞肺癌移植瘤的生长, 其受体后信息传递通过PKCβ和PKCδ而非PKCα, PKCβ抑制剂317615.2 HCl能抑制Hep肝细胞癌和胃癌移植瘤血管的形成, 并能加强5-氟尿嘧啶和吉西他宾的作用[12]. 我们采用[γ-32p] ATP掺入外源性底物的方法测定PKC的总活性, 结果发现, BBS能增加胃癌细胞胞质及胞膜的PKC活性, 采用Western blot方法, 进一步分析PKC亚型的表达, 发现BBS作用后, PKCα表达明显增加, 提示PKCα在BGC-823胃癌细胞的生长调控中起重要作用, 我们对46例人胃癌细胞的免疫组化研究表明, 胃癌组织PKCα及PKCε表达均明显增加, 而对BGC-823细胞的Western blot分析, 则未见PKCε表达, 这可能因不同生长状态的细胞PKC亚型的表达亦不同. cAMP是腺苷环化酶信号系统中重要的信号分子, 关于cAMP在细胞生长调控中的作用, 有不同报道, 有人认为cAMP对细胞增殖具有正调节作用, 在体外培养的Swiss 3T3细胞中, cAMP对细胞增殖起促进作用, 也有人认为, cAMP-PKA系统对肿瘤细胞增殖起负调节作用, 促进其分化, 本实验观察到, 不同浓度的BBS (10-7-10-5 mol/L)能促进cAMP合成, 呈剂量依赖关系. 提示cAMP是BBS促BGC-823细胞生长的重要细胞内信号. cAMP和PKC代表两个不同的信号传导途径. 有研究表明, 这两个主要的透膜信号系统之间存在相互作用, 特别是佛波酯或DG对PKC的激活, 能促进cAMP的集聚. 而PKC的下降调节会部分地抑制BBS引起的cAMP的集聚, 提示BBS通过两种机制促进cAMP在细胞内的集聚. SS是由D细胞分泌的一种多肽, 其生物学作用主要是抑制内分泌及外分泌功能, 并能影响细胞的增殖能力. 胃癌细胞上存在SS受体, SS类似物可抑制胃癌细胞的生长[4]. 我们的实验结果表明, 不同浓度的SS (10-5-10-8 mol/L)能显著抑制人低分化胃腺癌细胞株BGC-823的生长, 而且呈剂量依赖关系, 与文献报道一致. SS对胃癌细胞生长抑制作用的机制目前尚不清楚, Gao et al[13]报道, 奥曲肽显著抑制SGC7901胃癌细胞的生长, 这种作用可能通过抑制Akt/PKB和端粒酶活性介导, Wang et al[14]认为, 奥曲肽通过MAPK途经抑制SGC7901胃癌细胞生长, 我们的实验结果表明, 不同浓度的SS(10-5-10-10 mol/L), 对cAMP的产生均无明显的抑制作用, 提示SS对BGC-823细胞的生长抑制作用并非通过cAMP-PKA系统. 我们采用[γ-32p] ATP掺入外源性底物的方法, 发现不同浓度的SS能明显抑制胞质及胞膜的PKC活性, 尤以胞膜PKC活性下降显著, 提示SS抑制BGC-823细胞生长可能与降低PKC活性有关. BBS对BGC-823细胞生长有明显促进作用, 而SS-14能明显抑制BBS的促生长作用, 这种作用可能是直接通过SS受体, 抑制PKC活性, 另一方面可能是通过抑制BBS的自分泌作用. 而有研究表明, PKC活性的下降会减少细胞内cAMP的集聚, 这也可能是SS抑制BBS对BGC-823细胞促生长作用的机制之一. SS对细胞生长抑制作用的机制, 目前尚不清楚. 我们的实验结果表明, 使PKC活性下降可能是SS抑制细胞生长的重要机制之一, 另一方面也可能与干扰调节细胞生长的细胞内信号的传导以及肿瘤合成自分泌生长因子有关. 奥曲肽可通过抑制COX2及抑制VEGF和bFGF表达而抑制胃癌细胞的生长[15-16], SS也可通过诱发肿瘤细胞凋亡来抑制细胞生长[4].
总之, BBS能促进BGC-823胃癌细胞的生长, 这种促生长作用是通过细胞膜上的蛙皮素受体介导, 其受体后信息传递途径, 可能涉及OG-PKC和cAMP-PKA系统, 一方面激活PKCα促进细胞增殖, 另一方面可能通过激活腺苷环化酶, 使cAMP增加, 进一步激活PKA, 而促进细胞增殖. 而PKC的激活会进一步增加cAMP在细胞内的集聚, 两套信息传导系统在BBS促BGC-823胃癌细胞增殖的作用中, 起协同作用. PKCα和cAMP可能是BBS促进BGC-823细胞生长的细胞内早期信号, BBS促胃癌细胞生长的晚期信号是什么, 以及cAMP, PKC与核内信息的代谢通路及相互关系, 尚有待进一步研究. SS-14能抑制人BGC-823胃癌细胞的生长, 这种作用可能是直接通过特异性受体介导使细胞内PKC活性下降, 抑制蛋白质磷酸化而抑制细胞生长. 此外, SS-14能抑制BBS的促胃癌细胞生长作用, 其作用机制可能是直接通过SS受体介导, 另一方面也可能是通过干扰BBS的受体后信息传导而抑制细胞增殖.
近年来的研究表明, 某些胃肠激素与胃癌的生长转移密切相关, 如蛙皮素(bombesin,B B S ) 、生长抑苏、胃泌素等, 但作用机制尚不清楚, 对其进行进一步的深入研究将有助于胃癌的早期诊断和更有效的治疗.
本实验结果为研究开发特异性的蛙皮素受体拮抗剂或生长抑素类似物以及蛋白激酶C抑制剂提供了一定的理论依据, 为胃癌的诊断和治疗开辟了新的思路和前景.
本研究为实验研究, 方案设计细致, 有一定科学性、创新性和可读性.
电编: 张敏 编辑:王晓瑜
| 1. | Monstein HJ, Grahn N, Truedsson M, Ohlsson B. Progastrin-releasing peptide and gastrin-releasing peptide receptor mRNA expression in non-tumor tissues of the human gastrointestinal tract. World J Gastroenterol. 2006;12:2574-2578. [PubMed] [DOI] |
| 2. | Patel O, Shulkes A, Baldwin GS. Gastrin-releasing peptide and cancer. Biochim Biophys Acta. 2006;1766:23-41. [PubMed] |
| 3. | Szepeshazi K, Schally AV, Nagy A, Wagner BW, Bajo AM, Halmos G. Preclinical evaluation of therapeutic effects of targeted cytotoxic analogs of somatostatin and bombesin on human gastric carcinomas. Cancer. 2003;98:1401-1410. [PubMed] [DOI] |
| 4. | Hu C, Yi C, Hao Z, Cao S, Li H, Shao X, Zhang J, Qiao T, Fan D. The effect of somatostatin and SSTR3 on proliferation and apoptosis of gastric cancer cells. Cancer Biol Ther. 2004;3:726-730. [PubMed] [DOI] |
| 5. | Stangelberger A, Schally AV, Letsch M, Szepeshazi K, Nagy A, Halmos G, Kanashiro CA, Corey E, Vessella R. Targeted chemotherapy with cytotoxic bombesin analogue AN-215 inhibits growth of experimental human prostate cancers. Int J Cancer. 2006;118:222-229. [PubMed] [DOI] |
| 6. | Patel O, Dumesny C, Giraud AS, Baldwin GS, Shulkes A. Stimulation of proliferation and migration of a colorectal cancer cell line by amidated and glycine-extended gastrin-releasing peptide via the same receptor. Biochem Pharmacol. 2004;68:2129-2142. [PubMed] [DOI] |
| 7. | Lu MZ, Liu Y, Dai YZ, Yuan C, Deng Y. Expression of gastrin and gastrin releasing peptide in patient's with gastric cancer by using tissue chip technique. Zhonghua Weichang Waike Zazhi. 2005;8:159-161. [DOI] |
| 8. | Kanashiro CA, Schally AV, Cai RZ, Halmos G. Antagonists of bombesin/gastrin-releasing peptide decrease the expression of angiogenic and anti-apoptotic factors in human glioblastoma. Anticancer Drugs. 2005;16:159-165. [PubMed] |
| 9. | Uchida N, Okamura S, Kuwano H. Protein kinase C activity in human gastric carcinoma. Oncol Rep. 2000;7:793-796. [PubMed] [DOI] |
| 11. | Kanashiro CA, Schally AV, Zarandi M, Hammann BD, Varga JL. Suppression of growth of H-69 small cell lung carcinoma by antagonists of growth hormone releasing hormone and bombesin is associated with an inhibition of protein kinase C signaling. Int J Cancer. 2004;112:570-576. [PubMed] [DOI] |
| 12. | Teicher BA, Menon K, Alvarez E, Liu P, Shih C, Faul MM. Antiangiogenic and antitumor effects of a protein kinase C beta inhibitor in human hepatocellular and gastric cancer xenografts. In Vivo. 2001;15:185-193. [PubMed] |
| 13. | Gao S, Yu BP, Li Y, Dong WG, Luo HS. Antiprolife-rative effect of octreotide on gastric cancer cells mediated by inhibition of Akt/PKB and telomerase. World J Gastroenterol. 2003;9:2362-2365. [PubMed] [DOI] |
| 14. | Wang CH, Tang CW, Liu CL, Tang LP. Inhibitory effect of octreotide on gastric cancer growth via MAPK pathway. World J Gastroenterol. 2003;9:1904-1908. [PubMed] [DOI] |
| 15. | Tang C, Wang C, Tang L. Effects of combined octreotide and aspirin on the growth of gastric cancer. Chin Med J (Engl). 2003;116:373-377. [PubMed] |