修回日期: 2006-04-26
接受日期: 2006-05-24
在线出版日期: 2006-09-18
目的: 构建含人H. pylori 5种候选疫苗抗原Lpp20, HspA, UreaseA, CagA, UreaseB的编码基因的重组质粒并研究其抗原性.
方法: 应用PCR技术从H. pylori染色体中扩增编码Lpp20, HspA, UreaseA, CagA, UreaseB的基因片段, 将其T-A克隆和测序, 并与GenBank公布的其他H. pylori菌株基因序列比较, 再将目的基因克隆至融合表达载体pGEX-4T-1上中进行表达, 用GST亲和层析对其进行纯化, 纯化产物用于对29株小鼠抗H. pylori-全菌单克隆抗体(mAb)的鉴定及与H. pylori感染患者血清进行Western blot分析.
结果: 扩增的Lpp20, HspA, UreaseA, CagA, UreaseB基因全长分别为528 bp, 351 bp, 675 bp, 855 bp, 1704 bp (GenBank登录号分别为DQ106902, DQ141574, DQ141577, DQ141575, DQ141576), 与GenBank公布的其他菌株的核酸序列的同源性在95%-99%, 表达Lpp20, HspA, UreaseA, CagA, UreaseB融合蛋白的相对分子质量分别约为48 000, 41 000, 52 000, 60 000, 91 000 Da, 29株小鼠抗H. pylori全菌mAb中针对Lpp20, HspA, UreaseA, CagA, UreaseB抗原的分别为4, 5, 5, 1, 6株, 5种抗原的纯化产物均可被H. pylori感染患者血清特异性识别.
结论: 重组表达的Lpp20, HspA, UreaseA, CagA, UreaseB均具有较好的抗原性.
引文著录: 宁云山, 李妍, 龙敏, 董文其, 李明. 幽门螺杆菌5种候选疫苗抗原基因的克隆、表达及抗原性的鉴定. 世界华人消化杂志 2006; 14(26): 2605-2609
Revised: April 26, 2006
Accepted: May 24, 2006
Published online: September 18, 2006
AIM: To construct a recombinant plasmid contai-ning genes encoding Lpp20, HspA, UreaseA, CagA, UreaseB from H. pylori, express it in E.coli and explore the antigenicity.
METHODS: The genes, encoding Lpp20, HspA, UreaseA, CagA, and UreaseB, were amplified from H. pylori chromosomal DNA by polymerase chain reaction (PCR), and then T-A was cloned and sequenced. The target genes cloned into pGEX-4T-1 fusion expression vector were expressed in E.coli and purified by GST-affinity chromatography. The purified products were used to identify 29 strains of mouse monoclonal antibodies (mAbs) against H. pylori, and the antigenicity of the products was analyzed by Western blot with serum of H. pylori-infected patients.
RESULTS: Lpp20, HspA, UreaseA, CagA, and UreaseB fragments were 528 bp, 351 bp, 675 bp, 855 bp, and 1704 bp in length, respectively (GenBank submission No. DQ106902, DQ141574, DQ141577, DQ141575, and DQ141576, respectively), and the nucleotide homology was 95%-99% with other H. pylori strains. Lpp20, HspA, UreaseA, CagA, and UreaseB fusion protein were expressed with molecular weights of 48 000, 41 000, 52 000, 6 0000, and 91 000 Da in E.coli respectively. Of 29 anti-H. pylori mouse mAbs, there were 4, 5, 5, 1, and 6 strains against Lpp20, HspA, UreaseA, CagA, and UreaseB. Western blot proved that five recombinant proteins were specifically recognized by the serum of H. pylori-infected patients.
CONCLUSION: Five recombinant proteins, Lpp20, HspA, UreaseA, CagA, and UreaseB, preserve original antigenicity.
- Citation: Ning YS, Li Y, Long M, Dong WQ, Li M. Cloning, expression and antigenicity identification of five candidate vaccine antigen genes of human Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2006; 14(26): 2605-2609
- URL: https://www.wjgnet.com/1009-3079/full/v14/i26/2605.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i26.2605
1982年澳大利亚罗宾·沃伦和巴里·马歇尔发现一种长期定植于人体胃黏膜的致病菌--幽门螺杆菌(Helicobacter pylori, H. pylori), 并因此获得了2005年诺贝尔医学奖. 大量研究证实, 自然感染H. pylori后机体的免疫反应不能清除细菌, H. pylori的长期感染是慢性消化道疾病如B型(胃窦)胃炎、消化性溃疡、胃黏膜相关淋巴组织(MALT)胃癌等发生、发展的重要原因[1]. 目前在一些发达国家, H. pylori的感染率虽然有所下降, 但仍存在大量感染者; 而在发展中国家, H. pylori的感染状况则更为严重. 目前临床上常采用抗生素治疗H. pylori的感染, 虽可在一定程度上治愈感染, 但存在患者的依从性差、耐药菌株产生和反复感染等问题. 大量的实验证明, 免疫接种可预防甚至治疗H. pylori的感染, 所以H. pylori疫苗的研究具有深远的发展前景. H. pylori的抗原成分很多, 目前已发现H. pylori单一抗原的保护率几乎均低于80%, 2种或2种以上H. pylori抗原组合的疫苗有理想的保护效果[2]. 我们选取尿素酶A和B (UreaseA, B)、热休克蛋白A (heat shock protein, HspA)、脂蛋白(lipoprotein, Lpp20)、细胞毒素相关基因蛋白(cytotoxin-assosiated gene A, CagA)等作为研究对象, 利用基因工程技术构建了这5种基因的重组质粒, 并进行了测序和表达, 为H. pylori疫苗和诊断抗原的研究奠定基础.
H. pylori感染患者血清(尿素酶实验阳性)和健康正常人血清(尿素酶实验阴性)均来自南方医科大学附属南方医院消化科. H. pylori标准株NCTC11639由本校微生物实验室保存; 菌株E.coli DH5a, TOP10和表达载体pGEX-4T-1由本室保存. Taq DNA聚合酶、pMD18-T载体、限制性内切酶、T4连接酶、DNA Marker及蛋白Marker均为TaKaRa公司产品. 引物设计参考GenBank收录的H. pylori国际标准株26695的基因序列, 应用Primer 5.0设计目的基因的PCR引物如下: Lpp20: P1 5'-GAATTCATGAAAAATCAAGTTAAAAA-3'(EcoRⅠ) P2 5'-GTCGACCTACTTTTTAACCATGCC-3'(SalⅠ); HspA: P3 5'-GGATCCAAGTTTCAACCATTAGGA-3'(BamH Ⅰ) P4 5'-GAATTCTTAGTGTTTTTTGTGATC-3'(EcoRⅠ); UreaseA: P5 5'-GGATCCAAGTTTCAACCATTAGGA-3'(BamH Ⅰ) P6 5'-GAATTCTTAGTGTTTTTTGTGATC-3'(EcoRⅠ); CagA: P7 5'-GGATCCGGAGAAACAATGACTAAC-3'(BamH Ⅰ) P8 5'-GTCGACTTCCATATCGCCAAGA-3'(SalⅠ); UreaseB: P9 5'-GAATTCAAAAAGATTAGCAG-3'(EcoRⅠ) P10 5'-GTCGACGAAAATGCTAAAGA-3'(SalⅠ), 在每对引物的上、下游引进合适的酶切位点(划线处), 引物由上海博亚和大连TaKaRa公司合成. 细菌基因组DNA提取试剂盒、质粒提取试剂盒及切胶回收试剂盒均为TaKaRa公司产品. PVDF电转印膜为Bio-Rad公司产品. HRP-标记的羊抗鼠或羊抗人IgG及链亲霉素标记的二抗为Gibco BRL公司产品. 29株小鼠抗H. pylori全菌mAb由本室制备[3].
1.2.1 重组表达质粒的构建和鉴定: 从固体培养基上刮取适量生长状态良好的H. pylori菌落, 置于PBS缓冲液中, DNA的提取参照细菌基因组DNA提取试剂盒说明进行. 用Taq DNA聚合酶, 以提取的H. pylori染色体DNA为模板, 按照常规PCR条件进行扩增, 60 mL反应体积. 反应条件如下: 预变性95 ℃ 5 min, 变性95 ℃ 60 s, 退火温度Lpp20, HspA, UreaseA, CagA, UreaseB分别为58 ℃, 50 ℃, 50 ℃, 54 ℃, 52 ℃, 时间50 s, 延伸72 ℃ 60 s, 共进行35个循环, 最后一个循环结束后72 ℃再延伸6 min, 反应产物于10 g/L琼脂糖凝胶电泳进行分析. 将目的基因与pMD18-T载体进行连接, 以连接产物转化到E.coli DH5a感受态中. 挑取单个菌落, 37 ℃, 220 r/min摇过夜, 提取质粒, 进行双酶切鉴定, 将鉴定正确的重组质粒送上海博亚公司进行测序. 重组目的基因/pMD18-T进行双酶切, 表达载体pGEX-4T-1也用相同的酶进行双酶切. 将切胶纯化的目的基因和表达载体按4:1(摩尔数)用T4 DNA连接酶进行连接, 反应体积10 mL, 于16 ℃连接过夜. 将连接产物转化到E.coli TOP10感受态中, 涂于含氨苄青霉素(100 mg/L)LB固体培养基平皿中. 挑取单个菌落, 37 ℃, 220 r/min摇过夜, 提取质粒, 进行双酶切鉴定.
1.2.2 目的基因的表达及产物的纯化: 将鉴定正确的阳性克隆工程菌接种到含氨苄青霉素(100 mg/L)的LB液体培养基中, 37 ℃, 220 r/min摇过夜菌. 次日, 按1%接种到含氨苄青霉素(100 mg/L)的LB液体培养基中, 当A600 = 0.7时, 加入1 mol/L的IPTG至终浓度为1 mmol/L, 诱导4 h后收菌, 进行100 g/L SDS-PAGE分析. 表达产物超声破菌后, 在上清和沉淀中都存在目的蛋白, 取上清进行实验. 装Glutathione Sepharose 4B亲和层析柱(1.0 cm×20 cm), 用1×PBS (pH 7.2-7.4)平衡后, 上样超声破菌后的上清, 流速为1 mL/min, 再以 PBS平衡至基线, 用10 mmol/L谷胱甘肽洗脱, 收集各蛋白峰进行SDS-PAGE分析.
1.2.3 ELISA法鉴定抗H. pylori鼠mAb: 将纯化后的5种蛋白分别包被酶标板(5 mg/L), 依次加入本室制备的29株抗H. pylori鼠mAb及HRP-标记的羊抗鼠IgG, TMB底物显色, 用酶标仪于波长450 nm测定吸光度(A)值.
1.2.4 重组抗原的Western blot分析: 将纯化后的5种蛋白进行SDS-PAGE, 然后将凝胶上的蛋白转移至NC膜上, 依次滴加健康正常人血清、H. pylori感染患者血清进行反应, 二抗为HRP-标记的羊抗人IgG, 每步均经温育和洗涤. 暗室内将杂交后NC膜放入显色盒内, 加上混合好的显色液2 mL, 约1 min, 出现明显的蛋白带者为阳性.
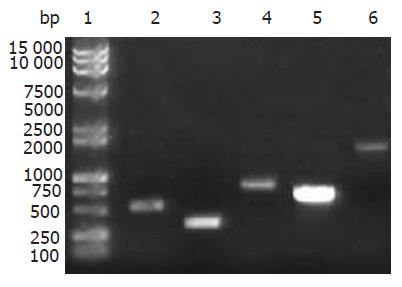
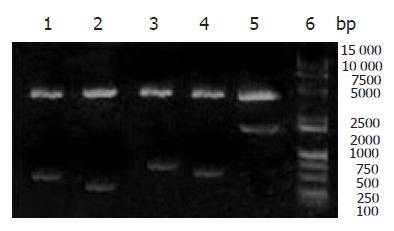
琼脂糖凝胶电泳分析, PCR扩增目的基因DNA片段的大小同预计的结果相符(图1). 重组目的基因/pMD18-T质粒用双脱氧核苷酸法测序后分析, Lpp20, HspA, UreaseA, CagA, UreaseB基因全长分别528, 351, 675, 855, 1704 bp, 与GenBank上公布的其他菌株核酸序列相比, 同源性为95%-99%, 在GenBank上登录这些序列, 登录号分别为DQ106902, DQ141574, DQ141577, DQ141575, DQ141576. 将重组表达质粒用相应的双酶切进行鉴定, 切出大约5000 bp表达载体和目的基因片段, 同预期的结果相符(图2).
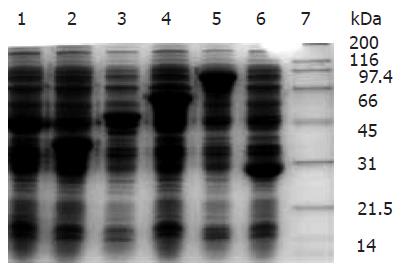
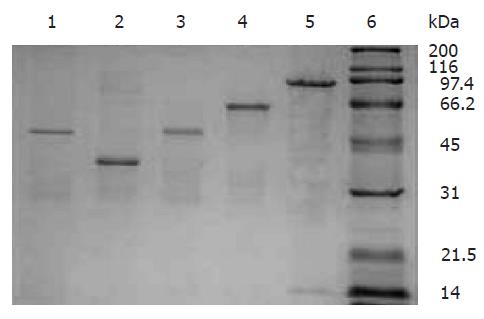
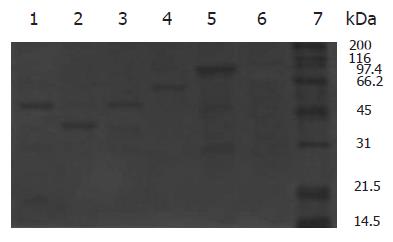
将含目的基因/pGEX-4T-1的工程菌在IPTG的诱导下在大肠杆菌中表达, 表达产物经SDS-PAGE分析, Lpp20, HspA, UreaseA, CagA, UreaseB分别表达分子质量约为48 000, 41 000, 52 000, 60 000, 91 000 kDa的融合蛋白(图3). 将表达产物超声破菌后, 上清和沉淀中都有目的蛋白的存在, 取上清进行亲和层析纯化. 纯化后的目的蛋白进行SDS-PAGE分析, 纯度均达到90%以上(图4).
应用ELISA法鉴定29株小鼠抗H. pylori全菌mAb, 针对Lpp20, HspA, UreaseA, CagA, UreaseB抗原的mAb分别为4, 5, 5, 1, 6株, 说明重组目的抗原具有很好的抗原性.
Western blot结果显示, 5种抗原均与H. pylori感染患者血清有特异性反应, 反应条带与预期大小一致(图5), 而与健康正常人血清没有反应.
从幽门螺杆菌疫苗的研究进展上看, 理想的疫苗候选抗原应该具有特异性、保守性、低毒性、能够定位于病原的表面等特征. Lpp20蛋白是定位于H. pylori外膜上的一种高度保守的脂蛋白, 将经H. pylori全菌蛋白免疫家兔制备的抗血清, 用于与细菌的蛋白组分进行反应时, 发现Lpp20蛋白是抗体识别的主要抗原组分[4]. 将Lpp20经口免疫小鼠, 能诱导出特异性的IgG抗体的产生. 将这种抗体的杂交瘤细胞回输到小鼠体内后, 能显著减少细菌的感染量, 表明Lpp20是一种理想的疫苗候选抗原[5]. HspA是H. pylori共有的抗原成分, 在不同的H. pylori菌株间氨基酸序列高度保守, 且HspA位于细菌表面, 易被宿主识别, 与H. pylori诱导的胃黏膜炎症密切相关[7], HspA诱发机体产生保护性免疫反应也已得到证实[6]. CagA基因和CagA蛋白是H. pylori毒力菌株的基因型和表型的标志. Ⅰ型(高毒株)分泌的CagA蛋白与消化性溃疡、萎缩性胃炎及胃癌的发生密切相关[7]. 另外, CagA还具有良好的免疫保护性, 在小鼠体内已证实可以预防和根治H. pylori的感染, 因此可作为研制H. pylori疫苗的候选抗原[8]. Urease是H. pylori最为保守和最为确定的一种保护性抗原成分, 他由A, B 2个亚单位组成, 以B亚单位的免疫反应性最强, 能引起H. pylori感染患者血清中抗该菌的IgG和IgA显著升高[9]. 应用细菌的超声粉碎抗原、纯化UreaseB作为抗原免疫动物取得了较好的免疫预防和治疗效果[10]. 从H. pylori菌体中分离各种抗原十分困难, 我们采用PCR方法从H. pylori标准株NCTC11639中获取Lpp20, HspA, UreaseA, CagA, UreaseB基因, 登录到GenBank上(登录号为DQ106902, DQ141574, DQ141577, DQ141575, DQ141576), 与GenBank上公布的其他H. pylori菌株相应的核酸序列相比具有高度的同源性. 我们首先将基因进行T-A克隆, 可克服直接酶切PCR产物效率不高的弊端. 在此基础上, 再将基因克隆入pGEX-4T-1融合表达的载体中, 由于pGEX-4T-1含有GST的融合表达标签, 所以融合表达的各种蛋白可用GST亲和层析进行纯化. 纯化后的各种蛋白用于对29株小鼠抗H. pylori全菌mAb筛选, 筛选出针对Lpp20, HspA, UreaseA, CagA, UreaseB抗原的抗体分别为4, 5, 5, 1, 6株, Western blot分析重组表达的各种蛋白可与H. pylori感染的患者血清发生特异性反应, 可见重组蛋白具有很好的抗原性.
人自然感染H. pylori后, 宿主的免疫反应不能有效清除病原菌, 目前临床上常采用联合应用质子泵抑制剂和抗生素的"三联"疗法来控制H. pylori的感染. 然而, 药物治疗有很大的局限性. 随着H. pylori全基因序列及功能蛋白的揭示, 用免疫方法来防治H. pylori的感染成为可能, 疫苗的研制逐渐成为研究热点.
Lpp20, HspA, UreaseA, CagA, Urease B等主要保护性抗原都可作为单独抗原使用, 在动物实验中均表现出一定的免疫保护作用, 但其保护性具有一定的局限性, 因此发展含有两种或两种以上主要保护性抗原组成的多价重组疫苗已成为H. pylori疫苗研制的方向.
第三军医大学邹全明教授成功研制的国家Ⅰ类新药--口服重组H. pylori疫苗, 就是分离、克隆H. pylori保护性抗原亚单位UreB及HspA基因, 将其融合构建成以LTB为分子内黏膜佐剂的基因工程疫苗候选株, 已进入Ⅰ、Ⅱ期临床实验, 这与本文的研究宗旨相符.
本文从H. pylori标准株NCTC11639中获取Lpp20, HspA, UreaseA, CagA, UreaseB基因, 登录到GenBank上, 这是关于NCTC11639菌株这些基因在GenBank上的首次登录, 与GenBank上公布的其他H. pylori菌株(如26695, J99)相应的核酸序列相比具有高度的同源性.
亲和层析(affinity chromatography): 利用共价连接有特异配体的层析介质分离蛋白质混合物中能特异结合配体的目的蛋白或其他分子的层析技术.
幽门螺杆菌与消化性溃疡、胃癌等疾病的发病关系密切, 如何有效的杀灭体内H. pylori, 是研究的热点. 本研究构建了5种H. pylori侯选疫苗抗原, 并检测了这些疫苗的抗原性, 为今后H. pylori检测试剂和疫苗的研究奠定基础. 该研究选题新颖, 设计合理, 结果可靠.
电编: 张敏 编辑:张焕兰
| 1. | Losonsky GA, Kotloff KL, Walker RI. B cell responses in gastric antrum and duodenum following oral inactivated Helicobacter pylori whole cell (HWC) vaccine and LT(R192G) in H. pylori seronegative individuals. Vaccine. 2003;21:562-550. [PubMed] [DOI] |
| 2. | Bumann D, Jungblut PR, Meyer TF. Helicobacter pylori vaccine development based on combined subproteome analysis. Proteomics. 2004;4:2843-2848. [PubMed] [DOI] |
| 4. | Kostrzynska M, O'Toole PW, Taylor DE, Trust TJ. Molecular characterization of a conserved 20-kilodalton membrane-associated lipoprotein antigen of Helicobacter pylori. J Bacteriol. 1994;176:5938-5948. [PubMed] [DOI] |
| 5. | Keenan J, Oliaro J, Domigan N, Potter H, Aitken G, Allardyce R, Roake J. Immune response to an 18-kilodalton outer membrane antigen identifies lipoprotein 20 as a Helicobacter pylori vaccine candidate. Infect Immun. 2000;68:3337-3343. [PubMed] [DOI] |
| 6. | Marchetti M, Arico B, Burroni D, Figura N, Rappuoli R, Ghiara P. Development of a mouse model of Helicobacter pylori infection that mimics human disease. Science. 1995;267:1655-1658. [PubMed] [DOI] |
| 7. | Blaser MJ, Perez-Perez GI, Kleanthous H, Cover TL, Peek RM, Chyou PH, Stemmermann GN, Nomura A. Infection with Helicobacter pylori strains possessing cagA is associated with an increased risk of developing adenocarcinoma of the stomach. Cancer Res. 1995;55:2111-2115. [PubMed] |
| 8. | Webb PM, Crabtree JE, Forman D. Gastric cancer, cytotoxin-associated gene A-positive Helicobacter pylori, and serum pepsinogens: an international study. The Eurogst Study Group. Gastroenterology. 1999;116:269-276. [PubMed] [DOI] |
| 9. | Perez-Perez GI, Cutler AF, Blaser MJ. Value of serology as a noninvasive method for evaluating the efficacy of treatment of Helicobacter pylori infection. Clin Infect Dis. 1997;25:1038-1043. [PubMed] [DOI] |