修回日期: 2006-06-26
接受日期: 2006-07-10
在线出版日期: 2006-09-08
目的: 探讨逆转录病毒介导的乙型肝炎病毒(HBV) X, P单、双靶区的反义RNA在乙型肝炎转基因小鼠肝细胞中HBV复制的影响.
方法: 构建表达HBV X, P双靶区正、反义RNA的重组载体质粒, 与脂质体混合, 注入小鼠体内, 第8周时取小鼠肝脏, 提取肝组织总RNA, 进行逆转录, 将逆转录后的cDNA用PCR扩增, 琼脂凝胶电泳和DNA测序定性, 荧光聚合酶链反应定量; 提取肝组织基因组DNA, 利用荧光聚合酶链反应定量测定HBV DNA含量.
结果: 经过PCR扩增, 琼脂凝胶电泳和DNA测序定性, 荧光聚合酶链反应定量等方法检测到小鼠肝脏内反义RNA得到高效表达; 8 wk后, 对HBV DNA (×105 copies/g)的作用: 与对照组相比(7.24±1.62), 空质粒组(9.49±3.34)及正义RNA组(6.52±1.53)之间无明显差异, 单(2.60±1.13, 2.83±1.67)、双靶区反义RNA组(3.24±0.45)与对照组之间有明显差异(P<0.05), 但单、双靶区反义RNA组间无明显差异(P>0.05).
结论: 将脂质体包裹逆转录病毒载体(质粒)介导的单、双靶区乙肝病毒反义RNA经iv导入转基因小鼠细胞的方法可行; 反义RNA对乙型肝炎病毒转基因小鼠有显著抗HBV复制作用; 对转基因小鼠肝脏中HBV DNA的复制有明显的抑制作用, 但单、双靶区反义RNA组间无明显差异.
引文著录: 张政, 席宏丽, 公维波, 李文刚, 于敏, 曾争, 徐小元. 逆转录病毒介导双靶区反义RNA在转基因小鼠肝细胞中的表达及对HBV DNA复制的影响. 世界华人消化杂志 2006; 14(25): 2551-2555
Revised: June 26, 2006
Accepted: July 10, 2006
Published online: September 8, 2006
AIM: To detect the expression of X and P region dual-target antisense RNA of hepatitis B virus (HBV) mediated by ratroviral vector in the liver cells of transgenic mice and its effect on the replication of HBV DNA.
METHODS: The recombinant retroviral vector plasmids expressing dual-target antisense RNA complementary to HBV X and P region were constructed and then injected into the transgenic mice. The experimental mice were divided into blank, pLXSN, pLXSN-asX, pLXSN-asP, pLXSN-asXP, and pLXSN-seXP group. The total RNA, extracted from the mice at the 8th wk, was reversely transcribed, and then the cDNA was amplified with polymerase chain reaction (PCR). Thereafter, agarose gel electrophoresis, sequencing analysis and fluorescent PCR were performed. The replication of HBV DNA was tested by fluorescence quantitative PCR.
RESULTS: The HBV dual-target antisense RNA was expressed in the liver cells of mice and with high efficiency. After 8 wk, the replications of HBV DNA (×105 copies/g) were 7.24 ± 1.62, 9.49 ± 3.34, 2.60 ± 1.13, 2.83 ± 1.67, 3.24 ± 0.45, 6.52 ± 1.53 in blank, pLXSN, pLXSN-asX, pLXSN-asP, pLXSN-asXP and pLXSN-seXP group. The levels of HBV DNA were significantly higher in single- or dual-target antisense RNA groups than those in other groups (P < 0.05). However, there were no marked differences between control groups as well as between single-target and dual-target group (P > 0.05).
CONCLUSION: The hepatitis B virus dual-target antisense RNA can be expressed in the liver cells of transgenic mice with high efficiency, and it can inhibit the replication of HBV DNA in mice liver. However, there is no significant difference between single-target and dual-target RNA.
- Citation: Zhang Z, Xi HL, Gong WB, Li WG, Yu M, Zeng Z, Xu XY. Retrovirus-mediated expression of dual-target antisense RNA in liver cells of transgenic mice and its influence on replication of hepatitis B virus. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2551-2555
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2551.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2551
乙型肝炎(HB)是严重危害我国人民身体健康的传染病, 近年来发展起来的基因技术为治疗HB提供了新途径[1-2]. 反义RNA是1980年代初发现的一种自然调控基因, 他是一类能与特异mRNA互补的小分子RNA, 通过其对mRNA的调控影响相应基因的表达与复制[3], 从而达到基因治疗的目的. 体外研究表明, 反义RNA在细胞水平上具有明显的抗HBV复制和表达作用[1-2,4]. 但HBV是高变异性病毒, 多靶位反义RNA可能会取得更高的抑制效率, 有研究表明, 双靶区反义RNA在体外有抗HBV的作用, 并且证明双靶区反义RNA较单靶区反义RNA抑制HBV复制的作用更强[5], 我们通过构建对HBV X, P区双靶区反义RNA逆转录病毒载体, 与脂质体混合, 并将其注入HBV转基因小鼠, 利用脂质体的组织靶向性, 将逆转录病毒载体导入肝细胞, 研究反义RNA在转基因小鼠肝细胞中的表达, 通过检测小鼠肝细胞中HBV DNA含量来研究反义RNA对转基因小鼠肝细胞内HBV复制的抑制作用.
单、双靶区逆转录病毒载体质粒由本室构建[6], 分别合成互补于HBV (ayw亚型)X区核苷酸1400-1430 nt的X片段以及互补于HBV P 区核苷酸2375-2405 nt的P片段的单靶区, 以及X, P区正、反义双靶区载体质粒; 转基因鼠购自广州空军医院[7], 血清HBsAg(+), HBV DNA(+), 48只(体质量18-20 g), 雌雄各半; 脂质体购自北京晶美公司; TRNzol试剂盒购自Invitrogen公司; AMV, RNA酶抑制剂、Taq酶、Buffer液、DNTPS等购自北京赛百胜公司; PCR仪、PCR荧光定量仪为ABI5700型; SYBR Green荧光染料购于北京天来生物医学科技公司; 引物序列由北京赛百胜合成; DNA测序由北京奥科公司完成; HBV DNA定量检测试剂盒购自广州达安基因有限公司.
1.2.1 重组逆转录病毒载体的构建[6]: 据HBV (ayw)基因序列, 合成互补于HBV (ayw亚型)X区核苷酸1400-1430 nt的X片段以及互补于HBV P区核苷酸2375-2405 nt的P片段, X片段两端分别含有SpeⅠ和BamHⅠ酶切位点. P片段两端分别含有AvrⅡ和BclⅠ酶切位点. 逆转录病毒载体pLXSN用相同的限制性内切酶酶切后, 琼脂糖凝胶电泳分离, 低溶点胶回收纯化大片段. 将X片段或P片段与载体片段按3:1摩尔浓度比混匀, 分别正向、反向插入质粒的相应酶切位点. 将连接物转化感受态JM109细菌, 铺于LB平板,氨苄青霉素筛选, 37 ℃过夜, 挑取菌落, 扩增后提取质粒, 经限制性内切酶分析筛选出正、反向插入的重组质粒. 将表达X区和P区反义RNA重组载体质粒分别命名为pLXSN-asX, pLXSN-asP. 将表达X区和P区正义RNA重组载体质粒分别命名为pLXSN-seX, pLXSN-seP. 将pLXSN-asX和pLXSN-seX用AvrⅡ和BclⅠ酶切后正向、反向插入P片段构建双靶区重组载体质粒. 将X, P双靶区反义RNA和正义RNA重组载体质粒分别命名为pLXSN-asXP和pLXSN-seXP.
1.2.2 脂质体包裹逆转录病毒载体(质粒)的制备[8]: 脂质体(20 mmol/L)与50 g/L的葡萄糖按2:3的比例混匀. 将等体积的质粒(1 kg/L)迅速加入上述溶液, 充分混匀, 室温下反应1 h后应用, 即脂质体-质粒混合物.
1.2.3 转染乙型肝炎转基因鼠[8]: 将48只转基因鼠随机分为6组, 每组8只(最后存活44只). 第1组为blank组(注射50 g/L的葡萄糖的空白对照), 第2-6组分别为pLXSN(空白载体对照)、pLXSN-asX(反义单靶区X组)、pLXSN-asP(反义单靶区P组)、pLXSN-asXP(反义双靶区XP组)、pLXSN-seXP(正义双靶区XP组). 分别在1, 3, 5 d经尾静脉给每只小鼠注射相应的脂质体-质粒混合物200 µL, 空白对照注射50 g/L葡萄糖200 µL. 于第8周取小鼠肝脏冷藏后备检.
1.2.4 组织RNA的提取: 取各小鼠部分肝组织称质量后, 按照TRIzol说明书进行准备和操作.
1.2.5 RNA的逆转录: 根据逆转录病毒载体的目的基因片段碱基顺序利用Primer 5软件设计引物(引物序列见1.2.6). 取10 µg RNA, 将RNA、引物(各组均取上游引物)、AMV、RNA酶抑制剂、dNTP、Buffer液加入一个反应体系中, 42 ℃ 60 min, 94 ℃ 5 min终止反应.
1.2.6 cDNA的PCR扩增: 由于质粒pLXSN-asX和pLXSN-asP插入片段分别只有30 bp, 故设计引物一端与插入片段互补, 一端与载体互补; 质粒pLXSN-asXP和pLXSN-seXP引物一端与X片段互补, 一端与P片段互补. 引物序列: pLXSN-asX组: sense: 5'CTGTACTAGTACGTAAACAAAGGA3', antisense: 5'GCGGGACTATGGTTGCTGAC3'; pLXSN-asP组: sense: 5'CGAGGGAGTTCTTCTTCTGA3', antisense: 5'TCTGTTGTGCCCAGTCATAG3'; pLXSN-asXP组: sense: 5'CTAGTACGTAAACAAAGGAC3', antisense: 5'CAGAAGAAGAACTCCCTC3'; pLXSN-seXP组: sense: 5'CTGCGTCTGTACTAGTTGCG3', antisense: 5'GAGGCGAGGGAGTTCTTCTT3'. 条件: pLXSN-asX组: 94 ℃ 60 s, 60 ℃ 80 s, 72 ℃ 90 s共35循环; pLXSN-asP组: 94 ℃ 60 s, 56 ℃ 45 s, 72 ℃ 90 s共35循环; pLXSN-asXP组: 94 ℃ 60 s, 52 ℃ 75 s, 72 ℃ 75 s共35循环; pLXSN-seXP组: 60 s, 57 ℃ 45 s, 72 ℃ 45 s共35循环, 然后进行琼脂凝胶电泳及测序检测.
1.2.7 荧光PCR定量分析: 按照SYBR荧光定量试剂盒说明书严格操作.
1.2.8 肝组织HBV DNA的检测: 每只小鼠各取部分肝组织称质量后研磨, 提取基因组DNA, 各取0.5 mg基因组DNA, 依照HBV核酸扩增荧光定量检测试剂盒使用说明进行操作, 定量检测HBV DNA含量.
1.2.9 血清HBV DNA的检测: 血清HBV DNA依照HBV核酸扩增荧光定量检测试剂盒使用说明进行检测, 结果以拷贝数/L表示.
统计学处理 引物设计软件: Primer 5; 统计软件: SPSS 11.5, 方法为单因素方差分析.
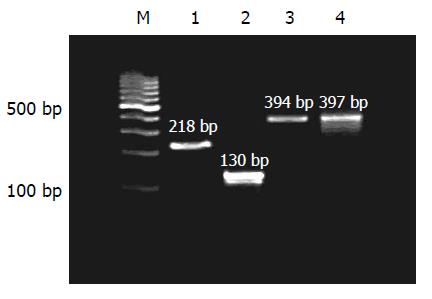
扩增产物经琼脂凝胶电泳分析与理论预计值相符(pLXSN-asX组, pLXSN-asP组, pLXSN-asXP组, pLXSN-seXP组分别应扩增出218 bp, 130 bp, 394 bp, 397 bp条带(图1). 经北京奥科公司测序鉴定核苷酸测序结果基本正确; PCR定量分析结果见表1. 经过检测pLXSN-asX组平均每克肝组织可检测到4.63×108拷贝反义RNA; pLXSN-asP组可检测到3.68×108拷贝反义RNA; pLXSN-asXP组可检测到4.60×108拷贝反义RNA; pLXSN-seXP组可检测到2.0×106拷贝正义RNA. 说明各组RNA在肝组织中均得到了表达. 然后分别检测了肝组织及血清中HBV DNA的含量(浓度), 用来检测反义RNA对小鼠HBV复制的影响(表2, 表3).
| pLXSN-asX(×108) | pLXSN-asP(×108) | pLXSN-asXP(×108) | pLXSN-seXP(×106) | |
| 4.53 | 2.29 | 4.55 | 1.18 | |
| 4.57 | 1.56 | 2.10 | 0.61 | |
| 5.69 | 6.65 | 9.63 | 2.49 | |
| 4.64 | 5.65 | 5.08 | 1.23 | |
| 4.27 | 0.67 | 2.96 | 2.92 | |
| 3.97 | 0.89 | 3.29 | 5.04 | |
| 4.73 | 6.32 | --- | 1.36 | |
| 4.60 | 5.37 | --- | 1.19 | |
| 平均 | 4.63±0.49 | 3.68±2.56 | 4.60±2.69 | 2.00±1.44 |
| blank | pLXSN | pLXSN-asX | pLXSN-asP | pLXSN-asXP pLXSN-seXP | ||
| 10.40 | 8.44 | 2.44 | 2.41 | 3.29 | 6.60 | |
| 6.33 | 6.04 | 1.94 | 2.97 | 3.27 | 5.44 | |
| 6.10 | 11.50 | 1.70 | 1.09 | 2.68 | 6.67 | |
| 5.53 | 10.70 | 3.03 | 3.97 | 3.11 | 10.14 | |
| 6.73 | 14.40 | 1.38 | 1.40 | 4.04 | 6.10 | |
| 8.60 | 5.85 | 2.90 | 1.66 | 3.03 | 5.55 | |
| 7.92 | --- | 2.36 | 6.24 | --- | 5.94 | |
| 6.31 | --- | 5.03 | 2.87 | --- | 5.68 | |
| 平均 | 7.24±1.62 | 9.49±3.34 | 2.60±1.13a | 2.83±1.67a | 3.24±0.45a | 6.52±1.53 |
| blank | pLXSN | pLXSN-asX pLXSN-asP | pLXSN-asXP | pLXSN-seXP | ||
| 10.10 | 0.92 | 6.40 | 1.30 | 0.96 | 8.60 | |
| 11.00 | 7.20 | 1.00 | 3.10 | 1.00 | 9.80 | |
| 2.00 | 15.00 | 0.93 | 3.20 | 1.00 | 0.91 | |
| 5.10 | 10.00 | 1.20 | 3.20 | 0.87 | 2.60 | |
| 1.97 | 21.00 | 0.76 | 1.00 | 1.10 | 3.30 | |
| 1.68 | 31.00 | 6.50 | 0.96 | 2.90 | 6.80 | |
| 6.80 | --- | 1.10 | 1.15 | --- | 1.40 | |
| 8.60 | --- | 5.20 | 3.50 | --- | 1.10 | |
| 平均 | 5.91±3.80 | 9.54±7.52 | 2.89±2.64a | 2.04±1.18a | 1.31±0.78a | 4.31±3.57 |
反义RNA导入细胞后, 可以与其相应的mRNA结合, 阻断其表达, 从而达到抑制病毒复制的作用, 我们可以通过检测血液及肝细胞中HBV的抗原标志物或HBV DNA来判断他的作用, 但是他能否起作用的前提是反义RNA是否被导入细胞内并得到表达. 季伟 et al[9]曾观察到利用逆转录病毒载体包装细胞系统能够介导HBV反义基因在真核细胞中转录表达. 本实验利用脂质体包裹逆转录病毒载体靶向导入肝细胞, 通过提取总RNA, 进行逆转录, 再利用PCR扩增, 琼脂凝胶电泳, 核苷酸测序的方法检测目的基因片段, 并利用荧光定量PCR的方法来检测其表达的数量. 结果表明, 反义RNA在转基因小鼠肝组织中得到正确表达, 每克肝组织中可检测到反义RNA约2.0×106-4.6×108拷贝. Goodarzi et al[10]合成了一系列的互补于HBV Pre-S及S基因的反义RNA片段, 把反义HBV RNA经不同途径注射小鼠, 系统地研究了反义HBV RNA在机体内的分布、稳定性及毒性等问题, 结果发现, 无论何种注射途径, 在注射后10-30 min内反义RNA在肝脏的浓度最高, 达1.3%-2%注射总量. 我们在8 wk后仍能检测到反义RNA的表达, 说明反义RNA在转基因小鼠体内得到了持续表达.
HBV虽是一种DNA病毒, 但其复制存在逆转录过程, 其先形成3.5 kb前基因组RNA, 以此作为DNA复制的模板. 同时作为HBsAg、HBeAg、HBcAg、PreSl、PreS2、DNA多聚酶、HBxAg的翻译模板. 而在转录过程中存在2.4, 2.1, 0.7 kb的RNA均可以成为反义RNA的重要结合靶链. 由于HBV DNA多聚酶缺乏校对作用, 在复制过程中易产生变异株而导致对药物治疗敏感降低或耐药现象, 因此需要研究作用于HBV位点较多的药物或疗法. 我室曾构建了表达互补于HBV (ayw亚型)的X区(1400-1430 nt)的X片段, 互补于HBV P区(2375-2405 nt)片段的正义、反义RNA的单、双靶区重组载体质粒并转染PA317细胞, 并观察到细胞内HBV反义RNA有明显抗HBV复制和表达的作用, 而且双靶区反义RNA抗HBV的作用较单靶区反义RNA更明显[5]. 我们在上述实验的基础上, 将单、双靶区反义RNA iv转基因小鼠体内, 观察对转基因小鼠肝组织内HBV DNA复制的影响.
反义RNA体内抗HBV的研究报道还并不多, Robaczewska et al[11]在北京鸭乙肝模型上(DHBV), 通过iv的方法, 将靶向于DHBV大包膜蛋白起始编码区的反义RNA (O-ODN-AS2)和包裹有PFI的反义RNA (PEI/O-ODN-AS2)分别转入, 流式仪分析表明, PFI/O-ODN-AS2的表达效率比O-ODN-AS2高出3倍, 且治疗9 d后肝脏组织中的DHBV DNA和RNA水平都明显降低, 而在相同抑制程度下其所需剂量比O-ODN-AS2, PEI/O-ODN-AS2对照组都要少. Ma et al[12]设计了以HBV PreS2基因的3203-3240 nt核苷酸为靶位点的反义RNA, 以HCC组织特异性反义RNA表达载体(AFP为启动子, 结合GF7-PL和HA20-PL的四元件复合体)包装, 经共培养和尾静脉注射分别转入HepG2.2.15细胞系和裸鼠体内, 结果发现, 该反义RNA可抑制细胞上清中HBsAg, HBeAg的表达分别达33.4%和58.5%. 本实验通过检测小鼠肝细胞中HBV DNA含量表明, 与对照组相比, 空质粒组及正义RNA组之间无明显差异, 单、双靶区反义RNA组与对照组有明显差异, 说明反义RNA对转基因小鼠肝脏中HBV DNA的复制有明显的抑制作用, 但单、双靶区反义RNA组间无明显差异, 与预计不一致, 其原因可能有: (1)双靶区反义RNA因结合靶点多, 可能达到完全结合的能力较差. (2)HBV DNA变异程度低, 双靶区反义RNA的抑制作用与单双靶区反义RNA的作用相差不明显. (3)样品例数偏少, 系统误差较大, 或者时间偏短尚未能发挥出双靶区反义RNA的作用.
反义RNA技术已被证明是研究、治疗病毒感染性疾病、遗传性疾病、肿瘤等多种疾病的行之有效的手段之一. 可针对在疾病发生、发展过程中发挥重要作用的生长因子、受体、关键酶、原癌基因、抑癌基因或凋亡相关基因, 通过反义RNA 技术特异性地进行结合, 封闭或调节其功能及产物表达, 从而达到治疗目的. 近年来, 体外研究及动物实验显示该方法具有较大的临床应用前景. 而且HBV是一种高变异病毒, 故容易产生耐药现象, 如果能增加反义RNA的结合位点有可能对耐药株起到抑制作用.
反义技术作为分子生物学的新型抗基因技术, 目前不仅广泛应用于生理学、病理学、药理学的基础研究, 而且已成为药物发展的新兴策略. 在反义RNA基础上发展的RNAi是目前研究的热点. 目前亟待解决的问题一是没有一种满意的乙肝动物模型, 另外就是缺乏特异性的肝脏导向药物.
吴赤红et al曾将表达HBV X区和P区正、反义RNA的重组体分别转染PA317细胞, 获取含逆转录病毒颗粒的细胞上清, 感染2.2.15细胞. 结果表明, 表达HBV X区和P区反义RNA的重组载体质粒转染包装细胞后形成稳定表达的克隆, 并能够释放约108 CFU/L感染滴度的假病毒颗粒. 针对HBV X, P 区的单靶区反义RNA对HBsAg, HBeAg 均有明显的抑制作用, 且抑制作用相近; 而二者联合表达则有协同作用, 双靶区反义RNA对HBV的抑制作用显著提高, 并对细胞无毒副作用. 赵尉et al检测了反义RNA对转基因小鼠肝组织中HBV标志物及血清中HBV DNA的影响, 认为双靶区反义RNA比单靶区反义RNA抑制HBV DNA的复制作用更强.
本文的实验再次验证了反义RNA对HBV的复制有抑制作用, 为今后反义药物的开发及进一步研究提供参考.
1 反义RNA: 指其核苷酸系列可以与其靶RNA(主要是mRNA)互补杂交产生双链RNA, 影响靶RNA的正常加工修饰、翻译等过程, 从而调控基因的表达的一类RNA分子.
2 PCR: polyme-rasechainreaction的英文缩写, 多聚酶链式反应. 他是以4种核苷酸为原料, 以DNA的一条链为模板, 在多聚酶的催化下, 通过碱基配对使寡核苷酸引物向3'方向延长合成DNA互补链(CDNA)的反应. 通过反复几次循环, DNA片段数量就能成指数状上升, 使目的基因快速大量扩增.
电编: 张敏 编辑:王晓瑜
| 3. | Simons RW. Naturally occurring antisense RNA control-a brief review. Gene. 1988;72:35-44. [PubMed] [DOI] |
| 4. | 马 春红, 孙 汶生, 刘 素侠, 丁 培芳, 张 利宁, 曹 英林, 宋 静. 抗HBV最佳反义寡核苷酸片段的体外筛选. 中华微生物学和免疫学杂志. 2000;20:12-14. |
| 5. | 吴 赤红, 曾 争, 王 勤环, 于 敏, 公 维波. 双靶区反义RNA抑制乙型肝炎病毒. 北京大学学报(医学版). 2001;33:462-464. |
| 9. | 季 伟, 王 勤环, 斯 崇文, 张 国庆, 刘 丹. 逆转录病毒载体介导乙型肝炎病毒反义基因的转录表达. 中华实验和临床病毒学杂志. 1997;11:325-328. |
| 10. | Goodarzi G, Gross SC, Tewari A, Watabe K. Antisense oligodeoxyribonucleotides inhibit the expression of the gene for hepatitis B virus surface antigen. J Gen Virol. 1990;71:3021-3025. [PubMed] [DOI] |
| 11. | Robaczewska M, Guerret S, Remy JS, Chemin I, Offensperger WB, Chevallier M, Behr JP, Podhajska AJ, Blum HE, Trepo C. Inhibition of hepad-naviral replication by polyethylenimine-based intravenous delivery of antisense phosphodiester oligodeoxynucleotides to the liver. Gene Ther. 2001;8:874-881. [PubMed] [DOI] |
| 12. | Ma CH, Sun WS, Tian PK, Gao LF, Liu SX, Wang XY, Zhang LN, Cao YL, Han LH, Liang XH. A novel HBV antisense RNA gene delivery system targeting hepatocellular carcinoma. World J Gastroenterol. 2003;9:463-467. [PubMed] [DOI] |