修回日期: 2006-06-26
接受日期: 2006-07-10
在线出版日期: 2006-09-08
目的: 探索降钙素基因相关肽(CGRP)相关的干预措施对胃痛觉过敏的影响, 了解CGRP在胃痛觉过敏形成过程中发挥的作用.
方法: 成年SD ♂大鼠, 均植入胃内气囊. 观察伤害性扩张或CGRP iv对大鼠疼痛阈值的影响; 观察由上述措施诱发内脏过敏的大鼠在给予CGRP受体特异性拮抗剂hCGRP8-37后疼痛阈值的变化; 观察不同剂量CGRP和hCGRP8-37对疼痛阈值的影响.
结果: CGRP iv后胃疼痛阈值为11.7±2.6 mmHg, 对照组疼痛阈值为19.2±2.0 mmHg, 生理盐水对照组则为18.3±2.5 mmHg, 实验组与其他两组比较P均<0.05. CGRP使大鼠的疼痛阈值降低. hCGRP8-37能逆转伤害性扩张和CGRP引起的内脏敏感性增高, 该作用呈剂量依赖性(r = 0.821, P<0.01).
结论: 胃扩张刺激能引起胃敏感性增高, 在此过程中CGRP具有重要的作用.
引文著录: 章菲菲, 莫剑忠, 吕有灵, 陈胜良, 吕鸣, 张珏莹, 杨龙. CGRP在大鼠胃痛觉过敏形成机制中的作用. 世界华人消化杂志 2006; 14(25): 2484-2487
Revised: June 26, 2006
Accepted: July 10, 2006
Published online: September 8, 2006
AIM: To explore the role of calcitonin gene-related peptide (CGRP) in gastric distention-induced visceral pain in conscious rats.
METHODS: Balloons were implanted into the stomach of 24 male Sprague Dawley rats. In this study we observed the following outcomes: (1) effects of noxious distention or CGRP intravenous injection on gastric sensitivity; (2) effects of a specific CGRP receptor antagonist, hCGRP8-37 on gastric hypersensitivity; (3) relationship between the doses of CGRP & hCGRP8-37 and their effects on gastric sensitivity. Gastric sensitivity was evaluated with gastric pain threshold determined by electromyography (EMG) of the neck muscles.
RESULTS: After intravenous injection of CGRP, the values of gastric pain threshold were 11.7 ± 2.6, 19.2 ± 2.0, and 18.3 ± 2.5 mmHg in experiment group, operation control group, and normal saline group, respectively, and there was significant difference between the former one and latter two (P < 0.05). CGRP down-regulated the gastric pain threshold. hCGRP8-37 reversed the harmful gastric distention, and inhibited the gastric hypersensitivity in a dose-dependent manner (r = 0.821, P < 0.01).
CONCLUSION: Gastric distention can stimulate the gastric hypersensitivity, in which CGRP plays an important role.
- Citation: Zhang FF, Mo JZ, Lv YL, Chen SL, Lv M, Zhang JY, Yang L. Role of calcitonin gene-related peptide in gastric hypersensitivity in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(25): 2484-2487
- URL: https://www.wjgnet.com/1009-3079/full/v14/i25/2484.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i25.2484
功能性消化不良与内脏神经感觉敏感性增高有关, 且后者具有特异性[1]. 早已证实胃肠道有降钙素基因相关肽(CGRP)神经纤维存在, 辣椒素敏感的神经纤维中80% CGRP免疫反应阳性, 而且在脊髓背根神经节内也发现CGRP免疫反应阳性的神经元, 这些神经元接受无髓鞘感觉神经纤维的投射. 现认为无论是中枢还是外周CGRP的释放均参与内脏敏感性变化. 但是目前关于CGRP与内脏感知的研究主要基于体表疼痛模型, 而且与内脏敏感性改变的研究主要集中在直肠和乙状结肠[2-6], 对CGRP在胃等其他部位刺激传入方面的作用尚无报道. 已发现伤害性扩张刺激能在中枢神经系统和肠神经系统诱导CGRP和c-Fos的表达[7], 而且二者的表达具有相关性. 我们通过探索CGRP相关的干预措施对胃痛觉过敏的影响, 了解CGRP在胃痛觉过敏形成过程中发挥的作用.
成年SD大鼠, ♂, 体质量350-400 g, 购自中科院上海实验动物中心; 乳胶气囊(l/2.5 cm, D/2 cm)与聚乙烯导管(l/10 cm, D/0.2 cm)为自制; CGRP (rat)和hCGRP8-37购自Sigma; 溶于9 g/L无菌氯化钠溶液. 将所有SD大鼠单独置于笼中饲养, 每12 h昼-夜交替, 尽量保持安静, 实验前给予1 wk时间适应环境.
1.2.1 伤害性胃扩张: 适应环境后, 术前禁食12 h, 不禁水, 20 g/L戊巴比妥(40 mg/kg) ip麻醉, 打开腹腔, 游离胃大弯, 在距贲门2 cm处沿胃大弯剪开胃壁约1 cm, 放入气囊. 气囊约占大鼠近端胃的60%, 在不充盈的状态下, 气囊不会阻塞幽门, 也不会阻碍胃排空. 气囊植入前, 先扩张数小时以消除扩张阻力. 气囊的直径一定要超过大鼠胃的内径, 否则扩张时测得的压力不能反映胃内的压力. 再次确定气囊是否完好, 缝合胃壁, 固定气囊, 逐层缝合胃壁, 气囊所连接的导管经皮下隧道固定于大鼠颈部. 术后当天禁食, 次日按常规喂养, 观察其腹部体征和排便情况. 48 h后将大鼠放置于特制的笼内, 固定. 气囊通过导管连接压力计, 行时相性胃扩张(80 mmHg, 每扩张20 min间歇10 min)2 h. 在颈部肌肉中植入3枚不锈钢电极, 用丝线固定, 所接导线与气囊导管固定于大鼠颈部的同一水平. 在刺激过程中将颈部电极与肌电仪相连接, 起始扩张压力为5 mmHg, 每次增加5 mmHg, 记录颈部肌肉的电位, 当颈肌电位达到基础值的2倍时, 此时的扩张强度就作为疼痛阈值[8]. 所有大鼠均接受胃内气囊和颈肌电极植入, 实验组行伤害性扩张或CGRP处理, 溶剂对照组使用生理盐水iv.
1.2.2 实验步骤: (1)在伤害性扩张(80 mmHg)或CGRP (500 ng) iv预处理后, hCGRP8-37 (30 μg) iv(通过颈静脉), 10 min后测定疼痛阈值. 设溶剂对照组、手术对照组. (2)给予未经伤害性扩张刺激的大鼠不同剂量(250, 500和750 ng)的CGRP iv, 10 min后测定疼痛阈值. (3)在伤害性扩张诱发胃痛觉过敏后, 给予不同剂量(7.5, 15, 30和60 μg)的hCGRP8-37 iv(通过颈静脉), 10 min后测定疼痛阈值. (4)在伤害性扩张或CGRP (500 ng) iv预处理后, hCGRP8-37 (30 μg)鞘内注射, 10 min后测定疼痛阈值. 实验分组均采用随机方法进行.
统计学处理 疼痛阈值用均值±标准差表示, 各组间差异用方差分析, P<0.05定为差异显著. 剂量与效应的相关性采用Spearman相关分析法. 使用SPSS 10.0软件完成统计分析.
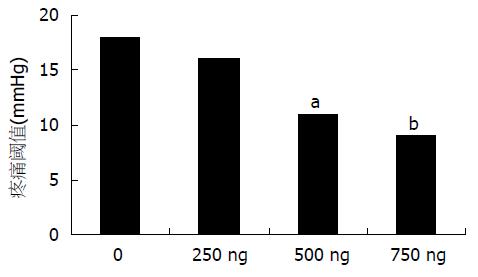
在对大鼠伤害性扩张或CGRP注射前先进行随机化分组, 经测定各组间疼痛阈值无显著差异(P>0.05). 大鼠经历伤害性扩张刺激后, 胃疼痛阈值显著降低, 为9.2±2.0 mmHg, 对照组则为17.5±4.2 mmHg (P<0.05). CGRP iv后胃疼痛阈值为11.7±2.6 mmHg, 对照组疼痛阈值为19.2±2.0 mmHg, 生理盐水对照组则为18.3±2.5 mmHg, 实验组与其他两组比较P均<0.05. 当CGRP iv剂量达到500 ng后, 胃疼痛阈值显著降低(500 ng时P<0.05, 750 ng时P<0.01), 阈值的下降与剂量相关(rs = 0.821, P<0.01, 图1).
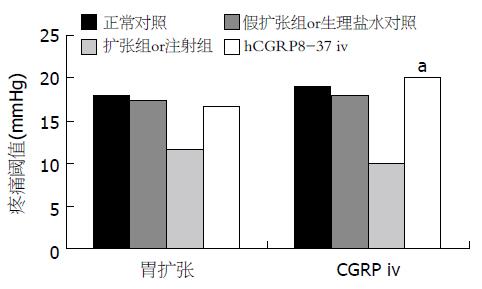
在扩张引起的胃痛觉过敏的大鼠, hCGRP8-37 (30 μg) iv后使其疼痛阈值恢复至正常(16.7±5.2 mmHg). 在CGRP引起的胃痛觉过敏的大鼠, hCGRP8-37 (30 μg) iv后使其疼痛阈值恢复(20.0±3.2 mmHg), 接近正常(图2). 当hCGRP8-37 iv剂量达到15 μg后, 因扩张引起的降低的阈值出现上升, 15 μg时为12.5±2.9 mmHg, 30 μg时为18.8±2.5 mmHg, 60 μg时为22.5±2.9 mmHg. 阈值的上升与剂量相关(rs = 0.821, P<0.01).
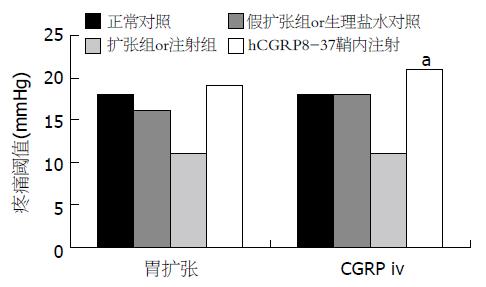
在扩张引起的胃痛觉过敏的大鼠, hCGRP8-37 (30 μg)鞘内注射后使其疼痛阈值恢复至正常(17.5±2.9 mmHg). 在CGRP引起的胃痛觉过敏的大鼠, hCGRP8-37 (30 μg)鞘内注射后使其疼痛阈值恢复( 21.5±4.8 mmHg), 接近正常(图3).
气囊扩张引起的内脏感觉阈值改变见于大多数肠易激综合征患者[9], 这种内脏敏感性变化似乎是患者既往内脏传入机制致敏的结果. 这种致敏既可以发生在外周或中枢, 也可以二者同时发生, 但是这种变化的确切机制和参与的递质未明. 胃肠道敏感性的评价常利用气囊扩张来完成, 因为中空脏器的扩张能模拟自然状态下内脏的刺激方式, 而且气囊扩张是一种具有可重复性的可靠的机械性刺激. 对于人而言, 内脏扩张诱导的感觉或疼痛通过语言表达或视觉分析量表很容易进行评价. 唯一需要注意的是应使用标准程序以获得可重复性的数据. 就动物而言, 由于动物主观的内脏感觉阈值不易获得, 因此研究者将注意力转向内脏-内脏(心率、血压、平滑肌收缩)或内脏动力反射如结直肠扩张诱导的腹部收缩.
大多数有关清醒动物胃肠道敏感性的研究使用结肠扩张, 利用植入腹外斜肌内的电极监测腹部收缩的频率. 其目标大多集中在结直肠敏感性变化, 有关上消化道如胃的敏感性改变机制研究较少. 由于传入纤维起源和投射不同, 例如在大鼠, 升结肠和直肠初级传入神经元胞体位于T13-L2及L6-S2的背根神经节中, 而胃的初级传入神经元胞体位于则位于T8-T10, 所以结肠扩张获得的数据不能推及到消化道其他部位的扩张. 近期研究发现, 半数以上的功能性消化不良存在胃饱胀、不适和疼痛的感知阈下降, 而胃肠器质性疾病(如消化性溃疡)的患者以及健康人则无上述表现, 这表明功能性消化不良与内脏神经感觉敏感性增高有关, 且后者具有特异性[7]. 鉴于临床常见病功能性消化不良与胃痛觉过敏的关系密切, 目前对功能性消化不良等疾病的治疗效果有限, 因此有必要深入研究内脏敏感性改变的机制, 继而探索可行的干预环节, 进而寻找安全有效的干预物质, 从而才能达到根本改善这类功能性疾病治疗效果的目的. 有研究显示, 大鼠的胃扩张并不能产生腹部收缩, 但是能引起抬头和身体的伸展, 因此本研究使用了另一种评价胃敏感性的方法[8]. 利用非麻醉状态下大鼠颈肌的肌电图作为定量的参数. 过去曾用被动的逃避动作来评价清醒大鼠胃扩张对其行为的影响, 但这种方法需要多次试验, 用于确定疼痛阈值和药物研究时并不方便. 研究发现人所能承受的最大胃扩张压力与大鼠接近[8]. 因此此方法获得的疼痛阈值较可靠. 例如, 当扩张压力低于10 mmHg时, 孤束核神经元的活动增强. 另一方面, 压力必须超过80 mmHg才能诱导孤束核的c-Fos表达. 该模型的不足之处是有创伤性. 但是气囊植入后大鼠的生存率>95%, 其进食与正常大鼠无异, 手术后3 wk未发现气囊损坏.
辣椒素敏感的传入神经纤维通过免疫组化显示, 多种神经肽类染色阳性, 其中CGRP是在大鼠外来内脏传入神经纤维中具有相当比重的神经肽类物质. CGRP与降钙素(calcitonin, CT)、支链淀粉(amylin, AMY)及肾上腺髓质素同属降钙素家族. 他们的胺基端都具有6个氨基酸组成的环状结构. CGRP分为αCGRP, bCGRP两类, αCGRP是一种由37个氨基酸组成的肽类物质, 由降钙素基因编码. 在神经组织中降钙素基因交替拼接合成αCGRP. bCGRP是αCGRP的类似物, 在人类两者有3个氨基酸存在差异, 在大鼠仅有1个氨基酸不同. bCGRP有其独特的编码基因, 与CT基因高度相似. αCGRP和bCGRP发挥相似的生物学作用. 传统上将CGRP受体分为两类: CGRP1和CGRP2[10]. 其中CGRP1受体对CGRP的拮抗剂hCGRP8-37较敏感. 我们发现, iv CGRP能产生类似伤害性扩张诱发的胃痛觉过敏, CGRP受体特异性的拮抗剂hCGRP8-37能逆转伤害性扩张或CGRP对胃痛觉过敏的诱导作用, 而且CGRP和hCGRP8-37的作用呈剂量依赖性. 上述结果与Plourde et al[11]在结肠的发现类似, 他们使用结肠内乙酸灌注法制造内脏高敏的大鼠模型研究CGRP的作用, 发现iv hCGRP8-37能完全消除乙酸致敏作用, 同时, CGRP iv可增高肠道敏感性, 类似乙酸的作用, 而且, 鞘内注射hCGRP8-37可逆转CGRP iv或乙酸所致的肠道敏感性增高, 其作用呈剂量依赖性. 上述事实说明CGRP在消化道致敏过程中发挥重要的作用.
但是根据我们的研究, 不能判断周围CGRP受体在消化道致敏中的确切作用. 事实上, 我们发现通过外周给予CGRP能产生伤害性刺激引起的胃痛觉过敏, 提示CGRP在外周能发挥作用, 除非这种神经肽能通过血-脑屏障. CGRP也许既能通过外周又能通过中枢产生痛觉过敏作用, 可能这种作用最初发生于外周, 继发于中枢. 由于CGRP穿透血-脑屏障的机制并不十分清楚, CGRP在该内脏痛觉过敏模型中作用的确切位置尚不能确定.
内脏敏感性增高是临床上一大类功能性消化系统疾病如: 肠易激综合征、功能性消化不良的重要发病机制之一, 但是内脏感觉过敏的产生机制尚无定论, 对于肠易激综合征和功能性消化不良等疾病的治疗效果有限. 目前已证实无论是中枢还是外周CGRP的释放均参与内脏敏感性变化.
最近临床研究发现, 存在胃感觉过敏的功能性消化不良患者胃组织中的CGRP含量高于对照组. Chan et al发现在直肠敏感性增高的大便失禁患者中, 其直肠黏膜下神经丛的CGRP阳性神经纤维增多, 这与在动物实验中获得的信息一致. 目前有关胃扩张性刺激在延髓以上的传导途径和刺激后肠神经系统活动情况的资料较少, 同时关于CGRP与内脏敏感性改变的研究主要集中在直肠和乙状结肠, 对CGRP在胃等其他部位刺激传入方面的作用报道很少.
通过CGRP相关干预措施对大鼠内脏敏感性影响的观察, 进一步证实在胃敏感性增高过程中CGRP具有重要的作用, 这可能对临床有关疾病的治疗具有一些参考价值.
鉴于临床常见病功能性消化不良与胃痛觉过敏的关系密切, 目前对功能性消化不良等疾病的治疗效果有限, 因此有必要深入研究内脏敏感性改变的机制, 继而探索可行的干预环节, 寻找安全有效的干预物质, 从而达到根本改善这类功能性疾病治疗效果的目的, 本文对于临床了解和诊治功能性消化不良具有较好参考价值.
电编: 张敏 编辑:潘伯荣
| 1. | 萧 树东. 胃肠病学和肝病学-基础理论与临床进展. 第1版. 上海: 世界图书出版公司. 2004;327-345. |
| 2. | Kawamura M, Kuraishi Y, Minami M, Satoh M. Antinociceptive effect of intrathecally administered antiserum against calcitonin gene-related peptide on thermal and mechanical noxious stimuli in experimental hyperalgesic rats. Brain Res. 1989;497:199-203. [PubMed] [DOI] |
| 3. | Cridland RA, Henry JL. Effects of intrathecal administration of neuropeptides on a spinal nociceptive reflex in the rat: VIP, galanin, CGRP, TRH, somatostatin and angiotensin II. Neuropeptides. 1988;11:23-32. [PubMed] [DOI] |
| 4. | Woolf C, Wiesenfeld-Hallin Z. Substance P and calcitonin gene-related peptide synergistically modulate the gain of the nociceptive flexor withdrawal reflex in the rat. Neurosci Lett. 1986;66:226-230. [PubMed] [DOI] |
| 5. | Welch SP, Singha AK, Dewey WL. The antinociception produced by intrathecal morphine, calcium, A23187, U50,488H, [D-Ala2, N-Me-Phe4, Gly-ol]enkephalin and [D-Pen2, D-Pen5]enkephalin after intrathecal administration of calcitonin gene-related peptide in mice. J Pharmacol Exp Ther. 1989;251:1-8. [PubMed] |
| 6. | Menard DP, van Rossum D, Kar S, St Pierre S, Sutak M, Jhamandas K, Quirion R. A calcitonin gene-related peptide receptor antagonist prevents the development of tolerance to spinal morphine analgesia. J Neurosci. 1996;16:2342-2351. [PubMed] |
| 7. | Mertz H, Fullerton S, Naliboff B, Mayer EA. Symptoms and visceral perception in severe functional and organic dyspepsia. Gut. 1998;42:814-822. [PubMed] [DOI] |
| 8. | Rouzade ML, Fioramonti J, Bueno L. A model for evaluation of gastric sensitivity in awake rats. Neurogastroenterol Motil. 1998;10:157-163. [PubMed] [DOI] |
| 9. | Bouin M, Plourde V, Boivin M, Riberdy M, Lupien F, Laganiere M, Verrier P, Poitras P. Rectal distention testing in patients with irritable bowel syndrome: sensitivity, specificity, and predictive values of pain sensory thresholds. Gastroenterology. 2002;122:1771-1777. [PubMed] [DOI] |
| 10. | Quirion R, Van Rossum D, Dumont Y, St-Pierre S, Fournier A. Characterization of CGRP1 and CGRP2 receptor subtypes. Ann N Y Acad Sci. 1992;657:88-105. [PubMed] [DOI] |
| 11. | Plourde V, St-Pierre S, Quirion R. Calcitonin gene-related peptide in viscerosensitive response to colorectal distension in rats. Am J Physiol. 1997;273:G191-G196. [PubMed] |