修回日期: 2006-06-20
接受日期: 2006-06-30
在线出版日期: 2006-08-28
目的: 构建抗人大肠癌重组双价单链抗体ND-1sc(Fv)2的融合基因, 并在大肠杆菌中表达.
方法: 采用基因重组技术借助GGGGS Linker序列, 将2个相同的ND-1scFv基因共价连接, 构建pET-28a(+)ND-1sc(Fv)2表达载体, 并在大肠杆菌中表达双价单链抗体的融合蛋白. 表达产物用Ni-NTA resin亲和层析方法纯化, SDS-PAGE和Western blotting检测表达的目的蛋白. 间接免疫荧光和ELISA检测抗体的免疫活性.
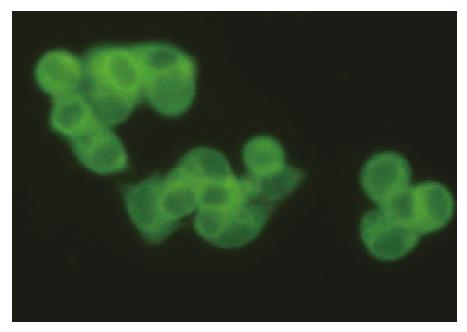
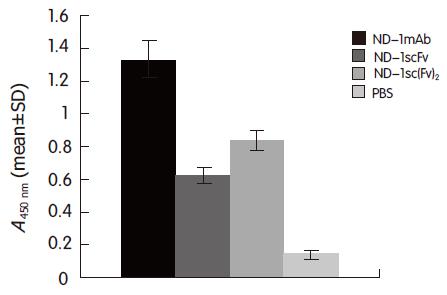
结果: 序列测定表明: ND-1sc(Fv)2基因全长1473 bp, 包含了2个729 bp的scFv序列和15 bp的GGGGS序列. SDS-PAGE和Western blotting检测显示, 融合蛋白的Mr 55500, 与预期值一致. ND-1sc(Fv)2表达产物以不溶性包涵体形式存在, 经亲和层析纯化后蛋白纯度达90%, 间接免疫荧光及ELISA检测表明, ND-1sc(Fv)2保留了亲本抗体的免疫活性, 对表达有相应抗原的靶细胞具有特异结合活性, 其免疫活性明显高于ND-1scFv.
结论: 成功地构建了抗人大肠癌双价单链抗体ND-1sc(Fv)2, 并在大肠杆菌中高效表达. 融合蛋白具有良好的免疫活性.
引文著录: 严丹丹, 杨福辉, 方瑾. 抗人大肠癌双价单链抗体基因的构建及表达. 世界华人消化杂志 2006; 14(24): 2395-2400
Revised: June 20, 2006
Accepted: June 30, 2006
Published online: August 28, 2006
AIM: To construct the fusion gene of recombinant bivalent single-chain antibody ND-1sc(Fv)2 against human colorectal carcinoma and express it in E. coli.
METHODS: The two same ND-1scFv genes against human colorectal carcinoma were covalently linked by a 15-bp linker with sequences encoding GGGGS. The expression vector pET-28a(+)ND-1sc(Fv)2 was constructed to express the ND-1sc(Fv)2 fusion protein in E. coli. The expressed product was purified by metal affinity chromatography using Ni-NTA resin and then detected by SDS-PAGE and Western blotting. Its immunity was analyzed by enzyme-linked immunosorbent assay (ELISA) and indirect immunofluorescence assay (IFA).
RESULTS: Sequencing results showed that the ND-1sc(Fv)2 gene was 1473 bp in length, including two scFv of 729 bp and one GGGGS of 15 bp. SDS-PAGE and Western blotting showed that the relative molecular mass of fusion protein was about 55 kDa, in accordance with its predicted Mr value. ND-1sc(Fv)2 was expressed in the form of an inclusion body, and SDS-PAGE analysis of the purified ND-1sc(Fv)2 showed 90% purity. IFA and ELISA revealed that ND-1sc(Fv)2 had specific binding activity to the corresponding antigen-target cells, obviously higher than that of ND-1scFv.
CONCLUSION: ND-1sc(Fv)2 gene against human colorectal carcinoma is constructed and expressed successfully in E. coli. The obtained fusion protein exhibits an excellent immunity.
- Citation: Yan DD, Yang FH, Fang J. Construction and expression of bivalent single-chain antibody against human colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2006; 14(24): 2395-2400
- URL: https://www.wjgnet.com/1009-3079/full/v14/i24/2395.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i24.2395
利用mAb进行导向诊断和治疗是肿瘤研究的重要课题. 基因工程双价抗体作为一种新型的小分子抗体既具有scFv(single-chain Fv)分子质量小, 组织穿透能力强及免疫原性低等特点, 又具有类似于完整抗体IgG的双价结合位点, 与scFv相比其抗体的亲和性大大提高, 适中的分子质量(55-80 kDa)既保证了抗体在肿瘤组织的良好穿透能力, 又大大改善了scFv在体内清除过快的缺点[1-3]. 因此近年来, 人们用scFv为元件构建的基因工程双价抗体分子在肿瘤的显像和治疗方面显示出良好的应用前景[4-5].
ND-1是我们以人大肠癌细胞系CCL-187为免疫原制备的鼠抗人大肠癌mAb[6], 体内外一系列实验显示, 该mAb特异性强, 亲和力高, 并优于目前广泛采用的美国商业产品抗CEA mAb[7]. 以该mAb构建的基因工程抗体ND-1scFv亦显示了良好的体内外特异结合活性[8]. 我们在此基础上, 借助连接肽(Linker)将2个ND-1scFv基因共价连接, 在大肠杆菌中表达双价单链抗体的融合蛋白, 并对其活性进行了检测.
CCL-187人大肠癌细胞株由美国哈佛大学医学院肿瘤所惠赠, Hela人宫颈癌上皮细胞株为本室保存. pET-28a(+)ND-1scFv表达载体由本室构建. pMD18-T Vector及E. coli JM109感受态细胞、限制性内切酶、Taq DNA聚合酶为大连宝生物公司产品. DNA片段回收试剂盒为上海华舜生物公司产品. T4 DNA连接酶为New England Biolabs公司产品. Ni-NTA亲和层析填料为Qiagen公司产品. FITC荧光标记羊抗鼠抗体为Sigma公司产品, 辣根过氧化物酶标记的羊抗鼠抗体为Santa公司产品. 抗His-Tag mAb为Invitrogen公司产品. TMB购自Bochringer mannhelm公司. Western blotting检测试剂盒(HisProbeTMWestern Blotting Kit)为美国Pierce公司产品. 引物P1, P2由大连宝生物公司合成, 其序列如下:
其中斜体部分为添加的酶切位点, 上游引物引入编码5个氨基酸GGGGS的Linker序列, 下游引物引入终止密码子, 扩增的基因片段为ND-1scFv, 约750 bp.
1.2.1 ND-1sc(Fv)2载体的构建和诱导表达: 以ND-1scFv表达质粒pET-28(+)ND-1scFv为模板, 以引物P1, P2进行PCR扩增形成5'端带有SalⅠ位点和Linker序列, 3'端带有终止密码子和Hind Ⅲ位点的Linker-ND-1scFv片段, 产物经15 g/L琼脂糖凝胶电泳, DNA片段回收试剂盒回收, 与pMD18-T Vector连接, 转化E. coli JM109, 随机挑取单菌落提取相应的质粒DNA, 用SalⅠ/Hind Ⅲ酶切鉴定, 并采用Sanger双脱氧末端终止法用AbiprismTM377测序仪进行DNA序列测定. 将测序正确的重组质粒pMD18-T-Linker-ND-1scFv用SalⅠ/Hind Ⅲ双酶切, 与相同酶切的pET-28a(+)ND-1scFv载体于16 ℃连接过夜, 转化宿主菌BL21, 用EcoRⅠ/Hind Ⅲ双酶切鉴定有插入片段的克隆. 挑取鉴定正确的阳性克隆接种于2 mL含50 mg/L卡那霉素LB培养基中, 37 ℃振荡培养过夜, 并以1%接种量转种到100 mL相同的LB培养基中, 37 ℃振荡培养至A600为0.6左右, 加入IPTG至终浓度1 mmol/L, 继续培养3 h, 离心收集菌体, 获得诱导培养物, 表达产物以SDS-PAGE鉴定, 并用凝胶灰度扫描测定蛋白表达量. 将诱导的菌体用裂解缓冲液冰上裂解30 min, 并于冰浴上超声破碎, 4 ℃, 10000 g离心20 min得到包涵体. 将包涵体重悬于原培养物0.1倍体积的变性液中(0.1 mol/L NaH2PO4, 0.01 mol/L Tris, 6 mol/L盐酸胍, pH 8.0), 待包涵体全部溶解后, 17700 g离心20 min, 取上清加至Ni-NTA resin亲和层析柱中, 按顺序分别用10倍柱体积的6 mol/L盐酸胍(pH 8.0)→8 mol/L尿素(pH 8.0)→8 mol/L尿素(pH 6.5)→8 mol/L尿素(pH 4.2)洗脱镍柱, 收集8 mol/L尿素(pH 4.2)流出液. 用变性液调整蛋白浓度至100 mg/L, 加入4倍体积复性液(20 mmol/L Tris, 0.25 mol/L NaCl, 5 g/L NP-40, 0.4 mmol/L PMSF, 2 mmol/L还原型谷胱甘肽, 0.2 mmol/L氧化型谷胱甘肽, 100 mmol/L EDTA)4 ℃复性24 h, 然后将复性样品转移至截留分子质量为8-10 kDa的透析袋中用透析液(20 mmol/L Tris, 500 mmol/L NaCl, 100 mL/L甘油)透析48 h, 超滤浓缩样品至适当体积, Brandford法检测蛋白浓度后, -20 ℃分装保存.
1.2.2 ND-1sc(Fv)2的Western blotting: 取含有重组质粒pET-28a(+)ND-1sc(Fv)2的BL21诱导表达菌液和诱导前的BL21菌体裂解物, 常规方法制备蛋白质电泳样品, 经120 g/L SDS-PAGE后, 湿转印至PVDF膜上, 用25 g/L BSA/TBST室温封闭1 h, TBST洗膜2次, 加HisProbeTM-HRP抗体摇床孵育1 h, 再以TBST洗膜后加化学发光剂(enhanced:luminol = 1:1)覆盖PVDF膜室温5 min, 置X光胶片上曝光1 min分析结果.
1.2.3 间接免疫荧光检测ND-1sc(Fv)2免疫活性: 取对数生长期的人大肠癌细胞CCL-187和人宫颈癌上皮细胞Hela分别传代于盖玻片上, 于37 ℃培养48 h后, 以ND-1sc(Fv)2为一抗, 抗His-tag mAb为二抗, FITC标记的羊抗鼠IgG为三抗, 于37 ℃各孵育1 h, PBS冲洗后, 于荧光显微镜下观察.
1.2.4 非竞争性ELISA检测抗体活性: 取处于对数生长期的人大肠癌细胞CCL-187, 以5×104接种于96孔培养板中, 100 μL/孔, 于37 ℃培养24 h, 弃去培养液, PBS涮洗3次, 25 mL/L戊二醛37 ℃固定5 min, PBS涮洗3次后, 每孔加入等摩尔的ND-1 mAb, ND-1scFv和ND-1sc(Fv)2作为一抗, 阴性对照孔加PBS, ND-1scFv孔和ND-1sc(Fv)2孔均以抗His-Tag抗体作为二抗, HRP-羊抗鼠抗体作为三抗; ND-1 mAb孔以HRP-羊抗鼠抗体作为二抗, 每孔分别加抗体100 μL, 于37 ℃分别孵育2 h, PBS涮洗后以底物TMB显色, 37 ℃暗处反应30 min, 1 mol/L H2SO4 100 μL/孔终止反应后, 于酶标仪上波长450 nm测定吸光度值.
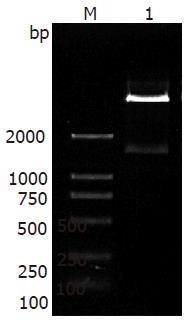
以pET-28a(+)ND-1scFv为模板, 加入引物P1, P2进行PCR, 产物经15 g/L琼脂糖凝胶电泳得到长度约750 bp的基因片段(图1). 将带有''A''尾的PCR产物与pMD18-T克隆载体连接, 提取重组质粒, 用SalⅠ/Hind Ⅲ进行双酶切电泳显示在750 bp处有一条带, 表明回收片段成功克隆到载体中. 将酶切正确的重组质粒经Sanger双脱氧末端终止法测序, 得到的DNA序列与设计的理论序列比对结果完全一致.
将测序正确的重组质粒pMD18-T-Linker-ND-1scFv用SalⅠ/Hind Ⅲ双酶切, 与经同样双酶切的pET-28a(+)ND-1scFv载体16 ℃连接过夜, 连接产物转化E. coli BL21, 提取重组子质粒, 经EcoRⅠ/Hind Ⅲ双酶切, 电泳显示在约1500 bp处呈现一明显条带, 提示Linker-ND-1scFv片段被克隆入pET-28a(+)ND-1scFv载体中, 且插入方向正确(图2), 表明pET-28a(+)ND-1sc(Fv)2构建成功. 综合上述测序和酶切结果证实ND-1sc(Fv)2基因全长1473 bp, 包含了2个729 bp的scFv序列和15 bp的GGGGS序列, 两侧为EcoRⅠ和Hind Ⅲ位点.
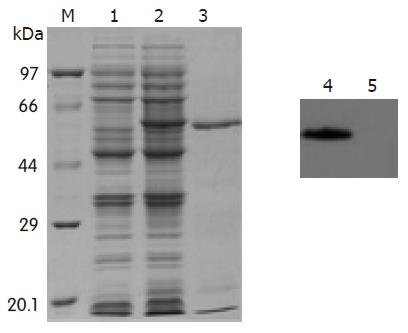
将构建正确的表达质粒pET-28a(+)ND-1sc(Fv)2转化宿主菌BL21, 以1 mmol/L IPTG诱导表达. SDS-PAGE和Western blotting检测结果显示, 经诱导的菌体裂解物在分子质量约55 kDa处有一条特异性蛋白带, pET-28a(+)载体在多克隆位点的上游有一编码His-Tag小肽的基因, 因此, 在IPTG诱导下表达的是ND-1sc(Fv)2蛋白与His-Tag及其上游序列的融合蛋白, 分子质量55 kDa[ND-1sc(Fv)2 51 kDa, His-Tag+上游序列4 kDa], 电泳结果与该融合蛋白的理论推算值相符(图3). 凝胶灰度扫描结果显示表达量占菌体总蛋白量的18%.
SDS-PAGE分析显示, 经IPTG诱导后的菌体裂解物上清中未见可溶性蛋白条带, 故推断ND-1sc(Fv)2蛋白主要以包涵体形式存在. 通过盐酸胍变性溶解后, 借助能与His序列特异结合的Ni-NTA亲和层析柱对变性的包涵体蛋白进行纯化, 获得了高纯度的ND-1sc(Fv)2(图3), Bradford法检测纯化后的蛋白浓度为1.1 g/L, 凝胶灰度扫描显示蛋白纯度达90%. 复性后的蛋白溶液澄清, 且凝胶电泳呈单一条带, 提示经复性处理后, ND-1sc(Fv)2获得正确构象, 且保持有效浓度.
肿瘤特异性mAb作为导向载体已经应用于肿瘤的放免诊断和治疗[9-10], 随着18种mAb产品的上市及100多种进入临床试验阶段, 作为生物制药已经原来了基因工程抗体时代[11]. 目前使用的mAb及大的酶解片段具有较高的肿瘤浓集, 但由于其鼠源性的特点, 对人体有较强的免疫原性, 分子质量较大, 组织穿透能力差, 血浆清除率较慢, 所含有的Fc段易造成体内非特异性分布, 对正常组织损害较大; 而小分子抗体Fab及scFv分子质量小, 穿透力强, 具有快速的血浆清除率, 此外不含Fc段, 免疫原性低, 可明显提高对肿瘤组织的特异性[12-14], 因而减少了对非特异组织的损害, 但由于只有一个抗原结合位点, 其亲和活性大大降低, 分子质量过小, 易在肾脏清除, 使绝大部分抗体还未在肿瘤组织充分发挥作用就已从体内清除[15]. 基因工程双价抗体是目前抗体应用研究的热点, 他是将两条相同或不同来源的scFv组合成具有同种或两种不同抗原结合特征的新型抗体[4,16], 通过其双结合位点提高在肿瘤诊断和治疗中的有效性. Pavlinkova et al[17]构建的CC49 mAb的单链抗体(Mr 27700)在荷瘤裸鼠体内的半衰期在10 min, 而其双价抗体(Mr 60000)是50 min, 由此看出双价抗体与单价小分子抗体相比有着更长的体内滞留时间, 因而, 有可能获得更好的显像和治疗效果. 我们借助GGGGS Linker序列将抗人大肠癌mAb的2个ND-1scFv基因共价连接, 构建了高效表达的pET-28a(+)ND-1sc(Fv)2融合蛋白表达载体, 在大肠杆菌中的表达量高达18%, 经纯化后纯度达90%, 整个体系操作简单, 重复性好, 为构建其他双价和双特异的抗体分子提供了简洁、高效的方法.
采用共价方式构建双价单链抗体其优势在于共价结合的稳定性高, 适当的连接肽可以为抗体的2个结合部位提供足够的柔韧性, 从而有利于抗体分子同时交联双抗原位点. Beresford et al[3]构建的CC49 mAb的双价单链抗体, 共价sc(Fv)2比非共价(scFv)2因具有更好的稳定性而显示出更高的肿瘤浓集和更长的肿瘤滞留时间. 我们采用共价方式构建了双价单链抗体, 细胞免疫荧光和ELISA检测表明, 该抗体保留了亲本抗体的免疫活性, 表达复性后的目的抗体4 ℃放置1 mo后, 仍具有良好的免疫活性(数据未显示), 提示以共价方式构建的双价单链抗体具有较好的稳定性. 我们以GGGGS作为Linker构建了抗人大肠癌双价单链抗体, GGGGS是ND-1scFv中连接VL, VH片段的Linker(GGGGS)3中的1个重复单位, 是目前众多scFv构建中普遍采用的Linker序列组成. 用于连接双价单链抗体的连接肽的长度和组成通常会对抗体的稳定性和功能产生影响, 过短的连接肽可在分子内部造成空间位阻, 影响抗体蛋白的正确折叠; 而过长的连接肽则可能增加抗体的免疫原性, 据有关文献报道过长的连接肽还可能影响抗体的活性和功能[18]. 目前用于构建共价双价单链抗体的Linker长度范围是6-25个氨基酸, 我们应用5个氨基酸的Linker构建了双价单链抗体, IFA和ELISA检测表明, ND-1sc(Fv)2保留了亲本抗体的免疫活性, 对表达相应抗原的靶细胞具有特异结合活性, 其免疫活性明显高于ND-1scFv. 表明双价单链抗体ND-1sc(Fv)2已折叠为正确的构象, 说明5个氨基酸可以作为构建双价单链抗体的连接肽. 但是, 值得注意的是尽管ELISA结果显示ND-1sc(Fv)2较ND-1scFv的亲和性有较大提高, 但和ND-1 mAb相比, ND-1sc(Fv)2在亲和性上并未达到与其相当的水平, 考虑可能的原因是5个氨基酸的Linker长度还不足以为两个抗原结合位点提供有效的空间距离, 影响相互交联的稳定性, 但过长的Linker序列又会导致额外的免疫原性, 影响体内应用. 我们目前正在进行有关Linker序列长度对双价单链抗体活性影响方面的研究探讨, 有望将抗体亲和活性进一步提高. 我们通过基因工程技术成功构建了抗人大肠癌双价单链抗体ND-1sc(Fv)2, 并在大肠杆菌中获得了高效表达, 经过纯化并复性的抗体蛋白显示了良好的免疫活性, 与ND-1scFv相比其免疫活性明显提高, 达到了预期的结果, 为体内实验奠定了良好的基础, 有望成为大肠癌临床导向诊断的理想载体.
大肠癌是常见的恶性肿瘤之一, 目前其发病率在我国位居第3位, 探讨有效的诊断和治疗手段是大肠癌研究的重要课题. 肿瘤特异性mAb作为导向载体已经应用于肿瘤的放免诊断和治疗, 但由于其鼠 源性、分子质量较大、在循环系统停留时间较长及具有较强的免疫原性等特点, 大大限制了其在临床肿瘤治疗中的应用. 近年来, 人们用scFv为元件构建出来的基因工程双价抗体分子则显示出良好的应用前景.
如何提高抗体的亲和力和效价是目前基因工程抗体研究的关键和热点.
本研究基于先前的工作基础, 采用共价方式, 借助GGGGS Linker首次构建了抗人大肠癌才双价单链抗体ND-1sc(Fv)2, 并在大肠杆菌中获得了高效表达, 融合蛋白具有良好的免疫活性, 提示该抗体有望成为大肠癌放免显像和治疗的理想载体.
本研究通过分子克隆技术构建了抗人大肠癌重组双价单链抗体, 并证实了其免疫活性明显高于ND-1scFv, 此研究结果对于开发肿瘤导向性药物具有重要的意义, 且整个体系操作简单, 重复性好, 为构建其他双价和双特异的抗体分子提供了简洁、高效的方法.
单链抗体: 是将抗体的重链可变区(VH)和轻链可变区(VL)通过一段连接肽(Linker)连接而成的一种小分子抗体, 是抗体具有抗原结合部位的最小功能结构单位. 以分子质量小、体内半衰期短、免疫原性低、可在原核细胞系统表达、易于基因工程操作等特点而备受关注.
本研究目标明确, 实验设计合理, 技术先进, 结果可信, 可读性较强, 具有创新性, 能较好地反映我国胃肠病学基础研究的先进水平, 有应用潜力.
电编: 张焕兰 编辑:潘伯荣
| 1. | Wu AM, Chen W, Raubitschek A, Williams LE, Neumaier M, Fischer R, Hu SZ, Odom-Maryon T, Wong JY, Shively JE. Tumor localization of anti-CEA single-chain Fvs: improved targeting by non-covalent dimers. Immunotechnology. 1996;2:21-36. [PubMed] |
| 2. | Adams GP, Schier R, McCall AM, Crawford RS, Wolf EJ, Weiner LM, Marks JD. Prolonged in vivo tumour retention of a human diabody targeting the extracellular domain of human HER2/neu. Br J Cancer. 1998;77:1405-1412. [PubMed] |
| 3. | Beresford GW, Pavlinkova G, Booth BJ, Batra SK, Colcher D. Binding characteristics and tumor targeting of a covalently linked divalent CC49 single-chain antibody. Int J Cancer. 1999;81:911-917. [PubMed] |
| 4. | Kikuchi Y, Uno S, Kinoshita Y, Yoshimura Y, Iida S, Wakahara Y, Tsuchiya M, Yamada-Okabe H, Fukushima N. Apoptosis inducing bivalent single-chain antibody fragments against CD47 showed antitumor potency for multiple myeloma. Leuk Res. 2005;29:445-450. [PubMed] |
| 5. | Perez L, Ayala M, Pimentel G, Bell H, Canaan-Haden L, Bequet M, Gonzalez LJ, Miranda M, Ravelo R, Roque L. A multivalent recombinant antibody fragment specific for carcinoembryonic antigen. Biotechnol Appl Biochem. 2006;43:39-48. [PubMed] |
| 6. | Bleday R, Song J, Walker ES, Salcedo BF, Thomas P, Wilson RE, Chen LB, Steele G Jr. Characterization of a new monoclonal antibody to a cell surface antigen on colorectal cancer and fetal gut tissues. Cancer. 1986;57:433-440. [PubMed] |
| 8. | Fang J, Jin HB, Song JD. Construction, expression and tumor targeting of a single-chain Fv against human colorectal carcinoma. World J Gastroenterol. 2003;9:726-730. [PubMed] |
| 9. | Buchsbaum DJ, Rogers BE, Khazaeli MB, Mayo MS, Milenic DE, Kashmiri SV, Anderson CJ, Chappell LL, Brechbiel MW, Curiel DT. Targeting strategies for cancer radiotherapy. Clin Cancer Res. 1999;5:3048s-3055s. [PubMed] |
| 10. | Hudson PJ. Recombinant antibody constructs in cancer therapy. Curr Opin Immunol. 1999;11:548-557. [PubMed] |
| 11. | Holliger P, Hudson PJ. Engineered antibody fragments and the rise of single domains. Nat Biotechnol. 2005;23:1126-1136. [PubMed] |
| 12. | Yu B, Ni M, Li WH, Lei P, Xing W, Xiao DW, Huang Y, Tang ZJ, Zhu HF, Shen GX. Human scFv antibody fragments specific for hepatocellular carcinoma selected from a phage display library. World J Gastroenterol. 2005;11:3985-3989. [PubMed] |
| 13. | Hu X, O'Dwyer R, Wall JG. Cloning, expression and characterisation of a single-chain Fv antibody fragment against domoic acid in Escherichia coli. J Biotechnol. 2005;120:38-45. [PubMed] |
| 14. | Yang X, Hu W, Li F, Xia H, Zhang Z. Gene cloning, bacterial expression, in vitro refolding, and characterization of a single-chain Fv antibody against PreS1(21-47) fragment of HBsAg. Protein Expr Purif. 2005;41:341-348. [PubMed] |
| 15. | Colcher D, Pavlinkova G, Beresford G, Booth BJ, Batra SK. Single-chain antibodies in pancreatic cancer. Ann N Y Acad Sci. 1999;880:263-280. [PubMed] |
| 16. | Grosse-Hovest L, Wick W, Minoia R, Weller M, Rammensee HG, Brem G, Jung G. Supraagonistic, bispecific single-chain antibody purified from the serum of cloned, transgenic cows induces T-cell-mediated killing of glioblastoma cells in vitro and in vivo. Int J Cancer. 2005;117:1060-1064. [PubMed] |
| 17. | Pavlinkova G, Beresford GW, Booth BJ, Batra SK, Colcher D. Pharmacokinetics and biodistribution of engineered single-chain antibody constructs of MAb CC49 in colon carcinoma xenografts. J Nucl Med. 1999;40:1536-1546. [PubMed] |
| 18. | Le Gall F, Reusch U, Little M, Kipriyanov SM. Effect of linker sequences between the antibody variable domains on the formation, stability and biological activity of a bispecific tandem diabody. Protein Eng Des Sel. 2004;17:357-366. [PubMed] |