修回日期: 2006-06-18
接受日期: 2006-06-24
在线出版日期: 2006-08-18
目的: 克隆大鼠原癌基因pim-3并构建真核表达重组质粒pEGFP-N2/pim-3, 观察他在真核细胞SMMC-7721中的表达情况以及对细胞凋亡的影响.
方法: 利用TRIzol从液氮保存的大鼠骨骼肌组织中提取总RNA, 采用RT-PCR方法获取pim-3 cDNA, 并构建重组质粒pEGFP-N2/pim-3, 转化用CaCl2法制备的大肠杆菌JM-109菌株, 酶切以及测序鉴定. 将重组质粒通过脂质体介导转染肝癌SMMC-7721细胞后利用倒置荧光显微镜观察基因表达情况, 并利用流式细胞术及MTT比色实验对转染细胞的生物学行为进行检测.
结果: 将RT-PCR产物全部用于低熔点琼脂糖凝胶电泳、回收, 在DL 2000 Marker 1000 bp附近可见清晰条带, 与实验设计符合; 阳性克隆质粒的酶切电泳和测序结果表明, 大鼠pim-3 cDNA的克隆和重组质粒pEGFP-N2/pim-3的构建成功; 重组质粒pEGFP-N2/pim-3转染组凋亡细胞占3.5%, 质粒pEGFP-N2转染组凋亡细胞占10.7%, 而仅加入转染液的空白组凋亡细胞占11.0%, 重组质粒转染组与两对照组之间差异有统计学意义(P<0.05); 倒置荧光显微镜可以观察到pim-3在SMMC-7721细胞中的正常表达; MTT比色实验显示原癌基因pim-3能够明显抑制细胞凋亡.
结论: 真核表达重组质粒pEGFP-N2/pim-3构建成功; 原癌基因pim-3能明显抑制肝癌细胞凋亡.
引文著录: 邓欢, 刘亮明, 张吉翔, 罗杰, 尹东, 熊瑛, 汤蕾, 谢正元. 原癌基因pim-3的克隆及其对肝癌细胞凋亡的影响. 世界华人消化杂志 2006; 14(23): 2288-2293
Revised: June 18, 2006
Accepted: June 24, 2006
Published online: August 18, 2006
AIM: To clone rat pim-3 cDNA and construct its eukaryotic expressing plasmid, and to investi-gate the expression of pim-3 and its effect on the apoptosis in SMMC-7721 cells.
METHODS: Total RNA was isolated from rat skeletal muscle tissues with TRIzol method. pim-3 cDNA was obtained by reverse transcription-polymerase chain reaction (RT-PCR) and constructed into eukaryotic expression vector pEGFP-N2, which expressed green fluorescent protein. The recombinant pEGFP-N2/pim-3 was then transformed into E. coli JM109 host bacteria. After identified by restriction endonuclease digestion and sequencing, plasmid pEGFP-N2/pim-3 was transfected into SMMC-7721 cells by liposome mediation. Fluorescent microscopy was used to examine the expression of pim-3 gene, and the biological behaviors of the transfected cells were tested by flow cytometry and MTT colorimetric assay.
RESULTS: Restriction enzyme digestion analysis and sequencing showed that the recombinant plasmid of rat pim-3 was correctly constructed; Flow cytometry showed the apoptosis rate was 3.48% in the cells transfected with the recombinant plasmid pEGFP-N2/pim-3, 10.74% in those transfected with the plasmid pEGFP-N2, and 11.01% in those without transfection. There were signicant differences between the recombinant plasmid transfected group and the other two control groups (both P < 0.05). Fluorescent microscopy and MTT showed that pim-3 was expressed in SMMC-7721 cells and the apoptosis of the transfected cells was significantly inhibited.
CONCLUSION: pim-3 gene is successfully cloned, and it can induce apoptosis of hepatocellular carcinoma cells.
- Citation: Deng H, Liu LM, Zhang JX, Luo J, Yin D, Xiong Y, Tang L, Xie ZY. Cloning of pro-oncogene pim-3 cDNA and its effect on apoptosis of hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2006; 14(23): 2288-2293
- URL: https://www.wjgnet.com/1009-3079/full/v14/i23/2288.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i23.2288
原癌基因pim家族已发现3个成员: pim-1, pim-2和pim-3, 目前对于pim-1的研究较为深入, 他编码的丝/苏氨酸激酶(serine/threonine kinase): Pim-1包含一个被称为ATP锚的活化位点, 属于钙/钙调蛋白调节激酶(calcium/calmodulin-regulated kinase, CAMP), 在多细胞组织的进化过程中高度保守[1]. 他广泛的分布于各种正常的组织细胞中, 是多种关键性信号传导通路的重要组成部分, 如: C-myc, STATs, Bcl-2等[2-4], Pim-1激酶能通过一个保守的甘氨酸环状模序(motif)磷酸化众多的特异性底物, 从而抑制细胞凋亡, 最终导致肿瘤细胞的出现[5].
而对于原癌基因pim-3的研究成果, 仅限于Fujii et al[6]成功克隆出的pim-3基因全长cDNA核苷酸序列. Pim-3激酶是否与Pim-1激酶一样能通过抑制细胞凋亡来促进肿瘤的发生, 以及二者之间的作用机制有何异同等问题, 目前尚不得而知. 为了研究Pim-3激酶对细胞凋亡的影响, 并进一步探讨其具体作用机制以及应用于临床疾病治疗的可能途径, 我们从Wistar大鼠的骨骼肌组织中克隆出pim-3基因, 并将其重组入真核表达载体pEGFP-N2内, 通过转染肝癌SMMC-7721细胞、倒置荧光显微镜观察细胞内绿色荧光蛋白(green fluorescent proein, GFP), 来研究Pim-3激酶在真核细胞内的的表达、定位及其具体的生物学功能, 并为进一步研究如何利用构建成功的重组质粒pEGFP-N2/pim-3能够抑制细胞凋亡的特性, 为治疗目前临床缺乏有效治疗手段的急性肝损伤、肝衰竭等疾病提供分子生物学基础.
健康成年♂Wistar大鼠, 体质量200±10 g, 南昌大学医学院动物科学部提供. 实验前1 wk领取动物, 分笼饲养, 给予自由进食和饮水. 室温维持25 ℃, 并每隔12 h开灯照明. TRIzol试剂, ThermoScriptTM reverse transcriptase, Lipofectamine 2000, RPMI 1640培养基购自美国Invitrogen公司; olig(dT)15, 1 kb DNA step ladder marker, 限制性核酸内切酶EcoRⅠ和KpnⅠ, Wizard SV gel and PCR Clean-Up System Kit, Wizard PureFection Plasmid DNA Purification System, T4 DNA连接酶均购自美国Promega公司; LA TaqTM DNA聚合酶, dNTP Mixture(各2.5 mmol/L), DL 2000 marker为日本TaKaRa公司; 质粒pEGFP-N2和E. coli JM109菌株为本实验室保存; 肝癌SMMC-7721细胞株购自上海细胞研究所; 胎牛血清为美国Gibco公司产品; 引物由上海Sangon公司合成; 无内毒素质粒小提取试剂盒(离心柱型)购自北京Tiangen生化科技有限公司.
1.2.1 RT-PCR获得目的基因pim-3 cDNA片段: 根据NCBI GenBank (NM_022602)收录的大鼠pim-3 mRNA序列, 借助Primer Premier 5.0软件(PremierBiosoft, USA)设计引物如下: 正义引物: 5'-TAT GAA TTC GAT GCT GCT GTC C-3'; 反义引物: 5'-TAT GGT ACC TCA AGC TCT CAC TGC-3'.
分别在正义引物和反义引物的5'末端引入了限制性核酸内切酶EcoRⅠ和KpnⅠ识别序列(下划线所示), 扩增产物长度为998 bp. 总RNA提取自成年Wistar大鼠骨骼肌组织, 按照TRIzol试剂说明书的操作步骤进行. 逆转录为cDNA后使用TaKaRa公司的LA Taq扩增Pim-3蛋白编码区域, 建立50 μL反应体系如下: LA Taq (5 U/μL) 0.5 μL, 2×GC BufferⅠ 25 μL, dNTP Mixture(各2.5 mmol/L) 8 μL, 逆转录产物2 μL, 上、下游引物(20 μmol/L)各1 μL, 补去离子水至50 μL. 扩增条件: 95 ℃预变性5 min; 94 ℃变性1 min; 55 ℃退火1 min 10 s; 72 ℃延伸1 min; 35个循环后72 ℃延伸2 min. PCR产物全部加入10 g/L低熔点琼脂糖凝胶进行电泳检测, 并用Wizard SV Gel and PCR Clean-Up System试剂盒纯化回收目的片段, 操作步骤同说明书.
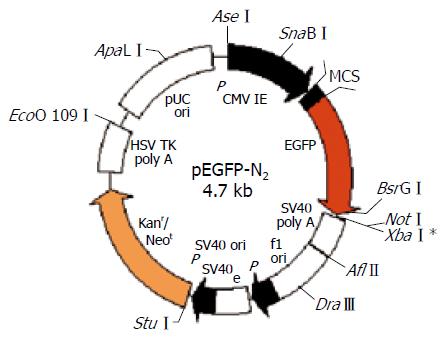
1.2.2 重组质粒pEGFP-N2/pim-3的构建与鉴定: 扩增产物纯化回收后用EcoRⅠ和KpnⅠ酶过量酶切, 酶切产物经10 g/L低熔点琼脂糖凝胶电泳、纯化回收, 与同样经EcoRⅠ和KpnⅠ双酶切后的线性pEGFP-N2质粒利用T4 DNA连接酶, 按照1:1, 1:3和3:1的比例, 室温3 h重新连接, 目的基因连接在EGFP编码区之前的多克隆位点区(图1). 将连接产物转化CaCl2法制备的E. coli JM109感受态细胞, 37 ℃培养48 h后, 于Kanamycin (+)的LB固体培养基上随机挑取单克隆进行小剂量质粒抽提用于EcoRⅠ和KpnⅠ双酶切鉴定, 双酶切证实的阳性克隆送北京三博远志生物工程有限公司进行测序分析.
1.2.3 重组质粒pEGFP-N2/pim-3转染真核细胞: 将重组质粒pEGFP-N2/pim-3通过Lipofectamine 2000转染进入肝癌SMMC-7721细胞中, 瞬时转染方法按照说明书进行. 将转染细胞放入CO2恒温孵育箱内, 分别于转染后24, 48和72 h在荧光倒置显微镜下, 利用488 nm激发波观察, 表达GFP的细胞发出绿色荧光. 为了探讨Pim-3激酶对细胞凋亡的影响, 收集在相同条件下分别用重组质粒pEGFP-N2/pim-3转染、空载体转染和仅加入转染液后72 h, 并且生长状态良好的SMMC-7721细胞, 制备细胞悬液, 测量时用碘化丙啶(PI)染色, 于流式细胞仪检测细胞凋亡率. 进一步观察Pim-3激酶对细胞生长状态的影响. 将制备好的SMMC-7721细胞悬液以103-104/孔的密度接种于96孔板内, 生长72 h后分别用重组质粒pEGFP-N2/pim-3和空载体转染, 分别于转染后24, 48和72 h时, 利用倒置荧光显微镜观察到正常的GFP表达后进行MTT比色实验, 检测细胞存活状态. 分组包括: 重组质粒pEGFP-N2/pim-3转染组、空载体转染组、正常细胞组和空白调零组, 每组细胞取4孔, 在酶联免疫检测仪上测吸光度值(A490 nm), 以空白孔调零, 求其平均值.
统计学处理 组间比较用One-Way ANOVA一元方差分析检验, 所有数据由SPSS 11.0统计学软件处理.
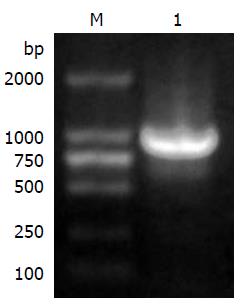
pim-3基因预计大小为998 bp(含酶切位点), 扩增产物在10 g/L琼脂糖凝胶上电泳, 于DL 2000 Marker 1000 bp条带附近形成1条明显条带, 与预计的cDNA片段大小一致(图2). 重组质粒的酶切鉴定结果: 利用从Kanamycin (+)的LB固体培养基上得到的阳性克隆, 分离、纯化重组质粒pEGFP-N2/pim-3, 经EcoRⅠ和KpnⅠ双酶切后, 20 g/L琼脂糖凝胶电泳出现1条约1000 bp的pim-3基因片段和1条约4.7 kb的pEGFP-N2质粒片段, 仅使用EcoRⅠ单酶切后只出现一条约5.7 kb的条带, 符合预期结果(图3).
将双酶切鉴定的阳性克隆测序, 获得的目的基因片段与NCBI GenBank (NM_022602)收录的大鼠pim-3 mRNA序列比较: 该基因第285位氨基酸编码碱基由T突变为G, 但编码的氨基酸都为丙氨酸; 第657位氨基酸编码碱基由T突变为C, 但编码的氨基酸都为亮氨酸, 属于沉默突变型, 表明已经成功的克隆并插入pim-3基因片段, 将重组质粒命名为pEGFP-N2/pim-3(图4).
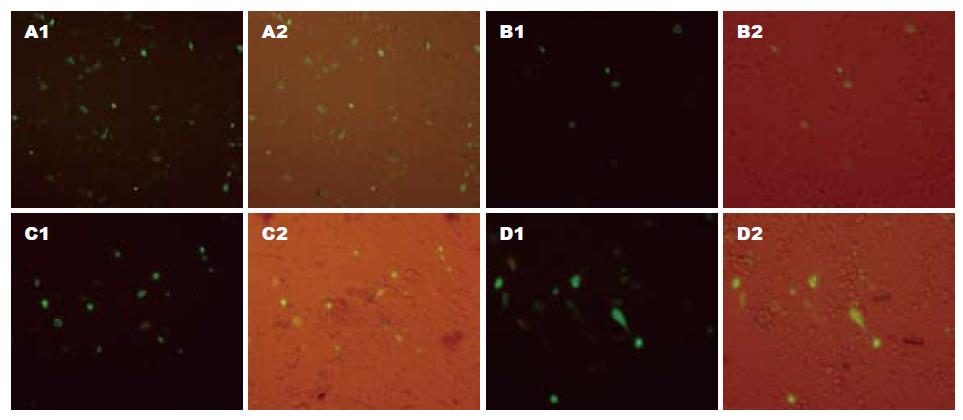
瞬时转染24 h后即可在倒置荧光显微镜下观察到明显的绿色荧光, 表明重组质粒pEGFP-N2/pim-3中的原癌基因pim-3在真核细胞内可以正常表达, 流式细胞术结果将验证pim-3基因对细胞凋亡的抑制作用. 转染72 h后, 仅加入细胞转染液的细胞组, 凋亡细胞占11.0%; 质粒pEGFP-N2转染细胞组, 凋亡细胞占10.7%; 重组质粒pEGFP-N2/pim-3转染细胞组, 凋亡细胞占3.5%, 重组质粒转染组与两对照组之间差异有统计学意义(P<0.05). 转染后24, 48和72 h, 重组质粒pEGFP-N2/pim-3转染组细胞状态与正常细胞对照组出现明显差异(P<0.05), 质粒pEGFP-N2转染组细胞与正常细胞对照组之间无明显差异(表1, 图5).
原癌基因pim家族第一个成员: pim-1基因最早是作为莫洛尼小鼠白血病病毒(MoMuLV)的前病毒插入点而被发现的[7], 他编码产生的丝/苏氨酸激酶Pim-1能够通过自身催化结构域与具有特定序列的底物结合, 这一共同序列为: (赖/精)3-X-丝/苏-X[(Lys/Arg)3-X-Ser/Thr-X]或者精/赖-精/赖-精-精/赖-X-丝/苏-X(Arg/Lys-Arg/Lys-Arg- Arg/Lys-X-Ser/Thr-X), X是一个具有一段侧链的氨基酸残基[8]. 随着研究的深入以及pim-2基因的发现, pim家族在细胞凋亡调控中的作用日益受到人们的关注. Pim激酶不仅能直接磷酸化BH3-only蛋白Bad上的第112位丝氨酸, 并使之失活从而失去与Bcl-2的结合能力, 导致线粒体外膜上通透性转换(permeability transition, PT)通道关闭, 线粒体内促凋亡因子无法释放进入细胞质, 从而促进了细胞在受到外界凋亡刺激因素作用下的存活[9-11]. 最近的研究表明, Pim激酶还可能通过p53/Puma这条重要途径来抑制细胞凋亡, 但具体作用机制尚不清楚. 虽然对于pim-1和pim-2的研究已经取得不少进展, 但对pim-3的了解仍处于一片空白: pim-3是否也能显著的抑制细胞凋亡; 如果能, 那么他的具体作用机制如何, 是与pim-1和pim-2类似或者还可以通过其他特定的途径来起作用; 临床上众多疾病都是由于细胞过度凋亡引起, 并且缺乏有效的治疗手段, 是否能够将pim-3基因抑制细胞凋亡这一重要特性用于这类疾病的治疗? 这同样也是一个令人感兴趣的疑问.
为了深入研究原癌基因pim-3, 并考虑到使用大鼠建立临床疾病模型的可行性和普遍性, 所以选择克隆大鼠pim-3基因, 利用基因重组技术将其连接到真核表达载体上. 在质粒的选择上, 采用具有GFP报告基因的pEGFP-N2质粒, 这样可以非常直观的利用荧光显微镜观察他在真核细胞内的表达情况, 以及在将其用于动物疾病模型后追踪pim-3基因在体内的作用部位以及分布浓度, 同时利用pEGFP-N2质粒的卡那霉素抗性基因进行转化细菌的阳性克隆筛选. 进行引物设计时, 去除pim-3基因的终止密码, 并将其插入在GFP报告基因之前的多克隆位点区域, 这样可以通过观察GFP的正常表达来部分监测重组质粒是否成功构建. 重组质粒经酶切鉴定表明成功插入长度为998 bp的目的基因, 经测序证实为大鼠原癌基因pim-3. 为了模拟并观察将重组质粒用于动物疾病模型后的表达效率, 我们选用通过脂质体介导的瞬时转染方法. 在利用重组质粒转染的肝癌SMMC-7721细胞内成功的观察到高效率的GFP表达, 也反映出重组质粒的正常功能, 将重组质粒命名为pEGFP-N2/pim-3. 这一步的完成, 为之后pim-3基因作用机制的深入研究提供了分子生物学基础. 为了初步研究pim-3基因对真核细胞凋亡的影响, 将成功构建的重组质粒pEGFP-N2/pim-3转染肝癌SMMC-7721细胞, 并进行流式细胞术以及MTT比色试验检测, 结果表明, pim-3能够显著抑制真核细胞的凋亡.
在临床上对于急性肝损伤、肝衰竭尚缺乏有效的治疗手段, 原因之一就是对于其发生机制缺乏足够的了解. 目前的研究发现, 急性肝损伤、肝衰竭的主要病理表现为肝细胞大面积的凋亡和坏死, 细胞凋亡在此过程中起着重要的作用, 他往往是肝细胞对损伤因子做出的第一反应, 之后才会有坏死发生[12-14]. 因此, 如何有效的抑制肝细胞对损伤因子做出的过度细胞凋亡的反应将成为急性肝损伤、肝衰竭防治过程中的重点. 我们已经成功的利用亚致死剂量的内毒素造成D-半乳糖苷(D-galactosamine, D-GalN)致敏大鼠的急性肝损伤实验动物模型[15], 他为研究急性肝损伤、肝衰竭的机制以及治疗手段提供了理想的平台. 下一步将致力于利用成功构建的重组质粒pEGFP-N2/pim-3通过内毒素性急性肝损伤实验动物模型, 探求急性肝损伤、肝衰竭的基因治疗途径.
Pim蛋白广泛表达于人类各种组织细胞中, 并且能够磷酸化多种在细胞凋亡、细胞周期调控中起着重要作用的细胞因子, 从而在肿瘤发生及发展过程中发挥着重要的作用. 目前对于Pim-1激酶的研究较为深入, 但对于pim家族的最新成员: pim-3仍知之甚少, 本实验在国内首次成功的克隆出pim-3基因, 并重点研究了Pim-3激酶对人肝癌细胞SMMC-7721凋亡的影响.
首次在国内成功克隆pim-3基因, 并构建真核表达重组质粒pEGFP-N2/pim-3; 重点研究pim-3基因对于人肝癌细胞SMMC-7721凋亡的影响.
应用要点真核表达重组质粒pEGFP-N2/pim-3的成功构建为在动物模型上进行pim-3基因的研究提供了有利条件, Pim-3激酶抑制凋亡的特性也为以凋亡为主要病理改变的临床疾病的治疗提供了全新的视角.
DNA克隆(DNA cloning): 在体外利用酶学方法将感兴趣的物种来源的DNA片段转移到能自主复制的遗传单元中, 形成重组的DNA分子, 并在宿主细胞中增殖;
细胞凋亡(apop-tosis): 是一种细胞生长的负性调控机制, 又称程序性细胞死亡, 是一种早期以染色体浓缩, 晚期以细胞质、细胞核裂解, 或出现凋亡小体为特征性表现的细胞死亡.
本文研究了原癌基因p im-3转染SMMC-7721细胞对凋亡抑制的影响, 实验方法可 靠, 结果可信, 有一定的学术价值.
电编: 张敏 编辑:潘伯荣
| 1. | Eichmann A, Yuan L, Breant C, Alitalo K, Koskinen PJ. Developmental expression of pim kinases suggests functions also outside of the hematopoietic system. Oncogene. 2000;19:1215-1224. [PubMed] |
| 2. | Heinrich PC, Behrmann I, Haan S, Hermanns HM, Muller-Newen G, Schaper F. Principles of interleukin (IL)-6-type cytokine signalling and its regulation. Biochem J. 2003;374:1-20. [PubMed] |
| 3. | Kim KT, Baird K, Ahn JY, Meltzer P, Lilly M, Levis M, Small D. Pim-1 is up-regulated by constitutively activated FLT3 and plays a role in FLT3-mediated cell survival. Blood. 2005;105:1759-1767. [PubMed] |
| 4. | Peltola KJ, Paukku K, Aho TL, Ruuska M, Silvennoinen O, Koskinen PJ. Pim-1 kinase inhibits STAT5-dependent transcription via its interactions with SOCS1 and SOCS3. Blood. 2004;103:3744-3750. [PubMed] |
| 5. | Bachmann M, Moroy T. The serine/threonine kinase Pim-1. Int J Biochem Cell Biol. 2005;37:726-730. [PubMed] |
| 6. | Fujii C, Nakamoto Y, Lu P, Tsuneyama K, Popivanova BK, Kaneko S, Mukaida N. Aberrant expression of serine/threonine kinase Pim-3 in hepatocellular carcinoma development and its role in the proliferation of human hepatoma cell lines. Int J Cancer. 2005;114:209-218. [PubMed] |
| 7. | Mochizuki T, Kitanaka C, Noguchi K, Sugiyama A, Kagaya S, Chi S, Asai A, Kuchino Y. Pim-1 kinase stimulates c-Myc-mediated death signaling upstream of caspase-3 (CPP32)-like protease activation. Oncogene. 1997;15:1471-1480. [PubMed] |
| 8. | Palaty CK, Clark-Lewis I, Leung D, Pelech SL. Phosphorylation site substrate specificity determinants for the Pim-1 protooncogene-encoded protein kinase. Biochem Cell Biol. 1997;75:153-162. [PubMed] |
| 9. | Cory S, Adams JM. The Bcl2 family: regulators of the cellular life-or-death switch. Nat Rev Cancer. 2002;2:647-656. [PubMed] |
| 10. | Datta SR, Ranger AM, Lin MZ, Sturgill JF, Ma YC, Cowan CW, Dikkes P, Korsmeyer SJ, Greenberg ME. Survival factor-mediated BAD phosphorylation raises the mitochondrial threshold for apoptosis. Dev Cell. 2002;3:631-643. [PubMed] |
| 11. | Aho TL, Sandholm J, Peltola KJ, Mankonen HP, Lilly M, Koskinen PJ. Pim-1 kinase promotes inactivation of the pro-apoptotic Bad protein by phosphorylating it on the Ser112 gatekeeper site. FEBS Lett. 2004;571:43-49. [PubMed] |
| 12. | Kasahara I, Saitoh K, Nakamura K. Apoptosis in acute hepatic failure: histopathological study of human liver tissue using the tunel method and immunohis-tochemistry. J Med Dent Sci. 2000;47:167-175. [PubMed] |
| 13. | Riordan SM, Williams R. Mechanisms of hepatocyte injury, multiorgan failure, and prognostic criteria in acute liver failure. Semin Liver Dis. 2003;23:203-215. [PubMed] |
| 14. | Togo S, Kubota T, Matsuo K, Shimizu T, Momiyama N, Takeda K, Tanaka K, Endo I, Sekido H, Shimada H. Mechanism of liver failure after hepatectomy. Nippon Geka Gakkai Zasshi. 2004;105:658-663. [PubMed] |