修回日期: 2006-06-20
接受日期: 2006-07-18
在线出版日期: 2006-08-08
目的: 探讨胃肠道间质瘤(GIST)的临床病理和免疫组化特点.
方法: 回顾性分析我院收治的24例GIST患者的临床病理及随访资料, 并对其石蜡标本采用免疫组化SP染色法检测, 分析其免疫组化特点.
结果: 本组GIST发病年龄29-75(平均54.5±13.5), 男16例, 女8例, 主要发生在胃、小肠、直肠. 并多以腹部隐痛不适、腹部肿物、上消化道出血为首发症状, 全部患者进行积极外科治疗, 肿瘤切除率100%, 术后复发转移率为14.3%. 大多数病例为手术切除后确诊. 肿瘤大小从2-16 cm(平均6.6±3.9 cm). 基本病理组织形态为梭形细胞型, 上皮细胞型较少. 5例核分裂像>5/50HPF者其肿瘤直径均>5 cm, 其中4例伴有囊性变、出血或坏死. 4例核分裂像为2-5/50HPF者肿瘤直径在3-5 cm之间. 免疫组化染色CD117, CD34, Vim为弥漫强阳性, 阳性率分别为91.7%, 62.5%和66.7%. S-100阴性, SMA呈灶状阳性.
结论: GIST好发于中老年, 缺乏特异的临床表现, 早期诊断困难, 外科手术仍是未转移的GIST的首要治疗方式, 并且其肿瘤细胞形态多变, 排列方式多样, 免疫组化染色为CD117, CD34和Vim阳性, S-100阴性, SMA呈灶状阳性.
引文著录: 顾国利, 王石林, 任力, 魏学明, 李德昌, 周晓武, 黄蓉蓉. 胃肠道间质瘤的临床病理分析和免疫组化特点. 世界华人消化杂志 2006; 14(22): 2241-2246
Revised: June 20, 2006
Accepted: July 18, 2006
Published online: August 8, 2006
AIM: To explore the histopathological and immunohistochemical features of gastrointesti-nal stromal tumors (GIST).
METHODS: Immunohistochemistry was performed in GIST, for a panel of antibodies such as CD117, CD34, Vim, SMA, S-100 by SP staining methods. Clinical data and follow-up documents of 24 patients with GIST admitted from January 2000 to May 2006 were studied retrospectively.
RESULTS: There were 24 patients (males and 8 females) aged from 29 to 75 (mean 54.5 ± 13.5). The tumors were mainly located at the stomach, small bowel and rectum. The initial presentations were bellyache (33.3%), abdomen mass (25.0%) and gastrointestinal bleeding (20.8%) in the most cases. All patients received successful surgical resection of tumor and the total resection rate was 100%. The rate of recurrence and metastasis was 14.3% (3/21) after operation. The most cases were diagnosed after surgical resection. Tumor size varied from 2 to 16 cm (mean 6.6 cm). The cells were spindle-like, and the epithelioid cells were rare. The mitotic count was higher than 5/50HPF in 5 cases, in which the tumor sizes were over or equal to 5 cm in diameter, and cystification, hemorrhage or necrosis was observed in 4 cases. The mitotic count was 2-5/50HPF in 4 cases, in which the tumor sizes were 3-5 cm in diameter. Immunohistochemically, CD117, CD34 and Vim showed diffuse and strong expression, and the positive rates were 91.7%, 62.5% and 66.7%, respectively. S-100 was hardly present, and SMA was focally present or absent.
CONCLUSION: GIST predominantly occurs in the middle aged or old patients without specific manifestations, so early diagnosis is fairly difficult. Surgery remains the standard treatment for non-metastasis patients with GIST. The tumor cells have various kinds of types and different arrangements. Immunohistochemical staining is positive for CD117, CD34 and Vim, negative for S-100, and focal positive for SMA.
- Citation: Gu GL, Wang SL, Ren L, Wei XM, Li DC, Zhou XW, Huang RR. Histopathological and immunohistochemical features of gastrointestinal stromal tumors. Shijie Huaren Xiaohua Zazhi 2006; 14(22): 2241-2246
- URL: https://www.wjgnet.com/1009-3079/full/v14/i22/2241.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i22.2241
胃肠道间质瘤(gastrointestinal stromal tumor, GIST)是一组独立起源于胃肠壁间质干细胞的肿瘤, 由未分化或多能的梭形或上皮样细胞组成, 免疫组化多数表达CD117和(或)CD34[1]. 因其临床病理和免疫组化特点突出, 近年来GIST受到了人们的广泛关注并成为消化道肿瘤研究的一个热点. 我院2000-01/2006-05共收治GIST 24例, 我们采用免疫组化SP染色法对其石蜡标本进行检测并结合临床病理及随访资料的回顾性分析, 探讨GIST的临床病理和免疫组化表达特点及其生物学行为.
2000-01/2006-05收治GIST患者的肿瘤组织石蜡标本24例. Leica RM2135病理切片机、LAB vision Autostainer360自动染色仪系统、Olympus Bx51光学显微镜、Olympus Dp70图像采集分析仪. 试剂一抗均为鼠(或兔)抗人mAb, EDTA抗原修复缓冲液, DAB和AEC显色剂. 以上抗体、试剂盒及显色液均购于北京中杉金桥生物科技有限公司.
对24例GIST患者的临床病理及随访资料进行回顾性分析. 将其肿瘤组织标本经40 g/L甲醛固定, 常规石蜡包埋切片(厚度4 μm), HE染色, 光镜观察. SP染色法检测CD117, CD34, SMA, S-100, Vim的表达情况, 用已购阳性切片作阳性对照, PBS代替一抗作为阴性对照, DAB显色, 苏木精复染, 显微镜下观察结果, 染色步骤和抗体稀释度均按产品说明书进行. 结果判定: 结构清晰, 着色明显高于背景, 在相应部位出现棕黄色颗粒者为阳性细胞; 不着色或显色强度与背景无差别者为阴性细胞. 每例切片随机选择5-10个高倍视野(×400), 统计阳性细胞数, 取其平均值; 无着色或<10%为阴性, 10%-25%为+, 26%-50%为++, >50%为+++.
统计学处理 应用SPSS 12.0统计软件进行统计分析. 数据用mean±SD表示, 采用计数资料的χ2检验及Spearman等级相关分析, P<0.05有统计学意义.
| 编号 | 性别 | 年龄(岁) | 首发症状 | 病史 | 部位 | 细胞形态 | 肿瘤大小 | 免疫组化 | 治疗 | 随访结果 | ||||
| (cm) | CD117 | CD34 | Vim | SMA | S-100 | |||||||||
| 1 | 女 | 72 | 上腹隐痛 | 1.5年 | 胃 | 上皮细胞 | 4×4 | ++ | - | + | - | - | 胃部分切除 | 72 mo健在 |
| 2 | 男 | 45 | 上腹隐痛 | 1 mo | 胃 | 梭形细胞 | 4×3 | +++ | - | - | - | - | 胃大部切除 | 术后失访 |
| 3 | 女 | 65 | 上腹隐痛 | 1.5年 | 胃细胞 | 上皮 | 3×3 | + | - | +++ | - | - | 胃大部切除 | 64 mo健在 |
| 4 | 男 | 35 | 上腹饱胀 | 1年 | 胃 | 梭形细胞 | 15×15 出血囊性变 | ++ | ++ | + | - | - | 全胃切除 | 39 mo后死于腹腔复发 |
| 5 | 男 | 72 | 上腹隐痛 | 1年 | 胃 | 混合细胞 | 5×5 | ++ | - | - | - | - | 胃大部切除 | 术后失访 |
| 6 | 男 | 46 | 腹部肿物 | 3 mo | 小肠 | 梭形细胞 | 11×10 出血囊性变 | +++ | + | +++ | - | - | 小肠部分切除 | 66 mo健在 |
| 7 | 男 | 61 | 上腹饱胀 | 6 mo | 胃 | 混合细胞 | 2×2 | ++ | ++ | + | ++ | - | 胃大部切除 | 14 mo健在 |
| 8 | 女 | 75 | 腹部肿物 | 3 mo | 胃 | 梭形细胞 | 5×5 | ++ | ++ | - | - | - | 胃部分切除 | 1 mo健在 |
| 9 | 女 | 74 | 便血 | 10 d | 小肠 | 混合细胞 | 4×4 | + | ++ | +++ | - | - | 小肠部分切除 | 13 mo健在 |
| 10 | 女 | 60 | 便血 | 7 d | 胃 | 梭形细胞 | 2×2 | +++ | ++ | +++ | - | - | 胃部分切除 | 38 mo健在 |
| 11 | 男 | 32 | 便血 | 7 d | 小肠 | 梭形细胞 | 8×8 | +++ | + | +++ | - | - | 小肠部分切除 | 36 mo健在 |
| 12 | 男 | 54 | 腹部肿物 | 4 mo | 小肠 | 梭形细胞 | 8×7 | +++ | + | ++ | +++ | - | 小肠部分切除 | 19 mo健在 |
| 13 | 女 | 70 | 上腹隐痛 | 4 mo | 胃 | 梭形细胞 | 16×16 出血囊性变 | - | ++ | ++ | - | - | 胃大部切除 | 4 mo健在 |
| 14 | 男 | 45 | 上腹隐痛 | 1年 | 胃 | 梭形细胞 | 2.5×2.5 | + | ++ | - | - | - | 胃大部切除 | 10 mo健在 |
| 15 | 男 | 46 | 腹部肿物 | 2 mo | 直肠 | 梭形细胞 | 10×6 | +++ | +++ | - | - | - | Miles | 9 mo健在 |
| 16 | 男 | 41 | 便血 | 8 d | 小肠 | 梭形细胞 | 6×6 | +++ | + | +++ | - | - | 小肠部分切除 | 9 mo健在 |
| 17 | 女 | 60 | 腹部肿物 | 1 mo | 结肠 | 梭形细胞 | 6.5×6 | + | ++ | +++ | - | - | 左半结肠切除 | 25 mo健在 |
| 18 | 男 | 56 | 便血 | 1 mo | 胃 | 梭形细胞 | 4.5×4 | ++ | ++ | +++ | - | - | 胃大部切除 | 24 mo健在 |
| 19 | 男 | 52 | 上腹饱胀 | 1 mo | 胃 | 梭形细胞 | 5×3.5 | + | - | ++ | - | - | 胃大部切除 | 40 mo健在 |
| 20 | 男 | 29 | 腹部隐痛 | 6 mo | 直肠细胞 | 梭形 | 10×10 出血囊性变 | + | ++ | +++ | - | - | 直肠前切除 | 39 mo健在 |
| 21 | 男 | 47 | 腹部肿物 | 1年 | 胃 | 梭形 | 5×5 | + | - | +++ | - | - | 胃大部切除 | 62 mo健在 |
| 22 | 男 | 69 | 无症状中探查发现, | 术 | 胃 | 混合细胞 | 3×3 | - | - | - | - | - | 胃大部切除 | 2 mo后死于其他疾病 |
| 23 | 男 | 50 | 腹部隐痛 | 1 mo | 直肠 | 梭形细胞 | 10×8 | +++ | - | - | - | - | 直肠前切除 | 术后失访 |
| 24 | 女 | 51 | 无症状,体检发现 | 直肠 | 梭形细胞 | 0×6 | +++ | - | - | - | - | Miles | 术后1年复发,再次手术 48 mo后死于肝转移 | |
本组患者24例, 男16例, 女8例. 男女比例2∶1. 年龄29-75(中位54.5±13.5)岁; 其中≥50岁者15例(占62.5%). 病灶位于胃14例(58.3%)、小肠5例(20.8%)、直肠4例(16.7%)、结肠1例(4.2%). 肿瘤直径2-16(平均6.6±3.9)cm, 其中<3 cm 3例, 3-5 cm 10例, >5 cm 11例. 发病至就诊时间为1 wk-1.5年, 平均5.4 mo. 临床首发表现: 腹部隐痛不适8例, 腹部肿物6例, 消化道出血5例, 上腹部饱胀3例, 体检或术中探查发现2例(无症状). 伴随症状有贫血、乏力、体质量减轻等. 除1例患者在术中探查被发现外, 其他均行内镜检查, 发现黏膜下肿物12例, 黏膜溃疡性肿物6例, 黏膜肿物出血5例. 内镜下组织活检确诊5例(20.8%), 其余为黏膜慢性炎. 20例行腹部CT检查均发现占位性病变, 考虑间质瘤9例、胃肠道癌6例、淋巴瘤5例. 14例行X线造影发现胃肠道腔内充盈缺损12例. 均行手术切除治疗, 其中胃大部切除术10例, 胃部分切除术3例, 全胃切除术1例, 小肠部分切除5例, Miles术2例, 直肠前切除2例, 左半结肠切除1例. 无手术死亡, 1例发生骶前静脉丛大出血, 经髂内动脉结扎、宫纱填塞后缓解, 其余无术后并发症. 本组有3例术后失访(12.5%), 其余患者采用门诊复查、电话及信访等方式随访, 时间1 mo-6年. 21例患者中术后没有伊马替尼(Imatinib mesylate, 商品名Gleevec或Glivec格列卫)治疗, 有10例行艾迪注射液、复方斑蝥胶囊等中药治疗. 1例术后1年复发再次手术切除, 1例死于其他疾病, 2例死于腹腔复发、肝脏转移, 其余健在. 21例患者中完成3年随访10例(47.6%), 完成5年随访5例(23.8%).
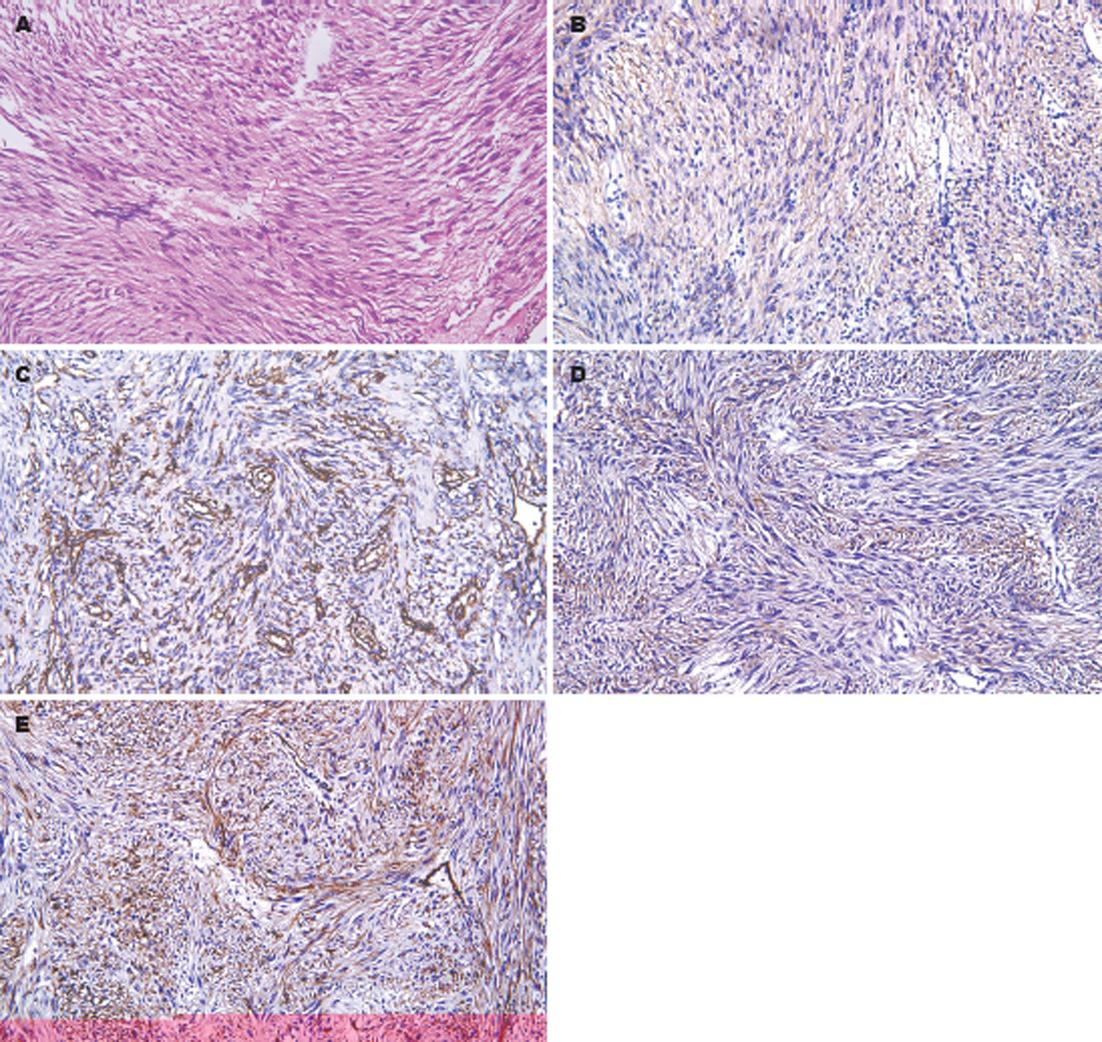
GIST肿瘤细胞基本形态为梭形细胞和上皮样细胞. 多数梭形细胞界限不清, 胞质丰富, µ染, 轻度嗜酸或略嗜碱, 多交叉束状、旋涡状、席纹状排列(图1A). 上皮样细胞多呈弥漫片状、束状或巢状排列, 胞质可嗜酸或嗜碱或二者都有, 细胞界限清楚. 依据梭形细胞和上皮样细胞的比例可分为上皮样细胞型(上皮样细胞>50%)、梭形细胞型(上皮样细胞<10%)和混合型(上皮样细细胞10%-50%). 本组有梭形细胞型18例(75.0%)、混合细胞型4例(16.7%)、上皮样细胞型2例(8.3%). 核分裂像>5/50 HPF者5例, 其肿瘤直径均>5 cm, 其中4例伴有囊性变或出血. 核分裂像在2-5/50 HPF者4例, 肿瘤直径3-5 cm, 其中上皮样细胞型和梭形细胞型各2例. CD117阳性22例(91.7%)(图1B)、CD34阳性15例(62.5%)(图1C), CD117和CD34共同阳性表达14例(58.3%), 多数病例的CD117阳性强度和范围高于CD34. Vim阳性16例(66.7%)(图1D), CD117, CD34, Vim多呈弥漫强阳性. SMA局灶阳性表达2例(8.3%)(图1E), S-100均无阳性表达.
GIST是最常见的消化道间叶性肿瘤[1-2], 约占消化道恶性肿瘤的2.2%. 本组占同期收治的胃肠道恶性肿瘤的2.8% (24/868). 在1983年Mazur et al[3]提出GIST的概念以前, 其常被诊断为胃肠道平滑肌瘤、平滑肌肉瘤或神经鞘瘤. 目前认为GIST起源于消化道间叶组织的、具有多向分化潜能的间质干细胞, 是由于人类染色体4q12-13区的c-Kit基因第11外显子发生突变所致[4-5], 极少数是由第9, 13, 14, 17外显子上发生突变所致[6-7]. GIST可见于各年龄段, 高峰为50-70岁, 无性别显著差异[1-2,8-14]. 本组男女比例2∶1, 可能是因例数较少所致. 本组中位发病年龄54.5岁, ≥50岁者占62.5%, 差异显著(P<0.05). 按GIST发生率的高低排序依次为胃部60%-70%、小肠20%-25%、结直肠约5%[1-2,8-14]. 本组发生部位也以胃、小肠、直肠居多, 结肠较少. 本组患者以腹部隐痛不适、腹部肿物和消化道出血为主要表现, 无特征性临床表现. 有23例行内镜检查虽均发现病变, 但镜下病理确诊率只有20.8%. 原因: GIST发生在消化道肌层, 主要在肌壁内或向浆膜面生长, 内镜多无法在消化腔内取到肿瘤组织. 即使其向腔内生长引起黏膜溃疡、出血、坏死, 钳取肿瘤组织的阳性率也较低. CT、超声、X线造影等影像学检查虽能发现肿瘤并作出定位诊断, 但因GIST缺乏特异性影像表现, 很难作出定性诊断. 因此手术切除活检和免疫组化检查仍是确诊的主要方法. 目前伊马替尼价格昂贵, 尚未在临床普及, 其用于GIST的治疗国内报道较少. 本组术后均未行伊马替尼治疗, 仅有部分患者行中药等治疗, 在并非全部患者完成5年随访的情况下, 其3年, 5年生存率仍较高. 因此, 对于GIST应积极手术治疗, 特别是首次手术时注意完整切除. 对于有恶性倾向者应行根治性切除. 国内外文献[1-2,8-15]报道: 恶性GIST完全切除肿瘤病灶者, 5年生存率35%-54%, 不完全切除者为8%. 本组显示, 原发肿瘤较小、恶性程度较低并行完整切除的病例预后较好, 而原发肿瘤较大者其恶性程度增加、完整切除的机会减少, 故复发的机会增加, 使预后变差. 因对GIST的生物学行为并未完全掌握, 所以对于直肠GIST的手术方式目前仍有争议, 根治性手术可能造成患者永久性结肠造口、性功能障碍、生活质量降低, 而姑息性切除可能使肿瘤复发风险增大、生存期缩短. 因此术前需与患者仔细沟通探讨、共同制订手术方式, 以免引发纠纷. 本组2例肿瘤较小且位置较高者行直肠前切除术, 另2例行Miles的原因是肿瘤较大、核分裂像多、有恶性倾向且位置较低并产生不全梗阻症状, 其中1例肿瘤侵犯骶前筋膜, 术中剥离时发生骶前静脉丛大出血, 经双侧髂内动脉结扎、填塞宫纱压迫止血才得以控制出血. 术后1 wk后分次拔出宫纱, 患者未再出血, 恢复正常出院. 目前, 绝大多数学者[16-28]认为CD117, CD34联合应用是诊断GIST的最有效方法. CD117是诊断GIST的一项主要指标但不是唯一标准, 必须结合CD34或其他免疫组化标记, 才能更有效与其他肿瘤鉴别[22-30]. 本组CD117阳性率为91.7% (P<0.05), CD34阳性率70.8%, 与文献[16-28]报道一致. Vim阳性表明肿瘤起源于间叶组织, 本组Vim阳性率66.7%, 高于CD34, 因此Vim也是诊断GIST的一个重要辅助指标. 本组结果显示CD117, CD34, Vim, SMA和S-100 5项指标的表达与患者年龄、性别、肿瘤部位及大小和预后均无相关性, 并且这5项指标内部之间的阳性表达也无相关性, 因此他们在GIST中的表达意义仅限于诊断, 对GIST的预后判断及治疗方式无指导意义.
GIST是最常见的消化道间叶性肿瘤, 其临床病理和免疫组化特点突出, 是目前消化道肿瘤研究的一个热点. GIST可见于各年龄段, 高峰为50-70岁, 其发生部位: 胃部60%-70%, 小肠20%-25%, 结直肠约5%. 以腹部隐痛、腹部肿物和消化道出血为主要表现, 无特征性临床表现. 因其发生于肌层并多向腔外生长, 故内镜活检的确诊率较低, 影像学检查虽能作出定位诊断;但因其缺乏特异性影像表现, 很难作出定性诊断.
本文在总结所诊治的GIST临床病理、随访资料的同时, 结合了免疫组化的基础研究,就GIST的诊断治疗经验进行了总结, 对提高广大读者对该病诊断与治疗的认识有一定参考价值.
GIST是最常见的消化道间叶性肿瘤, 其临床病理和免疫组化特点突出, 本文通过对所经治GIST病例的临床病理资料的总结和其免疫组化的染色, 以及结合国内外同行文献的学习, 归纳出GIST的临床病理和免疫组化特点, 以期临床医生在一线工作中提高对该病的认识和诊治技能, 加强随访和复查工作, 避免误诊误治.
胃肠道间质瘤(GIST): 是一组独立起源于胃肠壁间质干细胞的肿瘤, 由未分化或多能的梭形或上皮样细胞组成, 免疫组化多数表达CD117和(或)CD34. 多数是由于人类染色体4q12-13区的c-Kit基因第11外显子发生突变所致, 极少数是由第9, 13, 14, 17外显子上发生突变所致.
因其临床病理和免疫组化特点突出, 近年来GIST受到了人们的广泛关注并成为消化道肿瘤研究的一个热点, 本文研究临床内容为国内外研究的热点内容, 研究设计合理, 有科学研究价值和临床指导价值.
电编: 张敏 编辑:张焕兰
| 3. | Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol. 1983;7:507-519. [PubMed] [DOI] |
| 4. | Lasota J, Jasinski M, Sarlomo-Rikala M, Miettinen M. Mutations in exon 11 of c-Kit occur preferentially in malignant versus benign gastrointestinal stromal tumors and do not occur in leiomyomas or leiomyosarcomas. Am J Pathol. 1999;154:53-60. [PubMed] [DOI] |
| 5. | Lux ML, Rubin BP, Biase TL, Chen CJ, Maclure T, Demetri G, Xiao S, Singer S, Fletcher CD, Fletcher JA. KIT extracellular and kinase domain mutations in gastrointestinal stromal tumors. Am J Pathol. 2000;156:791-795. [PubMed] [DOI] |
| 6. | Heinrich MC, Corless CL, Duensing A, McGreevey L, Chen CJ, Joseph N, Singer S, Griffith DJ, Haley A, Town A. PDGFRA activating mutations in gastrointestinal stromal tumors. Science. 2003;299:708-710. [PubMed] [DOI] |
| 7. | Andersson J, Sjogren H, Meis-Kindblom JM, Stenman G, Aman P, Kindblom LG. The complexity of KIT gene mutations and chromosome rearrangements and their clinical correlation in gastrointestinal stromal (pacemaker cell) tumors. Am J Pathol. 2002;160:15-22. [PubMed] [DOI] |
| 15. | Crosby JA, Catton CN, Davis A, Couture J, O'Sullivan B, Kandel R, Swallow CJ. Malignant gastrointestinal stromal tumors of the small intestine: a review of 50 cases from a prospective database. Ann Surg Oncol. 2001;8:50-59. [PubMed] [DOI] |
| 24. | 胡 静姿, 刘 惠敏, 李 玉莉, 何 金, 徐 毅. 胃肠道间质瘤CD117、CD34、Ki-67的表达及其与临床病理因素和危险度的相关性. 第二军医大学学报. 2005;26:798-801. |
| 28. | 孙 梅, 王 玉新, 孙 亚欣, 李 东复. 胃肠道间质瘤的组织病理学和免疫组织化学特点. 吉林大学学报(医学版). 2005;31:918-920. |