修回日期: 2006-06-10
接受日期: 2006-06-14
在线出版日期: 2006-08-08
目的: 观察早期持续高容量血液滤过(HVHF)对重症急性胰腺炎(SAP)猪的胰腺及胰外重要脏器病理变化的影响.
方法: 长白猪24只, 随机分为: 对照组(n = 8, 模型组), 低容量血滤组(n = 8), 接受20 mL/(kg·h)置换量的血液滤过, 及HVHF组(n = 8), 接受100 mL/(kg·h)置换量的血液滤过. 通过向胰管注入40 g/L牛磺胆酸钠(1 mL/kg)和胰蛋白酶(2 U/kg)溶液, 诱导猪的SAP模型. 治疗组在模型诱导后立即开始血滤治疗, 并观察各组的生存时间以及胰腺和胰外重要脏器的组织病理学评分.
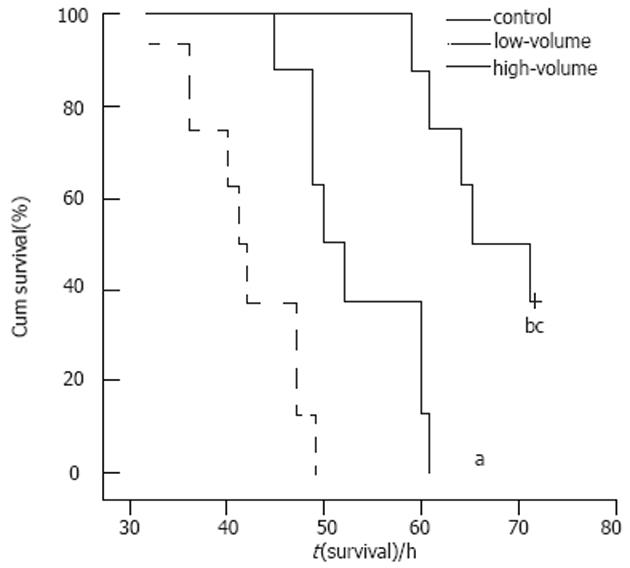
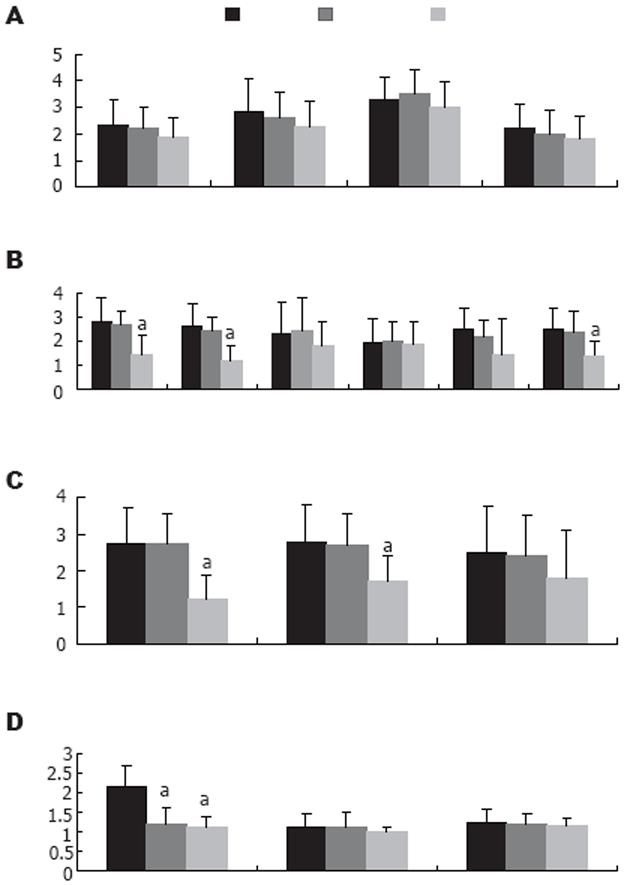
结果: 各组的半数生存期分别是41, 50和65 h (P<0.01). 胰腺本身的病理损害评分在各组间无明显差异(P>0.05), 但HVHF组在肝细胞的变性、肺透明膜和微血栓的形成以及肾小管损伤等指标的评分上明显降低(P<0.05).
结论: 持续性血液滤过虽然不能减轻SAP猪胰腺本身的病理损害, 但早期HVHF能有效地减轻SAP猪肝细胞的变性、肺透明膜和微血栓的形成以及肾小管的损伤, 延长生存时间.
引文著录: 张震环, 李维勤, 王浩, 燕晓雯, 黎介寿. 早期持续高容量血滤对SAP猪的胰腺及胰腺外器官病理变化的影响. 世界华人消化杂志 2006; 14(22): 2180-2185
Revised: June 10, 2006
Accepted: June 14, 2006
Published online: August 8, 2006
AIM: To observe the effect of early continuous high-volume hemofiltration on the histopatho-logical changes of pancreas and extrapancreatic organs in pigs with severe acute pancreatitis (SAP).
METHODS: Twenty-four domestic pigs were randomly and averagely assigned into 3 groups: control group (untreated model group) as group A, low-volume hemofiltration [20 mL/(kg·h)] group as group B, and high-volume hemofiltration [100 mL/(kg·h)] group as group C. SAP model was produced by injection of sodium taurocholate (40 g/L, 1 mL/kg) and trypsin (2 U/kg) via the pancreatic duct. The pigs in group B and C received hemofiltration immediately after modeling. The parameters including survival time and histopathological scores of pancreas and extra-pancreatic organs were observed.
RESULTS: The median survival times were 41, 50 and 65 h in group A, B, and C, respectively, and there were significant differences among them (P < 0.01). The histopathological scores had no marked differences between the three groups (P > 0.05). However, the scores for hepatocellular degeneration, pulmonary hyaline membranes and microthrombi, and renal tubular damage were obviously lower than those in the other groups (P < 0.05).
CONCLUSION: Although hemofiltration can not reduce the pancreatic damage in pigs with SAP, early continuous high-volume hemofiltration can significantly ameliorate the hepatocellular degeneration, the formation of pulmonary hyaline membranes and microthrombi, and the renal tubular damage in pigs with SAP, which is useful in improving the survival time.
- Citation: Zhang ZH, Li WQ, Wang H, Yan XW, Li JS. Effect of early continuous high-volume hemofiltration on histopathological changes of pancreas and extrapancreatic organs in pigs with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2006; 14(22): 2180-2185
- URL: https://www.wjgnet.com/1009-3079/full/v14/i22/2180.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i22.2180
血液滤过治疗特别是高容量血液滤过(HVHF), 能够有效地清除重症急性胰腺炎(SAP)时过多的炎症介质及细胞因子, 从而改善脏器的功能, 防治多器官功能障碍 综合征(MODS), 这一点已取得广泛共识[1-3]. 但是血液滤过是否能改善SAP的胰腺及胰腺外器官病理损害, 目前尚不清楚, 为了探讨这个问题, 我们观察了血液滤过对SAP猪的胰腺及胰腺外器官病理变化的影响.
牛磺胆酸钠购自美国Sigma公司. 胰蛋白酶购自美国Difco公司. 健康长白猪24只(由南京军区总医院动物实验中心提供), 体质量25-30 kg, 雌雄不限.
SAP猪模型的诱导. 术前晚开始禁食, 术晨禁水. 所有动物用氯胺酮20 mg/kg和阿托品1 mg im作诱导麻醉, 后持续iv 25 g/L硫喷妥钠, 根据麻醉深度由静脉泵控制在4-10 mg/(kg·h). 麻醉后行气管插管并接呼吸机辅助呼吸, 使用容量控制模式, 频率为20次/min, 潮气量为15 mL/kg, FiO2为0.21. 无菌条件下, 腹正中切口进腹, 暴露胰十二指肠, 将其向右·转, 在十二指肠系膜侧, 可见与肠系膜血管平行走向的主胰管, 沿系膜缘游离并切开主胰管, 小心置入直径为1 mm的聚氯乙烯导管, 深约1-2 cm, 备用. 使用含40 g/L硫磺胆酸钠和胰蛋白酶(2 kU/L)的生理盐水溶液, 按1 mL/kg、以100 mmHg的压力, 向胰管导管缓慢注入, 直视下可见整个胰腺因药物渗入变为棕黑色, 然后拔除导管并结扎胰管, 诱导成功后逐层关腹. 所有的动物在整个实验过程中给予一般治疗, 包括静脉输生理盐水5 mL/(kg·h), 持续麻醉、机械通气. 模型诱导后, 立即开始血液滤过治疗. 分组: (1)对照组(n = 8), 一般治疗; (2)低容量组(n = 8), 一般治疗+20 mL/(kg·h)置换量的血液滤过; (3)高容量组(n = 8), 一般治疗+100 mL/(kg·h)置换量的血液滤过. 血液滤过方案为零平衡持续性血液滤过(CVVH). 血管通路采用Seldinger血管穿刺技术, 经颈内静脉穿刺, 置入双腔血滤导管. 使用Baxter BM25机器, 置换液以前稀释方式输入, 低容量组置换液流量为20 mL/(kg·h), 高容量组为100 mL/(kg·h). 各组的血流量均为80 mL/min. 滤器使用聚丙烯腈膜(AN69, Hospal, France), 面积1.2 m2, 每24 h更换1次. 采用低分子肝素抗凝. 观察时限最长为72 h, 后静推100 g/L KCl 10 mL将动物处死. 立即留取胰腺(分别取头、体、尾)、肺(分别取自左右肺的每一叶)、肝、肾组织, 组织标本修剪成2 cm×1 cm×0.5 cm大小, 每个器官至少留取3块标本, 用100 g/L甲醛磷酸缓冲液(pH 7.4)固定. 常规石蜡切片, HE染色. 用Olympus显微镜观察组织学变化并照相. 胰腺采用Schmidt评分[4](表1), 肺、肾及肝脏评分按文献[5-6]标准(表2-4). 由病理科医师进行单盲读片, 根据镜下所见, 并结合大体病理严格依照标准进行评分, 同一器官不同区域及视野的分值有出入时取平均值.
| 水肿 | 腺细胞坏死(坏死细胞数/高倍视野) | 炎症(小叶内或血管周白细胞数/高倍视野) | 出血(血管外或间隔内红细胞数/高倍视野) |
| 1 = 小叶间隔局灶性扩张 | 1 = 1-4 | 1 = 1-10 | 1 = 1-50 |
| 2 = 同1+小叶间隔广泛性扩张 | 2 = 5-10 | 2 = 11-20 | 2 = 51-100 |
| 3 = 同2+腺泡间隔扩张 | 3 = 11-16 | 3 = 21-30 | 3 = 101-150 |
| 4 = 同3+细胞间隔扩张 | 4≥16 | 4≥30或小脓肿形成 | 4≥150 |
| 分值 | 透明膜 | 微血栓 | 水肿 | 肺间质浸润 | 肺不张 | 出血 |
| 0 | 无 | 无 | 无 | 无 | 无 | 无 |
| 1 | 稀少 | 有少, | 轻 | 轻 | 小灶 | 小灶 |
| 小血管 | ||||||
| 2 | 中度 | 有一些 | 中 | 中 | 大灶 | 大灶 |
| 3 | 严重 | 许多, | 重 | 重 | 广泛 | 广泛 |
| 大血管 |
| 分值 | 肾小管损伤 | 肾小球损伤 | 微血栓 |
| 0 | 无 | 无 | 无 |
| 1 | 广泛扩张, 灶性 | 内皮细胞肿胀 | 少量 |
| 刷状缘缺损 | |||
| 2 | 广泛刷状缘缺损, | 小球水肿 | 有一些 |
| 灶性小管坏死 | |||
| 3 | 广泛性肾小管坏死 | 小球纤维素样坏死 | 许多 |
| 分值 | 肝细胞变性或坏死 | 炎症(汇管区炎性细胞浸润) | 血管扩张 |
| 0 | 无 | 无 | 肝窦无扩张 |
| 1 | 灶性肝细胞水肿 | 轻 | 肝窦扩张, 窦内枯否细胞浊肿, 数量增多 |
| 2 | 广泛肝细胞水肿, 或轻度脂肪变性 | 中 | 肝窦扩张, 窦内枯否细胞浊肿, 数量明显增多 |
| 3 | 弥漫性肝脂肪变性, 或灶性坏死 | 重 | 肝窦显著扩张, 窦内枯否细胞浊肿, 数量明显增多, 可见PMNs |
统计学处理 生存时间采用Kaplan-Meier法计算生存曲线, 并进一步用Log rank检验进行生存曲线的比较. 病理组织学评分采用单因素方差分析, 组间比较用SNK-q检验. P<0.05认为有统计学意义.
对照组、低容量血滤组和HVHF组的半数生存时间分别是41, 50和65 h, 无论是低容量血滤组, 还是HVHF组均较对照组的生存时间显著延长(P<0.05), 而且HVHF组较低容量血滤组的生存时间也明显延长(P<0.05, 图1).
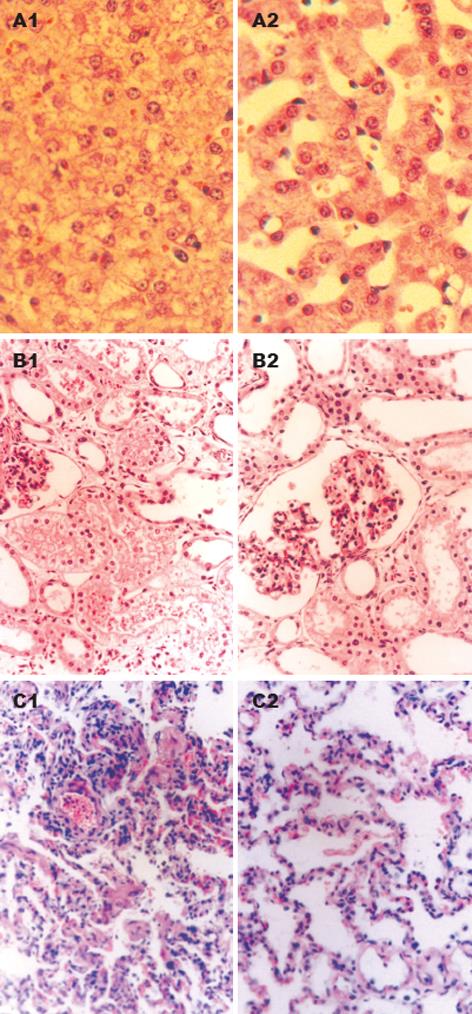
胰腺本身的病理损害评分在各组间无明显差异, 但HVHF组在肝细胞变性、肺透明膜和微血栓形成以及肾小管损伤的评分上明显降低(P<0.05, 图2, 3).
SAP是临床上常见的危重病, 既往死亡率高达50%, 近年来, 随着ICU的发展, 器官功能支持治疗不断进步, SAP的死亡率明显降低, 但仍然在15%-25%[7], 其死亡原因往往是MODS, 特别是早期进行性恶化的MODS[8]. 如何防治SAP早期进行性恶化的MODS, 是近年来危重病医学界一直关注并致力于解决的问题之一, MODS的形成原因可能与促炎和抗炎因子失衡有关. 任何一方的过度产生或减少, 都可引起不同的病理生理反应, 如全身炎症反应综合征(SIRS), 补偿性抗炎症反应综合征(CARS)和混合性拮抗反应综合征(MARS). SIRS多在疾病的早期出现, 是由于机体的免疫应激反应过于激烈, 促炎因子产生过多而引起的组织细胞自身性破坏及器官功能障碍 . 过去针对SIRS促炎因子mAb的实验研究空前高涨, 但在临床实验中, 这些mAb治疗全身性感染及多器官衰竭患者均不能降低病死率, 无一通过Ⅲ期临床研究, 结果令人失望[9]. 原因之一可能就是一种或几种促炎因子的阻滞并不能阻断其他炎性因子的有害影响.
CVVH可同时非选择性的清除多种炎症介质, 从理论上讲HVHF对炎症介质的清除更加有效, 从而有可能控制SIRS, 改善重要脏器的病理损害, 达到防治MODS, 延长生存时间的目的[10-11]. 从本次实验的生存分析来看, HVHF组的半数生存时间较对照组和低容量血液滤过组都显著延长, 达到了预期的目的. 一些实验研究证明, 通过早期HVHF, 可维持机体促炎和抗炎因子的平衡, 防治MODS[5,12-13]. MODS虽说是器官的功能障碍 , 但也有其病理解剖基础. 为此, 我们专门观察了SAP猪的胰腺及胰外重要脏器的镜下病理变化及早期HVHF对其变化的影响. 我们诱导SAP模型的胰腺病理变化主要表现为胰腺的水肿、白细胞浸润、腺细胞坏死和灶性出血. 从本实验来看, 无论是低容量血液滤过, 还是HVHF, 都不能有效地改善SAP时胰腺本身的病理损害, 与相关的实验结果一致[11,14]. 这符合急性胰腺炎的"共同通道"学说, 胰酶的激活导致胰腺的"自身消化", 是导致胰腺坏死的始动的和主要的原因. 在胰管注射的模型中, 由"白细胞的过度激活"带来炎症介质的过多释放所导致胰腺的病理损害是次要的. SAP模型的肝损害主要表现为肝细胞变性(水肿变性和脂肪变性)、坏死, 其次是汇管区的炎性细胞浸润和肝窦的扩张. 其机制可能有: (1)SAP产生的炎性介质、氧自由基等对肝细胞的损害, 实验研究表明, SAP早期TNF, IL-6明显升高, 且其升高程度与肝损伤呈正相关[15]; (2)急性胰腺炎时肝损害与低血容量和血管活性物质释放导致的肝微Ñ环障碍 、氧供下降有关; (3)急性胰腺炎时经门静脉回流至肝脏的毒性物质和生物活性物质增多, 同时, 肝脏对其清除和解毒作用下降. 血液滤过不仅可以清除炎性介质, 而且可以清除SAP时的部分毒性物质和生物活性物质, 从而减轻他们对肝细胞的损害. 从本实验看来, 无论是低容量血液滤过组, 还是HVHF组对肝细胞的变性、坏死较对照组都有明显的改善. 但对汇管区的炎性细胞浸润和肝窦的扩张都无改善作用, 这可能与这两项肝损害本身并不严重(评分较低)有关.
肺损伤是SAP最常见和最先出现的并发症[16-17]. 导致ARDS的病理变化既复杂又严重, 从本实验来看, 有肺水肿、间质炎症细胞浸润、肺不张、出血、微血栓和透明膜的形成. 造成肺脏损害的机制也很复杂, 有关因素有: (1)SAP时的肠功能障碍 , 菌群失调导致内毒素血症[18]; (2)白细胞的过度激活. 研究发现, 大量多形核白细胞(PMN)过度激活并聚集于肺组织是急性肺损伤早期的基本病理改变, 也是导致急性肺损伤的关键因素[19-22]. 杜成辉 et al[23]的实验研究证实, HVHF不仅能清除相关的炎性介质, 而且能促进PMN的凋亡, 减轻由于白细胞过度激活造成的病理损害. 我们的研究结果证实了HVHF组的部分肺损害指标(如: 肺出血、微血栓和透明膜的形成)有改善, 而低容量组则否. ARF在SAP中也较常见. 由于CVVH具有肾脏替代作用, 因此, 不能仅从肾功能指标来评价肾损害, 而应看其病理解剖的变化. 实验显示, SAP的肾损害表现为肾小管上皮细胞刷状缘的脱落和上皮的变性坏死, 肾小球内皮细胞的浊肿以及微血栓的形成. ARF的病理机制也与炎症介质的作用有关[24-26]. 从本实验的结果来看, HVHF有助于肾小球内皮和肾小管上皮损伤的改善, 而低容量血液滤过组则否. 这可能与HVHF对炎性介质的清除作用更为强大有关.
总之, CVVH虽然不能减轻SAP猪胰腺本身的病理损害, 但早期HVHF因其对炎症介质的强大清除效率, 能有效地减轻SAP猪肝细胞变性、肺透明膜和微血栓形成以及肾小管的损伤, 从而改善这些重要脏器的部分功能, 有助于MODS的防治, 达到延长生存时间, 改善其预后的目的.
重症急性胰腺炎(SAP)是临床上常见的危重病, 既往死亡率高达50%, 近年来, 随着器官功能支持治疗不断进步, SAP的死亡率明显降低, 但仍然在15%-25%, 其死亡原因往往是MODS. 而MODS的主要机制是免疫的失衡, 促炎和抑炎因子的紊乱.
高容量血液滤过(HVHF)由于其置换量大, 可更加有效地清除过多的炎性介质. 但HVHF是否能通过改善SAP胰外器官的病理损害, 而保护相应的器官功能及防治MODS呢? 这是目前研究的热点和亟待回答的问题.
本研究通过动物实验证实, HVHF能有效地减轻SAP猪胰外器官的病理损害, 更多地延长动物的生存时间.
虽然常规量血液滤过是否能改善SAP患者的预后尚有争议, 但HVHF的应用价值已得到认可. 在实际工作中, 不要因为HVHF的置换液需要量大, 护理工作繁重而影响其开展.
高容量血液滤过(HVHF): 是相对于常规量的血液滤过而言的. 何谓高容量目前尚无统一标准, 大多数作者认为置换量超过了3 L/h[42.8 mL/(h·kg)]则可认为高容量.
SAP的治疗目前还是全球研究的热点和难点, 本研究应用早期持续HVHF的方法有一定的创新性, 课题紧密结合临床, 对临床有一定的指导意义, 是一篇较好的动物实验论文.
电编: 张敏 编辑:潘伯荣
| 1. | Jiang HL, Xue WJ, Li DQ, Yin AP, Xin X, Li CM, Gao JL. Influence of continuous veno-venous hemofiltration on the course of acute pancreatitis. World J Gastroenterol. 2005;11:4815-4821. [PubMed] [DOI] |
| 2. | Yan XW, Li WQ, Wang H, Zhang ZH, Li N, Li JS. Effects of high-volume continuous hemofiltration on experimental pancreatitis associated lung injury in pigs. Int J Artif Organs. 2006;29:293-302. [PubMed] |
| 3. | Uchino S, Bellomo R, Goldsmith D, Davenport P, Cole L, Baldwin I, Panagiotopoulos S, Tipping P. Super high flux hemofiltration: a new technique for cytokine removal. Intensive Care Med. 2002;28:651-655. [PubMed] [DOI] |
| 4. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] [DOI] |
| 5. | Yekebas EF, Strate T, Zolmajd S, Eisenberger CF, Erbersdobler A, Saalmuller A, Steffani K, Busch C, Elsner HA, Engelhardt M. Impact of different modalities of continuous venovenous hemofiltration on sepsis-induced alterations in experimental pancreatitis. Kidney Int. 2002;62:1806-1818. [PubMed] [DOI] |
| 6. | 李 钢, 王 凯诚, 陈 海平. 活血化瘀药对实验性急性出血坏死性胰腺炎肝损伤的保护作用. 中国中西医结合外科杂志. 2001;7:393-395. |
| 7. | Bank S, Singh P, Pooran N, Stark B. Evaluation of factors that have reduced mortality from acute pancreatitis over the past 20 years. J Clin Gastroenterol. 2002;35:50-60. [PubMed] [DOI] |
| 8. | Buter A, Imrie CW, Carter CR, Evans S, McKay CJ. Dynamic nature of early organ dysfunction determines outcome in acute pancreatitis. Br J Surg. 2002;89:298-302. [PubMed] [DOI] |
| 9. | Rau BM, Kruger CM, Schilling MK. Anti-cytokine strategies in acute pancreatitis: pathophysiological insights and clinical implications. Rocz Akad Med Bialymst. 2005;50:106-115. [PubMed] |
| 10. | Honore PM, Joannes-Boyau O. High volume hemofiltration (HVHF) in sepsis: a comprehensive review of rationale, clinical applicability, potential indications and recommendations for future research. Int J Artif Organs. 2004;27:1077-1082. [PubMed] |
| 14. | Yang Z, Wang C, Tao J, Xiong J, Wan C, Zhou F. Effect of early hemofiltration on pro- and anti-inflammatory responses and multiple organ failure in severe acute pancreatitis. J Huazhong Univ Sci Technolog Med Sci. 2004;24:456-459. [PubMed] [DOI] |
| 15. | McKay CJ, Gallagher G, Brooks B, Imrie CW, Baxter JN. Increased monocyte cytokine production in association with systemic complications in acute pancreatitis. Br J Surg. 1996;83:919-923. [PubMed] [DOI] |
| 17. | Bhatia M, Moochhala S. Role of inflammatory mediators in the pathophysiology of acute respira-tory distress syndrome. J Pathol. 2004;202:145-156. [PubMed] [DOI] |
| 18. | Windsor JA, Fearon KC, Ross JA, Barclay GR, Smyth E, Poxton I, Garden OJ, Carter DC. Role of serum endotoxin and antiendotoxin core antibody levels in predicting the development of multiple organ failure in acute pancreatitis. Br J Surg. 1993;80:1042-1046. [PubMed] [DOI] |
| 19. | Kyriakides C, Jasleen J, Wang Y, Moore FD Jr, Ashley SW, Hechtman HB. Neutrophils, not complement, mediate the mortality of experimental hemorrhagic pancreatitis. Pancreas. 2001;22:40-46. [PubMed] [DOI] |
| 20. | Frossard JL, Saluja A, Bhagat L, Lee HS, Bhatia M, Hofbauer B, Steer ML. The role of intercellular adhesion molecule 1 and neutrophils in acute pancreatitis and pancreatitis-associated lung injury. Gastroenterology. 1999;116:694-701. [PubMed] [DOI] |
| 21. | Wittel UA, Rau B, Gansauge F, Gansauge S, Nussler AK, Beger HG, Poch B. Influence of PMN leukocyte-mediated pancreatic damage on the systemic immune response in severe acute pancreatitis in rats. Dig Dis Sci. 2004;49:1348-1357. [PubMed] [DOI] |
| 22. | Liu XM, Liu QG, Xu J, Pan CE. Microcirculation disturbance affects rats with acute severe pancrea-titis following lung injury. World J Gastroenterol. 2005;11:6208-6211. [PubMed] [DOI] |
| 24. | Simmons EM, Himmelfarb J, Sezer MT, Chertow GM, Mehta RL, Paganini EP, Soroko S, Freedman S, Becker K, Spratt D. Plasma cytokine levels predict mortality in patients with acute renal failure. Kidney Int. 2004;65:1357-1365. [PubMed] [DOI] |
| 25. | Cunningham PN, Dyanov HM, Park P, Wang J, Newell KA, Quigg RJ. Acute renal failure in endotoxemia is caused by TNF acting directly on TNF receptor-1 in kidney. J Immunol. 2002;168:5817-5823. [PubMed] [DOI] |
| 26. | Deng J, Kohda Y, Chiao H, Wang Y, Hu X, Hewitt SM, Miyaji T, McLeroy P, Nibhanupudy B, Li S. Interleukin-10 inhibits ischemic and cisplatin-induced acute renal injury. Kidney Int. 2001;60:2118-2128. [PubMed] [DOI] |