修回日期: 2006-05-02
接受日期: 2006-05-22
在线出版日期: 2006-07-18
目的: 应用基因芯片技术, 检测野生型K-ras2基因在结肠癌Caco2细胞中表达诱发的基因谱改变, 进一步阐明野生型K-ras2基因可能的分子生物学功能.
方法: 抽取正常人的静脉血, 提取RNA, 反转录成cDNA, 以此为模板, 采用PCR方法克隆K-ras2野生型全编码cDNA序列. 以常规的分子生物学技术将获得的K-ras2 cDNA克隆到T Easy载体中进行核苷酸序列的测定, 构建真核表达载体pCI-neo-K-ras2, 以脂质体转染结肠癌细胞系Caco2, 提取mRNA逆转录为cDNA 与转染空白表达载体pCI-neo的Caco2细胞进行cDNA芯片分析.
结果: 构建的表达载体经过限制性内切酶分析和DNA序列测定证实准确无误, 提取高质量的RNA逆转录为cDNA进行DNA芯片技术分析. 在135个差异表达基因中发现有24个基因表达水平显著上调, 121个基因表达水平显著下调. 差异表达基因与细胞增殖、分化、凋亡和信号传导等有关.
结论: 应用基因表达谱芯片技术成功筛选了野生型K-ras2转染结肠癌细胞后差异表达基因, 反映出野生型K-ras2对细胞增殖、代谢、转录调控等过程的负性调控状态, 为进一步阐明野生型K-ras2可能的生物学功能提供了新的线索.
引文著录: 李红, 曹厚法, 万军, 李园, 朱美玲, 韩为东. 野生型K-ras2诱导结肠癌细胞基因表达谱改变的特征分析. 世界华人消化杂志 2006; 14(20): 1970-1976
Revised: May 2, 2006
Accepted: May 22, 2006
Published online: July 18, 2006
AIM: To investigate the genes differentially expressed in human colon carcinoma cell line Caco2 transfected with wild type K-ras2-expressing plasmid and further elucidate the potential molecular biological function of wild type K-ras2.
METHODS: Sequence specific primers were designed and synthesized, and the wild type K-ras2 DNA fragment was amplified with polymerase chain reaction (PCR) technique. The expressive vector of pCI-neo-K-ras2 was constructed by routine molecular biological methods. cDNA microarray technique was employed to detect the mRNA expression in Caco2 cells transfected with pCI-neo-K-ras2 and pCI-neo, respectively, using lipofectamine.
RESULTS: The expressive vector was constructed and confirmed by restriction enzyme digestion and DNA sequencing analysis. High quality RNA and cDNA were prepared and successful microarray screening was conducted. The scanning results indicated that among 8568 genes which were obtained from gene expression profile analysis, there were 135 different ones of which 121 were down-regulated and 24 were up-regulated in the wild type K-ras2-expressing Caco2 cells. These genes differentially regulated by wild type K-ras2 included human genes encoding proteins involved in cell signal transduction, cell apoptosis, cell proliferation and differentiation.
CONCLUSION: cDNA microarray is successfully used to screen the genes differentially expressed in wild type K-ras2-expressing Caco2 cells, and the alteration of expression profile induced by the wide-type K-ras2 suggested the negatively regulatory function of wild type K-ras2 for cell signal transduction, apoptosis, cell proliferation and differentiation.
- Citation: Li H, Cao HF, Wan J, Li Y, Zhu ML, Han WD. Screening of genes differentially expressed in Caco2 cells transfected with wild type K-ras2 by cDNA microarray. Shijie Huaren Xiaohua Zazhi 2006; 14(20): 1970-1976
- URL: https://www.wjgnet.com/1009-3079/full/v14/i20/1970.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i20.1970
人结肠癌的发生和发展是多种肿瘤相关基因异常表达的结果, 其中的重要机制是癌基因的激活和抑癌基因的失活[1-2]. ras基因是一种与结肠癌的发生和发展密切相关的基因, 他包括3个成员: Hras1, Nras和K-ras2. 传统性的观点认为激活的ras基因具有显性癌基因的作用[3-4], 约30%的肿瘤有ras基因突变, 其中以K-ras2最为频繁[5-6], 结肠癌、胰腺癌和肺癌的突变率比较高[7-9]. 但是近期的一些研究对ras的显性癌基因作用提出了质疑, 如在人类和小鼠的肺腺癌已发现存在野生型ras频繁丢失的现象[10], 在非小细胞肺癌K-ras2基因所在的12p12-13区域存在杂合性缺失[11-12], 而我们也观察到在结肠癌发生、发展过程中该区域出现高频杂合性丢失[13]. 我们将野生型K-ras2基因导入结肠癌细胞后观察了细胞生长曲线及细胞周期的变化, 发现野生型K-ras2基因可使结肠癌细胞生长和周期进程减慢, 表现为G0-G1期细胞数量显著增高, G2-M期细胞数量显著降低, 从而抑制有增殖能力的静止细胞群进入增殖周期[14]. 为了深入研究野生型K-ras2 的生物学功能, 构建了野生型K-ras2基因真核表达载体, 应用基因表达谱芯片技术筛选野生型K-ras2基因转染细胞后差异表达的基因, 检测野生型K-ras2的表达对结肠癌细胞基因表达谱的影响, 推测其在体内可能存在功能的线索, 为研究结肠癌的发病机制及探索K-ras2基因的功能提供了新的方向.
结肠癌细胞株Caco-2购自ATCC公司, 细胞培养相关试剂、总RNA提取试剂Trizol及真核表达载体pCI-neo、脂质体Lipofectamine 2000均购自Invitrogen公司, 基因芯片购自上海生物芯片有限公司, 其中已知基因8568个, 主要包括有关细胞分化、细胞信号转导、细胞结构、细胞成分、基因和蛋白表达、代谢、假基因等已知功能或者与疾病相关的人类基因组分.
抽取正常人的静脉血, 提RNA, 再反转录成cDNA, 以此为模板, 采用PCR方法克隆K-ras2野生型全编码cDNA序列, 基因序列特异性引物序列分别为: Y1: 5'-ACCCACGCGTATGACTGAATATAAAC-3', Y2: 5'-AACGTCGACTTACAT AATTACACACT-3',由上海奥科生物公司合成, 分别含酶切位点Mlu1和Sal1. 将扩增产物插入到pGEM-T Easy载体中, 蓝/白斑筛选出阳性克隆pGEM-T-ras. 限制性内切酶Mul1、Sal1分别酶切pGEM-T-ras和pCI-neo真核表达载体, 割胶回收纯化, 再通过T4 DNA连接酶把野生型K-ras2基因连接到质粒pCI-neo上. 通过脂质体Lipofectamine 2000将pCI-neo-K-ras2质粒和对照空质粒pCI-neo转染至Caco-2细胞. G418 (Amresco USA)筛选阳性克隆. 使用Trizol试剂一步法提取转染pCI-neo-K-ras2和空载体pCI-neo的Caco2细胞总RNA(分别标记为对照组和转染组), 样品经紫外分光光度计定量, 琼脂糖凝胶电泳鉴定其质量, 常规方法逆转录标记cDNA探针并纯化. Cy3-dUTP标记对照组细胞RNA(5 mg), Cy5-dUTP标记实验组细胞RNA(5 mg). 乙醇沉淀后溶解在20 ℃ 5×SSC+2 g/L SDS杂交液中. 将基因芯片和杂交探针在95 ℃水浴变性5 min, 将混合探针加在基因芯片上置于60 ℃杂交15-17 h, 依次以2×SSC+2 g/L SDS, 1×SSC+2 g/L SDS洗涤10 min, 室温晾干. 用General Scanning公司的ScanArray 3000扫描芯片, 以预先选定的内参照基因对Cy3和Cy5的原始提取信号进行均衡和修正, 用ImaGene 3.0软件分析Cy3, Cy5两种荧光信号的强度, 计算Cy5/Cy3比值; 阳性结果判断: Cy5/Cy3>2.0为红色荧光显示表达增强; Cy5/Cy3<0.5为绿色荧光显示表达减弱.
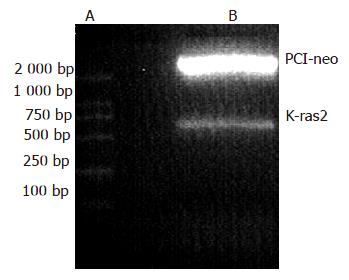
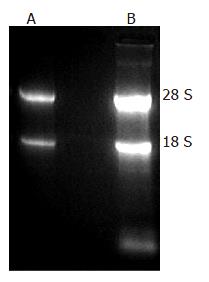
真核表达载体pCI-neo-K-ras2经过限制性内切酶作图分析(图1)和核苷酸序列的测定证实含有完整的开放读码框架序列准确无误. 所提总RNA的A260/A280在1.9-2.1之间, 28 S和18 S条带的比值约为2:1, 表明RNA无降解(图2), 可用于杂交探针制备.
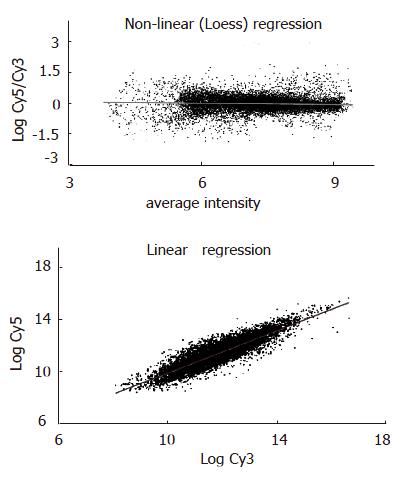
为了监控芯片杂交技术体系的整个过程, 芯片上设置了6个阴性对照和10个阳性对照, 杂交后芯片的扫描结果及芯片检测报告显示, 杂交芯片和样品RNA质量完好, 其背景值和噪音均匀, 杂交反应体系正常, 检测结果可靠. 比较转染组与对照组的基因谱, 绘制各组探针信号值的散点分布图, 显示大部分基因位于回归线附近, 表明大部分基因在两种组织中表达接近, 少数部分基因产生表达差异, 随着差异倍数增加, 差异基因数量逐渐减少(图3), 这些点的杂交信号均很低证实了数据的可靠性. 由于实验组探针标记Cy5荧光素(呈红色), 对照组探针标记Cy3荧光素(呈绿色), 红绿颜色的差异就显示该基因在实验组和对照组中基因表达水平上的差异, 黄色代表表达水平无差异. 按照实验设计中的比较方法, Cy5/Cy3≥2的基因共有24个, 为上调基因,占差异表达基因总数的17.76%, 所有上调基因的基本信息见表1; Cy5/Cy3≤0.5的基因共有121个, 为下调基因, 占差异表达基因总数的89.63%, 将下调基因按照Cy5/Cy3由小到大排列, 其前31个基因的基本信息见表2.
| 基因名称 | 染色体定位 | 生物学功能 | Cy5/Cy3 |
| NDP | Xp11.4 | 细胞间信号传导; 信号转导; 神经系统发育 | 4.509908 |
| SSX4 | Xp11.23 | 转录调控; 免疫反应 | 4.044489 |
| CASP1 | 11q23 | I-kappaB kinase/NF-kappaB级联反应的正性调节; 信号转导; 诱导凋亡 | 3.754063 |
| HPRT1 | Xq26.1 | 细胞溶解; 淋巴细胞增殖; 嘌呤核苷酸的生物合成 | 3.715372 |
| TM4SF2 | Xp11.4 | 细胞外成分 | 3.554822 |
| DXS1283E | Xp22.3 | 未知 | 3.418780 |
| DPYS | 8q22 | 神经系统发育; 信号转导; 核苷酸代谢 | 3.386352 |
| TYRP1 | 9p23 | 细胞代谢; 黑色素的生物合成 | 3.358984 |
| CADPS | 3p21.1 | 钙离子调节的胞外分泌 | 3.238552 |
| MCF2 | Xq27 | 细胞骨架 | 3.187850 |
| COL4A6 | Xq22 | 细胞外基质结构及其生物合成 | 3.201434 |
| F13A1 | 6p25.3-p24.3 | 转录调控 | 3.108515 |
| HTR2C | Xq24 | 磷酸肌醇介导的信号通路 | 3.061756 |
| IL13RA1 | Xq24 | 细胞外成分 | 3.050762 |
| OGT | Xq13 | 信号转导 | 3.030588 |
| TOSO | 1q32.1 | 防御反应; 抗细胞凋亡 | 2.994371 |
| MAB21L1 | 13q13 | 细胞增殖的正性调节; 视觉发育 | 2.990440 |
| CYBB | Xp21.1 | 细胞间信号传导; 趋化作用; 炎症反应; 信号转导 | 2.972307 |
| STK9/CDKL5 | Xp22 | 微管骨架结构及其生物合成; 形态发生 | 2.946810 |
| PTPRG | 3p21-p14 | 蛋白酪氨酸激酶信号通路 | 2.878286 |
| ELAVL2 | 9p21 | 转录调控 | 2.853002 |
| GLA | Xq22 | 破骨细胞分化的调节; 骨吸收的调节; 细胞黏附 | 2.851204 |
| APXL | Xp22.3 | 钠离子通道蛋白 | 2.839223 |
| SERPINA7 | Xq22.2 | 细胞外成分; 甲状性腺激素转运 | 2.833390 |
| 基因名称 | 染色体定位 | 生物学功能 | Cy5/Cy3 |
| SZF1 | 3p21 | 转录调控 | 0.181889 |
| MMP14 | 14q11-q12 | 内切酶活性; 蛋白水解 | 0.186609 |
| WIT-1 | 11p13 | 细胞增殖 | 0.189588 |
| LOC253012 | 7q21.3 | 呼吸道气体交换; 细胞黏附; 早期神经分化和轴突生成 | 0.201998 |
| OPCML | 11q25 | 细胞黏附; 神经元识别 | 0.239285 |
| PLAU | 10q24 | 趋化作用; 蛋白质水解; 信号转换 | 0.258662 |
| MYC | 8q24.12-q24.13 | 细胞增殖正性调控; 细胞周期阻滞; 铁离子平衡; 信使核糖核 | 0.274307 |
| 酸合成的调控 | |||
| SNTB1 | 8q23-q24 | 肌肉收缩; 骨架和基质间黏附 | 0.281322 |
| SERPINE1 | 7q21.3-q22 | 丝氨酸内切酶抑制剂; 细胞成分; 血管生成调节 | 0.290852 |
| SLC20A1 | 2q11-q14 | 磷酸盐转运; 细胞构成 | 0.294420 |
| SPTBN1 | 2p21 | 细胞骨架 | 0.298815 |
| GNAS | 20q13.2-q13.3 | 能量代谢; G蛋白耦联受体信号通路; 信号转导 | 0.302942 |
| PCOLCE | 7q22 | 蛋白质水解; 细胞成分 | 0.302975 |
| ENPP2 | 8q24.1 | 细胞运动; G蛋白耦联受体信号通路; 细胞磷酸化代谢; 水解 | 0.308640 |
| 酶活性; 磷酸酶活性; 细胞转录 | |||
| CDK6 | 7q21-q22 | 细胞增殖; 细胞周期; 蛋白连接 | 0.315290 |
| HIST2H2BE | 1q21-q23 | 染色体构成和合成 | 0.323090 |
| ZNF137 | 19q13.4 | 细胞转录和调控; 离子束缚 | 0.331670 |
| IL1B | 2q14 | 炎症反应; 细胞增殖; 趋化作用 | 0.335714 |
| IL1A | 2q14 | 细胞凋亡; 细胞增殖; 信号转导; 趋化作用 | 0.343137 |
| MTSS1 | 8p22 | 肌动蛋白骨架构成和其生物合成; 细胞黏附; 细胞运动; 蛋白 | 0.346133 |
| 酪氨酸激酶信号通路; 肌肉发育; 神经系统发育; 内吞小泡 | |||
| ACHE | 7q22 | 肌肉收缩; 信号转导 | 0.353254 |
| EPHB4 | 7q22 | 细胞增殖; 器官形成; 血管形成调节 | 0.367571 |
| AZGP1 | 7q22.1 | 细胞膜成分 | 0.375540 |
| PDE4DIP | 1q12 | 蛋白质生成; 肌动蛋白骨架构成及生物合成 | 0.376983 |
| PITPN | 17p13.3 | 磷脂转运 | 0.378532 |
| MEOX1 | 17q21 | 机体生长 | 0.385950 |
| GNB2L1 | 5q35.3 | 细胞内信号级联反应; 蛋白定位; 信号转导; 蛋白激酶C活性 | 0.394205 |
| MERTK | 2q14.1 | 信号转导; 细胞间信号传导; 蛋白质磷酸化 | 0.405261 |
| CUTL1 | 7q22.1 | 转录调控 | 0.419088 |
| FCGR2A | 1q23 | 免疫反应; 信号转换; 防御反应; B细胞增殖的负调节 | 0.428152 |
| PAX8 | 2q12-q14 | 器官形成; 细胞转录和调控; 后肾发育; 信使核糖核酸合成的调控 | 0.442376 |
根据Affymetrix分析中心GO (Gene Ontology)分类数据库中基因生物学过程的描述对野生型K-ras2差异表达基因进行功能分类, 其中与肿瘤发生、发展关系密切的主要有11个类别(表3).
| 基因类别 | 下调基因(个) | 占总下调基因比率(%) | 上调基因(个) | 占总上调基因比率(%) |
| 代谢相关 | 18 | 14.88 | 3 | 12.50 |
| 细胞增殖 | 30 | 24.79 | 3 | 12.50 |
| 细胞周期 | 16 | 13.22 | 0 | 0 |
| 信号转导 | 18 | 14.88 | 8 | 33.3 |
| 细胞骨架 | 8 | 6.61 | 1 | 4.17 |
| 转录调控 | 18 | 14.88 | 4 | 16.67 |
| 细胞黏附 | 11 | 9.09 | 1 | 4.17 |
| 细胞凋亡 | 8 | 6.61 | 2 | 8.33 |
| 细胞分化 | 14 | 11.57 | 4 | 16.67 |
| 免疫相关 | 14 | 11.57 | 2 | 8.33 |
| 胞外基质 | 6 | 4.96 | 1 | 4.17 |
既往研究表明, 结肠癌的发生与发展有明确的阶段性, 即从正常黏膜-不典型增生(包括肠化)-腺瘤-腺癌, 是一个多基因、多因素参与的过程[15], 其中K-ras2因为点突变而显现出的显性癌基因作用对癌变的进程起到了较大的促进作用, 这也正是其掩盖了野生型K-ras2基因可能具有抑癌效应的原因之一[16-17]. 体内外实验表明, 分别用两种致癌剂对杂合性缺失和野生型的小鼠进行处理后发现, 仅携带一个野生型K-ras2的杂合性缺失小鼠比带有两个野生型K-ras2拷贝的正常小鼠产生更多的肿瘤. 最为显著的是, 杂合性缺失的小鼠产生的肿瘤比野生型的小鼠最高可大50倍, 而且前者是分化很差的腺癌, 后者是腺瘤; 进一步研究显示, 将野生型K-ras2基因转染到带有激活的ras的细胞系中, 能够抑制细胞生长、克隆形成以及裸鼠致瘤; 这些均提示野生型K-ras2基因可能是一种潜在的抑癌基因[9,18]. 基于此, 我们应用基因芯片技术检测野生型K-ras2基因在结肠癌Caco2细胞中表达诱发的基因谱改变, 进一步探索野生型K-ras2基因可能的分子生物学功能.
在上调基因中, 信号转导、转录调控和细胞分化相关基因占据优势, 与信号转导有关的基因所占比例最高为33.33%; 下调基因中与细胞增殖有关的基因30个, 占下调基因比例最高, 为24.79%, 与细胞代谢相关、细胞周期、转录调控相关基因在下调基因中也占较高比例, 而且其数目远高于上调基因的比例, 这与转染野生型K-ras2细胞生长缓慢、细胞周期延长相一致, 反映出野生型K-ras2对细胞增殖、代谢、转录调控等过程的负性调控状态, 从而抑制肿瘤细胞的生长. 分析表达显著增强的基因, NDP上调最为显著, 他本身是个遗传位点, 其突变导致遗传相关疾病Norrie病, 即由于视网膜病变引起的先天性双盲. NDP基因的两种分子缺陷引起该病: (1)在第97密码子发生265C>G的错意突变, 导致精氨酸和脯氨酸的互换; (2)在第三外显子3'非翻译区的部分缺失[19]. 临床研究发现表现为基因部分缺失的病例, 临床症状相对严重, 相反, 发生基因突变的病例视网膜的病变较轻[20]. 而上调明显的SSX4基因, 其产物是高度同源的滑液肉瘤X(SSX)节点蛋白的家族成员, 功能是转录抑制作用, 也能自发引起肿瘤患者的体液和细胞免疫, 是肿瘤免疫疫苗治疗的十分有前途的靶点[21]. CASP1 (caspase1), 即凋亡相关半胱氨酸酶, 编码蛋白是半胱氨酸蛋白酶(caspase)家族成员, 有蛋白水解功能和激活IL-1前体作用, 并且在细胞凋亡中起重要作用[22]. 他在转染野生型K-ras2细胞中上调显著, 考虑与他诱发肿瘤细胞凋亡有关, 有研究显示CASP1是人类细胞p53依赖细胞凋亡的调节因子之一[23].
在下调基因中, 下调显著且功能与肿瘤最密切相关的是myc (c-myc)基因, 是一种多种物质调节的可调节基因, 促进细胞分裂,可使细胞无限增殖, 获永生化功能, myc基因参予细胞凋亡, 与多种肿瘤发生、发展有关[24]. 在不同的人体肿瘤细胞系中, 包括粒细胞性白血病细胞系, 视网膜母细胞瘤细胞系, 某些神经母细胞病细胞系, 乳腺癌细胞系及某些肺癌细胞系, 已发现c-myc相关序列的扩增, 在人结肠癌细胞系中也观察到c-myc基因的扩增[25-26]. 下调显著的MMP14基因(别名MT1-MMP)是金属蛋白酶(MMP)家族的成员, 通过糖氧化修饰, 与CD44相互作用, 内生化和再循环等过程发挥作用, 具有双重作用, 其正常功能的发挥依赖于在时间和空间上在细胞表面正常的表达[27], 通过激活MMP2蛋白, 在肿瘤侵袭中起作用. 有文献报道MMP2, MT1-MMP上调表达与脑恶性神经胶质瘤侵袭有关[28]; 也有作者观察MT1-MMP与口腔鳞癌的局部侵袭和淋巴结转移有关[29]; 在结肠癌LoVo细胞的作用机制也有报道[30]. WIT-1基因位于Wilms肿瘤基因的上游, 由共同的启动子向相反方向转录, 此基因的甲基化与肿瘤的化疗耐药和急性白血病有关[31].另一值得注意的下调基因为EPHB4, 他是最大已知的受体酪氨酸激酶家族的成员, 其编码蛋白是ephrin-B2的受体, 可以刺激移动和增殖, 在血管形成过程起重要作用[32]. 已经显示在前列腺癌、脑星形胶质细胞瘤的各种肿瘤中表达, 并且涉及转移显形转换[33-34]. 野生型K-ras2通过下调上述基因的表达提示该基因蛋白可能对细胞增殖、细胞信号传递途径、核内外物质运输及血管生成等过程有负调控作用而抑制某些与细胞转录调节密切相关的基因在肿瘤生成过程中发挥一定的作用.
大量的临床及实验研究表明, K-ras2基因的点突变对于促进肿瘤的发生与发展起着重要的作用. 直到2001-09发表在《Nature Genetics》杂志上的文章指出K-ras2不但会诱发肿瘤, 而且表现出肿瘤抑制功能, 在世界上首次全面阐述了K-ras2原癌基因的抑癌作用. 本课题组先前的研究也发现K-ras2基因所在的12p12-13区域在结肠癌发生、发展过程中存在杂合性缺失, 并且野生型K-ras2基因能有效抑制结肠癌细胞的生长. 本文应用基因表达谱芯片技术筛选野生型K-ras2基因转染细胞后差异表达的基因, 检测野生型K-ras2的表达对结肠癌细胞基因表达谱的影响, 推测其在体内可能存在功能的线索.
综合当前的研究, 不妨提出这样的一个假设, 即: K-ras2具有"癌"和"抑癌"双重作用. 在正常的生理状态下, 是一个原癌基因; 发生点突变后, 激活的K-ras2转变为"癌基因"; 而野生型的K-ras2发挥"抑癌"作用. 目前的研究初步证实了这种假设, 但需要进一步深入研究野生型K-ras2抑癌机制及在各种不同肿瘤的作用.
2001-09《Nature Genetics》杂志上, Zhongqiu Zhang发表的一篇题为"Wild type K-ras2 can inhibit lung carcinogene-sis in mice"的文章, 首次全面阐述了K-ras2原癌基因的抑癌作用. 作者从三个方面证实了K-ras2的抑制肿瘤作用: (1)分别用两种致癌剂对杂合性缺失和野生型的小鼠进行处理发现, 仅携带一个野生型K-ras2的杂合性缺失小鼠比带有两个野生型K-ras2拷贝的正常小鼠产生更多的肿瘤. 最为显著的是, 杂合性缺失的小鼠产生的肿瘤比野生型的小鼠最高可大50倍, 而且前者是分化很差的腺癌, 后者是腺瘤; (2)体外实验表明, 将野生型K-ras2基因转染到带有激活的ras的细胞系中, 能够抑制细胞生长、克隆形成以及裸鼠致瘤; (3)在一系列化学致癌剂诱导的肺腺癌中, 存在K-ras2杂合性缺失现象, 而且野生型K-ras2缺失的小鼠中, 有67%-100%存在K-ras2点突变的现象.
自从Zhongqiu Zhang提出野生型K-ras2在小鼠的抑癌作用后, 国外学者纷纷研究其在肺癌中的抑癌作用, 而本研究则首次探讨了人野生型K-ras2这一原癌基因在结肠癌中的抑癌作用.
通过本研究, 从广谱基因表达水平初步阐明K-ras2抑制肿瘤细胞增殖的可能分子学路径, 为寻找与结肠癌密切相关的基因奠定基础.
本文采用较先进的分子生物学技术, 国内外未检索到相同研究, 方案设计基本合理, 表达清晰, 用词准确, 之前有一定的研究基础, 提出了独特的观点, 为进一步阐明野生型K-ras2可能的生物学功能提供了新的线索.
电编: 张敏 编辑:潘伯荣
| 1. | Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell. 1990;61:759-767. [PubMed] [DOI] |
| 2. | Frattini M, Balestra D, Suardi S, Oggionni M, Alberici P, Radice P, Costa A, Daidone MG, Leo E, Pilotti S. Different genetic features associated with colon and rectal carcinogenesis. Clin Cancer Res. 2004;10:4015-4021. [PubMed] [DOI] |
| 3. | Bos JL. ras oncogenes in human cancer: a review. Cancer Res. 1989;49:4682-4689. [PubMed] |
| 4. | Barbacid M. ras genes. Annu Rev Biochem. 1987;56:779-827. [PubMed] [DOI] |
| 5. | Kranenburg O. The KRAS oncogene: past, present, and future. Biochim Biophys Acta. 2005;1756:81-82. [PubMed] |
| 6. | Bezieau S, Devilder MC, Avet-Loiseau H, Mellerin MP, Puthier D, Pennarun E, Rapp MJ, Harousseau JL, Moisan JP, Bataille R. High incidence of N and K-Ras activating mutations in multiple myeloma and primary plasma cell leukemia at diagnosis. Hum Mutat. 2001;18:212-224. [PubMed] [DOI] |
| 7. | Halatsch ME, Hirsch-Ernst KI, Weinel RJ, Kahl GF. Differential activation of the c-Ki-ras-2 proto-oncogene in human colorectal carcinoma. Anticancer Res. 1998;18:2323-2325. [PubMed] |
| 8. | Deramaudt T, Rustgi AK. Mutant KRAS in the initiation of pancreatic cancer. Biochim Biophys Acta. 2005;1756:97-101. [PubMed] |
| 9. | Kim DH, Kim JS, Park JH, Lee SK, Ji YI, Kwon YM, Shim YM, Han J, Park J. Relationship of Ras association domain family 1 methylation and K-ras mutation in primary non-small cell lung cancer. Cancer Res. 2003;63:6206-6211. [PubMed] |
| 10. | Zhang Z, Wang Y, Vikis HG, Johnson L, Liu G, Li J, Anderson MW, Sills RC, Hong HL, Devereux TR. Wildtype Kras2 can inhibit lung carcinogenesis in mice. Nat Genet. 2001;29:25-33. [PubMed] [DOI] |
| 11. | Li J, Zhang Z, Dai Z, Plass C, Morrison C, Wang Y, Wiest JS, Anderson MW, You M. LOH of chromo-some 12p correlates with Kras2 mutation in non-small cell lung cancer. Oncogene. 2003;22:1243-1246. [PubMed] [DOI] |
| 12. | De Gregorio L, Manenti G, Incarbone M, Pilotti S, Pastorino U, Pierotti MA, Dragani TA. Prognostic value of loss of heterozygosity and KRAS2 muta-tions in lung adenocarcinoma. Int J Cancer. 1998;79:269-272. [PubMed] [DOI] |
| 15. | Wang WS, Chen PM, Su Y. Colorectal carcinoma: from tumorigenesis to treatment. Cell Mol Life Sci. 2006;63:663-671. [PubMed] [DOI] |
| 16. | Geido E, Sciutto A, Rubagotti A, Oliani C, Monaco R, Risio M, Giaretti W. Combined DNA flow cytome-try and sorting with k-ras2 mutation spectrum analysis and the prognosis of human sporadic colorectal cancer. Cytometry. 2002;50:216-224. [PubMed] [DOI] |
| 17. | Kozma L, Kiss I, Nagy A, Szakall S, Ember I. Investigation of c-myc and K-ras amplification in renal clear cell adenocarcinoma. Cancer Lett. 1997;111:127-131. [PubMed] [DOI] |
| 19. | Rivera-Vega MR, Chinas-Lopez S, Vaca AL, Arenas-Sordo ML, Kofman-Alfaro S, Messina-Baas O, Cuevas-Covarrubias SA. Molecular analysis of the NDP gene in two families with Norrie disease. Acta Ophthalmol Scand. 2005;83:210-214. [PubMed] [DOI] |
| 20. | Khan AO, Shamsi FA, Al-Saif A, Kambouris M. A novel missense Norrie disease mutation associated with a severe ocular phenotype. J Pediatr Ophthalmol Strabismus. 2004;41:361-363. [PubMed] |
| 21. | Ayyoub M, Merlo A, Hesdorffer CS, Rimoldi D, Speiser D, Cerottini JC, Chen YT, Old LJ, Stevanovic S, Valmori D. CD4+ T cell responses to SSX-4 in melanoma patients. J Immunol. 2005;174:5092-5099. [PubMed] [DOI] |
| 22. | Martinon F, Burns K, Tschopp J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Mol Cell. 2002;10:417-426. [PubMed] [DOI] |
| 23. | Gupta S, Radha V, Sudhakar Ch, Swarup G. A nuclear protein tyrosine phosphatase activates p53 and induces caspase-1-dependent apoptosis. FEBS Lett. 2002;532:61-66. [PubMed] [DOI] |
| 24. | Kim YH, Girard L, Giacomini CP, Wang P, Hernandez-Boussard T, Tibshirani R, Minna JD, Pollack JR. Combined microarray analysis of small cell lung cancer reveals altered apoptotic balance and distinct expression signatures of MYC family gene amplification. Oncogene. 2006;25:130-138. [PubMed] |
| 25. | Kowara R, Golebiowski F, Chrzan P, Skokowski J, Karmolinski A, Pawelczyk T. Abnormal FHIT gene transcript and c-myc and c-erbB2 amplification in breast cancer. Acta Biochim Pol. 2002;49:341-350. [PubMed] |
| 26. | Pelengaris S, Khan M, Evan G. c-MYC: more than just a matter of life and death. Nat Rev Cancer. 2002;2:764-776. [PubMed] [DOI] |
| 27. | Itoh Y, Seiki M. MT1-MMP: an enzyme with multi-dimensional regulation. Trends Biochem Sci. 2004;29:285-289. [PubMed] [DOI] |
| 28. | Guo P, Imanishi Y, Cackowski FC, Jarzynka MJ, Tao HQ, Nishikawa R, Hirose T, Hu B, Cheng SY. Up-regulation of angiopoietin-2, matrix metalloprotease-2, membrane type 1 metalloprotease, and laminin 5 gamma 2 correlates with the invasiveness of human glioma. Am J Pathol. 2005;166:877-890. [PubMed] [DOI] |
| 29. | Myoung H, Kim MJ, Hong SD, Lee JI, Lim CY, Hong SP. Expression of membrane type I-matrix metalloproteinase in oral squamous cell carcinoma. Cancer Lett. 2002;185:201-209. [PubMed] [DOI] |
| 30. | Deryugina EI, Ratnikov BI, Yu Q, Baciu PC, Rozanov DV, Strongin AY. Prointegrin maturation follows rapid trafficking and processing of MT1-MMP in Furin-Negative Colon Carcinoma LoVo Cells. Traffic. 2004;5:627-641. [PubMed] [DOI] |
| 31. | Gessler M, Bruns GA. Sequence of the WT1 upstream region including the Wit-1 gene. Genomics. 1993;17:499-501. [PubMed] [DOI] |
| 32. | Steinle JJ, Meininger CJ, Forough R, Wu G, Wu MH, Granger HJ. Eph B4 receptor signaling mediates endothelial cell migration and proliferation via the phosphatidylinositol 3-kinase pathway. J Biol Chem. 2002;277:43830-43835. [PubMed] [DOI] |
| 33. | Xia G, Kumar SR, Masood R, Zhu S, Reddy R, Krasnoperov V, Quinn DI, Henshall SM, Sutherland RL, Pinski JK. EphB4 expression and biological significance in prostate cancer. Cancer Res. 2005;65:4623-4632. [PubMed] [DOI] |