修回日期: 2006-03-19
接受日期: 2006-03-29
在线出版日期: 2006-05-28
目的: 研究Caveolin-1对胃癌细胞增殖、分化的影响, 以探讨Caveolin-1作为基因治疗的候选基因的可能性.
方法: 运用基因重组技术, 将人全长Caveolin-1基因稳定转染胃癌细胞系MGC803,建立能稳定表达Caveolin-1的胃癌细胞系, 同时建立空载体转染的MGC803细胞系作为空白对照, 另用PD98059处理48 h作为阳性对照. 以重组细胞系作为研究模型, 通过免疫细胞化学及Western blot确认Caveolin-1蛋白在被转染细胞中的稳定表达. 运用光学显微镜观察转染前后MGC803细胞形态的变化; 另运用细胞计数检测了Caveolin-1对MGC803细胞生长的影响, 流式细胞术分析了Caveolin-1对MGC803细胞周期分布的影响.
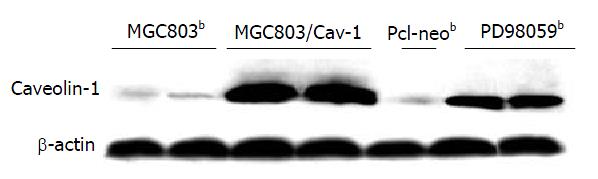
结果: Western blot 结果显示, 基因转染组及阳性对照组细胞中Vaveolin-1表达比未处理组细胞中明显增强(P<0.001, q值分别为23.067与13.3376), 且基因转染组中Caveolin-1表达比阳性对照组更强(P<0.001, q = 9.7294); 基因转染后的MGC803细胞形态发生明显变化, 由异形性明显、核大、胞质很少、核分裂明显变得形态较一致、胞质丰富、核/质比明显变小、核分裂相很少见; 基因转染后细胞的群体倍增时间明显延长, 由46.67 h延长至65.46 h, 差异有统计学意义(P<0.05, q = 4.8695); 基因转染后细胞周期分布发生了明显变化, G0/G1期细胞数明显增多(P<0.01, q = 9.1824), S期细胞数明显减少(P<0.01, q = 7.827), G2/M期细胞数无明显变化(P>0.05), Caveolin-1基因转染组与阳性对照组间细胞周期分布的变化也有明显差异性(其中G0/G1期P<0.01, q = 4.9323; S期P<0.05, q = 3.3295).
结论: Caveolin-1既能诱导MGC803细胞分化又能将其阻滞于G0/G1期, 通过延长细胞群体倍增时间而抑制胃癌细胞的体外增殖.
引文著录: 罗红梅, 唐圣松, 廖端芳, 严鹏科, 谭力铭, 汪煜华, 龙治峰, 刘月顺, 朱炳阳. Caveolin-1对胃癌细胞系MGC803细胞生长的影响. 世界华人消化杂志 2006; 14(15): 1448-1452
Revised: March 19, 2006
Accepted: March 29, 2006
Published online: May 28, 2006
AIM: To investigate the effect of Caveolin-1 on the proliferation and differentiation of gastric carcinoma cell line MGC803, and explore the probability that Caveolin-1 can be used for gene therapy.
METHODS: Caveolin-1 gene and Pcl-neo control plasmid were transfected into human MGC803 cell line by lipofectin, respectively. The positive clones were selected by G418. We also stabled a positive control group which was treated with PD98059 for 48 hours. Then the expression of Caveolin-1 in each group was detected by Western blot. Cell morphology was observed under optical microscope. Cell population doubling time was determined by cell counting method and cell cycle was analyzed by flow cytometry.
RESULTS: The expression of Caveolin-1 was significantly higher in the cells treated with Caveolin-1 or PD98059 than that in the empty controls (P < 0.001, q = 23.067 or 13.3376). Furthermore, Caveolin-1 expression was also markedly higher in the cells transfected with Caveolin-1 than that in the positive controls (P < 0.001, q = 9.7294). Under light microscope, marked changes occurred in cell morphous after gene transfection. Before transfection, the cells had a significant heteromorphism, with the features of large cell body, little cytoplasm, obvious karyokinesis. While in Caveolin-1-transfected MGC803 cells, the cell malignancy declined as the cellular heteromorphism diminished, with the ratio of nuclear-to-cytoplasm decreased, and the karyokinesis disappeared. Caveolin-1-transfected cells had an extended doubling time (65.46 h vs 46.67 h, P < 0.05, q = 4.8695). At same time, the population of Caveolin-1-transfected cells in G0/G1 phase was obviously increased (P < 0.01, q = 9.1824) while that in S phase was decreased (P < 0.01, q = 7.827). There were also notable differences in cell cycle distribution between Caveolin-1-transfected cells and the positive controls (G0/G1: P < 0.01, q = 4.9323; S: P < 0.05, q = 3.3295).
CONCLUSION: Caveolin-1 not only induces the differentiation of MGC803 cells, but also blocks them at in G0/G1 phase. Caveolin-1 can inhibit the proliferation of MGC803 cells in vitro by prolonging the cell doubling time.
- Citation: Luo HM, Tang SS, Liao DF, Yan PK, Tan LM, Wang YH, Long ZF, Liu YS, Zhu BY. Effect of Caveolin-1 on growth of human gastric cancer cell Line MGC803. Shijie Huaren Xiaohua Zazhi 2006; 14(15): 1448-1452
- URL: https://www.wjgnet.com/1009-3079/full/v14/i15/1448.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i15.1448
Caveolae是细胞膜生物功能多样性的重要结构基础, Caveolin-1是Caveolae最为重要的标记蛋白. 近年的研究表明, Caveolin-1在肿瘤中发挥着两种截然不同的作用, 在多种恶性肿瘤组织(如: 乳腺癌[1-5]、卵巢癌[6-8]、肉瘤[9]、胃癌[10]等)中表达下调, 且抑制肿瘤发展及转移, 而在少数恶性肿瘤细胞(如: 前列腺癌[11-13]、膀胱癌[14])中却表达上调, 且能促进癌细胞的浸润. 我们通过pcl-neo载体介导Caveolin-1基因转染胃癌MGC803细胞以探讨Caveolin-1对胃癌细胞生长的影响及作为基因治疗的候选基因的可能性.
重组pcl-neo-Caveolin-1人全长质粒由南华大学药物药理研究所惠赠, G418、RPMI 1640、LipofectamineTM 2000转染试剂均为Gibco公司产品, 兔抗人Caveolin-1多克隆抗体、BCA Protein Assay Reagent、Western blot荧光检测试剂盒为Santa Cruz公司产品, 辣根过氧化物酶标记的羊抗兔及羊抗鼠二抗、SABC免疫组化试剂盒、DAB显色剂为福州迈新生物有限公司, 其余试剂均为国产分析纯. 人胃腺癌细胞株MGC803由中山大学肿瘤所惠赠. 细胞培养在含100 mL/L新生牛血清的RPMI 1640培养液中, 置于二氧化碳培养箱内, 恒温37 ℃ 50 mL/L, 用2.5 g/L胰酶消化传代.
将对数生长期的MGC803细胞消化接种于6孔板中, 每孔2×105个细胞, 待细胞长至80%融合时, 换成完全培养基进行转染. 按转染试剂产品说明书提供的方法, 将载有人Caveolin-1全长cDNA序列的真核表达质粒pcl-neo-cav-1和pcl-neo空载质粒经扩增及常规限制性酶切鉴定后, 用脂质体介导转染入MGC803细胞, 转染时另设未处理组(即MGC803细胞)作为空白对照及经PD98059处理48 h作为阳性对照组. 48 h后转染组培养基加入400 mg/L G418继续培养, 约15 d后可获取G418抗性克隆. 收集对数生长期的各组细胞, 用细胞裂解液(25 mmol/L MBS pH 6.5, 0.15 mmol/L NaCl, 10 g/L Triton X-100)裂解细胞, 以提取细胞蛋白质. 电转移法将蛋白转印至PVDF膜并与兔抗人Caveolin-1抗体共孵育以检测转染前后MGC803细胞中Caveolin-1蛋白的表达变化. 同时用β-actin抗体检测细胞内β-actin表达作为参照. 细胞培养, 常规消化, 制成单细胞悬液, 接种于含盖玻片的培养板中培养. 待细胞基本长成单层后取出盖玻片, PBS洗3遍后用950 mL/L酒精固定30 min, PBS洗3遍, 常规HE染色于镜下观察细胞形态学的变化. 将处于对数生长期的各组细胞接种于24孔培养板培养, 每天取3孔进行计数, 连续观察7 d. 根据计数结果计算肿瘤细胞群体倍增时间(TD). 计算公式为: TD = t×lg2/lg(Nt/N0), (Nt为t时间的细胞数, N0为初种细胞数). 另收集对数生长期的各组细胞, 冷PBS洗涤3遍, 将细胞用700 mL/L冷乙醇5 mL 4 ℃固定24 h. 测试前用PBS洗细胞2遍, 加PI荧光染料(5 mg/L PI, 20 mg/L RNase A), 300目尼龙网滤过, 上流式细胞仪进行细胞周期分析.
统计学处理 各组数据用mean±SD表示, 采用单因素方差分析(one-way ANOVA)进行检验后, 多组间比较采用Student Newman Keuls检验, 全部数据用SPSS 11.0 for Windows统计软件处理.
利用Western blot发现Caveolin-1基因转染组及阳性对照组细胞中Caveolin-1表达比未处理组细胞表达明显增强(P<0.001, q值分别为23.067与13.3376); Caveolin-1基因转染组中Caveolin-1表达比阳性对照组更强(P<0.001, q = 9.7294); 空载体对照组细胞与未处理组细胞Caveolin-1表达无明显差别(P>0.05)(图1). 说明已成功筛选出稳定表达Caveolin-1基因的MGC803细胞株.
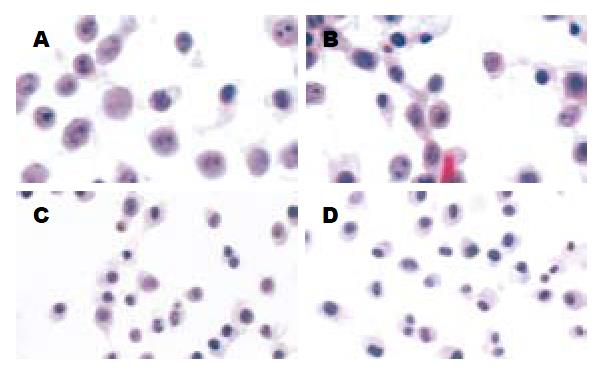
镜下观察发现未处理组及空载体对照组的MGC803细胞形态的异形性明显, 胞体大, 胞质很少, 有的有多核, 核分裂相很明显(图2A-B); 阳性对照组细胞核变得较小, 核分裂相也较少(图2C); 而Caveolin-1基因转染组细胞形态较一致, 胞质丰富, 核/质比明显变小, 核分裂相很少见(图2D).
根据细胞计数结果计算出各组细胞的群体倍增时间(表1), 结果显示, Caveolin-1基因转染组群体倍增时间明显比未处理组及空载体对照组细胞群体倍增时间要长(P<0.05, q = 4.8695); 而空载体对照组细胞的群体倍增时间与未处理组细胞的无明显差异.
Caveolin-1基因转染组及阳性对照组细胞与未处理组细胞相比, 其细胞周期分布发生了明显的变化: G0/G1期细胞数明显增多(前者P<0.01, q = 9.1824; 后者P<0.05, q = 4.6105), S期细胞数明显减少(前者P<0.01, q = 7.827; 后者P<0.05, q = 4.9929), G2/M期细胞数无明显变化(P>0.05). Caveolin-1基因转染组与阳性对照组间细胞周期分布的变化有明显差异性(其中G0/G1期P<0.01, q = 4.9323; S期P<0.05, q = 3.3295); 而空载体对照组与未处理组细胞相比较, 其细胞周期差异无统计学意义(表2).
研究发现, 在很多种肿瘤如乳腺癌[1-5]、卵巢癌[6-8]、肉瘤[9]等组织中存在着不同程度的Caveolin-1低表达, 本实验前期研究结果证实在胃癌组织中Caveolin-1的表达也下调[10]. 一般认为, Caveolin-1是一个候选抑癌基因[2,6,9,15], 但目前对其在肿瘤组织中的表达情况及功能尚存有异议[11-14,16], 在前列腺癌及膀胱上皮癌中, Caveolin-1表达明显升高, 且有促进癌细胞的增殖及淋巴结的转移的作用. 目前认为, 肿瘤的形成是机体局部细胞的增殖、分化、凋亡三者之间的平衡失调或失偶联所致, 细胞过度增殖, 分化及凋亡的阻遏是肿瘤形成的核心环节[17]. 本研究将Caveolin-1基因稳定地转染人胃癌细胞系MGC803中, 观察了Caveolin-1对MGC803细胞生物学性状的影响. 结果显示, 转染Caveolin-1基因后的MGC803细胞中Caveolin-1蛋白表达水平比未处理组及空载体对照组MGC803细胞明显要高, 甚至比阳性对照组表达水平也更高, 表明Caveolin-1基因已整合到MGC803细胞系中, 成功地构建了Caveolin-1稳定表达细胞系. MGC803在转染Caveolin-1基因后, 其形态相似, 异形性不明显, 胞质丰富, 核变小, 核/质比降低, 核分裂相少见. 提示, Caveolin-1具有诱导MGC803细胞向正常方向分化的作用.
细胞增殖是外界增殖信号作用于细胞膜或胞质受体, 经细胞内信号传递进而影响细胞周期的结果. 细胞周期不仅依靠细胞内的级联反应进行调控, 还受细胞外信号的影响, 细胞外信号通过细胞信号转导通路对细胞周期进行调控, 以实现其对细胞增殖的调控. 细胞周期存在两个主要检测点: G1/S检测点与G2/M检测点, 其中G2/M是保证染色体分开和细胞分裂前染色体均分的精确性; G1/S检测点是影响细胞周期的最关键点[17]. 已有研究表明, Caveolin-1主要作用于G1/S检测点, 通过引起G0/G1阻滞而影响细胞周期推进[18]. 我们通过细胞计数发现Caveolin-1能抑制肿瘤细胞增殖, 延长肿瘤细胞的群体倍增时间. 采用流式细胞术进一步分析了Caveolin-1对细胞周期分布的影响, 结果显示: 转染Caveolin-1基因后MGC803细胞的细胞周期分布发生了明显的变化: G0/G1期细胞数量明显增多, S期细胞数量明显减少, G2/M期无明显改变, 且其变化与ERK特异性抑制剂PD98059对细胞周期的影响有明显差别. 提示Caveolin-1主要作用于G1/S检测点, 阻止细胞周期由G0/G1期向S期推进, 且其对MGC803细胞增殖的抑制作用比ERK抑制剂的作用更强.
ERK1/2(p42/p44MAPK)信号通路是最为普遍的促进细胞增殖和分化的信号途径, 能被多种生长因子、细胞因子及促分裂剂激活, 同时其持续活化最终促进细胞的增殖和恶性转化[19-23]. 相应地, ERK的下调可促进细胞生长和转录的抑制[24-26]. 研究表明, MAPK通路在人胃癌细胞中处于活化状态[27]. PD98059是MAPK通路ERK的特异性抑制剂, 能抑制ERK的激活. 本结果显示, 用PD98059处理MGC803细胞48 h后, ERK的抑制率达到94.07%±3.01%. 同时显示: Caveolin-1对MGC803细胞增殖的抑制作用比ERK特异性的抑制剂PD98059的作用更强. 蛋白表达结果也显示: 用PD98059处理MGC803细胞后, Caveolin-1蛋白表达明显升高, 提示当ERK1/2活性降低时, Caveolin-1表达上调. 可见, Caveolin-1能抑制Ras/MAPK通路, 使细胞的接触抑制性作用加强, 从而导致细胞的生长阻滞, ERK1/2与Caveolin-1之间存在负反馈调节现象, 但两者间相互调节的机制还有待于进一步的研究.
Caveolae是细胞表面胞膜内陷形成的膜结构. Caveolin为一蛋白家族, 是Caveolae的重要组成蛋白, 相对分子量为21-24 kDa, 其家族成员有Caveolin-1, 2, 3三种, 其中Caveolin- 1是形成Caveolae所必不可少的结构蛋白. 研究表明, Caveolin-1与胆固醇的转运、胞饮作用及信号转导密切相关, 另外, Caveolin-1与肿瘤的发生、发展密切相关.
Caveolin-1与多种信号分子存在反向调节关系. Caveolin-1的主要作用是减缓细胞增殖进程, 作为抑癌基因发挥作用, 但在前列腺癌等肿瘤中可能作为促癌剂, 这可能与Caveolin-1的磷酸化(Tyr14及Ser80)及突变(P132L)导致骨架区功能丧失有关.
(1)许多细胞内的癌基因可引起Caveolin-1表达下调, 如: c-Myc, HPV E6, v-Abl, Bcr-Abl, H-Ras, v-Src及 Neu/ErbB2; (2)失去Caveolin-1的表达协同基因突变可导致INK4a的功能丧失, 而作为编码p16INK4a与p19ARE的细胞周期调节因子的INK4a基因一旦缺失就足以导致细胞永生化; (3)Caveolin-1存在着自然突变(P132L), 该突变能引起ERK-1/2的超活化; (4)在卵巢癌、乳腺癌及间充质肉瘤中, Caveolin-1表达均为下调.
本文着眼于Cave-olin-1与胃癌, 首次明确报道了Caveolin-1与肿瘤细胞分化的关系.
若能进一步研究将Caveolin-1抑制胃癌细胞增殖机制阐明, 可望为胃癌的基因治疗提供理论依据及靶点.
1 Caveolin-1: 译名较多, 有窖蛋白、陷窝蛋白、囊泡素等, 与细胞的多种生命活动密切相关, 包括细胞内吞、胆固醇的转运、信号转导和肿瘤发生等密切相关, 一般认为他是一抑癌基因.
2 PD98059: 是MAPK通路中ERK的特异性抑制剂, 抑制ERK的活化, 阻遏细胞周期的进程.
Caveolin是近年来热门研究的与肿瘤相关的细胞因子. 本文研究选题新颖、实验设计较合理、统计方法正确、结果可信、讨论较充分, 文章说明了Caveolin通过诱导细胞分化、阻滞分裂抑制肿瘤细胞的增殖, 为一种候选抑癌基因. 但要说明Caveolin通过抑制信号通路达到抑制细胞增殖尚需进一步研究探讨.
电编: 张敏 编辑:潘伯荣
| 1. | Fiucci G, Ravid D, Reich R, Liscovitch M. Caveolin-1 inhibits anchorage-independent growth, anoikis and invasiveness in MCF-7 human breast cancer cells. Oncogene. 2002;21:2365-2375. [PubMed] [DOI] |
| 2. | Hino M, Doihara H, Kobayashi K, Aoe M, Shimizu N. Caveolin-1 as tumor suppressor gene in breast cancer. Surg Today. 2003;33:486-490. [PubMed] |
| 3. | Bouras T, Lisanti MP, Pestell RG. Caveolin-1 in breast cancer. Cancer Biol Ther. 2004;3:931-941. [PubMed] [DOI] |
| 4. | Sloan EK, Stanley KL, Anderson RL. Caveolin-1 inhibits breast cancer growth and metastasis. Oncogene. 2004;23:7893-7897. [PubMed] [DOI] |
| 5. | Sotgia F, Williams TM, Schubert W, Medina F, Minetti C, Pestell RG, Lisanti MP. Caveolin-1 deficiency (-/-) conveys premalignant alterations in mammary epithelia, with abnormal lumen formation, growth factor independence, and cell invasiveness. Am J Pathol. 2006;168:292-309. [PubMed] [DOI] |
| 6. | Wiechen K, Diatchenko L, Agoulnik A, Scharff KM, Schober H, Arlt K, Zhumabayeva B, Siebert PD, Dietel M, Schafer R. Caveolin-1 is down-regulated in human ovarian carcinoma and acts as a candidate tumor suppressor gene. Am J Pathol. 2001;159:1635-1643. [PubMed] [DOI] |
| 7. | Bagnoli M, Tomassetti A, Figini M, Flati S, Dolo V, Canevari S, Miotti S. Downmodulation of caveolin-1 expression in human ovarian carcinoma is directly related to alpha-folate receptor overexpression. Oncogene. 2000;19:4754-4763. [PubMed] [DOI] |
| 8. | Davidson B, Nesland JM, Goldberg I, Kopolovic J, Gotlieb WH, Bryne M, Ben-Baruch G, Berner A, Reich R. Caveolin-1 expression in advanced-stage ovarian carcinoma-a clinicopathologic study. Gynecol Oncol. 2001;81:166-171. [PubMed] [DOI] |
| 9. | Wiechen K, Sers C, Agoulnik A, Arlt K, Dietel M, Schlag PM, Schneider U. Down-regulation of caveolin-1, a candidate tumor suppressor gene, in sarcomas. Am J Pathol. 2001;158:833-839. [PubMed] [DOI] |
| 11. | Yang G, Timme TL, Frolov A, Wheeler TM, Thomp-son TC. Combined c-Myc and caveolin-1 expression in human prostate carcinoma predicts prostate carcinoma progression. Cancer. 2005;103:1186-1194. [PubMed] [DOI] |
| 12. | Williams TM, Hassan GS, Li J, Cohen AW, Medina F, Frank PG, Pestell RG, Di Vizio D, Loda M, Lisanti MP. Caveolin-1 promotes tumor progression in an autochthonous mouse model of prostate cancer: genetic ablation of Cav-1 delays advanced prostate tumor development in tramp mice. J Biol Chem. 2005;280:25134-25145. [PubMed] [DOI] |
| 13. | Satoh T, Yang G, Egawa S, Addai J, Frolov A, Kuwao S, Timme TL, Baba S, Thompson TC. Caveolin-1 expression is a predictor of recurrence-free survival in pT2N0 prostate carcinoma diagno-sed in Japanese patients. Cancer. 2003;97:1225-1233. [PubMed] [DOI] |
| 14. | Fong A, Garcia E, Gwynn L, Lisanti MP, Fazzari MJ, Li M. Expression of caveolin-1 and caveolin-2 in urothelial carcinoma of the urinary bladder correlates with tumor grade and squamous differ-entiation. Am J Clin Pathol. 2003;120:93-100. [PubMed] [DOI] |
| 15. | Capozza F, Williams TM, Schubert W, McClain S, Bouzahzah B, Sotgia F, Lisanti MP. Absence of caveolin-1 sensitizes mouse skin to carcinogen-induced epidermal hyperplasia and tumor forma-tion. Am J Pathol. 2003;162:2029-2039. [PubMed] [DOI] |
| 16. | Said J. Biomarker discovery in urogenital cancer. Biomarkers. 2005;10 Suppl 1:S83-86. [PubMed] [DOI] |
| 17. | 卢 建, 余 应年, 徐 仁宝. 受体、信号转导系统与疾病. 第1版. 济南: 山东科学技术出版社 1999; 597-618. |
| 18. | Galbiati F, Volonte D, Liu J, Capozza F, Frank PG, Zhu L, Pestell RG, Lisanti MP. Caveolin-1 expression negatively regulates cell cycle progres-sion by inducing G(0)/G(1) arrest via a p53/p21(WAF1/Cip1)-dependent mechanism. Mol Biol Cell. 2001;12:2229-2244. [PubMed] [DOI] |
| 19. | Maestroni A, Tentori F, Meregalli G, Gabellini D, Asnaghi V, Ruggieri D, Zerbini G. Inhibition of MAP-kinase cascade normalizes the proliferation rate of fibroblasts from patients with Type 1 diabe-tes and nephropathy. J Diabetes Complications. 2005;19:291-296. [PubMed] [DOI] |
| 20. | Riddle RC, Taylor AF, Genetos DC, Donahue HJ. MAP kinase and calcium signaling mediate fluid flow-induced human mesenchymal stem cell proliferation. Am J Physiol Cell Physiol. 2006;290:C776-C784. [PubMed] [DOI] |
| 21. | Siriwardana G, Bradford A, Coy D, Zeitler P. Autocrine/paracrine regulation of breast cancer cell proliferation by growth hormone releasing hormone (GHRH) via Ras, Raf, and MAP Kinase. Mol Endocrinol. 2006;. [PubMed] [DOI] |
| 22. | Wilkinson MG, Millar JB. Control of the eukaryotic cell cycle by MAP kinase signaling pathways. FASEB J. 2000;14:2147-2157. [PubMed] [DOI] |
| 23. | Qi M, Elion EA. MAP kinase pathways. J Cell Sci. 2005;118:3569-3572. [PubMed] [DOI] |
| 24. | Torii S, Nakayama K, Yamamoto T, Nishida E. Regulatory mechanisms and function of ERK MAP kinases. J Biochem (Tokyo). 2004;136:557-561. [PubMed] [DOI] |
| 25. | Roux PP, Blenis J. ERK and p38 MAPK-activated protein kinases: a family of protein kinases with diverse biological functions. Microbiol Mol Biol Rev. 2004;68:320-344. [PubMed] [DOI] |
| 26. | Ebisuya M, Kondoh K, Nishida E. The duration, magnitude and compartmentalization of ERK MAP kinase activity: mechanisms for providing signaling specificity. J Cell Sci. 2005;118:2997-3002. [PubMed] [DOI] |
| 27. | Kuno Y, Kondo K, Iwata H, Senga T, Akiyama S, Ito K, Takagi H, Hamaguchi M. Tumor-specific activation of mitogen-activated protein kinase in human colorectal and gastric carcinoma tissues. Jpn J Cancer Res. 1998;89:903-909. [PubMed] [DOI] |