修回日期: 2005-03-15
接受日期: 2006-04-06
在线出版日期: 2006-05-18
目的: 观察环氧合酶-2(cyclooxygenase-2, COX-2)在肝癌细胞中表达, 探讨COX-2抑制剂celecoxib对肝癌细胞增殖和凋亡的作用.
方法: 免疫细胞化学、逆转录聚合酶链反应(RT-PCR)方法研究COX-2在肝癌细胞株中表达; MTT法观察COX-2抑制剂对肝癌细胞增殖的影响; 透射电镜及流式细胞仪观察celecoxib诱导肝癌细胞凋亡的作用、对细胞周期的影响及MDR1/P-gp表达的变化; 用RT-PCR方法检测Survivin mRNA药物处理后表达的变化.
结果: celecoxib对肝癌细胞抑制增殖、诱导凋亡呈时间和剂量依赖性. celecoxib作用HepG2 48 h抑制率为70.98%±0.67%(200 μmol/L)、47.93%±1.08% (100 μmol/L); Bel-7402为57.29%±0.67%(200 μmol/L)、43.84%±0.86%(100 μmol/L); 同样浓度但作用20 h, HepG2为45.51%±1.35%(200 μmol/L), 14.35%±1.55%(100 μmol/L); Bel-7402则为34.35%±0.63%(200 μmol/L), 15.35%±0.88%(100 μmol/L), 不同浓度以及不同作用时间相比均有显著差异(P<0.01); 100 μmol/L celecoxib作用24, 48, 72, 96 h的肝癌细胞凋亡率分别为12.2%±2.44%, 4.0%±1.67%, 20.4%±4.38%, 57.9%±5.74%(HepG2)和3.0%±1.05%, 18.5%±3.51%, 29.3%±3.25%, 48.4%±4.77%(Bel-7402), 与对照组相比有显著差异(P<0.01); 细胞周期分布改变, G0/G1期细胞比例增加, 24, 48, 72 h分别为: 44.17%±1.01%, 59.60%±0.61%, 62.7%±1.22%(HepG2)和47.80%±0.41%, 58.60%±0.46%, 78.40%±1.95%(Bel-7402), 与对照组比较有显著差异(P<0.01); 对照组PCNA蛋白表达呈强阳性(+++), 经药物处理后表达减弱, 并随时间延长而显著; HepG2中COX-2蛋白表达明显弱于Bel-7402, 药物处理后表达也不同. Survivin在肝癌细胞株中呈高表达状态, celecoxib作用48 h mRNA表达降至零, 而72 h后表达水平又有上升; 两株肝癌细胞中经celecoxib处理后, MDR1/P-gp表达有降低的趋势(Bel-7402), 或是基本上不受影响(HepG2).
结论: COX-2抑制剂celecoxib体外对肝癌细胞有较强的细胞毒作用且以剂量、时间依赖方式抑制细胞增殖, 并诱导凋亡, 使细胞周期阻滞于G1/S期. COX-2与P-gp, Survivin表达密切相关.
引文著录: 杨震, 秦成勇, 朱菊人, 任万华, 王旻. 环氧合酶-2对人肝癌细胞增殖和凋亡的调节作用. 世界华人消化杂志 2006; 14(14): 1382-1387
Revised: March 15, 2005
Accepted: April 6, 2006
Published online: May 18, 2006
AIM: To observe the expression of cyclooxy-genase-2(COX-2) and investigate the effects of COX-2 inhibitor, celecoxib, on the proliferation and apoptosis of hepatocarcinoma cells.
METHODS: The expression of COX-2 was detected by immunohistochemistry and reverse transcription polymerase chain reaction(RT-PCR). The effect of celecoxib on the growth of hepatocarcinoma cells(HepG2 and Bel-7402) were evaluated by MTT assay and changes proliferation cell nuclear antigen(PCNA). The apoptosis of hepatocarcinoma cells induced by celecoxib and P-gp expression were detected by electron microscopy and flow cytometry. The expression of Survivin was analyzed by RT-PCR.
RESULTS: Celecoxib inhibited the growth and induced apoptosis of hepatocarcinoma cells in a time- and concentration-dependent manner. The inhibitory rates for HepG2 cells were 70.98% ± 0.67% and 47.93% ± 1.08% after the cells were exposed to 200 and 100 mmol/L celecoxib, respectively, for 48 h, and 45.51% ± 1.35% and 14.35% ± 1.55% for 24 h; while the rates for Bel-7402 cells were 57.29% ± 0.67% and 43.84% ± 0.86% for 48 h, and 34.35% ± 0.63% and 15.35% ± 0.88% for 24 h(all P < 0.01). Substantial apoptosis was revealed by increment of apoptotic body under electron microscopy. After treatment with 100 mmol/L celecoxib for 24, 48, 72 and 96 h, the apoptosis rates of HepG2 cells were 12.2% ± 2.44%, 4.0% ± 1.67%, 20.4% ± 4.38%, and 57.9% ± 5.74%, respectively, while those of Bel-7402 cells were 3.0% ± 1.05%, 18.5% ± 3.51%, 29.3% ± 3.25%, and 48.4% ± 4.77%, respectively, which were significantly different from those in the controls. The percentage of G0/G1 phase cells was markedly increased(HepG2: 44.17% ± 1.01%, 59.60% ± 0.61%, 62.7% ± 1.22%; Bel-7402: 47.80% ± 0.41%, 58.60% ± 0.46%, 78.40% ± 1.95%; at 24, 48, and 72 h, respectively) in comparison with that of the controls(P < 0.01). COX-2 protein expression was obviously lower in HepG2 cells than that in Bel-7402 cells. PCNA expression was greatly lessened after celecoxib treatment. COX-2 and Survivin were down-regulated by celecoxib, but not linearly correlated. MDR1/P-gp expression was reduced or changed little as time went by after celecoxib treatment.
CONCLUSION: COX-2 inhibitor, celecoxib, inhibits the proliferation and induces the apoptosis of hepatocarcinoma cells in vitro a time- and concentration-dependent manner by down-regulating the expression of COX-2 and Survivin. COX-2 is correlated with MDR/P-gp and Survivin expression.
- Citation: Yang Z, Qin CY, Zhu JR, Ren WH, Wang M. Modulatory roles of cyclooxygenase-2 in proliferation and apoptosis of hepatocarcinoma cells. Shijie Huaren Xiaohua Zazhi 2006; 14(14): 1382-1387
- URL: https://www.wjgnet.com/1009-3079/full/v14/i14/1382.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i14.1382
环氧合酶(cyclooxygenase, COX)是花生四烯酸合成前列腺素的限速酶, 分为构成型COX-1和诱导型COX-2两种异构酶, 多数肿瘤组织及体外培养的肿瘤细胞株中COX-2呈高表达状态. 实验研究结果显示, COX-2可能参与了细胞增殖和凋亡平衡的调节过程, 而细胞的增殖和分化异常、凋亡调控失常与肝癌的发生、发展关系密切, 因此进一步研究COX-2对肝癌细胞的增殖及凋亡的调节作用有着重要的意义. 我们对人肝癌细胞株中COX-2表达以及COX-2抑制剂celecoxib对肝癌细胞增殖和凋亡的调节作用进行了相关的基础研究, 并就其机制进行了初步的探讨.
人肝癌细胞株HepG2和Bel-7402, 细胞在37℃, 50 mL/L CO2条件下, 于RPMI 1640培养基中(100 mL/L新生牛血清), 以2.5 g/L胰蛋白酶、0.2 g/L EDTA消化, 传代. celecoxib(北京医药研究开发中心合成, 以无水乙醇溶解配至0.2 mol/L, -20℃保存), 顺铂(cisplatin, DDP)(山东齐鲁制药厂生产, 无菌生理盐水稀释至血浆峰值浓度的100倍分装, -20℃保存), MTT(Sigma公司), 兔抗人COX-2抗体、鼠抗人PCNA(proliferating cell nuclear antigen, PCNA)抗体、SABC试剂盒、DAB显色试剂盒(武汉博士德生物工程有限公司), 鼠源性抗P-gp mAb、异硫氰酸荧光素(FITC)标记的羊抗鼠IgG mAb(Immunotech产品), TRIzol、M-MuLv ase、Taq DNA聚合酶、逆转录反应体系、PCR反应体系、DEPC(上海生物工程有限公司).
1.2.1 MTT比色法: 肝癌细胞1×104个/孔接种于96孔板中, 1 mL/L乙醇终浓度, 每种浓度设3个复孔, 设阴性对照及含相同浓度无水乙醇的空白对照, 作用不同时间后加入MTT溶液(5 g/L), 全自动酶标仪上以试验波长570 nm(参考波长630 nm)测出每孔吸光度值(A值), 计算细胞生长抑制率: 抑制率(IR) =(对照组A值-试验组A值)/(对照组A值-空白组A值)×100%.
1.2.2 免疫组化SABC技术: PCNA蛋白阳性染色为胞核呈棕黄色至棕褐色, COX-2蛋白阳性染色为胞质和核膜呈棕黄色. 采用半定量积分法: 根据片上阳性细胞率(以计数10个高倍镜视野为准, ≤5%为0分, 6%-30%为1分, 31%-70%为2分, ≥70%为3分)和阳性细胞着色程度(着色程度0分为阴性, 1分为弱阳性, 2分为阳性, 3分为强阳性)分别记分, 两项指标之和达0-1分为"-", 2分为"+", 3-4分为"++", 5-6分为"+++"; "-"~"+"为低表达, "++"~"+++"为高表达.
1.2.3 流式细胞仪检测: 细胞以不同浓度药物分别孵育24, 48, 72, 96 h, 按时收集细胞, PBS代替一抗设立阴性对照. 流式细胞仪测定细胞周期各个时相的分布比例、凋亡率以及P-gp蛋白的表达率.
1.2.4 RT-PCR法检测肝癌细胞COX-2和Survivin mRNA表达: 收集药物作用前后的肝癌细胞, 提取细胞总RNA. 引物: β-actin(产物317 bp): 5'-ATCATGTTTGAGACCTTCAACA-3', 5'-CATCTCTTGCTCGAAGTCCA-3'; Survivin(产物243 bp): 5'-AAGGCAGTGGCCTAAATCCT-3', 5'-CACCCTGCAGCTCTATGACA-3'; COX-2(产物531 bp): 5'-AAGCCTTCTCTAACCTCTCC-3', 5'-TAAGCACATCGCATACTCTG-3'. 按试剂盒说明进行逆转录和扩增. 取PCR产物10 μL电泳, 紫外灯下摄片. 采用图像分析仪分析数据, 获得各电泳条带的吸光度值(X), 用β-actin的吸光度值(A)作为内参照, 计算基因的相对表达量(X/A).
统计学处理 采用t检验.
celecoxib对细胞抑制率随时间延长及剂量的增大而升高. celecoxib作用HepG2 48 h抑制率为70.98%±0.67%(200 μmol/L)、47.93%±1.08%(100 μmol/L); Bel-7402为57.29%±0.67%(200 μmol/L)、43.84%±0.86%(100 μmol/L); 同样浓度但作用20 h, HepG2为45.51%±1.35%(200 μmol/L), 14.35%±1.55%(100 μmol/L); Bel-7402则为34.35%±0.63%(200 μmol/L), 15.35%±0.88%(100 μmol/L). 不同细胞株的不同浓度以及不同作用时间相比均有显著差异(P<0.01). 对照组(未3/4药物处理)PCNA蛋白表达呈强阳性(+++), 细胞核深染呈棕褐色; 3/4药物处理后表达减弱, 并且随时间延长而显著: 24 h为(++), 48 h为(+~++).
透射电镜下发现, 对照组细胞胞核和细胞器亚微结构清晰, 核膜完整, 而3/4celecoxib处理后, 凋亡细胞增多, 而且同一电镜切片中可以观察到不同时期的凋亡形态学改变, 并可见坏死细胞及细胞碎片. 流式细胞仪DNA直方图上出现典型的亚二倍体"凋亡峰". 100 μmol/L celecoxib作用24, 48, 72, 96 h的肝癌细胞凋亡率分别为12.2%±2.44%, 4.0%±1.67%, 20.4%±4.38%, 57.9%±5.74%(HepG2)和3.0%±1.05%, 18.5%±3.51%, 29.3%±3.25%, 48.4%±4.77%(Bel-7402). 与对照组相比有显著差异(P<0.01). 药物作用后G0/G1期细胞比例增加, 24, 48, 72 h分别为: 44.17%±1.01%, 59.60%±0.61%, 62.7%±1.22%(HepG2)和47.80%±0.41%, 58.60%±0.46%, 78.40%±1.95%(Bel-7402), 与对照组比较有显著差异(P<0.01).
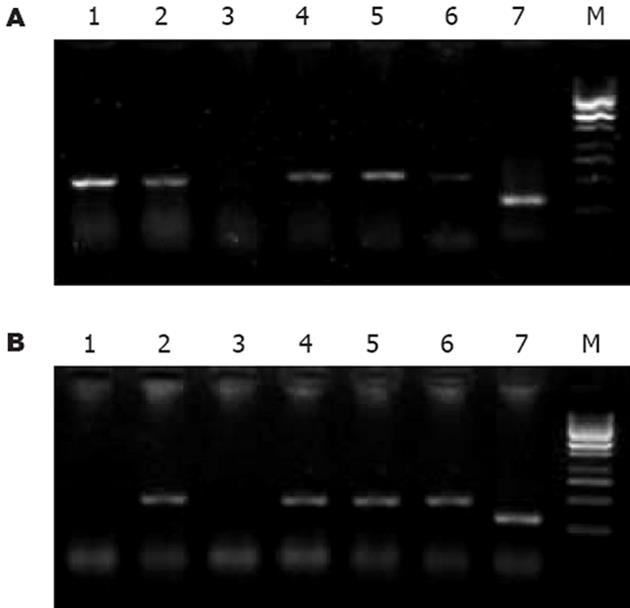
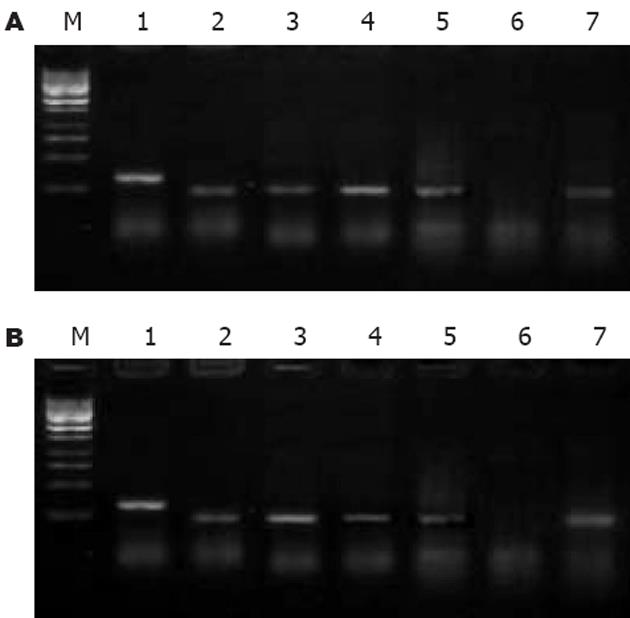
两株细胞对照组中COX-2蛋白表达不同, HepG2表达明显弱于Bel-7402; 药物处理不同时间后, COX-2表达变化亦不同: 0.1×PPC DDP组在0, 24, 48 h分别为+, +~++, ++(HepG2)和++, ++, +~++(Bel-7402), 无减弱趋势; celecoxib组在0, 24, 48 h分别为+, -, +(HepG2)和++, -, +~++(Bel-7402), 加入药物24 h后表达明显降低, 但48 h反又增强. COX-2 mRNA表达见图1. 人肝癌细胞COX-2与β-actin吸光度(X/A)的比值见表1.
| DDP | celecoxib | |||||
| 对照 | 24 h | 48 h | 24 h | 48 h | 72 h | |
| COX-2:HepG2 | 0.188 | 0.580 | 0.340 | 0 | 0.310 | 0.877 |
| Bel-7402 | 0.524 | 0.537 | 0.493 | 0 | 0.555 | 0 |
| Survivin:HepG2 | 0.500 | 0.550 | 0.860 | 0.570 | 0 | 0.298 |
| Bel-7402 | 0.539 | 0.907 | 0.352 | 0.360 | 0 | 0.460 |
Survivin mRNA表达见图2. 人肝癌细胞Survivin与β-actin吸光度(X/A)的比值见表1.
不同药物对P-gp表达的影响见表2.
| 24 h | 48 h | 72 h | 96 h | ||
| HepG2: | DDP | 2.06±0.28a | 6.03±0.23b | 19.33±0.78b | 11.90±1.85b |
| DDP+celecoxib | 15.40±1.51b | 6.65±0.69b | 5.65±1.08b | 3.86±0.60b | |
| celecoxib | 9.22±1.17b | 11.60±1.28b | 10.60±1.67b | 9.03±1.45b | |
| Bel-7402: | DDP | 95.80±0.66a | 80.40±1.90b | 88.40±1.25b | 61.70±1.95b |
| DDP+celecoxib | 99.30±0.50a | 98.40±0.26a | 65.50±2.40b | 18.70±2.69b | |
| celecoxib | 98.90±0.30a | 86.30±1.45b | 60.20±2.60b | 23.50±3.06b |
环氧合酶-2基因定位于1号染色体, 呈诱导性表达, 在正常生理状态下多数组织不表达, 但在肿瘤中却往往呈过表达状态, 肝癌组织中COX-2表达水平亦显著升高, 并且与癌细胞的分化以及肝癌的转移、预后及术后复发密切相关, 鉴于此进一步研究COX-2抑制剂对肝癌细胞的作用有着重要意义. COX-2抑制剂celecoxib安全性高且疗效同样出色, 对肿瘤细胞的抑制作用明显强于其他COX-2抑制剂[1-3], 并有可能逆转肿瘤消耗引起的消瘦而对正常细胞的结构、凋亡无明显影响[4]. 将celecoxib作用于肝癌细胞株HepG2及Bel-7402, 结果发现, 有显著的抑制增殖和诱导凋亡作用. 电镜下可观察到药物处理后典型的凋亡细胞形态, 流式细胞仪检测细胞凋亡更为敏感, celecoxib处理组细胞凋亡率呈逐渐增长趋势, 细胞周期分布亦发生改变, G0/G1期比率逐渐增高, S期逐渐降低, 而细胞分裂周期中决定细胞生长速度和细胞凋亡的关键即是G1期, 提示通过阻°细胞DNA的合成而诱导凋亡. 实验中发现不论是强COX-2表达的Bel-7402还是较弱COX-2表达的HepG2, celecoxib作用后均呈现COX-2表达的迅速降低, 而细胞凋亡率呈上升趋势, 表明celecoxib依赖COX-2途径诱导凋亡是可能的. 然而诱导细胞凋亡所需浓度远远高于抑制PGE2所需浓度; 并且有研究发现COX-2抑制剂对某些COX-2超表达和COX-2表达阴性肿瘤细胞抑制增殖和诱导凋亡的作用未见有显著差异[5-6], 所以近来众多研究倾向于非COX-2依赖性途径解释凋亡机制. 实验中也观察到celecoxib诱导细胞凋亡的作用并非完全与COX-2表达呈正比, 只是程度有差异而无本质的差别, 强COX-2表达的Bel-7402细胞抑制率反而低于HepG2(包括任何浓度梯度), 虽Bel-7402凋亡率稍高, 但是电镜下观察到HepG2细胞碎片明显多于Bel-7402, 推测可能是凋亡继发细胞死亡所致, 表明低COX-2表达的HepG2反较Bel-7402敏感, 并且celecoxib影响COX-2表达的效用并非线性, 随时间延长COX-2表达又有增强, 但细胞凋亡率并没有相应变化趋势, 这与有关研究报道是一致的, 进而提示我们celecoxib诱导细胞凋亡过程中非COX-2依赖性途径的存在. 已知在人类癌症中均存在着较高程度的药物抵抗, 尤以肝癌为著. 目前研究最多的仍是P-gp介导的MDR, 耐药细胞表面大多均有P-gp过度表达. 而COX-2与MDR功能及表达有显著相关性[7-8]: COX-2水平升高有助于MDR表达, 能够增加MDR1基因产物产量并增强其功能. Ratnasinghe et al[9]认为, 可能是COX-2表达上调引起前列腺素合成增加, 诱导PKC, C-Jun的表达, 而PKC、C-Jun的表达增加又诱导P-gp的表达所致, 并且此作用可被特异性COX-2抑制剂阻断. 实验中对HepG2, Bel-7402细胞研究发现, 对照组COX-2表达水平高的细胞株Bel-7402 MDR基因表达产物P-gp总体上表达也较高; celecoxib处理组P-gp表达呈降低倾向(Bel-7402), 或是基本上不受影响(HepG2); 而celecoxib联合小剂量(0.1×PPC)顺铂处理组同样不仅不引起P-gp表达增强, 还使得细胞凋亡率升高, 表明celecoxib可以通过降低P-gp表达、逆转MDR, 并提高肝癌细胞对化疗药物顺铂的敏感性、增加其疗效. Hashitani et al[10]观察celecoxib作用于头颈部癌细胞株SCC25和HSG时可以明显增强细胞对抗癌药物的敏感性, 并且与诱导凋亡率几乎呈平行状态, 也表明了COX-2与MDR功能及表达显著相关. 然而随药物作用时间延长, COX-2表达又有增强趋势, P-gp表达水平却持续降低, 二者并非线性相关, 提示可能有其他影响因素. 凋亡抑制蛋白(inhibitor of apoptosis, IAP)家族中新近克隆的同族体Survivin, 可能是迄今发现的最强的凋亡抑制因子, 具有肿瘤特异性表达的特点, 在肝癌的发生、发展过程中有着重要作用[11]. 其阳性表达率与肿瘤复发及预后等显著相关[12-14], 可作为肝癌患者判断预后以及术后复发的一个独立因素[15], 并且Survivin抑制肿瘤细胞凋亡、促进肿瘤细胞的增殖以及正常细胞有丝分裂以后基本不表达的特点使其有望成为治疗上一个较为合理的潜在靶点. Ambrosini et al研究发现, 持续转染反义Survivin的Hela细胞在去生长因子的情况下出现大量细胞的凋亡, 细胞增殖同时也受到抑制. 空载体转染3 d后, 细胞增殖288%, 而反义Survivin转染细胞增殖20%. 通过流式细胞仪测定细胞凋亡率: 短暂转染与转染空载体相比, 反义Survivin cDNA出现二倍体凋亡峰; 稳定转染时凋亡峰增加1.4倍. 实验中发现HepG2及Bel-7402细胞中Survivin呈高表达状态, celecoxib诱导肝癌细胞凋亡时表达即显著降低, 作用48 h时, Survivin表达几测不到, 因而COX-2抑制剂celecoxib可能同时也通过下调Survivin表达而诱导细胞发生凋亡. 在顺铂处理组Survivin表达却呈上升趋势, 表明Survivin基因可能和肝癌获得性多药耐药性有关, Notarbartolo et al[16]研究结果也表明Survivin参与了化疗药物及其他凋亡诱导剂的抵抗, 这种表达的上调可能是肝癌细胞在化疗药物作用下"细胞生存"的一种分子机制, 也是肝癌细胞一种获得性的耐药性.
总之, COX-2抑制剂celecoxib诱导细胞凋亡作用系下调COX-2, Survivin及P-gp表达, 影响细胞周期分布等多种因素综合作用的结果, COX-2与P-gp, Survivin表达密切相关, 因此设想是否能以COX-2为靶点, 通过反义技术诱导肿瘤细胞凋亡从而为治疗开辟新的途径尚需进一步研究.
COX-2参与细胞凋亡和增殖平衡的调节, 对肿瘤的发生、发展有着重要意义, 因此进一步研究COX-2抑制剂对肿瘤的作用已成为肿瘤靶向治疗研究的重点. 特异性COX-2抑制剂celecoxib出色的疗效以及安全性和耐受性使得用于临床肿瘤治疗可能性增加.
肝癌不仅存在着细胞的过度增殖, 同时细胞的凋亡调控也呈异常状态, 并且细胞对药物的不敏感性和抗药性, 严重影响了疗效和预后, 成为亟待解决的问题. 目前研究热点是发现有效的生物治疗靶点, 探讨其机制, 为治疗开辟新途径.
COX-2, Survivin及P-gp在COX-2抑制剂celecoxib诱导肝癌细胞凋亡过程中表达的变化及相互作用未见有文献报道.
本文结果表明celecoxib通过抑制COX-2表达进而引起Survivin、P-gp的下调, 最终达成抑制癌细胞增殖、诱导凋亡、逆转MDR、增强细胞对化疗药物的敏感性的作用, 但本文并非临床研究, 其确切临床作用尚需进一步研究.
本文的研究内容已有文献报道, 显示COX-2抑制剂celecoxib体外对肝癌细胞有较强的细胞毒作用, 并以剂量时间依赖方式抑制增殖, 诱导凋亡, 使细胞阻滞于G1/S期, 可能使肝癌生物治疗的新靶点. 文章选题先进, 设计科学, 可能为治疗肝癌开辟新途径.
电编: 张敏 编辑:潘伯荣
| 1. | Patti R, Gumired K, Reddanna P, Sutton LN, Phillips PC, Reddy CD. Overexpression of cyclooxygenase-2(COX-2) in human primitive neuroectodermal tumors: effect of celecoxib and rofecoxib. Cancer Lett. 2002;180:13-21. [PubMed] [DOI] |
| 2. | Waskewich C, Blumenthal RD, Li H, Stein R, Goldenberg DM, Burton J. Celecoxib exhibits the greatest potency amongst cyclooxygenase(COX) inhibitors for growth inhibition of COX-2-negative hematopoietic and epithelial cell lines. Cancer Res. 2002;62:2029-203. [PubMed] |
| 3. | Yamazaki R, Kusunoki N, Matsuzaki T, Hashimoto S, Kawai S. Selective cyclooxygenase-2 inhibitors show a differential ability to inhibit proliferation and induce apoptosis of colon adenocarcinoma cells. FEBS Lett. 2002;531:278-284. [PubMed] [DOI] |
| 4. | Davis TW, Zweifel BS, O'Neal JM, Heuvelman DM, Abegg AL, Hendrich TO, Masferrer JL. Inhibition of cyclooxygenase-2 by celecoxib reverses tumor-induced wasting. J Pharmacol Exp Ther. 2004;308:929-934. [PubMed] [DOI] |
| 5. | Grosch S, Tegeder I, Niederberger E, Brautigam L, Geisslinger G. COX-2 independent induction of cell cycle arrest and apoptosis in colon cancer cells by the selective COX-2 inhibitor celecoxib. FASEB J. 2001;15:2742-2744. [PubMed] |
| 6. | Agarwal B, Swaroop P, Protiva P, Raj SV, Shirin H, Holt PR. Cox-2 is needed but not sufficient for apoptosis induced by Cox-2 selective inhibitors in colon cancer cells. Apoptosis. 2003;8:649-654. [PubMed] [DOI] |
| 7. | Sorokin A. Cyclooxygenase-2: potential role in regulation of drug efflux and multidrug resistance phenotype. Curr Pharm Des. 2004;10:647-657. [PubMed] [DOI] |
| 8. | Patel VA, Dunn MJ, Sorokin A. Regulation of MDR-1(P-glycoprotein) by cyclooxygenase-2. J Biol Chem. 2002;277:38915-38920. [PubMed] [DOI] |
| 9. | Ratnasinghe D, Daschner PJ, Anver MR, Kasprzak BH, Taylor PR, Yeh GC, Tangrea JA. Cyclooxy-genase-2, P-glycoprotein-170 and drug resistance; is chemoprevention against multidrug resistance possible? Anticancer Res. 2001;21:2141-2147. [PubMed] |
| 10. | Hashitani S, Urade M, Nishimura N, Maeda T, Takaoka K, Noguchi K, Sakurai K. Apoptosis induction and enhancement of cytotoxicity of anticancer drugs by celecoxib, a selective cyclooxy-genase-2 inhibitor, in human head and neck carcinoma cell lines. Int J Oncol. 2003;23:665-672. [PubMed] |
| 11. | Ito T, Shiraki K, Sugimoto K, Yamanaka T, Fujikawa K, Ito M, Takase K, Moriyama M, Kawano H, Hayashida M. Survivin promotes cell proliferation in human hepatocellular carcinoma. Hepatology. 2000;31:1080-1085. [PubMed] [DOI] |
| 12. | Kawasaki H, Altieri DC, Lu CD, Toyoda M, Tenjo T, Tanigawa N. Inhibition of apoptosis by Survivin predicts shorter survival rates in colorectal cancer. Cancer Res. 1998;58:5071-5074. [PubMed] |
| 13. | Monzo M, Rosell R, Felip E, Astudillo J, Sanchez JJ, Maestre J, Martin C, Font A, Barnadas A, Abad A. A novel anti-apoptosis gene: Re-expression of Survivin messenger RNA as a prognosis marker in non-small-cell lung cancers. J Clin Oncol. 1999;17:2100-2104. [PubMed] |
| 14. | Kato J, Kuwabara Y, Mitani M, Shinoda N, Sato A, Toyama T, Mitsui A, Nishiwaki T, Moriyama S, Kudo J. Expression of Survivin in esophage-al cancer: correlation with the prognosis and res-ponse to chemotherapy. Int J Cancer. 2001;95:92-95. [PubMed] [DOI] |
| 15. | Ikeguchi M, Ueda T, Sakatani T, Hirooka Y, Kaibara N. Expression of Survivin messenger RNA correlates with poor prognosis in patients with hepatocellular carcinoma. Diagn Mol Pathol. 2002;11:33-40. [PubMed] [DOI] |
| 16. | Notarbartolo M, Cervello M, Dusonchet L, Cusimano A, D'Alessandro N. Resistance to diverse apoptotic triggers in multidrug resistant HL60 cells and its possible relationship to the expression of P-glycoprotein, Fas and of the novel anti-apoptosis factors IAP(inhibitory of apoptosis proteins). Cancer Lett. 2002;180:91-101. [PubMed] [DOI] |