修回日期: 2006-02-19
接受日期: 2006-02-21
在线出版日期: 2006-05-18
目的: 真核表达人自身抗原细胞色素P450 2D6(CYP2D6)显性表位285 bp基因片段, 获得具免疫学活性的纯化重组蛋白, 为自身免疫性肝炎抗体的检测提供特异性抗原.
方法: 以肝脏的cDNA混合文库为模板作PCR, 将PCR产物与真核表达载体pEGH共同转化酿酒酵母Y258, 碱裂解法进行质粒制备, PCR扩增鉴定. 表达载体构建成功后, 在半乳糖的诱导下表达产生重组融合蛋白, 利用GST亲和层析法进行纯化. 然后对其产物进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和蛋白质印迹法(WB)及蛋白质质谱学(MALDI-TOF)检测.
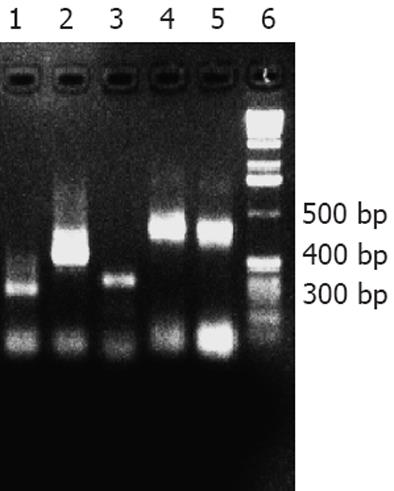
结果: PCR产物约290 bp, 与预期285 bp接近. pEGH-CYP2D6重组阳性克隆PCR鉴定与预期大小接近, SDS-PAGE和WB结果显示, 融合蛋白Mr37 000, 具有天然人自身抗原CYP2D6的免疫原性. 质谱蛋白肽指纹数据通过Mascot在人类蛋白质数据库中分析比对, 与CYP2D6蛋白同源性最高.
结论: 成功克隆表达人自身抗原CYP2D6的显性表位, 为建立新的自身免疫性肝炎抗体检测方法奠定了基础.
引文著录: 王文凯, 李永哲, 刘国振. 人自身抗原CYP2D6 285 bp基因片段克隆、真核表达及免疫性鉴定. 世界华人消化杂志 2006; 14(14): 1357-1361
Revised: February 19, 2006
Accepted: February 21, 2006
Published online: May 18, 2006
AIM: To clone and express immunodominant epitope of human autoantigen cytochrome P450 2D6 (CYP2D6) in Saccharomyces Cerevisiae, and establish a new assay for detecting autoantibody LKM-1.
METHODS: We obtained CYP2D6 DNA fragment by polymerase chain reaction (PCR), using total liver cDNA library as the template. The PCR products were recombined into pEGH expression vector to construct the high efficiency recombinant expression vector in Saccharomyces Cerevisiae Y258. The positive clones were identified by PCR and induced by galactose. Glutathione-Sepharose 4B was used for purification of recombinant CYP2D6 protein. The expression products were analyzed by SDS-PAGE and Western blot as well as by matrix-assisted laser desorption inoization-time of flight mass spectrometry (MALDI-TOF-MS.
RESULTS: The PCR product was about 290 bp in size, which was in accordance with the predicted 285 bp. The pEGH-CYP2D6 positive clone produced a Mr37 000 fusion protein, which was confirmed to have natural immunogenicity of human autoantigen CYP2D6 by SDS-PAGE and Western blot, and MALDI-TOF-MS showed that it also had high similarity with CYP2D6 protein.
CONCLUSION: The immunodominant epitope of human autoantigen CYP2D6 is successfully cloned and expressed in Saccharomyces Cerevisiae, which lays a foundation for a new method of autoantibody detection in autoimmune hepatitis.
- Citation: Wang WK, Li YZ, Liu GZ. Expression of Cyclin D1, proliferating cell nuclear antigen in liver of C57BL/6 mice infected with Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2006; 14(14): 1357-1361
- URL: https://www.wjgnet.com/1009-3079/full/v14/i14/1357.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i14.1357
自身免疫性肝炎(autoimmune hepatitis, AIH)是一种病因不明的肝脏坏死性炎症性病变[1-2], 以女性多见. 临床上以高丙种球蛋白血症, 血清中可检测出多种自身抗体、病理表现为肝脏汇管区碎屑样坏死、免疫抑制治疗有效为特征[3-5]. AIH的发生与HLA DR3、HLA DR4相关, 其病因、发病机制至今尚不清楚. 血清自身抗体是AIH的重要特征之一, 也是AIH诊断和分型的必备条件. AIH被分为二种主要的类型: 1型AIH和2型AIH[6-8]. 1型AIH的特点是血清中的自身抗体主要为抗平滑肌抗体(SMA)和/或抗核抗体(ANA). 抗中性粒细胞胞质抗体(ANCA)、抗去唾液酸糖蛋白受体(ASGP-R)抗体、抗可溶性肝抗原或肝-胰(SLA/LP)抗体对ANA/SMA均为阴性的AIH的诊断很有帮助. 2型AIH的特点是血清中的自身抗体主要为抗1型肝肾微粒体(LKM-1)抗体和/或抗肝细胞溶质蛋白(LC1)抗体. 2型AIH患者血清中的抗LKM-1抗体的主要靶抗原已被鉴定为CYP2D6. 已证实的CYP2D6在肝细胞膜上的表达提示抗LKM-1抗体的肝脏损伤的致病作用[9-11]. CYP2D6抗原决定簇的氨基酸序列是D-P-A-Q-P-P-R-D[12]. 我们采用分子生物学方法, 于国内首次成功地用真核细胞表达了一个含有上述8个氨基酸的核心序列的免疫显性表位, 旨在为抗CYP2D6抗体的检测提供特异性抗原, 为AIH特异性临床诊断提供有效工具.
pEGH为真核表达载体, 用于PCR产物的克隆, 带有gal1-10操纵子, 半乳糖诱导宿主菌Y258的GST的表达, 从而表达外源基因; pEGH表达的带有GST的融合蛋白, 可以特异地与Immobilized Glutathione(固相化谷胱苷肽, 即Glutathione-Sepharose 4B)的介质(beads)亲和从而达到分离的目的. pEGH质粒由北京华大基因公司提供. 酵母Y258用于感受态细胞的制备及质粒的转化, 同时也用于蛋白质的表达, 该菌株用于高效表达克隆于含有gal1-10启动子的pEGH表达载体的基因. 酵母Y258由北京华大基因公司提供. 限制性内切酶(Xbal Ⅰ、Hind Ⅲ)购自NEB公司; Taq酶购自TaKaRa公司; 1 kb DNA ladder Mr标准品和低Mr蛋白标准品购自北京天为时代科技有限公司; 预混合蛋白标准购自纽英伦生物技术(北京)有限公司; 引物由北京华大基因公司合成; ImmulisaTM抗LKM-1抗体检测试剂盒为美国IMMCO公司产品; CYP2D6标准血清由德国欧蒙医学试验诊断股份公司惠赠; 辣根过氧化物酶标记兔抗人IgG为Sigma公司产品; 酵母提取物、蛋白胨购自英国Oxoid公司; 棉子糖、半乳糖、丙稀酰胺、N-N亚甲基丙烯酰胺购自美国Sigma公司; Glutathione-Sepharose 4B购自美国Amersham公司; 还原性谷光苷肽购自北京经科宏达公司; 其余常规化学试剂均为分析纯. PTC-100TM Programmable Thermal Controlier (MJ Reasearch, INC), Centrifuge 5810R (Eppendorf公司), SORVALL fresco(索福/贺利公司), DYY-1118型稳压稳流电泳仪(北京六一仪器厂), 752一紫外光栅分光光度仪(上海分析仪器厂), Trans Blot SD半干电转印仪(美国Bio-Rad公司). 根据美国NCBI基因库中核酸数据库的CYP2D6基因序列和借助计算机辅助分析, 分别在CYP2D6的免疫显性表位(编码CYP2D6蛋白质的第257-351之间氨基酸)的两侧自行设计引物, 上游引物: 5' GCATCACCATCACCATCACCGTGGTGGTGAGCACAGG ATGACCTGGG 3', 下游引物: 5' AGGCAGATCGTCAGTCAGTCACGATAGAAGCCTGGTCACCCATCTCTG 3'(带下划线的斜体为通用引物, 用于在酿酒酵母细胞内基因片段与载体的同源重组).
PCR条件: 94℃预变性4 min, 94℃ 30 s, 58℃ 30 s, 72℃ 2 min, 35个循环, 72℃延伸10 min. PCR结束后, 离心片刻. 然后取PCR产物5 μL进行10 g/L琼脂糖凝胶电泳检测. 用乙醇沉淀法纯化PCR产物和被Xbal Ⅰ、Hind Ⅲ双酶切的pEGH载体共同转化感受态酿酒酵母Y258, 酵母Y258有损伤修复体系, 无需连接酶, 在酵母细胞内线性目的基因与线性载体可自动环化连接, 进行同源重组. 酵母Y258感受态的制备采用醋酸锂方法. 转化阳性克隆30℃培养48 h, 可在营养缺陷型SC-Ura-/glucose固体培养基上得到直径1-2 mm的单克隆菌落. 参照《分子克隆实验指南(第3版)》的方法, 对阳性菌落提质粒进行质粒PCR验证. 从质粒PCR验证正确的克隆的保菌液中取菌在Yeast平板划线培养48 h, 得到2 mm左右的单克隆菌落. 挑2 mm左右的单克隆菌落加到SC-ura/raffinose液体培养基, 30℃振荡培养至A600nm = 0.6-0.8后, 加入半乳糖至终浓度为2 g/L, 30℃振荡培养过夜. 收集菌液应用Glutathione-Sepharose 4B进行亲和纯化. 取2×loading buffer 5 μL和蛋白样品15 mL, 用PCR仪100℃变性10 min, 然后行SDS-PAGE电泳, 考马斯亮蓝R250染色. 蛋白质印迹法(WB)检测: 利用半干电转移仪将SDS-PAGE凝胶上的蛋白质转移至硝酸纤维素膜上, 50 g/L脱脂奶粉为封闭试剂, 一抗为自身免疫抗原的标准血清, 二抗为辣根过氧化物酶标记兔抗人IgG, 在DAB、H2O2下显色. 目的蛋白条带的鉴定: 采用胶内酶切, MALDI-TOF-MS测定PMF, Mascot数据库搜索鉴定. ELISA检测: 用包被液1∶100稀释重组蛋白, 包被酶标板, 经封闭后分别加入待检血清, 37℃孵育30 min, 洗3次后加入二抗, 再孵育及洗涤后, 加A和B显色液各一滴, 37℃显色15 min后, 加终止液终止反应, 酶标仪630 nm处测其A值.
统计学处理 用SPSS 11.0统计分析软件分析, 组间率的比较用χ2检验.
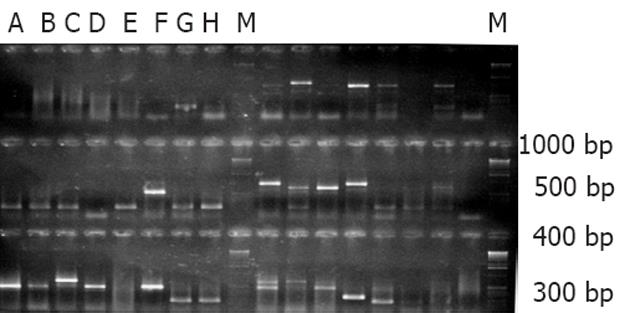
CYP2D6的免疫显性表位基因扩增产物经电泳分析显示, 有1条约290 bp扩增条带, 其大小与预期285 bp相符(图1). 通过PCR方法从人类肝脏cDNA文库中扩增出CYP2D6相应的目的基因片段, 与真核表达载体pEGH一同通过化学方法转入酵母细胞Y258进行同源重组, 利用pEGH的Ura的合成基因, 进行阳性克隆的筛选, 经过30℃培养48 h, 得到直径1-2 mm的单克隆菌落, 如图2. 经过30℃培养转化重组体48 h, 在平板上出现几十个白色小菌落, 可能是阳性克隆, 尚需进一步鉴定. 从这些克隆中提取质粒后进行质粒PCR验证. 阳性克隆能扩增出目的基因片段, 而阴性对照pEGH质粒则扩增不出目的片段. 质粒PCR产物经10 g/L琼脂糖凝胶电泳, 可见符合预期长度的目的基因. 目的基因片段与载体pEGH正确连接的克隆质粒PCR可得到485 bp(因质粒PCR使用的是针对载体的通用引物, 故多出200 bp)的片段(图3). 融合蛋白SDS-PAGE分析: 100 g/L SDS-PAGE显示, 酿酒酵母Y258感受态细胞经转化目的基因与载体pEGH后, 经30℃培养和半乳糖的诱导及Glutathione-Sepharose 4B的纯化, 得到只有一条带的Mr约为37 000的融合蛋白(图4). 用蛋白质印迹法对融合蛋白进行分析, 结果显示pEGH-CYP2D6重组质粒诱导表达了一条Mr约37 000的仅能被抗CYP2D6标准血清识别的特异性蛋白条带(图5). MALDI-TOF质谱蛋白质鉴定结果: 蛋白质酶解纯化样品加入a-氰-4-羟基肉桂酸基质作用, 点样于质谱上样板, 用MALDI-TOF质谱仪(北京华大基因公司)分析采集蛋白质肽指纹图数据. 质谱蛋白肽指纹数据通过Mascot在人类蛋白质数据库中分析比对. 分析比对结果为蛋白条带经质谱鉴定为CYP2D6蛋白. ELISA检测结果: 应用重组CYP2D6的免疫显性表位序列分别对抗LKM-1抗体阳性的2型AIH患者和对照组血清进行ELISA检测, 26个抗LKM-1抗体阳性血清中25个血清识别了目的蛋白, 而健康人对照组无一例阳性. 抗LKM-1抗体阳性的2型AIH组抗LKM-1抗体阳性率与正常对照组比较, 差异具有统计学意义(P<0.05).
在临床实践中, 由于大部分AIH患者对抗炎和免疫抑制治疗反应良好, 故识别、鉴定AIH是极为重要的. 此外, 有关骨髓造血干细胞和骨髓间质细胞的最新研究可能为AIH患者提供替代治疗方法[13]. 抗LKM-1抗体是2型AIH标记抗体[5,14]. 2型AIH患者血清中的抗LKM-1抗体的主要靶抗原已被鉴定为CYP2D6. 最近证实的CYP2D6在肝细胞膜上的表达提示抗LKM-1抗体具有肝脏损伤的致病作用. CYP2D6的抗原表位定位研究已发现至少4个不同的线性表位[12,15]. CYP2D6最具免疫显性的表位是257-269和321-351号氨基酸, 他们在2型AIH患者中大约分别呈70%和50%的阳性率[12,15]. 由373-389和410-429号氨基酸组成的两个不常见的表位也在一些患者中被抗LKM-1抗体识别[15]. 近来, Klein et al[16]和Kerkar et al[17]报道了CYP2D6另一个免疫显性表位(193-212号氨基酸), 他们报道的在2型AIH患者中阳性率分别为70%和93%. 2005年Imaoka et al[18]报道了CYP2D6的一个新的表位(1-146号氨基酸), 为空间构象依赖性的表位. 目前临床检测抗LKM-1抗体的方法主要是间接免疫荧光法(IIF)和酶联免疫吸附法(ELISA)[19-26]. 在应用IIF方法中, 对IIF着染的鉴定有一定的主观性, 因而对结果的解释可能在不同工作日之间、不同观察者之间、新老组织切片之间而有所不同. 随着抗LKM-1抗体的特异性抗原逐渐被发现及纯化, 抗原特异性ELISA检测方法得到了迅速推广. 目前的ELISA法用于包被的抗原是原核表达CYP2D6. 原核表达的CPY2D6蛋白缺乏天然蛋白的糖基化修饰, 也没有翻译后的加工, 所以可能影响活性, 原核表达的蛋白主要在包涵体中, 纯化和复性没有很好的解决方法, 所以我们构建了CYP2D6免疫显性表位的酿酒酵母的真核表达系统. 我们以人肝cDNA混合文库为模板, 用特异引物克隆出相应的目的基因, 经分离纯化及与载体pEGH共转化酵母Y258, 构建了表达性质粒pEGH/CYP2D6, 并在真核细胞中得到表达, 最后经SDS-PAGE电泳和WB鉴定, 结果表明该重组融合蛋白Mr约为37 000(他是由26 000的GST和11 000的CYP2D6 部分组成), 具有天然人自身抗原CYP2D6的免疫原性. 能为部分自身免疫性肝炎患者血清所特异识别, 为建立新的自身免疫性肝炎抗体检测方法奠定了基础.
AIH是一类以自身免疫反应为基础, 以高丙种球蛋白血症、高血清自身抗体为特征的肝脏炎症性病变. 抗1型肝肾微粒体(LKM-1)抗体是2型AIH的标志性自身抗体, 对其疾病的诊断具有重要价值.
目前研究重点是生产出合适的、具有抗原活性的CYP2D6蛋白抗原, 以开发出自身抗体检测诊断试剂盒.
本文是在总结和应用国内外相关研究的基础上, 将CYP2D6蛋白的优势片段首次采用酿酒酵母Y258用真核表达方法生产出特异、具抗原活性的重组抗原, 为自身免疫性肝炎的诊断提供物质基础.
通过研究表明, CYP2D6优势片段的重组蛋白具有良好的抗原性、特异性, 可以作为抗1型肝肾微粒体(LKM-1)抗体检测的底物.
电编: 张敏 编辑:潘伯荣
| 1. | Berdal JE, Ebbesen J, Rydning A. Incidence and prevalence of autoimmune liver diseases. Tidsskr Nor Laegeforen. 1998;118:4517-4519. [PubMed] |
| 2. | Boberg KM, Aadland E, Jahnsen J, Raknerud N, Stiris M, Bell H. Incidence and prevalence of primary biliary cirrhosis, primary sclerosing cholan-gitis, and autoimmune hepatitis in a Norwegian population. Scand J Gastroenterol. 1998;33:99-103. [PubMed] [DOI] |
| 3. | Manns MP, Strassburg CP. Autoimmune hepatitis: clinical challenges. Gastroenterology. 2001;120:1502-1517. [PubMed] [DOI] |
| 4. | Czaja AJ. Drug therapy in the management of type 1 autoimmune hepatitis. Drugs. 1999;57:49-68. [PubMed] [DOI] |
| 5. | Obermayer-Straub P, Strassburg CP, Manns MP. Autoimmune hepatitis. J Hepatol. 2000;32:181-197. [PubMed] [DOI] |
| 6. | Mizutani T, Shinoda M, Tanaka Y, Kuno T, Hattori A, Usui T, Kuno N, Osaka T. Autoantibodies against CYP2D6 and other drug-metabolizing enzymes in autoimmune hepatitis type 2. Drug Metab Rev. 2005;37:235-252. [PubMed] [DOI] |
| 7. | Ballot E, Homberg JC, Johanet C. Antibodies to soluble liver antigen: an additional marker in type 1 auto-immune hepatitis. J Hepatol. 2000;33:208-215. [PubMed] [DOI] |
| 8. | Zachou K, Rigopoulou E, Dalekos GN. Autoantibo-dies and autoantigens in autoimmune hepatitis: important tools in clinical practice and to study path-ogenesis of the disease. J Autoimmune Dis. 2004;1:2. [PubMed] [DOI] |
| 9. | Dalekos GN, Wedemeyer H, Obermayer-Straub P, Kayser A, Barut A, Frank H, Manns MP. Epitope mapping of cytochrome P4502D6 autoantigen in patients with chronic hepatitis C during alpha-interferon treatment. J Hepatol. 1999;30:366-375. [PubMed] [DOI] |
| 10. | Loeper J, Louerat-Oriou B, Duport C, Pompon D. Yeast expressed cytochrome P450 2D6 (CYP2D6) exposed on the external face of plasma membrane is functionally competent. Mol Pharmacol. 1998;54:8-13. [PubMed] |
| 11. | Muratori L, Parola M, Ripalti A, Robino G, Muratori P, Bellomo G, Carini R, Lenzi M, Landini MP, Albano E. Liver/kidney microsomal antibody type 1 targets CYP2D6 on hepatocyte plasma membrane. Gut. 2000;46:553-561. [PubMed] [DOI] |
| 12. | Manns MP, Griffin KJ, Sullivan KF, Johnson EF. LKM-1 autoantibodies recognize a short linear sequence in P450IID6, a cytochrome P-450 monooxygenase. J Clin Invest. 1991;88:1370-1378. [PubMed] [DOI] |
| 13. | Kyriakou DS, Alexandrakis MG, Zachou K, Passam F, Stathakis NE, Dalekos GN. Hemopoietic progenitor cells and bone marrow stromal cells in patients with autoimmune hepatitis type 1 and primary biliary cirrhosis. J Hepatol. 2003;39:679-685. [PubMed] [DOI] |
| 14. | Czaja AJ, Homburger HA. Autoantibodies in liver disease. Gastroenterology. 2001;120:239-249. [PubMed] [DOI] |
| 15. | Yamamoto AM, Cresteil D, Boniface O, Clerc FF, Alvarez F. Identification and analysis of cytochrome P450IID6 antigenic sites recognized by anti-liver-kidney microsome type-1 antibodies (LKM1). Eur J Immunol. 1993;23:1105-1111. [PubMed] [DOI] |
| 16. | Klein R, Zanger UM, Berg T, Hopf U, Berg PA. Overlapping but distinct specificities of anti-liver-kidney microsome antibodies in autoimmune hepatitis type II and hepatitis C revealed by recombinant native CYP2D6 and novel peptide epitopes. Clin Exp Immunol. 1999;118:290-297. [PubMed] [DOI] |
| 17. | Kerkar N, Choudhuri K, Ma Y, Mahmoud A, Bogdanos DP, Muratori L, Bianchi F, Williams R, Mieli-Vergani G, Vergani D. Cytochrome P4502D6(193-212): a new immunodominant epitope and target of virus/self cross-reactivity in liver kidney microsomal autoantibody type 1-positive liver disease. J Immunol. 2003;170:1481-1489. [PubMed] [DOI] |
| 18. | Imaoka S, Obata N, Hiroi T, Osada-Oka M, Hara R, Nishiguchi S, Funae Y. A new epitope of CYP2D6 recognized by liver kidney microsomal autoanti-body from japanese patients with autoimmune hepatitis. Biol Pharm Bull. 2005;28:2240-2243. [PubMed] [DOI] |
| 19. | Bakker-Jonges LE, ter Borg PC, van Buuren HR, Hooijkaas H. A retrospective study on the role of antibodies against soluble liver antigen (anti-SLA antibodies) and other autoantibodies in the diagnostics of autoimmune hepatitis. Ned Tijdschr Geneeskd. 2006;150:490-494. [PubMed] |
| 20. | Guidi M, Muratori P, Granito A, Muratori L, Pappas G, Bianchi FB. Significance of non-organ-specific autoantibodies in HCV-related chronic hepatitis. Recenti Prog Med. 2005;96:589-593. [PubMed] |
| 21. | Monti V, Aghemo A, Rumi MG, Donato MF, Del Ninno E, Colombo M. The prevalence, clinical features and response to antiviral therapy of patients with chronic hepatitis C who are seropo-sitive for liver-kidney microsome type 1 antibodies. Antivir Ther. 2005;10:715-720. [PubMed] |
| 22. | Diamantis I, Boumpas DT. Autoimmune hepatitis: evolving concepts. Autoimmun Rev. 2004;3:207-214. [PubMed] [DOI] |
| 23. | Dalekos GN, Obermayer-Straub P, Bartels M, Maeda T, Kayser A, Braun S, Loges S, Schmidt E, Gershwin ME, Manns MP. Cytochrome P450 2A6: a new hepatic autoantigen in patients with chronic hepatitis C virus infection. J Hepatol. 2003;39:800-806. [PubMed] [DOI] |
| 24. | Dalekos GN, Zachou K, Liaskos C, Gatselis N. Autoantibodies and defined target autoantigens in autoimmune hepatitis: an overview. Eur J Intern Med. 2002;13:293-303. [PubMed] [DOI] |
| 25. | Kitazawa E, Igarashi T, Kawaguchi N, Matsushima H, Kawashima Y, Hankins RW, Miyakawa H. Differences in anti-LKM-1 autoantibody immuno-reactivity to CYP2D6 antigenic sites between hepatitis C virus-negative and -positive patients. J Autoimmun. 2001;17:243-249. [PubMed] [DOI] |
| 26. | Miyakawa H, Kitazawa E, Kikuchi K, Fujikawa H, Kawaguchi N, Abe K, Matsushita M, Matsushima H, Igarashi T, Hankins RW. Immunoreactivity to various human cytochrome P450 proteins of sera from patients with autoimmune hepatitis, chronic hepatitis B, and chronic hepatitis C. Autoimmunity. 2000;33:23-32. [PubMed] [DOI] |