修回日期: 2006-02-01
接受日期: 2006-02-13
在线出版日期: 2006-04-18
目的: 建立多聚酶链式反应-限制性片段长度多态分析(PCR-RFLP)法检测转化生长因子β1(TGF-β1)启动子区C-509T位点的变异并探讨其在肝纤维化中的作用.
方法: 根据TGF-β1启动子区基因设计引物, 在C-509T位设计Bsu36 Ⅰ酶切位点, 根据PCR产物酶切结果判断该位点为C或T. 观察对象为慢性乙型肝炎患者50例, 乙型肝炎后肝硬化患者46例.
结果: 测序显示本文两株纯合子与TGF-β1启动子区序列同源性在99%以上, 并在C-509T位点出现预期变异; 乙型肝炎和乙型肝炎后肝硬化两组都是以CT基因型为主, 但是肝硬化组CC基因型(28.3%)高于TT基因型(19.6%),而肝炎组TT基因型(22%)高于CC基因型(4%), 几组之间有显著性差异(P<0.01).
结论: 本文建立的方法可用于TGF-β1启动子区C-509T位点基因多态性的检测, 该位点CC基因型可能与肝纤维化有关.
引文著录: 黄玉波, 魏红山, 董庆鸣, 刘志英, 郭晶晶, 成军, 毛羽. 转化生长因子β1启动子区C-509T位点基因多态性与肝纤维化关系. 世界华人消化杂志 2006; 14(11): 1093-1096
Revised: February 1, 2006
Accepted: February 13, 2006
Published online: April 18, 2006
AIM: To establish a polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) method to detect the polymorphism of C-509T at the promoter region of transforming growth factor (TGF) β1 gene and explore its probable role in liver fibrosis.
METHODS: Patients with chronic hepatitis B (n = 50) and liver cirrhosis (n = 46) were involved in this study. A polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) was established. A set of primers was designed according to the promoter region of TGF-β1 gene. Around C-509T was the enzyme digestion site for restriction endonuclease Bsu36Ⅰ. C or T was assured based on the enzymatic result of the polymerase chain reaction (PCR) products.
RESULTS: Sequencing revealed 99% homogeneity between the two homozygous strains and the promoter region of TGF-β1 gene. The anticipated mutations appeared at position C-509T. The CT genotype prevailed in both the hepatitis and the liver fibrosis patients. The frequency of CC genotype (28.3%) was higher than that (19.6%) of TT genotype in liver fibrosis patients while the frequency of TT genotype (22%) was higher than that (4%) of CC genotype in hepatitis patients. There were significant differences between all the groups (P < 0.01).
CONCLUSION: The established method may be applied to detect the C-509T polymorphism at the promoter region of TGF-β1 gene. The CC genotype may be involved in liver fibrosis.
- Citation: Huang YB, Wei HS, Dong QM, Liu ZY, Guo JJ, Cheng J, Mao Y. Polymorphism of C-509T at promoter region of transforming growth factor β1 gene might be related to liver fibrosis. Shijie Huaren Xiaohua Zazhi 2006; 14(11): 1093-1096
- URL: https://www.wjgnet.com/1009-3079/full/v14/i11/1093.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i11.1093
近年研究表明, 转化生长因子β(TGF-β)是与肝纤维化发病密切相关的关键细胞因子[1-2], 而且可以通过刺激细胞外基质的合成并抑制其降解而促进肝纤维化的形成[3-4]. TGF-β1基因位于人类染色体19q13, 包含6个内含子和7个外显子, 他的启动子区有2个重要位点来启动转录并具有多种调节机制, 基因启动子区多态现象可引起转录异常, 从而影响疾病的产生或严重程度, C-509T位点是其中的一个[5]. 而且C-509T基因多态性与血清中TGF-β的浓度显著相关[6]. 为此, 我们建立了多聚酶链式反应-限制性片段长度多态分析(PCR-RFLP)法检测C-509T位点的变异, 并探讨其在肝纤维化中的作用.
观察对象为2004-06-12北京地坛医院住院的慢性乙型肝炎患者50例, 男女各25例, 年龄35±5岁, 乙型肝炎后肝硬化患者46例, 男女各23例, 年龄45±6岁. 病例的诊断标准符合2000年西安第十次全国病毒性肝炎及肝病学术会议制定的《病毒性肝炎防治方案》. Taq聚合酶为上海生工生物工程公司产品, 100 bp DNA ladder和Bsu36Ⅰ内切酶为Promega公司产品, ReadyPCRTM全血基因组DNA纯化系统为华美生物工程公司产品, 质粒提取采用Sigma公司GenElute Plasmid Miniprep Kit. PCR仪为ABI公司9700型. 根据设计引物, C-509T位点位于两个引物之间. 由北京赛百盛公司合成. 引物序列如下: P1: 5'-TGAGTGACAGGAGGCTGCTTA-3'; P2: 5'-AGAACGGAAGGAGAGTCAGGCT-3'. 扩增产物为257 bp.
外周血白细胞基因组的提取, 采用华美生物工程公司ReadyPCRTM全血基因组DNA纯化系统, 严格按照试剂盒说明书操作. PCR系统含10×缓冲液3 μL, 25 mmol dNTPs 0.4 μL, 25 μmol/L P1和P2各0.5 μL, Taq聚合酶2 U, 血清提取物4 μL, 反应总体积为30 μL. 循环条件: 94 ℃预变性3 min, 94 ℃ 20 s, 55 ℃ 20 s, 72 ℃ 30 s, 共35个循环, 最后, 72 ℃延伸7 min. 取扩增产物8 μL经30 g/L琼脂糖凝胶(含1 g/L EB)电泳, 在198 bp处出现荧光带者为阳性. PCR产物酶切: Bsu36Ⅰ酶切位点为CC'TNAGG, 如果C-509T位点为C, 则产生Bsu36Ⅰ酶切位点, 如果为T, 则切不开. 取PCR产物8.5 μL, 10×缓冲液D 1 μL, Bsu36Ⅰ0.5 μL(5 U), 37 ℃酶切16 h. 取酶切产物10 μL经30 g/L琼脂糖凝胶电泳, 只在198 bp处出现条带者为TT纯合子, 在108 bp和90 bp处出现条带者为CC纯合子, 在以上3个位置均有条带者TC杂合子. PCR产物的分子克隆与测序: 分别取CC纯合子(命名为DT-C-509)和TT纯合子(DT-509T)的PCR产物, 用低熔点琼脂糖凝胶电泳分离纯化, 直接与T-easy载体连接, 转化XL-1-Blue细菌, PCR筛选阳性克隆, 提取质粒, 采用通用引物, 经双脱氧链末端终止法进行双向测序(由上海申能搏彩公司完成). DNA序列资料采用Vector NTI 9.0软件包及GeneDoc 2.6分析.
统计学处理 SPSS10.0 for Windows软件包, 计数资料组间差异采用χ2检验分析, P<0.05认为组间有显著差异.
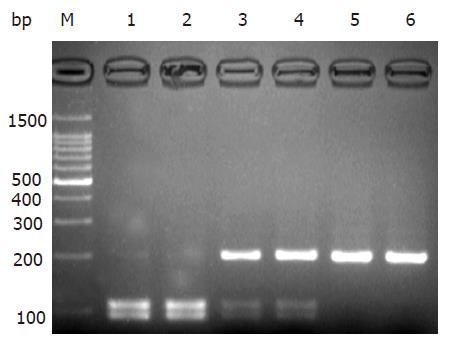
分别取CC纯合子、CT杂合子和TT纯合子阳性标本Bsu36Ⅰ酶切产物各两份经30 g/L琼脂糖凝胶电泳, 结果与预期相符(图1).
将DT-C-509、DT-509T和TFG-β1启动子区基因(GenBank注册号: J04431)相应序列进行比对发现, DT-C-509确为CC纯合子, DT-509T确为TT纯合子, 序列同源性在99%以上(图2).
检测50例肝炎和46例肝硬化患者外周血白细胞基因组TGF-β1启动子区C-509T位点多态性发现两组都是以CT基因型为主, 但是肝硬化组CC基因型(28.3%)高于TT基因型(19.6%), 而肝炎组TT基因型(22%)高于CC基因型(4%), 几组之间有显著性差异(P<0.01). 但是等位基因两组间并未显示出有何差异(P>0.05, 表1).
| 基因型 | 肝炎 | 肝硬化 |
| CC | 2(4) | 13(28.3) |
| TT | 11(22) | 9(19.6) |
| CT | 37(74) | 24(52.2) |
| C等位基因 | 39(44.8) | 37(52.9) |
| T等位基因 | 48(55.2) | 33(47.1) |
慢性肝炎是我国的常见病, 威胁着很多人的健康, 大多数患者会发展成肝纤维化或肝硬化. 肝纤维化是指肝脏内纤维性结缔组织异常增生, 是一种"创伤愈合"的慢性渐进的病理过程, 其机制为细胞外基质(ECM)的合成与降解失调, 病理特征为胶原纤维生成及大量细胞外基质在disse间隙沉积. 他是肝硬化的早期阶段和必经阶段, 在一定情况下可被逆转, 但若病因持续存在, 肝纤维化逐渐加重, 肝小叶及血管等逐渐被改建, 肝脏的正常结构遭到破坏, 中心静脉区和汇管区出现间隔、假小叶形成, 即发展为不可逆转的肝硬化. ECM主要来源于肝星状细胞(hepatic stellate cell, HSC), HSC由正常静止状态被激活, 转变成肌成纤维细胞(myofibroblast-like cells, MFBs)和成纤维细胞(fibroblast), 是肝纤维化发生的中心环节. 研究表明, ECM的合成和降解过程很大程度上由TGF-β1控制. TGF-β1是细胞因子TGF-β超家族成员之一, 最初是1970年代末从血小板中分离出来的, 因其能促进成纤维细胞的转化生长而得名. 在人体的结缔组织、肝、肾、脑、皮肤、肌肉等组织都有其表达. 目前, TGF-β至少有6种亚型, 在哺乳动物中只发现3种亚型. TGF-β是一种有多重功能的细胞因子, 可以调节细胞增殖、分化、细胞外基质的产生、伤口愈合和组织修复[7]. 多种器官纤维化、硬化、动脉粥样硬化等都与之有关. TGF-β1活化后与细胞膜表面受体结合, 激活Smad蛋白并形成复合物, 由此转入核内, 与各种转录因子相结合, 从而调控基因转录. 但是TGF-β1本身的表达也受其基因启动子区的调控. C-509T位点是其中的1个.
有研究表明, TGF-β1基因调控区C-509T基因多态性与阿尔茨默病[8]、浸润性乳腺癌、慢性牙周炎、哮喘、IgE增高、IgA肾病等多种疾病的发生或进展程度相关. 我们发现, 乙型肝炎和乙型肝炎后肝硬化患者C-509T位点都是以CT基因型为主, 但是肝硬化组CC基因型高于TT基因型, 而肝炎组TT基因型高于CC基因型, 但是等位基因两组间并未显示出有何差异. 这与目前国内外研究结果较为一致. 杨再兴et al[9]根据Child Pugh分级标准, 将肝纤维化人群分为A级、B级和C级, A级到C级肝纤维化程度逐渐加重. 结果发现, 该位点的多态性与肝纤维化的严重程度存在相关性. CC基因型在Child-Pugh分级的C级组中的分布频率显著高于TT基因型. 而且, 在患者中, 等位基因C以及基因型CC的分布频率随肝纤维化程度的加重而升高. 认为, 该多态性影响肝纤维化患者血浆中TGF-β1的浓度, 该位点等位基因C可能是影响肝纤维化进展程度的一个重要的遗传因素. Kim et al[10]发现在慢性乙型肝炎患者中C-509T位点TT或CT基因型发生肝细胞癌的危险性显著低于CC基因型.
总之, 我们发现TGF-β1基因调控区C-509T位点CC基因型可能与肝纤维化有关, 具体情况如何, 还需要进行更大样本的临床流行病学研究
TGF-β可以刺激间质细胞分泌细胞外基质, 在组织纤维化发生过程中具有关键性调控作用. 慢性乙型肝炎为我国最常见的传染病, 进展性肝纤维化是决定患者预后的关键因素之一. 但TGF-β基因多态性与HBV感染后肝硬化之间的关系仍未明确.
目前的研究显示TGF-β1基因有8个位点存在多态性, 其中3个位于启动子区, 3个位于编码区. 编码区, 如第25位密码子突变发现与HCV感染后肝纤维化发生有关, 但非编码区多态性与纤维化相关资料缺乏.
近期Drumm et al报道TGF-β1基因启动子区C-509T位点多态性与囊性纤维化发生显著相关.
本研究对我国慢性HBV感染及HBV感染后肝硬化患者TGF-β1基因启动子区C-509T位点多态性与肝硬化之间的可能关系进行了探讨.
编辑: 潘伯荣 电编:张敏
| 1. | Friedman SL. Seminars in medicine of the Beth Israel Hospital, Boston. The cellular basis of hepatic fibrosis. Mechanisms and treatment strategies. N Engl J Med. 1993;328:1828-1835. [PubMed] |
| 2. | Shin JY, Hur W, Wang JS, Jang JW, Kim CW, Bae SH, Jang SK, Yang SH, Sung YC, Kwon OJ. HCV core protein promotes liver fibrogenesis via up-regulation of CTGF with TGF-beta1. Exp Mol Med. 2005;37:138-145. [PubMed] |
| 3. | Blobe GC, Schiemann WP, Lodish HF. Role of tran-sforming growth factor beta in human disease. N Engl J Med. 2000;342:1350-1358. [PubMed] |
| 4. | Bachem MG, Meyer D, Melchior R, Sell KM, Gressner AM. Activation of rat liver perisinusoidal lipocytes by transforming growth factors derived from myofibroblastlike cells. A potential mechanism of self perpetuation in liver fibrogenesis. J Clin Invest. 1992;89:19-27. [PubMed] |
| 5. | Derynck R, Rhee L, Chen EY, Van Tilburg A. Intron-exon structure of the human transforming growth factor-beta precursor gene. Nucleic Acids Res. 1987;15:3188-3189. [PubMed] |
| 6. | Grainger DJ, Heathcote K, Chiano M, Snieder H, Kemp PR, Metcalfe JC, Carter ND, Spector TD. Genetic control of the circulating concentration of transforming growth factor type beta1. Hum Mol Genet. 1999;8:93-97. [PubMed] |
| 7. | Moustakas A, Heldin CH. Non-Smad TGF-beta signals. J Cell Sci. 2005;118:3573-3584. [PubMed] |
| 8. | Luedecking EK, DeKosky ST, Mehdi H, Ganguli M, Kamboh MI. Analysis of genetic polymorphisms in the transforming growth factor-beta1 gene and the risk of Alzheimer's disease. Hum Genet. 2000;106:565-569. [PubMed] |
| 10. | Kim YJ, Lee HS, Im JP, Min BH, Kim HD, Jeong JB, Yoon JH, Kim CY, Kim MS, Kim JY. Association of transforming growth factor-beta1 gene polymorphisms with a hepatocellular carcinoma risk in patients with chronic hepatitis B virus infection. Exp Mol Med. 2003;35:196-202. [PubMed] |