修回日期: 2005-10-29
接受日期: 2005-10-31
在线出版日期: 2006-01-08
目的: 探讨内毒素(LPS)致幼鼠肠组织NO、MDA的作用及基因重组肠三叶因子(recombinant intestinal trefoil factor, rITF)的保护作用.
方法: Wistar幼鼠10日龄96只分为A组: 生理盐水对照组, B组: LPS组, C组:LPS+rITF组, 每组32只. 以生理盐水(1 mL /kg), EcoliO55: B5 (1 mL /kg)、5 g/L rITF(0.1 mL)ip后2, 6, 24, 72 h处死动物, 留取肠组织生化法检测NO, MDA含量, PCR法检测诱导型一氧化氮合酶(iNOS)mRNA表达, 同时作电镜观测肠组织超微结构变化.
结果: B组NO和MDA含量明显高于A组, LPS作用后6, 24 h达高峰(NO 24 h: 55.25±7.30 vs 6.25±2.05, P< 0.01; MDA 6 h: 7.60±1.14 vs 5.01±0.74, P<0.01). C组NO和MDA含量明显降低, 其中6, 24 h组NO较B组下降, 但仍高于A组, 差异显著(P<0.05或P<0.01),至72 h基本降至正常; 6, 24 h组MDA含量较B组下降(P<0.01), 较A组无差异, 至72 h基本降至正常. iNOS mRNA在A组各时间点均有微弱的表达, 在B组6, 24 h时表达明显增强(1.17±0.15 vs 0.31±0.08, P<0.01; 1.24±0.18vs 0.30±0.05, P<0.01), 较A组差异显著; 而C组2, 72 h iNOS mRNA微弱表达, 6, 24 h时表达明显减少(0.91±0.13, 0.96±0.15), 较B组差异显著(P<0.01). B组超微结构改变明显, 而C组较B组超微结构有不同程度减轻.
结论: LPS可致幼鼠肠组织NO和MDA含量增加及诱导iNOS mRNA表达增加, rITF可抑制iNOS mRNA表达而减少NO含量, 同时降低MDA含量, 发挥对肠损伤的保护作用.
引文著录: 李军, 赵亚娟, 孙梅, 潘莉莉, 高红. 肠三叶因子对内毒素诱导幼鼠肠组织NO和MDA的作用. 世界华人消化杂志 2006; 14(1): 63-67
Revised: October 29, 2005
Accepted: October 31, 2005
Published online: January 8, 2006
AIM: To investigate the effects of recombinant intestinal trefoil factor (rITF) on the expression of nitric oxide (NO) and malondialdehyde (MDA) induced by lipopolysaccharide (LPS) in infant rats.
METHODS: Ninety-six 10-day-old Wistar rats were divided into 3 groups. The rats in group A served as normal controls and were injected with normal saline (1 mL/kg) intraperioneally. The rats in group B and C were intraperioneally treated with LPS (1 mL/kg) and LPS (1 mL/kg) plus rITF (5 g/L, 0.1 mL), respectively. Intestinal tissues were collected at 2, 6, 24, and 72 h for the examination of NO, MDA productions, iNOS mRNA expression and intestinal histological changes.
RESULTS: In comparison with group A, the NO and MDA contents were significantly increased in Group B and reached the peak 6 or 24 h after LPS administration (NO 24 h: 55.25 ± 7.30 vs 6.25 ± 2.05, P < 0.01; MDA 6 h: 7.60 ± 1.14 vs 5.01 ± 0.74, P < 0.01) respectively. As compared with group B, the NO were decreased in group C (P < 0.05 or P < 0.01), but still sustained a higher level than that in group A at 6 and 24 h, which attained normal at 72 h; the content of MDA were decreased than that in group B (P < 0.01) and had no discrepancy with that in group A (P > 0.05) at 6 and 24 h. iNOS mRNA was weakly expressed in group A, but significantly increased in group B at 6 and 24 h (1.17 ± 0.15 vs 0.31 ± 0.08, P < 0.01; 1.24 ± 0.18vs 0.30 ± 0.05, P < 0.01). The expression of iNOS mRNA at 6 and 24 h in group C (0.91 ± 0.13, 0.96 ± 0.15) was markedly decreased that that in group B (P < 0.01). The pathological changes in group C alleviated notably than those in group B.
CONCLUSION: LPS can induce the increase of NO, MDA and expression of iNOS mRNA in intestinal tissues of infant rats, and rITF can protect intestine against injury through decreasing the contents of NO and MDA and inhibiting the expression of iNOS mRNA.
- Citation: Li J, Zhao YJ, Sun M, Pan LL, Gao H. Effects of recombinant intestinal trefoil factor on endotoxin-induced expression of nitric oxide and malondialdehyde in intestinal tissues of infant rats. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 63-67
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/63.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.63
小儿胃肠功能障碍被认为是多器官功能衰竭的始动因子, 发病与内毒素血症和肠屏障功能密切相关, 常提示病情加重和预后不良. 而肠三叶因子(intestinal trefoil factor, ITF)是近年发现的新型表皮生长因子, 对肠黏膜屏障具有保护作用, 在胃肠道的损伤修复及胃肠的先天性免疫中有重要的作用[1,2]. 近年来受到广泛关注, 但多局限于烧伤及溃疡性结肠炎的研究, 对幼鼠炎症性肠损伤是否有保护作用, 报道甚少. 我们应用内毒素致肠损伤, 探讨ITF的保护作用.
Wistar幼鼠10日龄, 体质量18-30 g, 96只, 由中国医科大学第二临床医院动物室提供. 分为A组: 生理盐水组(1 mL/kg). B组: 内毒素组EcoliO55: B5(LPS 1 mL/kg, Sigma公司, 用生理盐水配制成5 g/L). C组: 内毒素+三叶因子组(LPS 1 mL/kg+rITF 0.1 mL/只), rITF(基因重组小肠三叶因子rITF由北京大学蛋白质工程及植物基因工程国家重点实验室提供). 每组32只. 三组幼鼠ip后放回母鼠笼内继续哺乳, 至2, 6, 24, 72 h分别断头处死动物, 留取近回盲部肠组织约1-2 cm放于25 g/L戊二醛中固定, 备作电镜检测, 其余肠组织放于-80 ℃液氮中保存, 以备生化法检测NO, MDA含量及PCR法检测iNOS mRNA表达.
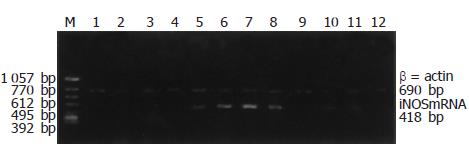
从液氮中取出肠组织立即称质量, 加入生理盐水后在冰浴中用超声波匀浆机充分匀浆, 以3 500 r/min 4 ℃离心, 制备100 g/L肠组织匀浆液; 采用生化方法检测肠组织匀浆液中NO, MDA含量. 采用考马斯亮兰法测定匀浆液中蛋白含量(g/L), 生化检测试剂盒均购于南京建成生物工程研究所, 按试剂盒说明操作进行检测. iNOS mRNA表达: 提取总RNA后行RT-PCR, 扩增产物经20 g/L琼脂糖凝胶电泳分析后, 紫外灯下观察RT-PCR产物并拍照, 用Kodak ID型凝胶成像系统输入计算机, 以该软件进行扩增产物的半定量分析. iNOS扩增片断为418 bp, 引物: 上游 5-CTACCTACCTGGGGAACACCTGGGG-3; 下游5-GGAGGAGCTGATGGAGTAGTAGCGG-3; β-actin: 上游5-GATTGCTCAGGACATYYCTG-3; 下游5-GATTGCTCAGGACATTT-3. iNOS引物和内参照β-actin引物均由上海博亚生物技术有限公司合成. 反转录和PCR扩增所需要的酶及其他试剂均购自日本TaKaRa公司. 常规行透射电镜观察肠组织超微结构变化.
统计学处理 所有数据以mean±SD表示, SPSS12.0统计软件进行方差分析, 组间比较采用q检验, P<0.05为有显著性差异.
B组动物在ip LPS后0.5 h即出现懒动, 随之出现口唇、皮毛青紫、呼吸急促、精神萎靡、吃奶少; 1-2 h出现腹泻, 腹胀明显, 至6 h上述症状明显加重, 成活鼠24 h观察其体质量不增或明显下降, 临床症状部分缓解. LPS后72 h观察青紫、呼吸状态好转, 部分体重可恢复至用药前, 死亡率约20%. 而C组上述临床症状较B组轻, 而且出现的时间较B组晚, 体质量下降少或无明显下降, 死亡率约10%, A组鼠活泼、吃奶好、体质量增加明显, 无死亡.
B组动物在ip LPS后2 h可见肠管、肠系膜轻度充血肿胀, 6 h时可见充血肿胀明显, 有胃潴留, 部分肠管扩张, 肠腔内有出血; 24 h仍有胃潴留及肠管充血, 72 h上述症状有好转. C组以上症状较B组轻, A组无明显变化.
内毒素作用后2 h见NO明显增加, 致24 h达高峰, 72 h NO明显减少, 其中6, 24 h组NO含量较A组明显增加(P<0.01). C组较B组NO含量于6, 24 h明显减少(P<0.05和P<0.01), 但仍高于A组(P<0.01), 至72 h下降与A, B组无差异(表1), B组肠组织MDA含量明显增加, 其中6, 24 h组较A组增加明显(P<0.01), 并于6 h达高峰, 72 h组下降较A组无差异; C组较B组MDA含量明显下降, 其中6, 24 h组差异显著(P<0.01), 72 h组下降较B组无差异(表1). iNOS mRNA在A组各时间点均有微弱的表达, B组各时间点iNOS mRNA表达较A组明显增强, 其中6,24 h组较A组差异显著(P<0.01)(图1), 并于24 h表达最强. 而C组2, 72 h iNOS mRNA表达微弱; 6, 24 h时表达明显减少, 各时间点iNOSmRNA表达较B组差异显著(P<0.01)(表1).
| 指标 | 2 h | 6 h | 24 h | 72 h | |
| NO(μmoL/g) | A | 4.50±0.93 | 5.75±1.67 | 6.25±2.05 | 5.25±1.16 |
| B | 11.25±3.62 | 39.13±7.64d | 55.25±7.30d | 13.25±4.53 | |
| C | 9.25±2.25 | 30.88±5.19ad | 42.50±9.30db | 8.38±3.38 | |
| MDA(μmoL/g) | A | 4.75±0.46 | 5.01±0.74 | 5.12±0.25 | 5.25±0.53 |
| B | 5.18±0.54 | 7.60±1.14d | 7.34±1.23d | 5.55±0.77 | |
| C | 5.07±0.36 | 5.59±0.38b | 5.41±0.36b | 5.66±0.46 | |
| INOSmRNA(iNOS/β-actin积分A比值) | A | 0.31±0.09 | 0.31±0.08 | 0.30±0.05 | 0.29±0.04 |
| B | 0.99±0.22d | 1.17±0.15d | 1.24±0.18d | 0.97±0.21d | |
| C | 0.31±0.11b | 0.91±0.13db | 0.96±0.15db | 0.29±0.05b |
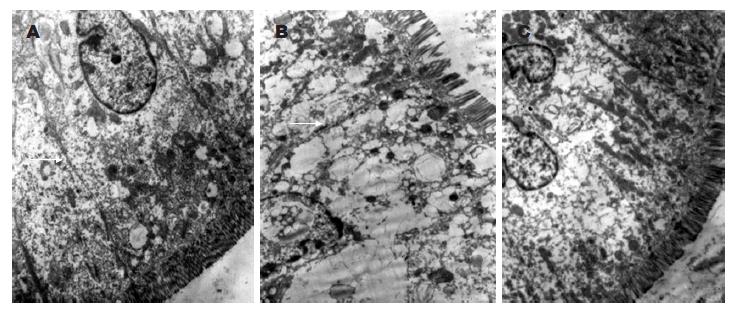
正常肠上皮细胞可见肠绒毛排列整齐, 紧密连接完整, 内质网及线粒体清晰; 内毒素作用下线粒体呈空泡样改变, 微绒毛排列不整、部分断裂、缺失, 部分紧密连接增宽或断裂, 细胞核浓缩, 染色质边聚; 肠三叶因子组肠组织损伤较内毒素组减轻(图2).
感染是儿科常见病之一, 其危重症常伴发胃肠功能障碍, 发病机制与内毒素和肠黏膜屏障功能密切相关. 内毒素血症可通过缺氧、炎症介质释放、自由基增多使肠黏膜屏障受损, 大量细菌移位, 最终造成多器官功能衰竭, 甚至死亡[3]. 我们应用内毒素(LPS)ip引起幼鼠腹泻、腹胀及肠管充血水肿等胃肠功能紊乱症状, 电镜下见肠组织线粒体空泡、微绒毛损伤、紧密连接断裂证明内毒素可引起肠损伤. 研究表明LPS能降低上皮细胞的抵抗力、促进细胞凋亡的产生并疏松紧密连接而增加上皮细胞通透性, 促进细菌移位, 损伤肠黏膜屏障, 引起肠炎症改变, 包括固有层水肿, 绒毛结构的丢失, 炎性细胞浸润[4,5]. 在一定条件下还可激发细胞因子和其他炎性介质如TNF-α, IL-8, IL-1β, IL-6的连锁反应, 引起全身各器官的损害[6,7]. 炎症同时可引起组织缺血, 改变过氧化物酶体及线粒体内细胞色素氧化酶系统, 甚至改变一氧化氮合酶的活性而产生氧自由基, 同时消耗大量ATP. ATP不足使钙泵活性下降, 并阻碍呼吸链的传递, 介导质子过氧化反应, 促进氧自由基的形成, 进一步损伤细胞膜和结构[8]. 而质子过氧化物反应的最终产物MDA含量可间接反应组织氧自由基损害的程度.
我们的研究证明肠损伤时伴有NO、MDA升高, 同时iNOSmRNA表达增强, 在6,24 h明显, 电镜亦示明显损伤, 证明NO、MDA升高与肠损伤有一定的关系. NO是由L-精氨酸在一氧化氮合酶(NOS)作用下生成的, 其NOS分为三型, 神经型(nNOS)、内皮型(eNOS)和诱导型(iNOS), 前两者统称为结构型, 能诱导产生少量NO, 维持胃肠道的完整性, 发挥生理作用[9]. 而在LPS, TNF-α,IL-1β等作用下iNOS基因表达明显, 可诱导产生大量NO, 产生致炎和对细胞的损伤作用[10-13]. 过量的NO又可影响多种免疫活性物质的形成, 如TNF-α、IL-1、IL-2等, 引起局部和全身炎症反应, NO与O2-作用形成过氧化亚硝酸盐(peroxynitrite), 可使蛋白质或酶失活, 抑制呼吸链酶, 破坏线粒体结构, 启动质子过氧化反应, 引起肠组织损伤, 并使肠上皮细胞通透性增强[14-18]. 而抑制iNOS基因表达, 从而可以抑制NO的大量产生, 减轻组织及脏器损伤[19,20]. 在我们的研究中, 由于iNOSmRNA的表达使NO生成增多, 增强促炎性细胞因子的作用, 使肠组织细胞线粒体空泡状, 细胞间紧密连接不完整, 肠绒毛受损.
ITF是三叶肽家族成员之一, 由肠黏膜上皮杯状细胞分泌, 广泛存在于胃肠道, 能与黏液中黏蛋白结合, 形成稳定的凝胶复合物, 抵抗胃肠道胃酸, 蛋白酶和机械损伤, 从而增强了胃肠道黏膜屏障的防御能力[21,22]. 在胎龄20 d之后的鼠类及早产儿均有不同表达, 在胃肠道的先天防御上起一定的作用[23,24]. ITF可促进上皮细胞向损伤处的迁移, 被认为是内源性具有抗调亡特性的肽类物质[25,26]. 在肠道的自我保护和损伤后修复中占有重要地位. 口服和皮下注射ITF能预防和治疗乙醇和消炎痛引起的大鼠胃溃疡使胃溃疡指数下降, 并随剂量增加保护作用增强, 且不影响胃酸分泌[27,28]. 在实验性结肠炎模型中, 杯状细肠合成和分泌ITF, 维持肠黏膜上皮细胞的完整性并于炎症时发挥其黏膜修复作用. 敲除编码鼠ITF基因后, 小鼠由于肠道内缺乏ITF, 缺乏保护作用, 当饮用硫酸葡聚糖钠溶液时, 1/2死于结肠炎, 当给予口服重组ITF后肠黏膜损伤明显减轻[29-31]. 证明ITF对肠道损伤具有一定的保护作用[32-34]. 在我们的研究中给予外援性ITF可使肠组织损伤减轻, 并能降低肠组织NO, MDA含量, 同时降低iNOSmRNA表达, 抑制了过量产生的NO、MDA对肠组织的毒性作用, 电镜也同时观察到其线粒体、肠绒毛改变有好转, 因此, rITF对内毒素作用肠损伤有一定的保护作用, 与Giraud[35]研究相似.
我们的研究证明基因重组ITF通过下调iNOSmRNA表达使NO生成减少, 降低MDA的含量, 降低内毒素作用下幼鼠肠组织的炎症反应, 对肠黏膜损伤具有一定的防御作用, 为预防重症感染患儿胃肠道损伤提供了理论基础.
由各种原因引起的感染性疾病是儿科常见疾病, 严重感染可引起多器官功能衰竭, 胃肠功能障碍被认为是始动因子, 发病与内毒素血症和肠屏障功能障碍密切相关, 常提示病情加重和预后不良. 因此探讨炎症性肠损伤的发病机制, 寻求有效的治疗方法具有广泛的意义.
肠三叶因子(ITF)是近年发现的新型表皮生长因子, 具有促进细胞增殖与迁移, 增强黏膜屏障作用, 对肠黏膜具有保护和损伤后修复功能及抗凋亡作用. 在成人多局限于烧伤及溃疡性结肠炎的研究, 对新生鼠缺血缺氧造成的坏死性小肠炎也有保护作用.
在烧伤动物模型和新生鼠缺血缺氧模型中已证实ITF的保护作用. 敲除编码鼠ITF基因后, 小鼠由于肠道内缺乏ITF, 缺乏保护作用, 当饮用硫酸葡聚糖钠溶液时, 1/2死于结肠炎, 当给予口服重组ITF后肠黏膜损伤明显减轻.
1 彭曦、汪士良、陶麟辉、王风君、赵云、王裴. 肠三叶因子与严重烧伤后肠道损伤及修复关系. 第三军医大学学报 2000; 22: 1023-1025
本文的创新点,证明幼鼠内毒素作用下, 其肠损伤与NO和MDA 升高有一定的关系, 而ITF 可以降低NO和MDA的含量, 证明ITF的保护作用是通过抑制NO和MDA的产生而实现的.
ITF作为新型表皮生长因子之一, 对肠损伤有很好的保护作用, 在炎症性肠损伤的治疗方面有很好的应用前景.
本研究设计合理, 技术方法先进, 结果可靠, 结论可信, 为预防重症感染患儿胃肠道损伤提供了理论依据.
电编: 李琪 编辑:潘伯荣 审读:张海宁
| 1. | Viswanathan VK, Hecht G. Innate immunity and the gut. Current Opinion in Gastroenterology. 2000;16:546-551. |
| 2. | Mammen JMV, Matthews JB. Mucosal repair in the gastrointestinal tract. Crit Care Med. 2003;31:S532-S537. |
| 4. | Qureshi FG, Leaphart C, Cetin S, Li J, Grishin A, Watkins S, Ford HR, Hackam DJ. Increased expression and function of integrins in enterocytes by endotoxin impairs epithelial restitution. Gastroenterology. 2005;128:1012-1022. [PubMed] |
| 5. | Alscher KT, Phang PT, McDonald TE, Walley KR. Enteral feeding decreases gut apoptosis, permeability, and lung inflammation during murine endotoxemia. Am J Physiol Gastrointest Liver Physiol. 2001;281:G569-576. [PubMed] |
| 6. | Adams JK, Tepperman BL. Colonic production and expression of IL-4, IL-6, and IL-10 in neonatal suckling rats after LPS challenge. Am J Physiol Gastrointest Liver Physiol. 2001;280:G755-G762. [PubMed] |
| 7. | Wischmeyer PE, Kahana M, Wolfson R, Ren H, Musch MM, Chang EB. Glutamine reduces cytokine release, organ damage, and mortality in a rat model of endotoxemia. Shock. 2001;16:398-402. [PubMed] |
| 8. | Meneshian A, Bulkley GB. The physiology of endothelial xanthine oxidase: from urate catabolism to reperfusion injury to inflammatory signal transduction. Microcirculation. 2002;9:161-175. [PubMed] |
| 9. | Kubes P, McCafferty DM. Nitric oxide and intestinal inflammation. Am J Med. 2000;109:150-158. [PubMed] |
| 10. | Han X, Fink MP, Delude RL. Proinflammatory cytokines cause NO-dependent and-independent changes in expression and localization of tight junction proteins in intestinal epithelial cells. Shock. 2003;19:229-237. [PubMed] |
| 11. | Chamulitrat W, Skrepnik NV. Spitzer JJ. Endotoxin-induced oxidative stress in the rat small intestine: role of nitric oxide. Shock. 1996;5:217-222. [PubMed] |
| 12. | Di Lorenzo M, Krantis A. Nitric oxide synthase isoenzyme activities in a premature piglet model of necrotizing enterocolitis: effects of nitrergic manipulation. Pediatr Surg Int. 2002;18:624-629. [PubMed] |
| 13. | Nadler EP, Dickinson E, Knisely A, Zhang XR, Boyle P, Beer-Stolz D, Watkins SC, Ford HR. Expression of inducible nitric oxide synthase and interleukin-12 in experimental necrotizing enterocolitis. J Surg Res. 2000;92:71-77. [PubMed] |
| 14. | Morin MJ, Karr SM, Faris RA, Gruppuso PA. Developmental variability in expression and regulation of inducible nitric oxide synthase in rat intestine. Am J Physiol Gastrointest Liver Physiol. 2001;281:G552-G559. [PubMed] |
| 15. | Hogaboam CM, Jacobson K, Collins SM, Blennerhassett MG. The selective beneficial effects of nitric oxide inhibition in experimental colitis. Am J Physiol. 1995;268:G673-G684. [PubMed] |
| 16. | Potoka DA, Nadler EP, Upperman JS, Ford HR. Role of nitric oxide and peroxynitrite in gut barrier failure. World J Surg. 2002;26:806-811. [PubMed] |
| 17. | Ford H, Watkins S, Reblock K, Rowe M. The role of inflammatory cytokines and nitric oxide in the pathogenesis of necrotizing enterocolitis. J Pediatr Surg. 1997;32:275-282. [PubMed] |
| 18. | Forsythe RM, Xu DZ, Lu Q, Deitch EA. Lipopolysa-ccharide-induced enterocyte-derived nitric oxide induces intestinal monolayer permeability in an autocrine fashion. Shock. 2002;17:180-184. [PubMed] |
| 19. | Southey A, Tanaka S, Murakami T, Miyoshi H, Ishizuka T, Sugiura M, Kawashima K, Sugita T. Pathophysiological role of nitric oxide in rat experimental colitis. Int J Immunopharmacol. 1997;19:669-676. [PubMed] |
| 20. | Unno N, Wang H, Menconi MJ, Tytgat SH, Larkin V, Smith M, Morin MJ, Chavez A, Hodin RA, Fink MP. Inhibition of inducible nitric oxide synthase ameliorates endotoxin-induced gut mucosal barrier dysfunction in rats. Gastroenterology. 1997;113:1246-1257. [PubMed] |
| 22. | Renes IB, Verburg M, Van Nispen DJ, Taminiau JA, Buller HA, Dekker J, experimental colitis: alterations in carbonic anhydrase I, mucin MUC2, and trefoil factor 3 expression. Int J Colorectal Dis. 2002;17:317-326. [PubMed] |
| 23. | Lin J, Holzman IR, Jiang P, Babyatsky MW. Expression of intestinal trefoil factor in developing rat intestine. Biol Neonate. 1999;76:92-97. [PubMed] |
| 24. | Lin J, Nadroo AM, Chen W, Holzman IR, Fan QX, Babyatsky MW. Ontogeny and prenatal expression of trefoil factor 3/ITF in the human intestine. Early Hum Dev. 2003;71:103-109. [PubMed] |
| 25. | Podolsky DK. Mechanisms of regulatory peptide action in the gastrointestinal tract: trefoil peptides. J Gastroenterol. 2000;35:67-74. [PubMed] |
| 26. | Taupin DR. Kinoshita K. Podolsky DK. Intestinal trefoil factor confers colonic epithelial resistance to apoptosis. Proc Natl Acad Sci USA. 2000;2:799-804. [PubMed] |
| 27. | Babyatsky MW. deBeaumont M, Thim L, Podolsky DK. Oral trefoil peptides protect against ethanol and indomethacin-induced gastric injury in rats. Gastroenterology. 1996;110:489-497. [PubMed] |
| 29. | Renes IB, Verburg M, Van Nispen DJ, Buller HA, Dekker J, Einerhand AW. Distinct epithelial responses in experimental colitis: implications for ion uptake and mucosal protection. Am J Physiol Gastrointest liver Physiol. 2002;283:G169-G179. [PubMed] |
| 30. | Mashimo H, Wu DC, Podolsky DK, Fishman MC. Impaired defense of intestinal mucosa in mice lacking intestinal trefoil factor. Science. 1996;274:262-265. [PubMed] |
| 31. | Marchbank T, Cox HM, Goodlad RA, Giraud AS, Moss SF, Poulsom R, Wright NA, Jankowski J, Playford RJ. Effect of ectopic expression of rat trefoil factor family 3 (intestinal trefoil factor) in the jejunum of transgenic mice. J Biol Chem. 2001;76:24088-24096. [PubMed] |
| 32. | Marchbank T, Cox HM, Goodlad RA, Giraud AS, Moss SF, Poulsom R, Wright NA, Jankowski J, Playford RJ. Effect of ectopic expression of rat trefoil factor family 3 (intestinal trefoil factor) in the jejunum of transgenic mice. J Biol Chem. 2001;76:24088-24096. |
| 33. | 陈 丽萍, 张 丙宏, 李 艳, 麦 根荣, 刘 仲熊. 肠三叶因子对新生鼠缺氧肠损伤模型及细胞介素8, 丙二醛的影响及其意义. 中华围产医学杂志. 2003;36:306-309. |
| 34. | Zhang BH, Yu HG, Sheng ZX, Luo HS, Yu JP. The therapeutic effect of recombinant human trefoil factor 3 on hypoxia-induced necrotizing enterocolitis in immature rat. Regul Pept. 2003;116:53-60. [PubMed] |