修回日期: 2005-10-28
接受日期: 2005-10-31
在线出版日期: 2006-01-08
目的: 观察了大黄多糖对溃疡性结肠炎(UC)小鼠结肠上皮细胞和外周血中性粒细胞(PMN)凋亡的影响, 进一步阐明大黄多糖治疗的机制.
方法: 用2, 4, 6-三硝基苯磺酸(TNBS)灌肠复制小鼠UC模型, 动物分为对照组、模型组、大黄多糖(400 mg/kg)治疗组. TUNEL法检测结肠上皮细胞凋亡, 免疫组织化学方法观察Caspase 3表达情况, Western-blot法检测Fas、FasL蛋白表达, 流式细胞仪测定PMN凋亡率变化.
结果: 模型组动物结肠上皮细胞凋亡均显著高于对照组, 而PMN凋亡率则显著低于对照组(40.5±7.8% vs 57.7±8.2%,P<0.01); 大黄多糖治疗组结肠上皮细胞凋亡低于模型组, PMN凋亡率(46.3±6.5%)则明显高于模型组(P<0.01). 与对照组相比, 模型组小鼠结肠上皮Caspase 3、Fas、FasL蛋白表达量明显增加; 大黄多糖治疗后, Caspase 3、Fas、FasL蛋白表达量显著减少, 低于模型组.
结论: 大黄多糖通过降低Caspase 3表达, 从而抑制Fas/FasL途径引起的结肠上皮细胞的凋亡, 同时增加PMN凋亡率, 减少PMN向结肠的募集, 从而减轻肠道局部免疫反应, 起到治疗溃疡性结肠炎的作用.
引文著录: 王志鹏, 张蓉, 刘莉, 梅其炳, 刘琳娜. 大黄多糖对溃疡性结肠炎小鼠结肠上皮细胞和外周血中性粒细胞凋亡的影响. 世界华人消化杂志 2006; 14(1): 29-34
Revised: October 28, 2005
Accepted: October 31, 2005
Published online: January 8, 2006
AIM: To investigate the effects of rhubarb polysac-chrides (RP) on the apoptosis of colonic epithelial cells and peripheral blood polymorphonuclear neutrophils (PMN) in mice with ulcerative colitis, and to explore the mechanisms of RP in the treatment of ulcerative colitis.
METHODS: A mouse mode1 of ulcerative colitis was induced with 2, 4, 6-trinitrobenzene sulfonic acid (TNBS) by enema. The mice were divided into three groups: nomal control, model, and RP treatment (400 mg/kg) group. TUNEL method was used to investigate the apoptosis of cells in colon, and the expression of Fas and FasL protein were measured by Western-blot. The level of Caspase 3 expression was detected by immunohistochemistry. Meanwhile, flow cytometry was used to examine the apoptosis of PMN.
RESULTS: The apoptosis level of colonic epithelial cells was dramatically higher in the model mice than that in the normal controls, while the rate of PMN apoptosis was significantly lower in the former (40.5 ± 7.8% vs 57.7 ± 8.2%, P < 0.01). However, the apoptosis level of colonic epithelial cells in RP treated mice was markedly lower than that in the model group, while the rate of PMN apoptosis was notably higher in the former (46.3 ± 6.5% vs 40.5 ± 7.8%, P < 0.01). In model group, the expression of Caspase 3, Fas, and FasL protein were significantly increased in comparison with those in the normal controls, but 3 d after treatment with RP, the expression of Caspase 3, Fas, and FasL protein were remarkably decreased as compared with those in the model mice.
CONCLUSION: Rhubarb polysacchrides can protect the intestinal tract against ischemic inflammation by down-regulation of Caspase-3 expression, which leads to the inhibition of apoptosis induced by Fas/FasL pathway.
- Citation: Wang ZP, Zhang R, Liu L, Mei QB, Liu LN. Effects of rhubarb polysacchrides on apoptosis of colonic epithelial cells and peripheral blood polymorphonuclear neutrophils in mice with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 29-34
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/29.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.29
溃疡性结肠炎(ulcerative colitis, UC)的病程特点是慢性、迁延、反复发作, 严重影响身体健康和生活质量. 其病理表现为上皮表浅而广泛的缺失和固有层的炎症改变, 结肠上皮细胞凋亡增多是导致结肠上皮层破坏的机制之一[1-4]. 此外, 外周血中性粒细胞(neutrophils, PMN)凋亡的抑制使PMN在血液循环和炎症部位的作用时间延长, 并释放活性介质, 加重炎症反应, 进一步引起组织损伤[5-7]. 这也是UC发病的又一个重要因素.
治疗UC的方法和药物很多[8]. 据报道, 中医中药对UC的疗效较好. 以大黄为主药的复方治疗溃疡性结肠炎疗效可达92%以上[9]. 本室从唐古特大黄中提取、分离得到水溶性多糖. 对其进行的研究表明, 大黄多糖对2, 4, 6三硝基苯磺酸(TNBS)诱导的大鼠溃疡性结肠炎具显著性疗效[10]. 机制可能与其促进肠上皮细胞增殖、移行、分化和抑制CD4+T细胞向肠道黏膜募集, 减轻CD4+T细胞触发的肠道黏膜局部免疫反应有关[11,12]. 然而, 大黄多糖对结肠上皮细胞和PMN凋亡这些UC发病的重要机制是否有影响, 尚无报道, 为进一步探讨其治疗UC的机制, 我们观察了大黄多糖对UC小鼠结肠上皮细胞和外周血PMN凋亡的影响, 现报道如下.
SPF级BALB/C小鼠购自第四军医大学实验动物中心. 2, 4, 6-三硝基苯磺酸(TNBS)为Sigma公司产品; 凋亡检测试剂盒、Caspase 3多克隆抗体、Fas、FasL多克隆抗体、辣根标记的羊抗兔二抗、DAB染色剂均购自武汉博士德公司; 淋巴细胞分离液购自上海华精生物高科技有限公司. RPMI1640培养基购于美国GiBco公司, 小牛血清产自杭州四季青生物工程公司.
1.2.1 动物分组与模型复制: SPF级BALB/C小鼠24只(18-22 g), 雌雄各半, 随机分为对照组、模型组、治疗组. 各组小鼠术前禁食24 h, 自由饮水, 造模时乙醚麻醉小鼠后用一直径2.0 mm, 长约10 cm的硅胶管由肛门轻缓插入深约4 cm, 模型组小鼠8只, 以含150 g/L TNBS的380 mL/L 乙醇溶液缓慢推入结肠(150 mg/kg), 诱导UC形成. 为确保注入之TNBS能够在大肠内弥散分布, 注入后将大鼠尾巴提起, 持续倒置30 S. 并以生理盐水2 mL/只灌胃, 1次/d. 大黄多糖治疗组小鼠8只, TNBS处理同上, 并以大黄多糖400 mg/kg灌胃, 1次/d, 3 d后处死动物.
1.2.2 凋亡检测: 模型组和治疗组动物选择病变局部肠段, 对照组选择距肛门4 cm左右肠段, 经40 g/L甲醛溶液固定, 石蜡包埋. TUNEL法检测结肠上皮细胞凋亡按照试剂盒说明书操作.
Western-blot方法检测和Fas/FasL蛋白表达的变化. 方法如下, 结肠黏膜组织在缓冲液中匀浆(缓冲液含0.1 mol/L PBS, 0.2 mol/L Tris-HCL pH 8.0, 0.15 mol/L Nacl, 1 g/L NaN3, 10 g/L Nonidet P-40, 1 g/L十二烷基磺酸钠, PMSF, 异丙醇, (H2O), 冰浴10 min, 14 000 g离心15 min, 4 ℃. 取上清水煮变性后经120 g/L十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳, 电压120 EV, 电泳2 h, 然后转移至硝酸纤维素膜(NC膜), 转移电压100 EV, 转移2 h, 5%脱脂奶粉37 ℃封闭1 h, 封闭的硝酸纤维素膜经PBS-Tween缓冲液洗涤后, 分别加入兔抗小鼠Caspase 3和Fas/FasL多克隆抗体(1:200稀释), 4 ℃过夜, 充分洗涤后加入辣根标记的羊抗兔IgG二抗(1:500稀释), 室温孵育1.5 h, DAB染色.
免疫组织化学方法检测Caspase 3表达情况. 步骤如下, 石蜡切片脱蜡至水, 30 mL/L过氧化氢室温10 min, 灭活过氧化物酶; 0.1 mol/L PBS充分洗涤后, 正常山羊血清室温封闭20 min;加兔抗小鼠Caspase 3多克隆抗体4 ℃过夜; 0.1 mol/L PBS充分洗涤后, 加羊抗兔二抗室温20 min, 0.1 mol/L PBS充分洗涤后, SABC室温孵育20 min后, DAB显色.
流式细胞术检测PMN凋亡. 用Hank,s液洗细胞3次, 计数并调整细胞浓度. 细胞经涂片染色分类见PMN纯度>90%, 台盼蓝染色活细胞比>95%. 将分离的PMN悬于含100 mL/L FBS血清的RPMI1640培养液中, 并使细胞浓度为2×109/L, 于50 mL/L CO2、37 ℃培养. 于培养后24 h取细胞检测PMN凋亡. 取培养后PMN用pH7.2 PBS洗涤2次, 调整细胞浓度为2×109/L. 加入碘化丙啶(PI), 室温避光放置30 min, 上流式细胞仪进行DNA亚二倍体峰凋亡分析.
统计学处理 数据用mean±SD表示, 采用SPSS10.0 统计软件处理. 两组间比较采用t检验.
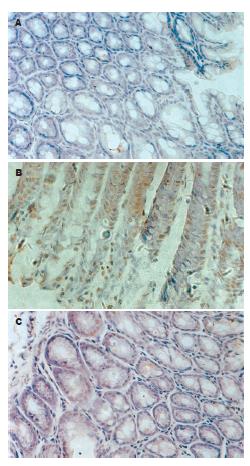
应用TUNEL法检测结肠上皮细胞凋亡. 结果表明, 对照组小鼠结肠黏膜上皮仅有少量凋亡细胞, 模型组动物结肠凋亡现象普遍, 大黄多糖400 mg/kg治疗组小鼠结肠上皮细胞凋亡较模型组明显减轻(图1).
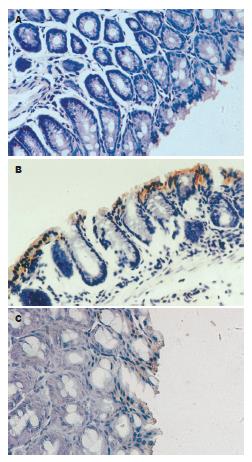
免疫组织化学方法检测结肠上皮细胞Caspase 3表达情况. 模型组动物结场上皮细胞Caspase 3表达显著强于对照组(图2). 大黄多糖400 mg/kg治疗组小鼠结肠上皮细胞Caspase 3表达较模型组弱.
Western-blot方法检测结肠上皮细胞Fas的结果表明, 与对照组相比, 模型组小鼠结肠上皮Fas、FasL蛋白表达量明显增加. 大黄多糖400 mg/kg治疗3 d后, 小鼠结肠上皮细胞Fas、FasL蛋白表达量显著减少, 低于模型组(图3).
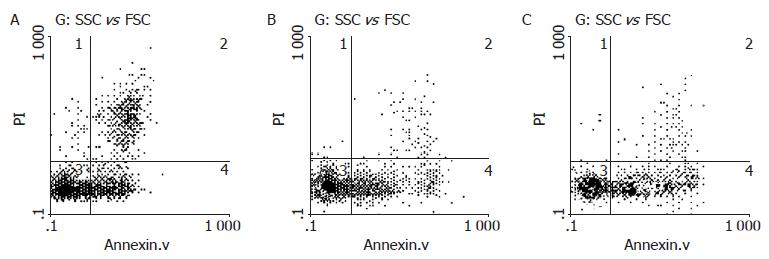
应用流式细胞仪检测小鼠PMN凋亡率. 图4显示, 模型组小鼠PMN凋亡率40.5±7.8%明显低于对照组57.7±8.2%(P<0.01). 大黄多糖400 mg/kg治疗组PMN凋亡率46.3±6.5%则显著高于模型组小鼠(P<0.01).
UC是一种主要累及直肠、结肠黏膜的慢性非特异性炎症, 以腹痛、腹泻、黏液血便、里急后重为主要临床表现. 病程迁延不愈, 亦有发生癌变的可能性[13-15]. 临床上至今没有特异性根治措施, 问题的关键是对其确切发病机制仍不清楚. 据报道, 参与UC发病机制的因素有免疫、遗传、环境、自由基损伤等[16,17]. 有越来越多的证据提示, 细胞凋亡对于溃疡性结肠炎的组织损伤和免疫紊乱有着重要的影响[18].
细胞凋亡是细胞接受刺激信号后一种主动的、由凋亡相关基因控制的细胞程序性死亡方式. 研究发现, 在溃疡性结肠炎的发病中, 包括了结肠上皮细胞的凋亡加速和炎性细胞的凋亡减慢两种病理性凋亡倾向, 两者同时存在是造成溃疡性结肠炎炎症持续的重要原因[19,20]. 正常的结肠上皮细胞很少发生凋亡, 但当UC时, 凋亡的结肠上皮细胞明显增多. 活动期UC除肠腔上皮细胞外, 病变处及邻近的非病变处隐窝上皮细胞凋亡增加, 从而使由上皮细胞构成的黏膜屏障破坏, 导致结肠黏膜的损伤和溃疡[21]. 对这种结肠上皮细胞病理性凋亡倾向的研究, 主要集中在对Caspase 3和Fas/FasL介导途径的探讨[22,23]. Fas及其配体FasL是一对调节细胞凋亡的蛋白因子. FasL 蛋白能与Fas特异性亲和, 激活Fas蛋白介导的信号通路[24]. 在UC组织中, 不仅表达FasL的淋巴细胞和单核细胞数增多, 而且正常结肠上皮细胞对Fas诱导的凋亡高度敏感[25]. Caspase 3属于Caspase超家族成员, 在Fas/FasL诱导的细胞凋亡过程中起着重要的作用. Caspase 3一经激活并导致底物裂解, 细胞凋亡将不可逆转地进行下去, 这样Caspase 3就成为细胞凋亡的重要标志[26]. UC中肠道局部炎性损伤是其另一个重要病理改变, 大量炎性细胞浸润肠壁和持续活化是其主要特征, 而炎性细胞的凋亡减慢则是造成这种现象的重要原因. 随着对UC发病机制研究的深入, 各种炎症细胞的作用倍受重视[27]. PMN生理情况下对机体的防御起着十分重要的作用, 但其内容物具有组织毒性及酶解基质蛋白的作用, 同时产生多种炎性介质, 如前列腺素、白三烯、血小板活化因子和活性氧介导和放大炎症反应. 因此PMN是炎症过程中引起组织损伤的重要细胞[28]. 凋亡的中性粒细胞被巨噬细胞吞噬、清除, 一方面使PMN不释放内容物, 另一方面也缩短了PMN介导炎症反应的时间. 因此, 中性粒细胞凋亡是机体自我限制炎症反应的一种重要方式.
随着对UC研究的不断深入, 减少UC结肠上皮凋亡, 从而减轻肠黏膜的损伤, 以及诱导UC炎症细胞的凋亡, 进而减轻炎症反应, 将可能成为治疗UC的有效方法[29-31], 从祖国医学宝库中筛选出具有针对性的中草药正是我们努力的方向. 大黄具有泻下攻积、清热泻火、活血化瘀之功效, 是用于胃肠道疾病的良药, 治疗UC取得较好的临床效果[32]. 本实验室提取大黄水溶性成分多糖, 用于UC 的治疗. 以往的研究表明, 大黄多糖对TNBS诱导的UC疗效显著, 呈现出良好的量效一依赖关系. 提示大黄多糖可能是大黄治疗UC的有效成分之一. 可通过促进肠上皮细胞的增殖、移行和分化促进肠黏膜的损伤修复. 此外, 抑制CD4+T细胞向肠道黏膜募集, 减轻CD4+T细胞触发的肠道黏膜局部免疫反应, 这可能是其治疗大鼠溃疡性结肠炎的机制之一. 我们的研究发现, 大黄多糖可显著减少UC小鼠结肠上皮细胞凋亡, 同时使Caspase 3、Fas、FasL蛋白表达降低. 因此, 我们推测, 大黄多糖可能通过抑制Caspase 3表达, 从而抑制Fas/FasL途径来阻遏结肠上皮细胞凋亡过程, 减少肠上皮细胞损伤, 增强肠黏膜屏障作用, 是其治疗UC的机制之一. 另外, 大黄多糖增加UC动物PMN凋亡率, 减轻其对结肠组织的浸润, 从而缓解结肠局部的炎症反应, 减轻肠道上皮细胞损伤和凋亡, 这可能是其治疗UC的另一个重要机制.
溃疡性结肠炎(UC)反复发作, 迁延不愈, 且发病率逐年升高. 其机制尚未完全阐明, 目前公认, UC是一种自身免疫性疾病, 抗原提呈细胞(APC)、T细胞作为免疫细胞, 是肠道免疫反应的重要参与者, 一旦APC和T细胞"失控", 其自身的分化以及分泌细胞因子的功能出现异常, 将会引起肠道的高敏反应, 甚至是炎症, 导致肠道上皮细胞的破坏. 因此, 目前的治疗方案主要是应用免疫抑制剂. 但随之而来的不良反应也不容忽视. 从传统的中草药中寻找高效低毒的有效成分来治疗UC成为近年来的研究热点.
近来的研究表明, 骨髓干细胞可促进非造血组织的损伤修复, 且在肠道发现了骨髓来源的上皮细胞. 据报道, 应用粒细胞巨噬细胞集落刺激因子(GM-CSF)治疗UC有一定疗效, 可能就是通过增加未成熟骨髓细胞进入外周血, 诱导分化, 促进肠道上皮细胞再生和修复来发挥作用. 另据报道, 骨髓移植配合大剂量免疫抑制剂可在减轻肠道炎症发应的同时, 促进肠道上皮细胞修复. 寻找既可以抑制肠道炎症, 又可以促进肠道上皮细胞增殖与分化的新型疗法将成为未来的研究热点.
1 Markus F. Neurath, Susetta Finotto, Laurie H. Glimcher. The role of Th1/Th2 polarization in mucosal immunity. Nature medicine 2002; 8: 567-732
2 Ryuichi Okamoto, Mamoru Watanabe. Cellular and Molecular Mechanisms of the Epithelial Repair in IBD. Digestive Diseases and Sciences 2005; 50: S34-S38
本文应用大黄多糖治疗小鼠UC, 结果发现大黄多糖既可减少肠道上皮细胞凋亡, 又可增加外周血中性粒细胞的凋亡. 表明大黄多糖可以通过抑制肠道免疫反应和减少肠道上皮凋亡两个途径发挥治疗UC的作用.
大黄多糖通过多途径治疗UC, 疗效较好, 且未发现毒性反应, 可望开发成为一种治疗UC的新药.
本研究观察了小鼠溃疡性结肠炎模型经大黄多糖治疗后结肠上皮细胞和外周血中性粒细胞凋亡的变化, 并初步探讨了其中可能的机制, 是基于前期研究成果基础上的进一步深入研究, 所采用的方法得当, 数据明确, 并得出一定的结论, 对于中医药治疗溃疡性结肠炎机制的探讨有一定的意义.
电编: 李琪 编辑:菅鑫妍 审读:张海宁
| 1. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] |
| 2. | Cui HF, Jiang XL. Treatment of corticosteroid-resistant ulcerative colitis with oral low molecular weight heparin. World J Gastroenterol. 1999;5:448-450. [PubMed] |
| 4. | Brannigan AE, O'Connell PR, Hurley H, O'Neill A, Brady HR, Fitzpatrick JM, Watson RW. Neutrophil apoptosis is delayed in patients with inflammatory bowel disease. Shock. 2000;13:361-366. [PubMed] |
| 6. | Kruidenier L, Kuiper I, Lamers CB, Verspaget HW. Intestinal oxidative damage in inflammatory bowel disease: semi-quantification, localization, and association with mucosal antioxidants. J Pathol. 2003;201:28-36. [PubMed] |
| 7. | Mallolas J, Esteve M, Rius E, Cabre E, Gassull MA. Antineutrophil antibodies associated with ulcerative colitis interact with the antigen(s) during the process of apoptosis. Gut. 2000;47:74-78. [PubMed] |
| 12. | 刘 莉, 王 志鹏, 梅 其炳, 李 晨. 2、4、6-三硝基苯磺酸诱导的大鼠结肠炎CD4+T细胞增加. 中国病理生理杂志. 2004;20:347-350. |
| 13. | Kirsner JB. Inflammatory bowel diseases: from the mystical to the cellular and now the molecular. World J Gastroenterol. 2005;11:4127-4128. [PubMed] |
| 14. | Cao YB, Zhang JD, Diao YY, Yan L, Wang DJ, Jia XM, Gao PH, Cheng MH, Xu Z, Wang Y. Effects of Changtai granules, a traditional compound Chinese medicine, on chronic trinitrobenzene sulfonic acid-induced colitis in rats. World J Gastroenterol. 2005;11:3539-3543. [PubMed] |
| 15. | Katz S. Update in medical therapy of ulcerative colitis: newer concepts and therapies. J Clin Gastroenterol. 2005;39:557-569. [PubMed] |
| 16. | Freeman HJ. Collagenous mucosal inflammatory diseases of the gastrointestinal tract. Gastroenterology. 2005;129:338-350. [PubMed] |
| 17. | Pardi DS. Microscopic colitis: an update. Inflamm Bowel Dis. 2004;10:860-870. [PubMed] |
| 18. | Bu P, Keshavarzian A, Stone DD, Liu J, Le PT, Fisher S, Qiao L. Apoptosis: one of the mechanisms that maintains unresponsiveness of the intestinal mucosal immune system. J Immunol. 2001;166:6399-6403. [PubMed] |
| 19. | Xia B, Yu YH, Guo QS, Li XY, Jiang L, Li J. Association of Fas-670 gene polymorphism with inflammatory bowel disease in Chinese patients. World J Gastroenterol. 2005;11:415-417. [PubMed] |
| 20. | Ohd JF, Wikstrom K, Sjolander A. Leukotrienes induce cell-survival signaling in intestinal epithelial cells. Gastroenterology. 2000;119:1007-1018. [PubMed] |
| 21. | Vetuschi A, Latella G, Sferra R, Caprilli R, Gaudio E. Increased proliferation and apoptosis of colonic epithelial cells in dextran sulfate sodium-induced colitis in rats. Dig Dis Sci. 2002;47:1447-1457. [PubMed] |
| 22. | Bregenholt S, Petersen TR, Claesson MH. The majority of lamina propria CD4(+) T-cells from scid mice with colitis undergo Fas-mediated apoptosis in vivo. Immunol Lett. 2001;78:7-12. [PubMed] |
| 23. | Neurath MF, Finotto S, Fuss I, Boirivant M, Galle PR, Strober W. Regulation of T-cell apoptosis in inflammatory bowel disease: to die or not to die, that is the mucosal question. Trends Immunol. 2001;22:21-26. [PubMed] |
| 24. | Suzuki A, Sugimura K, Ohtsuka K, Hasegawa K, Suzuki K, Ishizuka K, Mochizuki T, Honma T, Narisawa R, Asakura H. Fas/Fas ligand expression and characteristics of primed CD45RO+ T cells in the inflamed mucosa of ulcerative colitis. Scand J Gastroenterol. 2000;35:1278-1283. [PubMed] |
| 25. | Abreu-Martin MT, Palladino AA, Faris M, Carramanzana NM, Nel AE, Targan SR. Fas activates the JNK pathway in human colonic epithelial cells: lack of a direct role in apoptosis. Am J Physiol. 1999;276:G599-G605. [PubMed] |
| 26. | Jones SA, Butler RN, Sanderson IR, Wilson JW. The effect of specific caspase inhibitors on TNF-alpha and butyrate-induced apoptosis of intestinal epithelial cells. Exp Cell Res. 2004;292:29-39. [PubMed] |
| 27. | Le'Negrate G, Selva E, Auberger P, Rossi B, Hofman P. Sustained polymorphonuclear leukocyte transmigration induces apoptosis in T84 intestinal epithelial cells. J Cell Biol. 2000;150:1479-1488. [PubMed] |
| 28. | Wu HG, Zhou LB, Shi DR, Liu SM, Liu HR, Zhang BM, Chen HP, Zhang LS. Morphological study on colonic pathology in ulcerative colitis treated by moxibustion. World J Gastroenterol. 2000;6:861-865. [PubMed] |
| 29. | Mukoyama T, Kanbe T, Murai R, Murawaki Y, Shimomura T, Hashiguchi K, Saeki T, Ichiba M, Yoshida Y, Tanabe N. Therapeutic effect of adenoviral-mediated hepatocyte growth factor gene administration on TNBS-induced colitis in mice. Biochem Biophys Res Commun. 2005;329:1217-1224. [PubMed] |
| 30. | Fedorak RN, Madsen KL. Probiotics and the management of inflammatory bowel disease. Inflamm Bowel Dis. 2004;10:286-299. [PubMed] |