修回日期: 2005-03-11
接受日期: 2005-03-22
在线出版日期: 2005-05-01
目的: 提取人肝癌组织的α-L-岩藻糖苷酶(α-L-fucosidase, AFU)经纯化和鉴定后, 为制备特异性多克隆抗体提供纯化的抗原.
方法: 运用超滤和离子交换层析等方法提取、纯化人肝癌组织的AFU, 并经SDS-PAGE检测蛋白纯度及相对分子质量. 根据荧光底物4-甲基微型酮-α-L-岩藻糖苷(4-methylumbelliferyl-α-L-fucopyranoside, 4-MU-fucoside)和纯化的蛋白在特定条件下反应生成产物4-甲基微型酮(4-methylumbelliferone, 4-MU)的量来检测酶活性. 检测蛋白浓度用Bradford方法.
结果: 提纯并纯化的AFU经SDS-PAGE鉴定有一个亚单位Mr 55 000. 经过一系列纯化步骤后, 肝癌组织的AFU可得到74倍纯化, 15%收率.
结论: 肝癌组织的AFU可通过离子交换层析法提取和纯化并可用于制备抗体.
引文著录: 李超, 林菊生, 陈孝平, 易继林, 陶璐薇. 人肝癌组织α-L-岩藻糖苷酶的提取和鉴定. 世界华人消化杂志 2005; 13(9): 1089-1093
Revised: March 11, 2005
Accepted: March 22, 2005
Published online: May 1, 2005
AIM: To purify and characterize α-L-fucosidase (AFU, EC3.2.1.51) from human hepatocellular carcinoma (HCC).
METHODS: Ion exchange chromatography on CM-52 and ultrafiltration were used to separate AFU from crude extract of liver cancer tissue. SDS-PAGE was performed to determine the molecular weight of the subunit of AFU. Bradford method was used to measure protein concentration. 4-methylumbelliferyl -α-L-fucopyranoside (4-MUF) was used as a fluorescent substrate to quantify the purified AFU activity in each step. Standard curve of known product of enzyme-substrate reaction was drawn.
RESULTS: Human HCC AFU was purified by 74-fold to apparent homogeneity with 15% yield. SDS-PAGE indicated the presence of one subunit of Mr 55 000. Specific activity of AFU in pooled fraction by chromatography was 10 085 μkat/mg.
CONCLUSION: AFU in human HCC tissue can be purified through ion exchange chromatography, which can be used as an immunogen to generate specific antibody against human hepatocellular carcinoma.
- Citation: Li C, Lin JS, Chen XP, Yi JL, Tao LW. Purification and characterization of α-L-fucosidase from human hepatocellular carcinoma tissue. Shijie Huaren Xiaohua Zazhi 2005; 13(9): 1089-1093
- URL: https://www.wjgnet.com/1009-3079/full/v13/i9/1089.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i9.1089
最早在岩藻糖苷酶缺乏症中发现由于α-L-岩藻糖苷酶缺失可导致岩藻糖苷贮积[1], 后来发现此酶对某些恶性肿瘤如肝癌[2-6]、卵巢癌[9]、结肠癌[10-11,29]的诊断颇具一定临床价值. 目前临床上可作为甲胎蛋白阴性肝癌患者血清学诊断辅助指标. 我们首次采用离子交换层析方法提取人肝癌组织中AFU并鉴定其活性和纯度, 为进一步实验打下基础.
从外科手术室获取人肝癌组织经病理活检为原发性肝细胞癌, 去除脂肪和结缔组织后, 切成小块分装在冻存盒内加入200 mL/L甘油保存在-70℃冰箱待用. 检测酶活性所需的底物和标准产物购自Sigma公司, 检测仪器为F-4500日立荧光光度计. 脱盐所用超滤管购自美国Millipore公司. 层析柱规格2.6 cm×30 cm购自上海锦华层析设备厂. 层析所需的CM-52树脂购自Whatman公司. 使用 Phamacia Biotech Gene Quant仪器检测层析收集液A280吸光度值.
根据参考文献[24]修改而成.-70℃冰箱中取出肝癌组织, 去除附着脂肪和结缔组织后称取25 g, 在冰上用眼科剪和镊子剪碎, 在聚丙烯烧杯中按质量/体积(m/V)1: 10 用冷的50 mmol/L醋酸钠溶液(pH 5.0), 240 mL与组织混匀. 用20 mL玻璃匀浆器在冰上人工匀浆, 充分研磨. 收集匀浆液. 破细胞: 将匀浆液37℃水浴中加热1 h, 释放酶. 匀浆液pH用冰醋酸迅速调至5.0后, 60℃水浴中加热10 min, 在冰浴上冷却至室温.0℃高速离心17 000 g, 30 min, 弃沉淀. 上清pH用7.5 mol/L NH4OH调至5.0. 离心后上清收集于一聚丙烯烧杯中, 测得220 mL. 查表0℃硫酸铵饱和度从0%-35%需加入194 g/L固体硫酸铵, 缓缓加入42.68 g, 边加边轻轻搅拌, 4℃静置4 h. 然后0℃, 15 500 g, 离心30 min, 弃沉淀后收集上清, 测得232 mL.0℃硫酸铵沉淀饱和度从35%-50%需加入87 g/L固体硫酸铵, 缓缓加入20.18 g, 边加边轻轻搅拌, 4℃静置20 h.0℃, 15 500 g, 离心30 min, 沉淀溶于4 mL的0.1 mol/L柠檬酸钠, pH5.0, 0.2 g/L NaN3, -20℃保存. 上清收集于一聚丙烯烧杯中, 测得227 mL. 查表0℃硫酸铵饱和度从50%-60%需加入60 g/L固体硫酸铵, 缓缓加入13.62 g, 边加边轻轻搅拌, 4℃静置20 h. 然后0℃, 15 500 g, 离心30 min, 沉淀溶于2 mL的0.1 mol/L柠檬酸钠, pH5.0, 0.2 g/L NaN3-20℃保存. 以上每步离心前后均留取一小等分用于测定蛋白浓度和酶活性. 称量70 g CM-52, 用初始平衡缓冲液0.011 mol/L柠檬酸-氢氧化钠溶液, pH 4.5, 0.2 g/L NaN3, 按质量/体积(m/V)1: 10混合, 搅拌均匀, 充分溶胀. 用玻棒将混合好的树脂浆引流入层析柱, 静置使其完全沉淀到柱下部, 吸掉上清, 继续加入混合液, 重复上述步骤直至树脂全部加入层析柱内. 用样品缓冲液平衡层析柱, 当流出液体积达750 mL, 下端流出液pH与样品缓冲液pH相等即达到平衡目的. 使用Millipore超滤离心管(1.5 mL, 截流Mr 10 000). 将35%-50%和50%-60%饱和硫酸铵沉淀后组分分别装入超滤管, 离心条件5 480 r/min, 4℃, 9 min. 收集35%-50%上端液体3 mL, 50%-60%上端液体1 mL分别稀释在初始平衡缓冲液里, 从上端加入层析柱内, 关闭上下流出端使样品在树脂中平衡约30 min. 用0.05, 0.10, 0.15, 0.25 mol/L NaCl缓冲液进行分步洗脱, 收集洗脱液, 并测定A280值及酶活性. 合并收集含有目的蛋白的洗脱液. 用Bradford法试剂盒测定蛋白浓度, 按照使用说明进行操作. 酶的活性为: 37℃每秒生成1 μmol产物所需酶量为1 μkat.
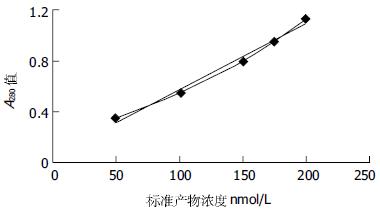
参照文献[30]建立标准产物的标准曲线: 不同标准产物浓度的标准溶液50, 100, 150, 200 nmol.
参照文献[7,20]修改建立酶活性检测反应体系: 0.2 mol/L柠檬酸, pH5.0, 150 μL, 样品30 μL, 底物液20 μL, 37℃水浴30 min, 加入0.2 mol/L K2CO3 4 mL, pH10.0终止反应. 检测酶活性时的激发波长为365 nm, 释放波长为460 nm. 同时设置空白管, 不加样品, 其他反应条件不变.
相对分子质量及蛋白纯度测定: SDS-PAGE变性-聚丙烯酰胺凝胶电泳所用试剂均用去离子水按照《蛋白质技术手册》(汪家政, 科学技术出版社, 2002)配制而成. Bio-Rad Mini Protean-Ⅲ 电泳系统. 分离胶8%-10%, 堆积胶5%, 80V堆积胶, 120V分离胶. 考马斯亮蓝染色, 脱色.
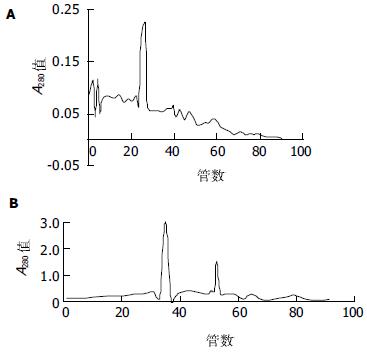
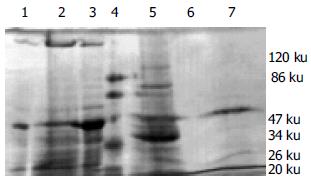
采用阳离子交换层析法, 经过饱和硫酸铵沉淀和超滤离心脱盐后的35%-50%组分及50%-60%组分分别得到纯化.35%-50%组分经过层析柱洗脱后依次测定收集管内的洗脱液A280值, 发现当用0.1 mol/L NaCl缓冲液洗脱时, 第24-28管内的收集液出现一个明显的洗脱峰, 并经电泳证实其纯度, 为一条Mr 55 000的亚单位, 蛋白浓度约25 mg/L(图1A, 图2 带1).50%-60%组分经过层析柱洗脱后依次测定收集管内的洗脱液A280值, 发现当用0.1 mol/L NaCl缓冲液洗脱时, 第33-37管内的收集液出现一个明显的洗脱高峰, 蛋白浓度约180 mg/L, 经测定活性证实有大量杂蛋白被洗脱. 当用0.15 mol/L NaCl缓冲液洗脱时, 第52-54管内的收集液出现一个相对较低的洗脱峰, 并经电泳证实其纯度, 为一条Mr 55 000的亚单位, 蛋白浓度约90 mg/L. 合并含有洗脱峰的收集液, 总蛋白量为1.82 mg(图1B, 图2 带7). 纯化过程中对每一步的总蛋白, 总活力、比活力、纯化倍数以及收得率进行比较发现: 随着纯化步骤的深入, 总蛋白和总活力呈逐步下降的趋势, 而比活力和纯化倍数则逐步升高, 收得率有一定的波动, 表明杂蛋白含量逐步减少, 目的蛋白逐步得到纯化(表1, 图2). 超滤离心后组分包括35%-50%组分和50%-60%组分, 与层析后合并的收集液对比可以看出前者的杂蛋白含量较高, 分别为22.00 mg, 5.60 mg, 比活力则分别为2 122 μkat/mg, 1 221 μkat/mg, 在电泳图中表现为杂蛋白条带较多(表1, 图2 带2, 带5). 电泳图中高速离心后的上清中几乎未见蛋白, 表明饱和硫酸铵沉淀这一步浓缩, 分离蛋白的效果较为理想(图2 带6). 层析后合并的收集液内总蛋白仅为1.82 mg, 其比活力却为10 085 μkat/mg, 纯化倍数为74, 表明此纯化方案具有一定的可行性(表1).
| 步骤 | 总蛋白/mg | 总活力/μkat | 比活力/(μkat/mg) | 纯化倍数 | 收得率(%) |
| 37℃孵育后匀浆 | 878.40 | 120 024 | 137 | ||
| 35%-50%组分 | 126.55 | 95 352 | 753 | 5 | 79 |
| 50%-60%组分 | 46.55 | 16 420 | 353 | 3 | 14 |
| 超滤离心后组分 | |||||
| 35%-50%组分 | 22.00 | 46 676 | 2 122 | 16 | 39 |
| 50%-60%组分 | 5.60 | 6 835 | 1 221 | 9 | 6 |
| CM-52层析收液 | 1.82 | 18 354 | 10 085 | 74 | 15 |
发现标准产物浓度在50-200 nmol/L之间, 其对应的A280值可近似为线性关系, 与Microsoft excel生成的趋势线接近一致(图3).
AFU(E. C.3.2.1.51)是一种岩藻糖聚合物, 可水解岩藻糖苷成为水和L-岩藻糖. 正常情况下在肝脏中含量很低, 疾病状态下由肝细胞释放入血液中, 导致血清中的活性升高, 目前导致此酶升高的确切机制尚不清楚, 可能是伴随肿瘤细胞中AFP出现, AFU合成和分泌增加并引起岩藻糖胺含量的转换[4], 因为血清AFU水平被认为与AFU表型的种族差异性也有关系[5]. 然而有研究认为, 与非肝癌组织相比, 一些肝癌组织中AFU水平明显降低[6]. 人AFU相关基础研究仅限于在胎盘[7], 血清[4,8-12], 脾[13], 细胞表面(造血细胞, 上皮细胞, 间叶细胞)[14], 脑[15]等方面, 在肝脏方面多是关于岩藻糖苷酶缺乏症患者及正常肝脏的研究[14,16-21], 而对于肝癌患者AFU的研究目前尚无报道. 我们采用离子交换层析方法提取人肝癌组织AFU并鉴定其纯度, 为下一步制备特异性抗体打下基础. 在检测所有样本中AFU活性之前, 必须建立体外测定AFU的最优条件[10]. AFU在pH3.5-7.0之间显示高活性水平, 这与报道的AFU在人血清中最佳pH值一致. 我们采用pH5.0缓冲液作为体外检测条件, AFU活性在4℃体外控制和37℃孵育条件中均可在此pH值时保持稳定.
样品溶液上柱前首先要通过离心分离或者用0.45 μm孔径滤纸过滤成为无色澄清溶液. 溶解蛋白的样品缓冲液离子强度最好低于50 mmol/L. 层析过程中主要有两大难点: (1)酶在低于离子强度0.05时不稳定. (2)AFU在pH值5-7范围以外活性不稳定, 因此在实验中有必要严格将层析pH值控制在5.0-6.0之间达到AFU的最佳复性条件. 尽管柱反应对条件改变相当敏感, 但当摸索到合适条件时, 层析分步解离的方法简单且具有重复性[24]. 有人认为人肝AFU是一种由4个相同亚基构成的四聚体[16], SDS-PAGE显示仅有一条Mr 50 000亚单位. 而一些研究文献报道[28-29] AFU经过SDS-PAGE可有两条带, 两个亚基Mr大约51 000和56 000, 均为糖基化, 而且仅56 000亚单位含有唾液酸残基. 纯化后精浆AFU仅出现含有多种酸性异构体的唾液酸化56 000亚单位, 精子AFU则仅见含有中性异构体的51 000亚单位[31-32]. 有人发现人结肠组织AFU经Western blot显示有两条带, 59 000和50 000[29]. 在本实验中AFU经过SDS-PAGE有一条带, Mr 55 000. 人不同组织AFU虽然在免疫化学方面的差别尽管有多肽链上的差异, 但可能主要与酶的各种翻译后修饰活动有关[22]. SDS-PAGE可分离出1-2条相距很近的50 000-60 000蛋白条带. 而有人用淀粉凝胶电泳和等电聚焦方法发现AFU可有5-6条带, 二者之间关系尚不明确, 有人提出条带数量与AFU中所含的唾液酸残基含量有关[8]. 每步纯化后的目的蛋白比活性逐步升高, 最终可达到10 085 μkat/mg, 用DEAE阴离子交换层析柱分离人胎盘AFU得到的比活性3 534 μkat/mg[7], 分离大鼠附睾AFU比活性213 μkat/mg[26], 表明这一分离方案是切实可行的.
由于本实验中纯化得到的AFU量较少, 限制了进一步进行酶动力学, 底物特异性以及最适pH方面的研究, 因此关键是寻找如何制备大量具有生物活性AFU 的途径. 有研究报道[23], 将带有人AFU全长序列的cDNA插入到原核表达载体pGEX-2T, 经IPTG诱导后在大肠杆菌细胞内可检测到高表达的GST融合蛋白. 然而GST-AFU蛋白多以包涵体的形式存在, 一些优化表达可溶性蛋白的尝试也不甚理想. 总之, 获取纯化的人肝癌组织AFU有助于制备特异性抗体以用于建立高灵敏度的临床诊断方法, 本实验为下一阶段的抗体制备打下基础.
感谢华中科技大学同济医学院免疫学系朱慧芬老师在实验过程中给予的技术支持.
编辑: 张海宁 电编: 潘伯荣
| 1. | Seo HC, Willems PJ, Kretz KA, Martin BM, O払rien JS. Fucosidosis: four new mutations and a new polymorphism. Hum Mol Genet. 1993;2:423-429. [PubMed] |
| 2. | Giardina MG, Matarazzo M, Varriale A, Morante R, Napoli MD, Martino R. Serum alpha-L-fucosidase. A useful marker in the diagnosis of hepatocellular carcinoma. Cancer. 1992;70:1044-1048. [PubMed] |
| 3. | Giardina MG, Matarazzo M, Morante R, Lucariello A, Varriale A, Guardasole V, De Marco G. Serum alpha-L-fucosidase activity and early detection of hepatocellular carcinoma: a prospective study of patients with cirrhosis. Cancer. 1998;83:2468-2474. [PubMed] |
| 4. | Deugnier Y, David V, Brissot P, Mabo P, Delamaire D, Messner M, Bourel M, Legall JY. Serum alpha-L-fucosidase: A new marker for the diagnosis of primary hepatic carcinoma? Hepatology. 1984;4:889-892. [PubMed] |
| 5. | Bukvfzer S, Stass PM, Kew MC, de Beer M, Groeneveld HT. Alpha-L-fucosidase as a serum marker of hepatocellular carcinoma in southern African blacks. Br J Cancer. 1989;59:417-420. [PubMed] |
| 6. | Leray G, Deugnier Y, Jouanolle AM, Lehry D, Bretagne JF, Campion JP, Brissot P, Le Treut A. Biochemical aspects of alpha -L-fucosidase in hepatocellular carcinoma. Hepatology. 1989;9:249-252. [PubMed] |
| 7. | Di Matteo G, Orfeo MA, Romeo G. Human alpha -L-fucosidase purification and properties. Biochim Biophys Acta. 1976;429:527-537. [PubMed] |
| 8. | Alhadeff JA, Janowky AJ. Human serum alpha -L-fucosidase. Clin Chim Acta. 1978;82:133-140. [PubMed] |
| 9. | Abdel-Aleem H, Ahmed A, Sabra AM, Zakhari M, Soliman M, Hamed H. Serum alpha-L-fucosidase enzyme activity in ovarian and other female genital tract tumors. Int J Gynecol Obstetrics. 1996;55:273-279. [PubMed] |
| 10. | Ayude D, Fernández-Rodriguez J, Rodriguez-Berrocal FJ, Martínez-Zorzano VS, de Carlos A, Gil E, de la Cadena MP. Value of the serum alpha -L-fucosidase activity in the diagnosis of colorectal cancer. Oncology. 2000;59:310-316. [PubMed] |
| 11. | Ayude D, de la Cadena MP, Martínez-Zorzano VS, Fernández-Briera A, Rodriguez-Berrocal FJ. Preoperative serum alpha-L-fucosidase activity as a prognostic marker in colorectal cancer. Oncology. 2003;64:36-45. [PubMed] |
| 12. | DiCioccio RA, Barlow JJ, Matta KL. Substrate specificity and other properties of -L-fucosidase from human serum. J Biol Chem. 1982;257:714-718. [PubMed] |
| 13. | Chien SF, Dawson G. Purification and properties of two forms of human alpha-L-fucosidase. Biochim Biophys Acta. 1980;614:476-488. [PubMed] |
| 14. | Cordero OJ, Merino A, Paez de la Cadena M, Bugia B, Nogueira M, Vinuela JE, Martinez-Zorzano VS, de Carlos A, Rodriguez-Berrocal FJ. Cell surface human alpha-L-fucosidase. Eur J Biochem. 2001;268:3321-3331. [PubMed] |
| 15. | Hopfer RL, Johnson SW, Masserini M, Giuliani A, Alhadeff JA. Hydrolysis of fucosyl-GM1 ganglioside by purified pellet-associated human brain and human liver alpha-L-fucosidases without activator proteins or detergents. Biochem J. 1990;266:491-496. [PubMed] |
| 16. | Alhadeff JA, Miller AL, Wenaas H, Vedvick T, O'Brien JS. Human liver alpha -L-fucosidase. purification, characteriza-tion, and immunochemical studies. J Biol Chem. 1975;250:7106-7113. [PubMed] |
| 17. | Robinson D, Thorpe R. Human liver alpha -L-fucosidase. Clin Chim Acta. 1973;47:403-407. [PubMed] |
| 18. | Wiederschain GY, Kolibaba LG, Rosenfeld EL. Human a-L-fucosidase. Clin Chim Acta. 1973;46:305-310. [PubMed] |
| 19. | Robinson D, Thorpe R. Affinity chromatography of human liver a-L-fucosidase. FEBS Lett. 1974;45:191-193. [PubMed] |
| 20. | Alhadeff JA, Miller AL, Wenger DA, O'Brien JS. Electrophoretic forms of human liver -L-fucosidase and their relationships to fucosidosis (mucopolysaccharidosis F). Clin Chim Acta. 1974;57:307-313. [PubMed] |
| 21. | Thorpe R, Robinson D. Isoelectric focusing of isoenzymes of human liver α-L-fucosidase. FEBS Letters. 1975;54:89-92. [PubMed] |
| 22. | Alhadeff JA. Structure and function of mammalian alpha -L-fucosidase. Trends Comparative Biochem Physiol. 1998;4:105-118. |
| 23. | de Carlos A, Montenegro D, Alonso- Rodriguez A, Paez de la Cadena M, Rodriguez-Berrocal FJ, Martinez-Zorzano VS. Purification of human alpha-L-fucosidase precursor expressed in Escherichia coli as a glutathione S-transferase fusion protein. J Chromatography. 2003;786:7-15. [PubMed] |
| 24. | Carlsen RB, Pierce JG. Purification and properties of an alpha -L-fucosidase from rat epididymis. J Biol Chem. 1972;247:23-32. [PubMed] |
| 25. | Wang JJ, Cao EH. Rapid kinetic rate assay of the serum α-L-fucosidase in patients with hepatocellular carcinoma by using a novel substrate. Clin Chim Acta. 2004;347:103-109. [PubMed] |
| 26. | Opheim DJ, Touster O. The purification and characterization of rat liver lysosomal α-L-fucosidase. J Biol Chem. 1977;252:739-743. [PubMed] |
| 28. | Johnson SW, Piesecki S, Wang RF, Damjanov I, Alhadeff JA. Analysis of purified human liver alpha-L-fucosidase by western-blotting with lectins and polyclonal and monoclonal antibodies. Biochem J. 1992;282:829-834. [PubMed] |
| 29. | Fernández J, Rodriguez-Berrocal FJ, de Carlos A, de Castro G, de la Cadena MP. Nonradioactive immunoquantification of alpha -L-fucosidase protein in human colon tissues. J Biochem Biophys Methods. 1996;31:39-47. [PubMed] |
| 30. | A TD-700 Laboratory Fluorometer Method for b-Galactosidase. Turner Biosystems, Inc. Available from: http://www. turnerdesigns.com/. |
| 31. | Khunsook S, Alhadeff JA, Bean BS. Purification and characterization of human seminal plasma α-L-fucosidase. Mol Hum Reprod. 2002;8:221-227. [PubMed] |
| 32. | Khunsook S, Bean BS, McGowan SR, Alhadeff JA. Purification and characterization of plasma membrane-associated human sperm α-L-fucosidase. Biol Reprod. 2003;68:709-716. [PubMed] |