修回日期: 2005-03-01
接受日期: 2005-03-10
在线出版日期: 2005-05-01
目的: 探讨在肿瘤细胞中凋亡与增殖平衡的变化(apoptotic index/proliferative index, AI/PI)以及与相关基因的关系.
方法: 取普外科手术切除的标本68例, 其中胃正常组10例, 癌旁组10例, 胃癌标本48例. 术前均未接受过化疗或放疗. 男32例, 女16例. 年龄24-74(平均54.4)岁. 术前内镜活检病检诊断, 术后病理诊断证实. 标本均经中性甲醛(40 g/L)固定, 常规石蜡包埋, 作4 μm厚连续切片. 应用流式细胞仪, 分别定量分析细胞的凋亡群体和增殖群体; 免疫组化方法检测survivin, Fas与FasL基因表达的变化; 共聚焦显微镜对细胞增殖进行形态学观察.
结果: 在从胃正常组, 癌旁组到肿瘤组细胞的演进过程中, AI/PI分别为0.460.14, 0.350.12, 0.230.11. 胃正常组, 癌旁组和肿瘤组细胞相互之间, 差异有显著性(F = 19.453, P = 0.000<0.01). 胃癌细胞的AI/PI经频数分布表分析和检验均服从正态分布. 胃癌细胞AI/PI范围0.05-0.46. 中位数和均数北曜疾罘直鹞0.245和0.230.11. Skewness的值为0.067, Kurtosis的值为-0.868. 胃癌细胞随着恶性进展, AI/PI总体呈下降的趋势, 与淋巴转移和远处转移相关(P<0.05). survivin, Fas与FasL基因表达阳性染色主要定位于肿瘤细胞胞质或胞膜中, 为粗细不一的棕黄色颗粒. 在48例胃癌中survivin, Fas与FasL的阳性表达率分别为56.2%, 43.8%和60.4%. AI/PI的中位数为0.245, 将胃癌分为>0.245组和<0.245组. 结果显示相应的两组组织切片中survivin阳性表达率增加(χ2 = 6.857, P<0.01), 而Fas的阳性表达率降低(χ2 = 4.148, P<0.05)和FasL的阳性表达率增加(χ2 = 4.269, P<0.05). 共聚焦显微镜显示肿瘤组织中Ki-67高表达.
结论: AI/PI总体呈下降的趋势, 可能与survivin基因表达上调, Fas基因表达下调有关.
引文著录: 陈金明, 李伟华, 周海波, 冯永东, 王家顿, 谢大兴, 余源. 胃癌细胞凋亡与增殖的平衡与相关基因的关系. 世界华人消化杂志 2005; 13(9): 1078-1081
Revised: March 1, 2005
Accepted: March 10, 2005
Published online: May 1, 2005
AIM: To investigate the balance between cell proliferation and apoptosis in gastric cancer and their association with related genes.
METHODS: Sixty-eight surgically resected samples were collected between 2000 and 2001, including 10 normal gastric tissues, 10 para-cancerous tissues, and 48 gastric carcinoma tissues from pathologically confirmed patients(32 males and 16 females, aged 24-74 years with mean age 54.4 years). The patients did not receive chemotherapy or radiotherapy. All of the samples were fixed in 40 g/L formalin, embedded in paraffin, and sliced into 4 mm-thick sections. The apoptotic cells and proliferative cells were quantitatively analyzed by flow cytometry. Immunohistochemical assay (SP method) was used to detect the expression of survivin, Fas and FasL. The morphology of proliferating cells was identified by confocal microscope.
RESULTS: In the normal, para-cancerous and tumor groups, the ratio of apoptosis and proliferation indexes (AI/PI) were 0.46 ± 0.14, 0.35 ± 0.12, and 0.23 ± 0.11, respectively. The difference was significant (F = 19.453, P < 0.01). Normal distribution was observed by frequency distribution of AI/PI in gastric carcinoma cells. Tumors exhibited a wide range of AI/PI from 0.05 to 0.46. Overall, the median and mean ± SD of AI/PI were 0.245 and 0.23 ± 0.11, respectively. The value of Skewness and Kurtosis were 0.067 and -0.868, respectively. A stepwise decreasing trend in AI/PI was noted in clinicopathological variables, including lymph node metastasis and beyond metastasis(P < 0.05 for each). Granular staining was observed in both the cytoplasm and cell membrane of survivin, Fas and FasL positive cells. The expression rates of survivin, Fas and FasL in 48 gastric cancer were 56.2%, 43.8% and 60.4%, respectively. Using the median AI/PI of 0.245, we divided the cells into two groups(greater than and less than the median AI/PI). The expression of survivin and FasL in >0.245 were significantly lower than that of < 0.245. On the contrary, the expression of Fas in >0.245 was significantly higher than that of < 0.245. The high expression of ki-67 in tumor was found by confocal microscope.
CONCLUSION: A stepwise decreasing trend in AI/PI may exist in tumor progression, which might be correlated with the up-regulation of survivin gene and the down-regulation of Fas gene.
- Citation: Chen JM, Li WH, Zhou HB, Fen YD, Wang JD, Xie DX, Yu Y. Balance of cell apoptosis and proliferation and its association with related genes in gastric cancer. Shijie Huaren Xiaohua Zazhi 2005; 13(9): 1078-1081
- URL: https://www.wjgnet.com/1009-3079/full/v13/i9/1078.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i9.1078
在人体的正常组织器官, 特定组织中AI/PI维持着动态的平衡状态. 细胞的凋亡与增殖是紧密偶联的, 在高增殖、高分化和更具侵袭性的肿瘤中, 常观察到高的凋亡率. 近年来, 凋亡与增殖和生存状态的关系, 引起人们的密切关注[1-3]. 凋亡和增殖细胞转换平衡机制的改变将导致组织内环境稳定的紊乱. 失控的增殖和凋亡与各种肿瘤密切相关[4]. 在幽门螺杆菌引起胃上皮细胞的凋亡研究中发现, 从萎缩性胃炎、肠上皮化生到分化不良的演变中, 细胞凋亡和细胞增殖的平衡机制发生了一系列改变, 但仍能达到新的动态平衡. 而在胃癌中平衡机制被打破[5]. 我们对胃癌细胞中的凋亡群体与增殖群体同时进行联合分析, 揭示其中发生的凋亡与增殖平衡机制的破坏规律, 并探讨其与相关基因的关系如下.
2000-09/2001-06华中科技大学同济医学院附属同济医院普外科手术切除标本, 其中胃正常组10例(同期胃溃疡手术切除标本, 取远离溃疡、临床观察正常的胃黏膜组织), 癌旁组10例(取胃癌边缘5 cm以内的胃黏膜组织), 胃癌标本48例. 胃癌患者术前均未接受过化疗或放疗. 其中男32例, 女16例. 年龄24-74(平均54.4)岁. 术前内镜活检病检诊断, 术后病理诊断证实. 标本均经中性甲醛固定, 常规石蜡包埋, 作4 μm厚连续切片.
应用流式细胞仪, 分别定量分析细胞的凋亡群体和增殖群体; 免疫组化方法检测survivin, Fas与FasL基因表达的变化; 共聚焦显微镜对细胞增殖进行形态学观察.
1.2.1 流式细胞术: 手术切除的新鲜标本迅速置于4℃的冷PBS液中, 充分清除标本上的坏死组织、黏液和残留血液. 将经过上述处理的标本重新置于清亮的冷PBS液中, 用手术刀片轻柔刮削组织直至PBS液变混浊, 先用80目的尼龙网过滤. 取滤液进一步用200目纤维膜过滤, 滤液用PBS液洗涤两次(800 r/min×5 min), 弃上清, 细胞用800 ml/L的冰乙醇固定, 置于-20℃的冰箱中过夜. 固定细胞用PBS洗涤2次, 2.5 g/L的TritonX-100处理5 min, 再用PBS洗涤2次, 加入用10 g/L BSA稀释的鼠抗人Ki-67mAb(100 μL含 5×105细胞与0.25 μg抗体反应), 在4℃孵育过夜. 次日细胞用PBS液洗涤, 加入标有F-ITC羊抗鼠IgG抗体(Dako公司. 用10 g/LBSA以1: 40的比例稀释), 在室温下孵育30 min, 再次洗涤细胞后, 用10 mg/L PI和1.0 g/L RnaseA室温避光染色20 min. 抗体特异性同质对照采用同质特异性抗体鼠抗人IgG mAb(Dako公司). 经处理的细胞, 荧光标记成功后, 应用FACSort流式细胞仪(Becton Dickson, 美国)检测, 经488 nm激光激发, 被标记的细胞发射的红色(PI)和绿色(FITC)荧光同时被FAC Sort流式细胞仪的标准透镜接收, 应用Cellquest软件(Becton Dickson, 美国), 对上述所测细胞的双参数荧光强度任一细胞群体的平均荧光强度进行分析. 凋亡群体(apoptosis population): 应用流式细胞术, 可诱出Sub G1峰, 测量凋亡群体. 增殖群体(proliferation population): Ki-67可代表大部分增殖细胞, 测Ki-67阳性部分.
1.2.2 免疫组织化学染色: 采用免疫组织化学SP法. 一抗survivin兔抗人多克隆抗体、Fas兔抗人多克隆抗体、FasL兔抗人多克隆抗体均为美国Santa Cruz公司产品; SP试剂盒为美国Zymed公司产品, 一抗工作浓度均为1: 50. 实验步骤严格按试剂盒说明书进行. 石蜡切片脱蜡, 以微波枸橼酸盐进行抗原修复, DAB显色, 苏木精复染, 脱水, 透明封片, 显微镜下观察, 用已知的阳性切片作为阳性对照, 用磷酸盐缓冲液代替一抗, 作为阴性对照. 结果判定: 在组织切片中survivin, Fas, FasL阳性细胞均表现为胞质或胞膜染为棕黄色. 判定标准: 阳性细胞数≤5%为阴性(-), 阳性细胞数>5%为阳性(+).
1.2.3 共聚焦显微镜观察胃癌细胞增殖的形态学: 中性甲醛固定标本, 用LEICA切片机连续制备10 μm切片. 一抗为鼠抗人Ki-67 mAb, 一抗工作浓度为1: 100. 常规免疫组化染色后, 加PI(propidium iodide), 室温避光放置20 min; 经双荧光标记后的组织切片封片后用Confocal(购自Leica公司)进行扫描, 经488 nm激光激发, 被标记细胞同时发射红色(PI)和绿色(FITC)荧光. 分别被Confocal的不同透镜接收.
统计学处理 采用SPSS11.1统计软件包进行统计学处理. 计量资料采用单因素方差分析, 实验数据以mean±SD表示, 当各组均数之间差异有显著性后, 进一步两两比较采用q检验. 计数资料采用χ2检验.
胃正常组, 癌旁组到肿瘤组细胞演进过程中, AI/PI呈逐渐下降的趋势. 胃正常组, 癌旁组和肿瘤组细胞相互之间, 差异有显著性(P<0.01, 表1).
胃癌细胞的AI/PI经频数分布表分析和检验均服从正态分布. 胃癌细胞AI/PI范围0.05-0.46. 中位数和均数±标准差分别为0.245和0.23±0.11. Skewness的值为0.067, Kurtosis的值为-0.868. 胃癌细胞AI/PI与临床病理特征的关系中, AI/PI在肿瘤的大小、分化程度和浸润深度等病理特征中, AI/PI呈下降的趋势, 但未见统计学差异. 随着肿瘤细胞的淋巴转移、远处转移, 差异有显著性(P<0.05, 表2).
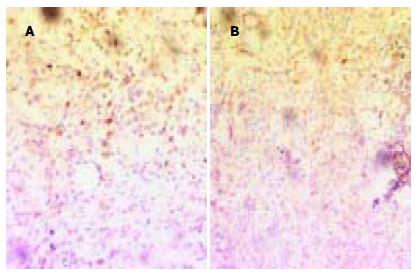
survivin, Fas与FasL基因表达阳性染色主要定位于肿瘤细胞胞质或胞膜中, 为粗细不一的棕黄色颗粒(图1A-B). 在48例胃癌中survivin, Fas与FasL的阳性表达率分别为56.2%, 43.8%和60.4%. survivin蛋白表达阳性的27例癌组织中有15例Fas阳性, 20例FasL阳性. 经Spearman等级相关分析survivin基因与Fas, FasL的表达显著性相关(相关系数分别为r = 0.37和r = 0.407, P<0.01). 根据AI/PI的中位数值0.245, 将胃癌细胞分为>0.245组和<0.245组. 结果显示相应的两组组织切片中survivin阳性表达率增加(χ2 = 6.857, P<0.01), 而Fas的阳性表达率降低(χ2 = 4.148, P<0.05)和FasL的阳性表达率增加(χ2 = 4.269, P<0.05, 表3).
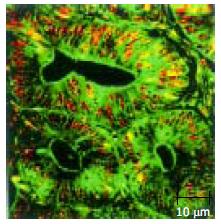
另共聚焦显微镜下见肿瘤组织中Ki-67高表达. 由胃腺癌可见, 腺体大小不等, 排列紊乱, 间距减少, 腺体中Ki-67高表达(图2).
探讨肿瘤演化进展中细胞凋亡和增殖平衡破坏的机制, 对肿瘤生物学特性的揭示, 具有重要意义. 流式细胞术能迅速而准确地分析大的细胞群体的凋亡率和增殖率. 运用Sub G1法分析细胞的凋亡群体, 同时运用双参数法分析Cyclins和DNA含量或通过增殖相关蛋白区分Go期和增殖细胞的方法分析细胞增殖群体[6-8]. 人类Ki-67蛋白的表达严格与细胞增殖有关. Ki-67核抗原是出现在除Go期以外(某些作者认为还包括G1早期)所有细胞周期中的特异性非组蛋白, 与细胞合成代谢有关, 是检测细胞增殖的常用和较好的标记物, 但他的功能意义还尚不清楚[9]. 本结果显示, 胃癌中凋亡的频数分布基本呈降低的趋势, 而增殖却呈逐渐增高的趋势, 二者密切相关. 在肿瘤的临床病理特征中, 随着肿瘤的恶性进展AI/PI呈下降的趋势. AI/PI提示肿瘤细胞群体中净增细胞所占的比例. AI/PI总体呈下降的趋势表明, 随着肿瘤细胞的恶性进展, 肿瘤细胞群体中净增细胞所占的比例越来越大. 这可能与肿瘤细胞的进化演进中, 由于固定的突变率的存在, 肿瘤细胞逐渐获得异常增殖、减少凋亡、无限复制和易侵犯和转移等能力密切相关. 但是, 肿瘤细胞生长的过程也伴随着一系列潜在的生长抑制的现象, 例如凋亡、分化、衰老、低氧和限制造成细胞的丧失[4,10].
特定组织中癌基因诱导的凋亡与增殖平衡的破坏在肿瘤的演化进展中起决定作用[11]. survivin是IAP家族的一个新成员. 生存素具有强大的抑制细胞凋亡的功能, 能够直接抑制caspase3和caspase7的活性, 抑制Fas, Bax, caspase及多种化疗药物诱导的凋亡, 并在细胞的有丝分裂和胞质分裂中起重要作用[12-14]. Fas抗原是细胞膜I型跨膜蛋白, FasL是Fas在人体内的天然配体, 为II型跨膜蛋白, 他们都属于TNF家族. Fas/FasL结合后可转导凋亡信号, 诱导Fas所在细胞的凋亡. 随着肿瘤细胞的恶性进展, 胃癌细胞AI/PI的降低可能与肿瘤细胞survivin基因表达的上调和Fas表达的下调的协同作用有关.
总之, 探讨肿瘤细胞凋亡与增殖的平衡及其与相关基因的关系, 对指导肿瘤的防治具有积极的意义. 如何运用现代分子生物学的手段, 修复和纠正肿瘤相关基因的结构和功能缺陷, 干预肿瘤细胞凋亡与增殖平衡的破坏, 都需进一步深入研究.
编辑: 张海宁 电编: 潘伯荣
| 1. | Liu S, Edgerton SM, Moore DH 2nd, Thor AD. Measures of cell turnover(proliferation and apoptosis)and their association with survival in breast cancer. Clin Cancer Res. 2001;7:1716-1723. [PubMed] |
| 2. | Michael-Robinson JM, Reid LE, Purdie DM, Biemer-Huttmann AE, Walsh MD, Pandeya N, Simms LA, Young JP, Leggett BA, Jass JR. Proliferation, apoptosis, and survival in high-level microsatellite instability sporadic colorectal cancer. Clin Cancer Res. 2001;7:2347-2356. [PubMed] |
| 3. | Stanton KJ, Sidner RA, Miller GA, Cummings OW, Schmidt CM, Howard TJ, Wiebke EA. Analysis of Ki-67 antigen expression, DNA proliferative fraction, and survival in resected cancer of the pancreas. Am J Surg. 2003;186:486-492. [PubMed] |
| 4. | Evan GI, Vousden KH. Proliferation, cell cycle and apoptosis in cancer. Nature. 2001;411:342-348. [PubMed] |
| 5. | Xia HH, Talley NJ. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: implications in gastric carcinogenesis. Am J Gastroenterol. 2001;96:16-26. [PubMed] |
| 6. | Lockshin RA, Zakeri Z. Programmed cell death and apoptosis: origins of the theory. Nat Rev Mol Cell Biol. 2001;2:545-550. [PubMed] |
| 7. | Darzynkiewicz Z, Bedner E, Smolewski P. Flow cytometry in analysis of cell cycle and apoptosis. Semin Hematol. 2001;38:179-193. [PubMed] |
| 8. | Gong J, Traganos F, Darzynkiewicz Z. A selective procedure for DNA extraction from apoptotic cells applicable for gel electrophoresis and flow cytometry. Anal Biochem. 1994;218:314-319. [PubMed] |
| 9. | Scholzen T, Gerdes J. The ki-67 protein: from the known and the unknown. J Cell Physiol. 2000;182:311-322. [PubMed] |
| 11. | Pelengaris S, Rudolph B, Littlewood T. Action of myc in vivo-proliferation and apoptosis. Curr Opin Genet Dev. 2000;10:100-105. [PubMed] |
| 12. | Sui L, Dong Y, Ohno M, Watanabe Y, Sugimoto K, Tokuda M. Survivin expression and its correlation with cell proliferation and prognosis in epithelial ovarian tumors. Int J Oncol. 2002;21:315-320. [PubMed] |
| 13. | Hay BA. Understanding IAP function and regulation: a view from Drosophila. Cell Death Differ. 2000;7:1045-1056. [PubMed] |
| 14. | Tamm I, Wang Y, Sausville E, Scudiero DA, Vigna N, Oltersdorf T, Reed JC. IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas (CD95), Bax, caspases, and anticancer drugs. Cancer Res. 1998;58:5315-5320. [PubMed] |