修回日期: 2005-03-01
接受日期: 2005-03-03
在线出版日期: 2005-04-15
目的: 探索通过RNA干涉技术抑制gankyrin的表达对肝癌细胞系HepG2增殖及细胞周期的影响.
方法: 建立稳定表达靶向gankyrin的shRNA的HepG2细胞系. 通过Western blotting验证基因表达的抑制效果. 采用细胞计数及MTT法检测细胞的增殖能力. 流式细胞仪分析细胞周期.
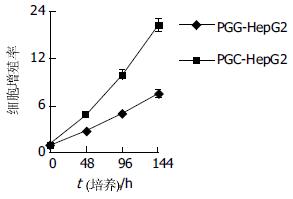
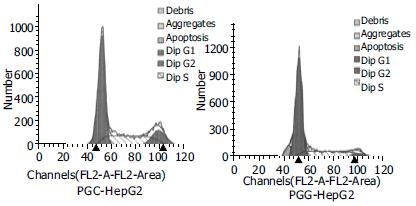
结果: 抑制gankyrin基因的表达显著抑制了HepG2细胞的生长, 与转染阴性对照shRNA质粒细胞相比, 细胞计数示细胞数目明显减低(d 6: 24.4×103±5.2×103vs 123.3×103±2.8×103, P<0.05), MTT分析显示细胞增殖率明显下降(144 h: 7.53±0.50 vs 16.30±0.38, P<0.05), 流式细胞分析示细胞周期阻滞在G1期(G1: 71.63±3.60% vs 52.57±2.82%, P<0.05).
结论: 在HepG2细胞中抑制gankyrin的表达可有效抑制细胞生长并导致细胞周期的阻滞. 利用RNA干涉技术抑制gankyrin的表达可能会成为一种有效的肝癌基因治疗手段.
引文著录: 杨诏旭, 窦科峰, 路凡, 卢兹凡, 赵忠良. 抑制gankyrin的表达对肝癌细胞系HepG2增殖的影响. 世界华人消化杂志 2005; 13(8): 988-992
Revised: March 1, 2005
Accepted: March 3, 2005
Published online: April 15, 2005
AIM: To explore the effect of suppressing gankyrin expression using RNA interference (RNAi) technique on the proliferation and cell cycle of hepatocellular carcinoma cell line HepG2.
METHODS: HepG2 cell line stably expressing shRNA targeted at gankyrin gene was established. The gankyrin expression was assessed by Western blotting analysis. Cell growth was evaluated by cell counting and MTT assay, and cell cycle was analyzed by flow cytometry.
RESULTS: The growth of HepG2 cells was inhibited significantly by suppressing the expression of gankyrin. Compared with the cells transfected with control plasmid, the number of the gankyrin-suppressed cells was much lower (d 6: 24.4×103±5.2×103vs 123.3×103±2.8×103, P<0.05). MTT assay showed cell proliferation was decreased (144 h: 7.53±0.50 vs 16.30±0.38, P<0.05), flow cytometric analysis demonstrated that the cell cycle was stuck at G1 phase (G1: 71.63±3.60% vs 52.57±2.82%, P<0.05).
CONCLUSION: Suppression of the expression of gankyrin in HepG2 cells leads to cell proliferation inhibition and cell cycle arrest. RNAi-mediated inhibition of gankyrin may be a useful therapeutic approach for human hepatocellular carcinoma.
- Citation: Yang ZX, Dou KF, Lu F, Lu ZF, Zhao ZL. Effects of suppressing gankyrin expression on proliferation of human hepatocellular carcinoma cell line HepG2. Shijie Huaren Xiaohua Zazhi 2005; 13(8): 988-992
- URL: https://www.wjgnet.com/1009-3079/full/v13/i8/988.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i8.988
肝细胞癌(HCC)是我国最常见的恶性肿瘤之一, 与肝炎病毒的感染以及多种肿瘤相关基因的异常表达密切相关. Gankyrin(癌性锚蛋白重复蛋白, GeneBank NM-02814)是近年来发现的癌基因[1], 几乎在所有的肝癌组织中高表达[1-2], 因此他也为我们对肝癌的基因治疗提供了一个潜在的靶点. 我们通过短发夹状RNA(small hairpin RNA, shRNA)载体pGenesil-1(武汉晶赛生物技术公司提供)携带靶向gankyrin的shRNA对肝癌细胞系中的gankyrin基因进行过RNA干涉研究, 发现针对靶序列(AAGGACCATTATGAGGCTACA, gankyrin cDNA 的第501-521个碱基)的shRNA可有效抑制gankyrin的表达, 现研究抑制gankyrin的表达对HepG2细胞增殖及细胞周期的影响.
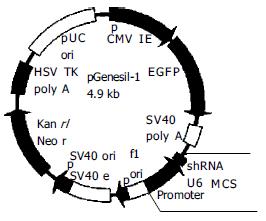
重组质粒pGensil-1-gankyrin(转录靶向gankyrin的shRNA序列, 简称PGG)及阴性对照质粒pGensil-1-control(转录与所有人鼠基因均不同源的shRNA序列, 简称PGC)为本室保存. 载体pGenesil-1含抗G418的耐药基因, 可在G418作用下筛选稳定转染的细胞. 同时携带绿色荧光蛋白(EGFP)基因, 可直接在正置荧光显微镜下观察转染效率并挑取成功转染的细胞克隆. 编码shRNA的引物序列插入到BamHⅠ和HindIII酶切位点之间, 由U6启动子启动转录(图1). 阴性对照PGC 所编码的shRNA与所有人鼠基因均不同源(图2). Transfast 转染试剂购自Promega. HepG2细胞培养于DMEM(Gibco)培养基加100 mL/L胎牛血清中, 至对数生长期. 将1×105个细胞接种于24孔板, 从而使细胞在转染时的汇合率达到80%-90%.24 h后按每孔1 μg质粒分别将PGG, PGC质粒转染细胞(操作按Transfast转染试剂盒说明进行).48 h后胰酶消化细胞并均匀铺于24孔板内. 按终浓度500 mg/L 加入G418, 筛选稳定表达shRNA的细胞克隆.
1.2.1 Western b: lotting分析: 将筛选的细胞克隆扩大培养. 取1×106个细胞加入100 μL细胞裂解液(10 mmol/L Tris-HCL pH7.5, 10 g/L Triton X-100, 150 mmol/L NaCl, 1 mmol/L EDTA PH8.0, 1 mmol/L EGTA, 5 g/L NP-40, 用前加入1 mg/L aprotinin, 1 mg/L leupeptin, 1 mg/L pepstatin, 0.2 mmol/L PMSF)进行裂解. 于冰上裂解30 min, 所得裂解液, 于12 000 g, 4℃离心10 min. 蛋白定量按BCA蛋白定量试剂盒说明书进行. 取上清加入1/4体积的5×SDS蛋白加样缓冲液, 煮沸10 min. 所得蛋白样品, 经120 g/L SDS-PAGE分离后, 电转至硝酸纤维素膜上, 丽春红染色验证蛋白转移成功. 以5 g/L的脱脂奶粉封闭2 h后, 依次加入兔抗gankyrin抗血清(室温2 h, TTBS洗4次), 及山羊抗兔IgG-AP(室温1 h, TTBS洗3次, TBS洗1次), 最后加入NBT/BCIP底物显色.
1.2.2 细胞增殖状况分析: 将稳定转染PGG, PGC的HepG2细胞按5×103个细胞每孔接种于24孔板, 每24 h取3孔, 用胰蛋白酶消化后, 分别进行细胞计数, 取平均值. 连续观察7 d, 绘制生长曲线, 并按以下公式计算群体倍增时间(population doubling time, PDT) = [log2/(logNt-logN0)]×t, 其中N0和Nt分别代表接种时和培养t小时后的细胞数. 分别将上述细胞按1×103个细胞每孔接种于96孔板, 分别于培养6, 48, 96, 144 h后, 加入MTT(5 g/L, Sigma)20 μL, 继续培养4 h, 移除培养液, 加DMSO 200 μL, 充分振摇10 min, 在酶联免疫检测分析仪上测定吸光度(A570nm). 细胞增殖率 = A570nm(48, 96, 144 h)/A570nm(6 h). 以只加培养液不加细胞的空白对照孔调零. 每一个实验点均设3组重复.
1.2.3 细胞周期分析: 收集1×106个细胞, 用PBS洗涤, 置于4℃预冷的细胞固定液(700 mL/L酒精, 300 mL/L PBS)中固定并于4℃保存. 测量时去除乙醇用碘化丙啶 (PI)染色, 于流式细胞仪分析细胞周期.
统计学处理 组间比较用Student's t检验, 用SPSS 10.0进行分析.
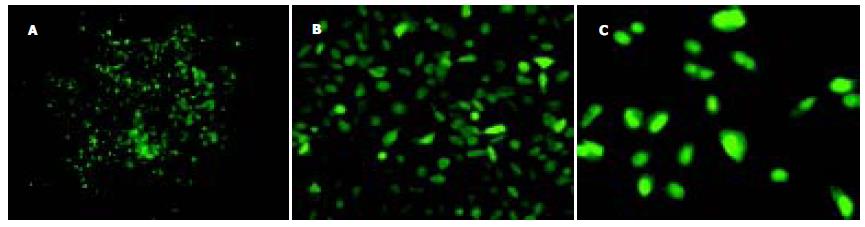
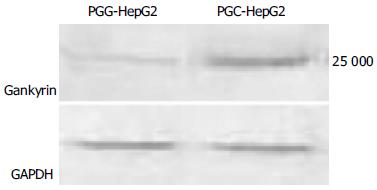
于G418筛选培养约2-3 wk后, 稳定转染PGG及阴性对照PGC质粒的细胞克隆形成. 于荧光正置显微镜下观察, 见部分克隆带绿色荧光, 取之进一步扩大培养(图3). Western blotting结果验证在PGG细胞内gankyrin的表达被有效抑制(图4).
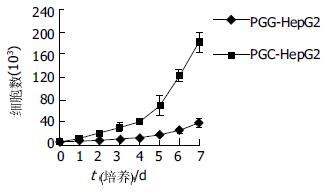
PGG细胞的生长速度明显低于PGC细胞, 所绘制的生长曲线明显向右下移动(图5), 群体倍增时间明显延长(61.05 h vs 28.41 h). MTT分析结果显示在各个时间点上, PGG细胞的增值率均明显低于PGC细胞(图6). 二者均提示抑制gankyrin的表达引起HepG2细胞的生长抑制.
PGG细胞的G1期明显高于PGC细胞(71.63±3.60% vs 52.57±2.82%, P<0.05), G2期(4.33 ±1.31% vs 16.03±1.81%, P<0.05)及S期(24.03±3.67% vs 31.40±1.01%, P<0.05)均明显低于PGC细胞. 提示更多的PGG细胞被阻滞在G1期(图7).
癌基因的过表达被认为与多种肿瘤的发生发展密切相关, 同时也为肿瘤的治疗提供了一个潜在的靶点[3]. RNA干涉(RNA interference, RNAi)是近年来发展起来的新技术, 相对于传统的反义核酸技术, 对靶基因的抑制作用强、特异性高[4]. 而DNA载体介导的shRNA则可以稳定而持久地抑制靶基因的表达[5-10]. 近年来RNAi在基因功能、抗肿瘤和抗病毒基因治疗方面均有着广泛的应用[11-16]. 虽然发现肿瘤抑制基因p53 及p16INK4A等的失活与肝癌的发生关系密切, 但其机制并不清楚, 且并没有发现在肝癌上普遍激活的癌基因[1,17].2000年Higashitsuji et al[1]通过比较肝癌组织与正常肝组织的cDNA首次发现在肝癌组织中存在gankyrin的过表达. 并分别有实验调查了34[1]及64[2]例肝癌患者, 结果gankyrin在癌组织中的过表达率分别为100%(34/34)及96.9%(62/64), 而在正常的肝组织中则不存在gankyrin的表达[2]. 而我们也调查了3种肝癌细胞系HepG2, SMMC-7721, HHCC, 结果显示均存在gankyrin的表达. Gankyrin包含6个锚蛋白重复序列, 是一个癌基因, 属于锚蛋白(ankyrin)重复序列家族的成员. 锚蛋白重复序列(ankyrin repeat)是生物体中广泛利用的一种序列模体, 他由数目不等的ankyrin串联起来, 形成种类众多但功能各异的ankyrin蛋白质分子. 其中ankyrin结构域介导蛋白质与蛋白质的相互作用, 他能够和多种配体结合, 实现纷繁复杂的生物功能. Gankyrin可以与Rb蛋白结合, 促使其磷酸化, 降低Rb的稳定性, 释放出转录因子E2F1的活性, 而E2F1则是促使细胞进入增殖周期的重要因子, E2F与其他一些癌基因共同转染可促进细胞的恶性转变[1,17]. Gankyrin同时可以与CdK4结合, 对抗p16INK4A及p18INK4C对肿瘤生长的抑制作用[17-22]. 在一个肝癌形成的动物模型中, 发现从肿瘤发生的最初阶段, 即出现了gankyrin的过表达[23-24]. 而在爆发性肝坏死后的再生过程中, 也存在gankyrin的表达[25-26]. 这些结果表明, 在肝癌的发生过程及肝细胞的生长周期调控中, gankyrin起着重要的作用, 同时也为肝癌的治疗提供了一个潜在的靶点. 利用新兴的RNA干涉技术, 如能有效抑制gankyrin的表达, 将有可能起到治疗肝癌的作用.
我们采用shRNA抑制gankyrin的表达. 由于脂质体转染试剂介导的细胞转染相对于病毒效率较低, 可能会影响基因沉默的效果, 所以我们采用稳定转染挑取细胞克隆. 为了防止自身耐药细胞的繁殖影响试验结果, 我们选择pGenesil-1作为shRNA载体. PGenesil-1同时含G418耐药基因及绿色荧光蛋白(EGFP)基因, 通过可激发的绿色荧光可以直接在正置荧光显微镜下判断转染效率. 且在使用G418的同时, 可在直视下判断所形成的细胞克隆是否是成功转染的细胞. 由于有研究认为siRNA本身也具有细胞增殖的抑制作用[27], 所以我们选择一段与人鼠基因均不同源的shRNA序列作为阴性对照.
我们的结果显示, 抑制gankyrin的表达将明显抑制HepG2细胞的增殖, 细胞生长曲线明显右移, 群体倍增时间显著延长, 细胞增长率明显降低. 流式细胞分析显示更多的PGG-HepG2细胞被阻滞在G1期, 由于gankyrin的过表达可引起Rb的磷酸化, 从而释放E2F1的活性, 抑制gankyrin的表达可能会使E2F1重新被抑制, 这可能是细胞周期变化的机制之一, 进一步的实验应测定Rb的磷酸化水平及E2F1的活性. 总之, 抑制gankyrin的表达可能会成为一种有效的肝癌基因治疗手段. 当然, 进一步应进行相应的体内试验以证明其可行性.
编辑: 张海宁 电编: 潘伯荣
| 1. | Higashitsuji H, Itoh K, Nagao T, Dawson S, Nonoguchi K, Kido T, Mayer RJ, Arii S, Fujita J. Reduced stability of retinoblastoma protein by gankyrin, an oncogenic ankyrin-repeat protein overexpressed in hepatomas. Nat Med. 2000;6:96-99. [PubMed] |
| 2. | Fu XY, Wang HY, Tan L, Liu SQ, Cao HF, Wu MC. Overexpression of p28/gankyrin in human hepatocellular carcinoma and its clinical significance. World J Gastroenterol. 2002;8:638-643. [PubMed] |
| 3. | Malumbres M, Barbacid M. To cycle or not cycle: a critical decision in cancer. Nat Rev Cancer. 2001;1:222-231. [PubMed] |
| 4. | Bertrand JR, Pottier M, Vekris A, Opolon P, Maksimenko A, Malvy C. Comparison of antisense oligonucleotides and siRNAs in cell culture and in vivo. Biochem Biophys Res Commun. 2002;296:1000-1004. [PubMed] |
| 5. | Paul CP, Good PD, Winer I, Engelke DR. Effective expression of small interfering RNA in human cells. Nat Biotechnol. 2002;20:505-508. [PubMed] |
| 6. | Sui G, Soohoo C, Affar el B, Gay F, Shi Y, Forrester WC, Shi Y. A DNA vector-based RNAi technology to suppress gene expression in mammalian cells. Proc Natl Acad Sci USA. 2002;99:5515-5520. [PubMed] |
| 7. | McCaffrey AP, Meuse L, Pham TT, Conklin DS, Hannon GJ, Kay MA. RNA interference in adult mice. Nature. 2002;418:38-39. [PubMed] |
| 8. | Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science. 2002;296:550-553. [PubMed] |
| 9. | Tiscornia G, Singer O, Ikawa M, Verma IM. A general method for gene knockdown in mice by using lentiviral vectors expressing small interfering RNA. Proc Natl Acad Sci USA. 2003;100:1844-1848. [PubMed] |
| 10. | Rubinson DA, Dillon CP, Kwiatkowski AV, Sievers C, Yang L, Kopinja J, Rooney DL, Ihrig MM, McManus MT, Gertler FB. A lentivirus-based system to functionally silence genes in primary mammalian cells, stem cells and transgenic mice by RNA interference. Nat Genet. 2003;33:401-406. [PubMed] |
| 11. | Brummelkamp TR, Bernards R, Agami R. Stable suppression of tumorigenicity by virus-mediated RNA interference. Cancer Cell. 2002;2:243-247. [PubMed] |
| 12. | Yang ZG, Chen Z, Ni Q, Xu N, Shao JB, Yao HP. Inhibition of hepatitis B virus surface antigen expression by small hairpin RNA in vitro. World J Gastroenterol. 2005;11:498-502. [PubMed] |
| 13. | Zhang XN, Xiong W, Wang JD, Hu YW, Xiang L, Yuan ZH. SiRNA-mediated inhibition of HBV replication and expression. World J Gastroenterol. 2004;10:2967-2971. [PubMed] |
| 14. | Ni Q, Chen Z, Yao HP, Yang ZG, Liu KZ, Wu LL. Inhibition of human La protein by RNA interference downregulates hepatitis B virus mRNA in 2. 2. 15 cells. World J Gastroenterol. 2004;10:2050-2054. [PubMed] |
| 15. | Cheng SQ, Wang WL, Yan W, Li QL, Wang L, Wang WY. Knockdown of survivin gene expression by RNAi induces apoptosis in human hepatocellular carcinoma cell line SMMC-7721. World J Gastroenterol. 2005;11:756-759. [PubMed] |
| 16. | Jiang M, Rubbi CP, Milner J. Gel-based application of siRNA to human epithelial cancer cells induces RNAi-dependent apoptosis. Oligonucleotides. 2004;14:239-248. [PubMed] |
| 17. | Nagao T, Higashitsuji H, Nonoguchi K, Sakurai T, Dawson S, Mayer RJ, Itoh K, Fujita J. MAGE-A4 interacts with the liver oncoprotein gankyrin and suppresses its tumorigenic activity. J Biol Chem. 2003;278:10668-10674. [PubMed] |
| 18. | Dawson S, Apcher S, Mee M, Higashitsuji H, Baker R, Uhle S, Dubiel W, Fujita J, Mayer RJ. Gankyrin is an ankyrin-repeat oncoprotein that interacts with CDK4 kinase and the S6 ATPase of the 26 S proteasome. J Biol Chem. 2002;277:10893-10902. [PubMed] |
| 19. | Yuan C, Li J, Mahajan A, Poi MJ, Byeon IJ, Tsai MD. Solution structure of the human oncogenic protein gankyrin containing seven ankyrin repeats and analysis of its structure--function relationship. Biochemistry. 2004;43:12152-12161. [PubMed] |
| 20. | Krzywda S, Brzozowski AM, Al-Safty R, Welchman R, Dawson S, Fujita J, Higashitsuji H, Mayer RJ, Wilkinson AJ. Crystallization of gankyrin, an oncoprotein that interacts with CDK4 and the S6b (rpt3) ATPase of the 19S regulator of the 26S proteasome. Acta Crystallogr D Biol Crystallogr. 2003;59:1294-1295. [PubMed] |
| 21. | Padmanabhan B, Adachi N, Kataoka K, Horikoshi M. Crystal structure of the homolog of the oncoprotein gankyrin, an interactor of Rb and CDK4/6. J Biol Chem. 2004;279:1546-1552. [PubMed] |
| 22. | Krzywda S, Brzozowski AM, Higashitsuji H, Fujita J, Welchman R, Dawson S, Mayer RJ, Wilkinson AJ. The crystal structure of gankyrin, an oncoprotein found in complexes with cyclin-dependent kinase 4, a 19 S proteasomal ATPase regulator, and the tumor suppressors Rb and p53. J Biol Chem. 2004;279:1541-1545. [PubMed] |
| 23. | Park TJ, Kim HS, Byun KH, Jang JJ, Lee YS, Lim IK. Sequential changes in hepatocarcinogenesis induced by diethylnitrosamine plus thioacetamide in Fischer 344 rats: induction of gankyrin expression in liver fibrosis, pRB degradation in cirrhosis, and methylation of p16(INK4A)exon 1in hepatocellular carcinoma. Mol Carcinog. 2001;30:138-150. [PubMed] |
| 24. | Lim IK. Spectrum of molecular changes during hepatocarcino-genesis induced by DEN and other chemicals in Fisher 344 male rats [Mechanisms of Ageing and Development 123 (2002) 1665-1680]. Mech Ageing Dev. 2003;124:697-708. [PubMed] |
| 25. | Iwai A, Marusawa H, Kiuchi T, Higashitsuji H, Tanaka K, Fujita J, Chiba T. Role of a novel oncogenic protein, gankyrin, in hepatocyte proliferation. J Gastroenterol. 2003;38:751-758. [PubMed] |
| 26. | Qin JM, Fu XY, Li SJ, Liu SQ, Zeng JZ, Qiu XH, Wu MC, Wang HY. Gene and protein expressions of p28/GANK in rat with liver regeneration. World J Gastroenterol. 2003;9:2523-2527. [PubMed] |
| 27. | Nagy P, Arndt-Jovin DJ, Jovin TM. Small interfering RNAs suppress the expression of endogenous and GFP-fused epidermal growth factor receptor (erbB1)and induce apoptosis in erbB1-overexpressing cells. Exp Cell Res. 2003;285:39-49. [PubMed] |