修回日期: 2005-02-11
接受日期: 2005-02-16
在线出版日期: 2005-04-15
目的: 为建立可回复性永生化肝细胞株, 构建带有筛选基因NeoR、报道基因EGFP及重组位点loxP的可回复性永生化逆转录病毒载体.
方法: 将2.1 kb SV40T亚克隆到pIRES2-EGFP的相应位点, 再酶切下3.4 kb SV40T-IRES-EGFP片段插入逆转录病毒载体pLNCX2的两个相同酶切位点之间, 构成新载体pLNCTIG. 最后, 将线性化pLNCTIG和loxP双链片段混合连接. 取连接产物转化高效感受态DH5α细胞. 菌落PCR和酶切法鉴定阳性克隆. 转染包装细胞PT67并在荧光显微镜下观察绿色荧光蛋白的表达. 扩大培养稳定转染的细胞, 免疫组化染色检测SV40T基因的表达.
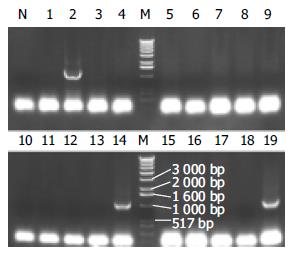
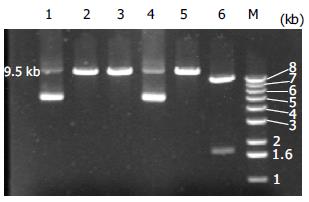
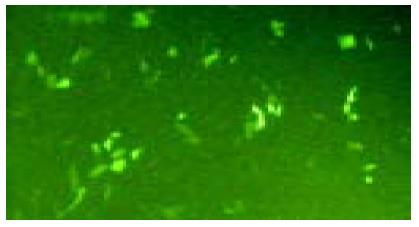
结果: 随机挑取19个克隆, 3个电泳分离出约1.1 kb阳性条带. 取上述阳性克隆进行酶切鉴定, 结果仅出现一条约9.5 kb的条带, 证明该克隆为阳性重组体. 转染PT67细胞24 h后, 荧光显微镜下可见散在多处绿色荧光. 免疫组化染色显示细胞胞核呈阳性染色.
结论: 成功构建并表达可回复性永生化逆转录病毒载体pLNCTIGlox.
引文著录: 陈耀凯, 李俊刚, 王宇明. 可回复性永生化逆转录病毒载体pLNCTIGlox的构建与表达. 世界华人消化杂志 2005; 13(8): 975-978
Revised: February 11, 2005
Accepted: February 16, 2005
Published online: April 15, 2005
AIM: To construct a retroviral vector carrying selection marker gene NeoR, reporter gene EGFP and recombination site sequence LoxP for hepatocyte reversible immortalization.
METHODS: 2.1 kb SV40T gene was inserted into vector pIRES2-EGFP to obtain a 3.4 kb fragment of SV40T-IRES-EGFP by restriction endonuclease digestion. The fragment was further subcloned into retroviral vector pLNCX2 to obtain a new vector pLNCTIG. The linearized pLNCTIG was mixed with double stranded LoxP to construct pLNCTIGlox. Escherichia coli DH5α was transformed with pLNCTIGlox and positive clones were identified by colony polymerase chain reaction (PCR) and restriction endonuclease digestion. PT67 cells were transfected with pLNCTIGlox and the expression of green fluorescence protein was observed. The transfected cells were stained immunochemically to detect the expression of SV40 large T antigen.
RESULTS: Among the 19 randomly selected colonies, 3 showed positive DNA bands on electrophoresis gel. One of the three clones was further analyzed by restriction endonuclease digestion and only one 9.5 kb band was separated electrophoretically, demonstrating that the analyzed clone was the positive recombinant. Twenty-four hours after transfection, PT67 cells emitted green fluorescence under the fluorescence microscope. The nuclei of the transfected cells were positive for immunochemical staining.
CONCLUSION: The retroviral vector pLNCTIGlox for reversible immortalization was successfully constructed and expressed.
- Citation: Chen YK, Li JG, Wang YM. Construction and expression of a retroviral vector pLNCTIGlox for reversible immortalization. Shijie Huaren Xiaohua Zazhi 2005; 13(8): 975-978
- URL: https://www.wjgnet.com/1009-3079/full/v13/i8/975.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i8.975
以肝细胞为主要生物成分的生物人工肝、肝细胞移植关键是获得理想的肝细胞材料[1-2]. 肝细胞永生化是解决肝细胞来源的重要途径之一[2-5], 但传统肝细胞株存在安全性及特异性功能分化较差的缺点. 可回复性永生化(reversible immortalization)是先将永生化基因SV40T导入原代细胞以获得永生化细胞株, 然后再以特异性位点重组技术切除SV40T基因, 使细胞株回复到永生化前的状态[1,6-8]. 我们以永生化载体pLLTSN[9]为基础进一步构建了新霉素抗性基因NeoR作为筛选基因, 加强型绿色荧光蛋白EGFP作为报道基因, SV40T 作为目的基因, loxP作为重组位点的可回复性永生化逆转录病毒载体.
逆转录病毒载体pLLTSN为本组前期研究成果, 该质粒含有SV40T基因序列[9]; 质粒pIRES2-EGFP和pLNCX2购自美国Clontech公司; 限制性内切酶EcoRⅠ, BamHⅠ等购自英国NEB公司; T4 DNA连接酶为美国Promega公司产品; 大肠杆菌DH5α株为本研究所保存菌种; pfu DNA聚合酶购自北京鼎国公司; 2×PCR混合液和玻璃珠法DNA胶回收纯化试剂盒购自上海生工生物工程技术有限公司; PCR产物纯化试剂盒为德国Roche公司产品. 基因转染试剂Perfectin为美国GTS公司产品. 所有引物均由中国上海生工生物工程有限公司合成, PAGE纯化后去离子水溶解, 浓度均为50 μmol/L. 正链引物EgfpPs(EGFP 编码序列1-14 nt附加酶切位点)为5'-ATCAGTCGACACCATGGTGAGCAAGGG-3'. loxP片段正链LoxPs为5'-CTAGTGGGAATAACTTCGTATAGCATACATTATACGAAGTTATGCTGC-3'. loxP片段负链LoxPas为5'-CTAGGCAGCATAACTTCGTATAATGTA TGCTATACGAAGTTATTCCCA-3'. 小鼠抗SV40T mAb为美国Santa Cruz产品.
使用EcoRⅠ和BamHⅠ酶切下pLLTSN载体上的2.1 kb SV40T, 亚克隆到pIRES2-EGFP的相应位点, 构成的新载体称为pCTIG. 再用XhoⅠ和NotⅠ酶切下pCTIG上的约3.4 kb SV40T-IRES-EGFP片段, 插入逆转录病毒载体pLNCX2的两个相同酶切位点之间, 构成新载体pLNCTIG. 最后, 用XbaⅠ酶切线性化pLNCTIG产生两个相同的粘端; 人工合成的loxPs(正链)和loxPas(负链)在PCR缓冲液中等摩尔比混匀, 94℃加热10 min, 置室温缓慢冷却退火, 形成的双链具有两个与XbaⅠ酶切末端相同的4碱基粘端. 将回收的线性化pLNCTIG和loxP双链片段按约1: 8的摩尔比混合, 45℃水浴5 min, 再冷却到0℃, 置于冰上, 在10 μL体系中加入10×反应缓冲液1 μL和T4 DNA连接酶1 μL, 16℃连接过夜. 次日取连接产物2 μL转化高效感受态DH5α细胞. loxP重组阳性克隆pLNCTIGlox的鉴定如下. (1)菌落PCR法用与载体pLNCTIG序列互补的引物egfpPs和插入片段loxP的负链loxPas配对进行PCR. 在20 μL反应体系中加入无菌水9.2 μL, 2×PCR混合液10 μL, EgfpPs和loxPas各0.4 μL, 以高压灭菌牙签沾取单个菌落少许, 点入反应体系中作为模板. 反应条件: 94℃预变性5 min; 然后94℃ 30 s, 65℃ 30 s, 72℃ 1 min共30个循环; 最后72℃延伸10 min. 将PCR产物进行8 g/L琼脂糖凝胶电泳, 电泳分离出约1.1 kb条带者为阳性. (2)酶切法 取PCR阳性克隆接种于 5 mL含100 kU/L氨苄西林的LB培养基中, 37℃摇床中250 r/min振荡培养过夜. 碱裂解法提取质粒DNA, 以BamHⅠ和XbaⅠ双酶切后进行8 g/L琼脂糖凝胶电泳分析, 同时以母载体pLNCTIG行相同双酶切作为对照. 阴性对照将电泳分离出约7.8 kb和1.7 kb条带, 阳性克隆因XbaⅠ酶切位点消失而只被BamHⅠ线性化为一条约9.5 kb的条带.
质粒转染前将包装细胞PT67培养至50%-70%汇片. 用43 μL无血清DMEM稀释7 μL Perfectin, 将2 μg纯化的pLNCTIGlox质粒DNA稀释于50 μL DNA稀释液中, 5 min后将二者混合, 置室温5-20 min以形成DNA-脂质体复合物, 再加100 μL DMEM和终浓度为80 mL/L的胎牛血清, 混匀后用其替换24孔板孔中PT67细胞的培养液. 继续培养24 h后更换新鲜的完全DMEM, 并在荧光显微镜下观察绿色荧光蛋白的表达. 转染后48 h按1: 10的比例分散培养细胞, 加入500 mg/L G418, 每2-4 d更换一次培养液, 选择培养10-20 d以使耐药细胞克隆选择生长. 扩大培养稳定转染的细胞, 制备细胞爬片, 以小鼠抗SV40T抗体为第一抗体进行免疫组化染色检测SV40T基因的表达. 细胞爬片PBS漂洗后以4%多聚甲醛溶液固定30 min, 用含0.2 g/L吐温-20的PBS漂洗, 然后200 mL/L正常山羊血清37℃封闭15 min, 然后加1: 100稀释的第一抗体4℃过夜; 漂洗后移入PBS中浸泡2 min, 再加生物素标记的第二抗体37℃ 45 min; 加结合过氧化物酶链霉亲和素37℃ 45 min; 加新鲜配制的DAB, 显微镜下观察5-10 min, 棕黄色染色为阳性信号; 以未转染的包装细胞PT67作为阴性对照.
菌落PCR法转化感受态细胞后平板上形成的克隆有数百个, 随机挑取19个克隆进行菌落PCR鉴定, 直接鉴定loxP是否插入以及插入的方向. 结果有3个菌落电泳分离出约1.1 kb条带(图1). 从菌落PCR鉴定为阳性的3个克隆质粒中任取1个, 以BamHⅠ和XbaⅠ双酶切后进行8 g/L琼脂糖凝胶电泳分析, 同时以母载体pLNCTIG行相同双酶切作为对照. 结果该克隆只被线性化为一条约9.5 kb的条带, 而pLNCTIG对照电泳分离出约7.8 kb和1.7 kb条带(图2), 证明该克隆为阳性体.
经扩大培养的转染细胞胞核呈阳性染色(图4), 而作为阴性对照的未转染细胞则未见阳性反应.
采用两种限制性内切酶消化外源片段和质粒载体后进行连接, 是质粒载体构建过程中最容易、最有效的克隆策略. 我们将pLLTSN上的2.1 kb SV40T插入到pIRES2-EGFP的EcoRⅠ和BamHⅠ位点之间即是采用这一方法. 然而质粒与外源片段的酶切位点之间并非总是能找到"门当户对"的理想搭配关系, 此时必须采取不同的策略. 在本研究中我们拟在逆转录病毒载体pLNCTIG的3'长末端重复(LTR)序列的U3区插入loxP特异重组位点, 但该处仅有一个XbaⅠ单酶切位点可供利用, 因此只能采用单酶切连接策略插入loxP片段. 用XbaⅠ酶切载体pLNCTIG后产生2个相同的粘端, 通常要将其5'端去磷酸化, 以减少载体自身环化导致较高的非重组体菌落背景. 但若将载体pLNCTIG 5'端去磷酸化, 将无法与loxP双链的匹配末端连接, 原因是loxP作为合成的DNA是缺少5'磷酸基团的. 此时有两种选择可以采用: (1)将载体pLNCTIG 5'端去磷酸化, 再使合成的loxP双链DNA 5'端磷酸化, 然后进行连接. 该方式的缺点是会使loxP片段在重组质粒中形成串联拷贝, 不利于单拷贝重组体的筛选. (2)不将载体pLNCTIG 5'端去磷酸化, 直接与缺少5'磷酸基团的loxP双链DNA进行连接反应, 在此过程中loxP片段在重组质粒中不会形成串联拷贝, 阳性重组质粒只能是插入单拷贝loxP序列的克隆. 我们采用第2种方式, 为了减少载体自身环化, 我们将载体与外源loxP片段的摩尔比提高到1: 8, 以减少非重组体菌落背景. 结果成功, 并已筛选出正向插入XbaⅠ酶切位点的阳性克隆. 由于loxP双链DNA粘端与XbaⅠ酶切粘端连接后, 改变了原来的酶切位点序列, XbaⅠ酶切位点不复存在, 用XbaⅠ酶不能切开重组质粒. 用BamHⅠ和XbaⅠ酶切重组质粒和pLNCTIG, 前者只能被BamHⅠ酶切线性化, 而后者可被BamHⅠ和XbaⅠ酶切为约1.7 kb和7.8 kb大小的两个片段. 实际结果与理论预期完全符合.
Cre/LoxP是最常用的基因位点重组系统, 最早在噬菌体P1的研究中被发现[8]. LoxP位于噬菌体P1染色体交叉部位, 由两个反向重叠序列(reverted repeat)和一个8 bp间隔区组成. Cre是催化位点重组的酶, 与反向重叠序列结合, 剪切两个LoxP之间的DNA序列. 本研究成功构建带有目的基因、筛选基因及LoxP重组位点的质粒载体, 并进行蛋白表达与鉴定, 为下一步进行细胞永生化奠定了良好的基础.
编辑: 张海宁 电编: 潘伯荣
| 1. | Kobayashi N, Okitsu T, Nakaji S, Tanaka N. Hybrid bioartificial liver: establishing a reversibly immortalized human hepatocyte line and developing a bioartificial liver for practical use. J Artif Organs. 2003;6:236-244. [PubMed] |
| 2. | Kobayashit N, Tanaka N. Engineering of human hepatocyte lines for cell therapies in humans: prospects and remaining hurdles. Cell Transplant. 2002;11:417-420. [PubMed] |
| 3. | Sato Y, Endo H, Ajiki T, Hakamata Y, Okada T, Murakami T, Kobayashi E. Establishment of Cre/LoxP recombination system in transgenic rats. Biochem Biophys Res Commun. 2004;319:1197-1202. [PubMed] |
| 4. | Watanabe N, Odagiri H, Totsuka E, Sasaki M. A new method to immortalize primary cultured rat hepatocytes. Transplant Proc. 2004;36:2457-2461. [PubMed] |
| 5. | Wege H, Le HT, Chui MS, Liu L, Wu J, Giri R, Malhi H, Sappal BS, Kumaran V, Gupta S. Telomerase reconstitution immortalizes human fetal hepatocytes without disrupting their differentiation potential. Gastroenterology. 2003;124:432-444. [PubMed] |
| 6. | Kobayashi N, Noguchi H, Westerman KA, Watanabe T, Matsumura T, Totsugawa T, Fujiwara T, Leboulch P, Tanaka N. Cre/loxP-based reversible immortalization of human hepatocytes. Cell Transplant. 2001;10:383-386. [PubMed] |
| 7. | Noguchi H, Kobayashi N, Westerman KA, Sakaguchi M, Okitsu T, Totsugawa T, Watanabe T, Matsumura T, Fujiwara T, Ueda T. Controlled expansion of human endothelial cell populations by Cre-loxP-based reversible immortalization. Hum Gene Ther. 2002;13:321-334. [PubMed] |
| 8. | Min KJ, Young CJ, Sun KM, Chang KS. In vivo excision and amplification of large human genomic segments using the Cre/loxP-and large T antigen/SV40 ori-mediated machinery. J Biotechnol. 2004;110:227-233. [PubMed] |