修回日期: 2005-02-21
接受日期: 2005-03-03
在线出版日期: 2005-04-01
目的: 了解苦参碱(matrine)对L-02人肝细胞系超低温冻存复苏后功能的影响, 探索一种合适肝细胞保存的方法.
方法: 常规培养的L-02人细胞系用胰酶消化后, 将收集的L-02人细胞系分别以六种不同的冻存液(二甲基亚砜、二甲基亚砜+低分子右旋糖苷、二甲基亚砜+低分子右旋糖苷+0.2 mg/L苦参碱、二甲基亚砜+低分子右旋糖苷+2 mg/L苦参碱、二甲基亚砜+低分子右旋糖苷+6 mg/L苦参碱、二甲基亚砜+低分子右旋糖苷+10 mg/L苦参碱)在液氮中冷冻保存1 mo.1 mo后快速复苏L-02人肝细胞系, 做存活率、形态学及功能检测.
结果: 含有不同浓度的苦参碱冻存液保存的L-02人肝细胞系其活率、形态学及功能表现均有所不同, 其中单用二甲基亚砜(DMSO)的冻存液效果最差; 二甲基亚砜+低分子右旋糖苷(Detrax-40)+6 mg/L苦参碱冻存液效果最佳. 二甲基亚砜+低分子右旋糖苷(Detrax-40)+6 mg/L苦参碱冻存液组复苏后L-02人肝细胞系存活率为(89.6%±3.4%), 细胞形态与未冻存组相似, 其尿素及白蛋白分泌量与其他冻存液组有显著差异(P<0.05).
结论: 二甲基亚砜+低分子右旋糖苷+6 mg/L苦参碱联合冻存液显著提高了L-02人肝细胞系的冻存质量.
引文著录: 朱应乾, 高毅, 汪燕. 苦参碱对L-02人肝细胞系液氮下冻存复苏后功能的影响. 世界华人消化杂志 2005; 13(7): 919-922
Revised: February 21, 2005
Accepted: March 3, 2005
Published online: April 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 919-922
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/919.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.919
终末期肝病常需要生物人工肝(bioartificial liver BLA)来维持患者的生命, 为患者等待肝移植提供条件和时间, 目前用生物人工肝治疗肝衰的研究已经越来越得到医学界的重视, 但是生物人工肝的核心是需要大量有活性的肝细胞来进行肝功能支持, 这就大大地限制了生物人工肝的发展, 所以探索出一种实用可靠的低温保存方法, 建立一个肝细胞库, 临床随时可以得到大量高活率、有功能的肝细胞, 生物人工肝技术才能得以普遍推广. 临床上用苦参碱对肝脏疾病进行护肝治疗, 且体外实验证实苦参碱对肝细胞有抗损伤和改善肝细胞分泌蛋白作用[1]. 我们通过对含有苦参碱的不同冻存液冻存L-02人细胞系进行对照研究, 以探讨其低温下对肝细胞是否有保护作用, 寻求一种效果较好的冻存液, 来进一步改善冻存肝细胞的活率及功能.
L-02人肝细胞系由中国医学科学院上海细胞生物研究所提供. 苦参碱(西安, 富捷), Hepes、Trypabblue(上海华美公司), HAMF12、RPMI-1640 (HyClone), 低分子右旋糖苷(Baxter), 胰酶、DMSO(Sigma), 胎牛血清(杭州四季公司). CO2孵箱(Heraeus), 超净工作台(Y F-1型), 冰箱(SANYO Medical Freeze), 六孔培养板、1.8 mL冻存管、75 m2培养瓶(CORNING).
1.2.1 实验准备: 将RPMI-1640常规培养的L-02人肝细胞系用胰酶消化, 用全培养基终止胰酶, 1 000 r/min离心5 min, 弃上清液, 将肝细胞用HAMF12液调至浓度为1.0×1010-2.0×1010/L, 分装入冻存管(CORNING)各0.7 mL备用. 并取1.0×109/L为细胞接种培养板常规培养作对照组(Ⅰ组: 未冻存组), 收集上清液(低温保存)备检.
1.2.2 制备冻存液: 将已配好的六种冻存液各取0.7 mL, 等量分装入有0.7 mL肝细胞悬液的冻存管中, 用吸管轻轻吹打使细胞均匀. 此时, 冻存管中各成分终浓度为: Ⅱ组10% DMSO(100 mL/L)+20% FBS(200 mL/L); Ⅲ组: 5% DMSO+20% FBS+5% Detrax-40(50 g/L); Ⅳ: 组5% DMSO+20% FBS+5% Detrax-40 +0.2 mg/L苦参碱; Ⅴ组: 5% DMSO+20% FBS+5% Detrax-40+2 mg/L苦参碱; Ⅵ组: 5% DMSO+20% FBS+5% Detrax-40+6 mg/L苦参碱, Ⅶ: 5% DMSO+20% FBS+5% Detrax-40 +10 mg/L苦参碱. 细胞终浓度为0.5×1010/L-1.0×1010/L. 冷冻时采用逐级降温方法: 先将冻存管在0℃下冻存30 min, 然后放入-30℃冻存h, 再放入-80℃冻存4 h, 最后移入液氮罐中, 保存1 mo.
1.2.3 L-02人肝细胞系复苏: 1 mo取出冻存管快速置于37℃水浴1-2 min, 震荡直至细胞悬液完全融化, 然后用10倍HAMF12液稀释离心后, 去除上清液, 再重复3次.
1.2.4 调节细胞浓度: 用含FBS(100 mL/L)RPMI-1640培养液调节细胞浓度为1×109/L, 按等同于未冻存组量接种于培养板, 在37℃含50 mL/L CO2的培养箱里培养7 d, 每24 h换一次液, 并收集第1、3、5、7 d培养液(低温保存)备检.⑴人白蛋白含量测定: 用人白蛋白放免试剂盒(北方原子能研究所提供)检测培养上清中人白蛋白含量, 采用放射免疫抗原竞争法, 与牛血清白蛋白无交叉反应[2].⑵尿素含量测定: cx7全自动生化分析仪测定, 采用Beckman传导电极的电导法.
1.2.5 肝细胞活率的测定: 将上述六种冻存系在冷冻保存复温后分别取样, 用苔盼蓝拒染法测定活率. 每天换液前后在倒置相差显微镜下观察培养肝细胞的生长情况及形态变化.
统计学处理 数据以mean±SD表示, 采用SPSS10.0软件对数据作单向方差分析.
胰酶刚消化的细胞活率96.2%±1.4%, Ⅱ组76.6%±3.8%, Ⅲ组81.9%±3.6%, Ⅳ组81.6%±2.4%, Ⅴ组84.7%±2.8%, Ⅵ组89.6%±3.4%, 组86.9%±1.6%. 实验Ⅵ组生存率明显高于其他处理组(P<0.05).
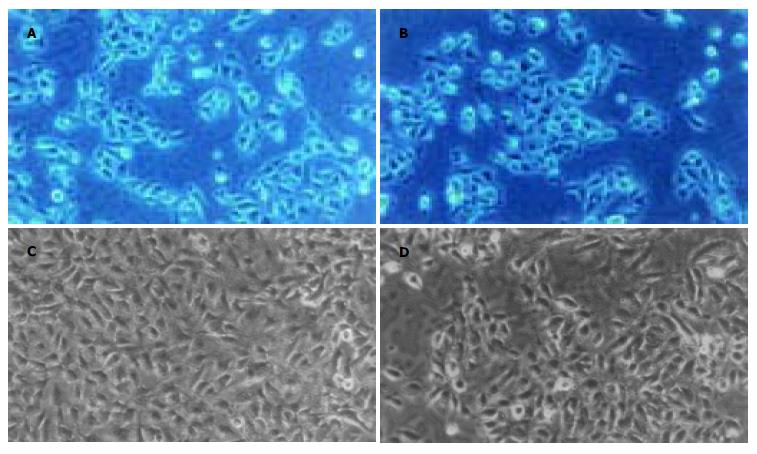
复苏后L-02人肝细胞系24 h大部分贴壁, L-02人肝细胞系生长快, 第5 d细胞已平铺满细胞形态均一规则, 细胞间的接触密实, 尤以Ⅵ组肝细胞极性恢复快, 肝细胞生长旺盛, 细胞膜完整, 胞浆内有丰富颗粒, 核仁清楚, 少数细胞内出现空泡, 与未冻存组肝细胞形态相似(图1).
肝细胞复苏后苦参碱浓度6 mg/L组明显优于其他处理组, 与对照组相似; 单用DMSO组均低于其他处理组; 苦参碱浓度低于6 mg/L组之间无显著差异, 明显低于苦参碱浓度高于6 mg/L组(表1).
肝细胞复苏后苦参碱浓度6 mg/L组白蛋白分泌量明显高于其他处理组, 与对照组无显著差异; 其他处理组之间相似, 均低于对照组(表2).
| 1 d | 3 d | 5 d | 7 d | |
| Ⅰ组 | 8.54±0.09 | 11.11±0.13 | 13.46±0.17 | 12.70±0.18 |
| Ⅱ组 | 7.52±0.20 | 10.54±0.20 | 12.13±0.26 | 11.41±0.07 |
| Ⅲ组 | 7.44±0.16 | 10.54±0.21 | 12.13±0.29 | 11.41±0.12 |
| Ⅳ组 | 7.43±0.19 | 10.55±0.25 | 12.35±0.20 | 11.42±0.13 |
| Ⅴ组 | 7.59±0.23 | 10.62±0.24 | 12.45±0.20 | 11.34±0.36 |
| Ⅵ组 | 8.52±0.12a | 11.05±0.14a | 13.43±0.20a | 12.65±0.20a |
| Ⅶ组 | 7.62±0.14 | 10.65±0.15 | 12.38±0.16 | 11.35±0.31 |
BLA已经过了多年广泛深入的实验研究, 但其细胞材料来源问题至今尚未解决[3]. BLA要代替肝脏, 必须具备两个条件: 一是细胞必须具有肝脏特异性代谢功能; 二是细胞数量至少达到15%的人肝细胞数量, 即约1010个数量级才有临床意义[4-6]. 目前肝细胞来源有人肝细胞、异种动物的肝细胞、肝干细胞、永生化肝细胞株. 人肝细胞多来源于临床上肝硬化或其他肝疾病患者手术切除的部分肝脏, 但数量相当有限; 动物来源细胞可能有病毒感染的危险[7-8]; 肝干细胞还处于研究起步阶段, 目前还不可能用于BLA. 人肝细胞系是有活性的生物材料的潜在来源[9], 有易获得、形态一致、功能稳定等优点, 且分泌的白蛋白等物质与人体内的物质结构一致. Sussman et al[10]建立了一种人肝细胞系, 保存了正常肝细胞包括生物功能在内的许多特性, 用于BLA成功地抢救了肝衰动物模型和一例患者, 证明高分化的人肝细胞系可以为爆发性肝功能衰竭提供充分的肝功能支持. Kuddus et al[11]也证实高分化的人肝细胞系细胞可以为急性肝功能衰竭的患者提供充分的肝功能支持.
解决临床上所需大量肝细胞来源, 传统上采取传代培养及用特殊材料为载体进行高密度培养方法, 但其工作量大、易污染、费用高、对环境要求高, 而且肝细胞经多次传代后, 其活性、功能将降低. 然而, 肝细胞冻存可以克服肝细胞培养缺点, 是解决大量肝细胞来源的较好方法之一.
合适的冻存液将有效帮助肝细胞在冻存过程中抵抗渗透压的变化, 减少肝细胞冻存中损伤. 传统用的保护体系为DMSO与血清及冻存液配置而成, DMSO终浓度为10%[12-13]. DMSO是渗透性保护剂, 能够降低细胞冰点, 减少冰晶的形成, 减轻自由基对细胞损害, 改变生物膜对电解质、药物、毒物和代谢产物的通透性, 是肝细胞冻存最常用的保护剂; 但是研究表明, DMSO存在严重的毒性作用, 与蛋白质疏水集团发生作用, 导致蛋白质变性. 已证实非渗透性保护剂羟乙基淀粉(HES)和渗透性保护剂DMSO的联合使用, 发挥了细胞内与细胞外两种冷冻保护剂的协同作用, 且降低了DMSO的浓度(由10%降至5%), 抑制了核蛋白和溶酶体酶的释出, 减少冻存过程中由胞内冰晶引起的肝细胞损伤, 其效果明显优于单用DMSO的冷冻保存方法[14-15]. Detrax-40也是非渗透性保护剂, 在冻存过程中可减少细胞内冰晶的形成, 复温时还可以减轻由于渗透压改变而引起的细胞肿胀. 刘斌et al[16]用DMSO+ Detrax-40液氮下冻存脐血造血细胞比单用DMSO效果好, 且降低DMSO的用量, 同时缩短复温时间. 我们采用10% DMSO、5% DMSO+5% Detrax-40冻存L-02人肝细胞系, 实验结果表明DMSO和Detrax-40有协同作用, 比单用DMSO好.
苦参碱是苦参、山豆根等中药中的主要药效成分, 为四环喹嗪啶(quinoilizidine)类衍生物, 属于生物碱类. 苦参碱能清除自由基, 保护肝细胞膜结构, 减轻肝细胞的损伤. 甘乐文et al[17]证实苦参碱对CCl4引起的大鼠慢性肝损伤具有一定的防护作用. 目前研究发现苦参碱明显抑制由肿瘤坏死因子-α(TNF-α)及放线菌素D(ActD)所诱导的体外大鼠肝细胞的凋亡, 且对肝细胞分泌ALB的功能有很强的促进作用[1,18]. 本实验分6个处理组10% DMSO、5% DMSO+5% Detrax-40和5% DMSO+5% Detrax-40+不同浓度(0.2 mg/L、2 mg/L、6 mg/L、10 mg/L)的苦参碱, 来冻存L-02人肝细胞系, 其结果含有6 mg/L苦参碱组冻存肝细胞复苏后, 肝细胞生存率及其白蛋白、尿素分泌功能明显优于其他组, 与对照组无显著差异; 其他各组肝细胞生存率、白蛋白分泌与对照组有显著差异, 所有DMSO+ Detrax-40组或DMSO+ Detrax-40+苦参碱组肝细胞生存率、尿素合成均优于单用DMSO组; 苦参碱高浓度(6 -10 mg/L)组肝细胞复苏后细胞活率、功能好于低浓度(0.2-2 mg/L)组(P<0.05), 这表明了低温保存L-02人肝细胞系时苦参碱浓度对其复苏后活率、功能有较大影响, 但随着苦参碱浓度升高(6-10 mg/L), 肝细胞复苏后活率、功能下降, 可能是苦参碱对肝细胞有毒作用. 因此, 我们的结果表明苦参碱对液氮下冻存L-02人肝细胞系有保护作用, 与DMSO、Detrax-40有很好协同作用, 且有浓度效应. 但苦参碱与DMSO、Detrax-40之间浓度关系, 以及长期低温保存时对肝细胞活性影响, 还待于进一步研究.
编辑: 张海宁
| 3. | Tsiaoussis J, Newsome PN, Nelson LJ, Hayes PC, Plevris JN. Which hepatocyte will it be? Hepatocyte choice for bioartificial liver support sustems. Liver Transpl. 2001;7:2-10. [PubMed] |
| 4. | Hughes RD, Williams R. Use of artificial and bioartificial liver support devices. Semin Liver Dis. 1996;16:435-444. [PubMed] |
| 5. | Sielaff TD, Hu MY, Rao S, Groehler K, Olson D, Mann HJ, Remmel RP, Shatford RA, Amiot B, Hu WS. A technique for porcine hepatocyte harvest and description of differentiated functions in static culture. Transplantation. 1995;59:1459-1463. [PubMed] |
| 6. | Watanabe FD, Mullon CJ, Hewitt WR, Arkadopoulos N, Kahaku E, Eguchi S, Khalili T, Arnaout W, Shackleton CR, Rozga J. Clinical experience with a bioartificial liver in the treatment of severe liver failure. A phase I clinical trial. Ann Surg. 1997;225:484-494. [PubMed] |
| 7. | Paradis K, Langford G, Long Z, Heneine W, Sandstrom P, Switzer WM, Chapman LE, Lockey C, Onions D, Otto E. Search for cross-species transmission of porcine endogenous retrovirus in patients treated with living pig tissue. Science. 1999;285:1236-1241. [PubMed] |
| 8. | Weiss RA. The Leeuwenhoek Lecture 2001. Animal origins of human infectious disease. Philos Trans R Soc Lond B Biol Sci. 2001;356:957-977. [PubMed] |
| 10. | Sussman NL, Kelly JH. Improved liver function following treatment with an extracorporeal liver assist device. Artif Organs. 1993;17:27-30. [PubMed] |
| 11. | Kuddus R, Patzer JF, Lopez R, Mazariegos GV, Meighen B, Kramer DJ, Rao AS. Clinical and laboratory evaluation of the safely of a bioartificial liver assist device for potential transmission of porcine endogenous retrovirus. Transplantation. 2002;3:420-429. [PubMed] |
| 12. | Hengstler JG, Utesch D, Steinberg P, Platt KL, Diener B, Ringel M, Swales N, Fischer T, Biefang K, Gerl M. Cryopreserved primary hepatocytes as a constantly available in vitro model for the evaluation of human and animal drug metabolism and enzyme induction. Drug Metab Rev. 2000;32:81-118. [PubMed] |
| 13. | Diener B, Utesch D, Beer N, Durk H, Oesch F. A method for the cryopreservation of liver parenchymal cells for studies of xenobiotics. Cryobiology. 1993;30:116-127. [PubMed] |
| 14. | Walter Z, Szostek M, Weglarska D, Raguszewska D, Jablonski M, Lorenz F, Skotnicki AB. Methods for freezing, thawing and viability estimation of hemopoietic stem cells. Przegl Lek. 1999;56:34-39. [PubMed] |