修回日期: 2005-01-28
接受日期: 2005-02-02
在线出版日期: 2005-04-01
目的: 观察重组表达质粒pcDNA3.1- S2S和pcDNA3.1- S1S2S对HBV DNA复制和抗原表达的抑制效果.
方法: 以能表达乙肝表面抗原主蛋白S(HBsAg)的重组真核表达质粒为骨架, 构建了分别含有HBV前S1抗原和/或前S2抗原编码基因的pcDNA3.1- S1S2S, pcDNA3.1-S2S, 并各以100 μg肌肉接种C57BL/6 HBVDNA转基因小鼠, 2, 4 wk后各加强免疫1次. 然后动态检测小鼠血清HBVDNA水平的变化、抗-HBs和前S2抗体的诱生, 以及肝组织内HBsAg、前S2抗原的消长情况.
结果: 小鼠肝组织内HBsAg, 前S2抗原呈逐渐减弱的趋势, 8 wk后各有1/3的小鼠已不能检出. pcDNA3.1-S1S2S组接种后4, 8, 12 wk抗-HBs阳转率分别为50%、67%、100%, 明显高于pcDNA3.1-S2S组(17%、33%、50%)(P<0.05); 而前S2抗体阳转率均低于17%. 接种后8 wk, 12 wk, pcDNA3.1- S1S2S组和pcDNA3.1- S2S组小鼠血清HBVDNA水平明显下降, 均低于自身接种前、接种后4 wk以及同期对照组(P<0.05).
结论: 重组表达质粒pcDNA3.1-S2S和pcDNA3.1-S1S2S接种, 能够抑制转基因小鼠体内的HBV复制, 而重组质粒中S1基因的共表达使抑制作用得到增强.
引文著录: 周陶友, 陈敏, 赵连三, 王松, 陈守春, 何芳, 刘丽, 唐红. 乙肝病毒前S/S抗原的重组表达质粒对HBV转基因小鼠的免疫治疗效应. 世界华人消化杂志 2005; 13(7): 844-847
Revised: January 28, 2005
Accepted: February 2, 2005
Published online: April 1, 2005
AIM: To evaluate the effects of recombinant plasmids pcDNA3.1-S1S2S and pcDNA3.1-S2S encoding hepatitis B virus (HBV) envelope S/preS1 or S/preS2 antigens on the inhibition of HBV DNA replication and antigen expression in HBV transgenic mice.
METHODS: Plasmids pcDNA3.1-S1S2S and pcDNA3.1-S2S were constructed. 100 μg of each plasmid was injected muscularly to inoculate C57BL/6 HBV DNA transgenic mice. The inoculation was boosted 2 and 4 weeks later. Serum samples were collected to measure anti-HBs, anti-HBc and HBV DNA. The liver tissue biopsies were performed to detect HBsAg and preS2 antigen.
RESULTS: Four, 8 and 12 weeks after inoculation, the positive rates of anti-HBs in pcDNA3.1-S1S2S group were 50%, 67% and 100%, respectively, which were higher than those in pcDNA3.1-S2S group (16.7%, 33%, 67%) (P<0.05). The positive rates of anti-preS2 were lower than 16.7% in both groups. The numbers of HbsAg or preS2 antigen positive hepatocytes were also decreased significantly in both groups. The serum HBV DNA titers at 8, 12 weeks were lower than those before and 4 weeks after the first inoculation. No change was observed in the control mice, which were inoculated with the empty plasmid vector.
CONCLUSION: The data showed that pcDNA3.1-S1S2S and pcDNA3.1-S2S inoculation might inhibit replication of HBVDNA and expression of HbsAg and preS2 antigen in mice. The preS1 insert may enhance the effect of pcDNA3.1-S2S. It is suggested that pcDNA3.1-S1S2S and pcDNA3.1-S2S can be DNA vaccine candidates for the treatment of chronic HBV infection.
- Citation: Zhou TY, Chen M, Zhao LS, Wang S, Chen SC, He F, Liu L, Tang H. Immune therapeutical effect induced by inoculation with recombinant plasmid encoding preS/S antigen in HBV DNA transgenic mice. Shijie Huaren Xiaohua Zazhi 2005; 13(7): 844-847
- URL: https://www.wjgnet.com/1009-3079/full/v13/i7/844.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i7.844
乙型肝炎病毒(HBV)前S抗原在HBV感染后的免疫清除方面发挥重要的作用[1-2]. 为进一步了解含有HBV前S抗原的乙肝基因疫苗对HBV慢性携带者是否具有治疗效应, 我们以能表达乙肝表面抗原主蛋白S(HBsAg)的重组真核表达质粒为骨架, 构建了分别含有HBV前S1抗原和/或前S2抗原编码基因的pcDNA3.1-S1S2S, pcDNA3.1-S2S, 作为候选乙肝基因疫苗对HBV转基因小鼠分组进行接种, 观察所诱生的免疫应答反应, 及其对小鼠体内HBV复制和抗原表达的影响.
质粒载体pcDNA3.1(美国Invitrogen公司); Pyrobest DNA聚合酶、限制性内切酶、DNA ligation kits(日本Takara公司); 质粒抽提试剂盒、DNA胶回收试剂盒(德国Qiagen公司). 兔抗-HBs单克隆抗体(美国DAKO公司); 乙肝病毒HBsAg和抗-HBs检测试剂盒(上海科华生物工程公司); 乙肝病毒前S2抗体以及前S2抗体检测试剂盒(北京大学肝炎试剂中心). HBV DNA荧光定量PCR检测试剂盒(广州中山达安基因诊断中心). 通过常规酚/氯仿法, 从1例慢性乙肝患者的血清标本中提取HBV DNA. 采用一对引物P1(GCGGGTACCATGCAGTGGAACTCCACAACATTCCAC), P2(GGGGCGGCCGCTTAAATGTATACCCAAAGACAAAAGAA)扩增HBV外膜中蛋白的编码基因S2S; 采用另一对引物P3(GACGGTACCATGGGAGGTTGGTCTTCCAAACCTCGA)和P2, 扩增产生HBV外膜大蛋白的编码基因S1S2S. 将S2S和S1S2S经Kpn I, Not I双酶切后定向插入质粒载体pcDNA3.1中, 获得重组质粒pcDNA3.1-S2S和pcDNA3.1-S1S2S, 并交上海基康生物工程公司测序. 然后分别转染SP2/0细胞, 通过ELISA法确认有HBsAg表达后, 即作为乙肝基因疫苗备用. HBV全基因转基因C57BL/6小鼠(第二军医大学转基因动物中心), 为SPF级, 3月龄, 能在体内稳定表达HBsAg抗原和复制HBV DNA, 并稳定传代. 将HBV转基因鼠18只分成对照组和两个实验组(S1S2S和S2S组), 每组6只, 雌雄各半.
实验组小鼠im pcDNA3.1-S2S或pcDNA3.1-S1S2S, 每只100 μg; 对照组接种空载质粒pcDNA3.1, 每只100 μg.首次免疫2, 4 wk后, 用等剂量加强免疫1次. 初次接种前和接种后4, 8, 12 wk, 分别活检小鼠肝组织标本. 方法是: 采用10 g/L戊巴比妥钠按50 μg/g ip麻醉小鼠, 剖腹手术切取0.5 cm×0.5 cm大小的肝组织, 随后关闭腹腔, 将小鼠放回笼中继续饲养. 肝组织标本离体后立即置40 g/L中性甲醛液中固定并常规石蜡包埋. 为保证实验结果的可比性, 作者将全部小鼠所采集的肝组织标本制作成组织芯片, 采用免疫组织化学SABC法检测肝组织HBsAg, 前S2抗原.首次免疫前及4, 8, 12 wk眼静脉采血, 分离血清置-80℃保存待检. 为避免批间误差, 所有4次血清同时检测, 每份标本均作1: 5, 1: 10, 1: 25, 1: 50, 1: 100稀释. 血清抗HBs和前S2抗体检测方法及结果判断均按试剂盒说明书. 采用荧光定量PCR法, 对所有血清进行HBV DNA检测, 模板抽提及荧光检测过程均按说明书.
统计学处理 应用PEMS 3.1统计软件, 其中抗体检出率采用组内合并后进行两个样本比较的秩和检验, 而HBV DNA含量采用对数的标难差t检验.
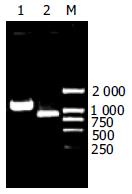
从血清HBV基因组模板中, 分别扩增出约870 bp, 1.2 kb的清晰单一条带(图1), 分子质量分别与S2S、S1S2S基因片段大小相符. 对重组质粒pcDNA3.1-S2S和pcDNA3.1-S1S2S的测序结果表明: S1长357 bp, S2长165 bp, S基因长681 bp, 符合预期的设计; 将S基因核苷酸序列带入GenBank中检索, 显示属于基因型B/血清亚型adw2.
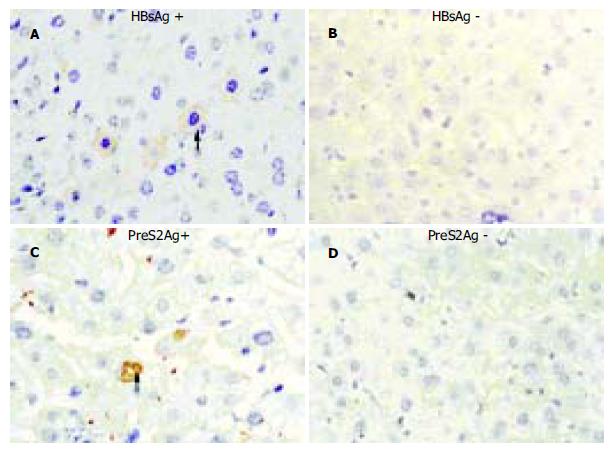
接种上述疫苗前, 所有转基因小鼠的肝组织均能同时表达HBsAg、前S2抗原, 二者主要分布于细胞浆内. 其中HBsAg的表达强度相对更强. 随着接种次数的增多, 肝组织内HBsAg和前S2抗原的表达呈逐渐减弱的趋势, 同时未见明显的炎症坏死征象(图2); 接种后8 wk, 在1/3小鼠肝组织内表达的HBsAg和前S2抗原已低于可检出的水平. 而同期对照组小鼠接种前后肝组织HBsAg, 前S2抗原的表达情况未见明显改变.
疫苗接种后4, 8, 12 wk, S1S2S组小鼠抗-HBs检出率分别达到50%(3/6), 67%(4/6), 100%(6/6); S2S组则分别为17%(1/6), 33%(2/6), 50%(3/6), 二者相比较总体差异具有显著性(P<0.05). 但两组抗-HBs滴度水平接近(1: 50). 对照组小鼠血清抗-HBs检测全部阴性. 实验组小鼠的血清前S2抗体检测表明: 接种后4 wk, S1S2S组和S2S组前S2抗体检出率均为16.7%(1/6), 抗体水平分别为1: 2和1: 5, 以后全部转阴性.
接种后8-12 wk, 实验组小鼠血清HBV DNA滴度较0 wk和4 wk时呈明显下降(P<0.05). 其中, S1S2S组第12 wk时HBV DNA滴度又低于S2S组(P<0.05), 且S1S2S组有一只小鼠血清HBV DNA自第8 wk起即降至可检测水平以下(<1×106copies/L)并保持到第12 wk. 而对照组小鼠的血清HBV DNA始终保持在5×105的相对稳定水平(表1).
慢性HBV感染是严重危害人类身体健康的主要传染病之一, 迄今尚无特效的治疗药物和手段. 患者的特异性细胞免疫应答能力低下, 乃至对HBV的免疫耐受状态, 是HBV难以清除、导致感染持续状态的重要原因. 作者在既往的基因疫苗动物实验中[3-5], 应用编码HBV前S/S抗原的真核表达质粒作为候选的乙肝基因疫苗免疫正常BALB/c小鼠, 诱导高滴度的抗-HBs和前S2抗体产生, 并持续存在3 mo以上; 同时诱生一定水平的细胞毒性T淋巴细胞(CTL)活性, 提示乙肝基因疫苗可诱导抗HBV感染的特异性体液免疫应答和细胞免疫应答. 近年的研究表明[6-7], 乙肝基因疫苗接种HBV转基因小鼠后, 同样能够激发机体的特异性免疫应答, 从而提示乙肝基因疫苗接种有望打破HBV慢性感染者机体的免疫耐受状态, 促进乙肝病毒的清除. 国内外某些学者曾进行相关的研究, 如刘红 et al[8]采用pcDNA-S2S诱导乙肝转基因小鼠产生抗-HBs; Roh et al[9]将重组痘苗病毒vvHBV(表达HBsAg)免疫乙肝转基因小鼠, 诱导出抗-HBs和CTL活性; 但是, 上述学者的研究均未对疫苗接种后的治疗效应进行观察. 本文作者构建了pcDNA3.1-S1S2S和pcDNA3.1-S2S, 他们分别能表达乙肝外壳抗原的S、前S1和/或前S2, 作为候选乙肝基因疫苗对HBV转基因小鼠分组进行接种, 验证其能否抑制慢性感染者体内的HBV复制. HBV转基因小鼠的染色体整合有HBV全基因组, 可在体内实现HBV基因组的复制和抗原表达. 由于免疫耐受, 转基因小鼠不能自然产生抗-HBs和前S2抗体, 因而模拟了HBV慢性感染持续状态, 是用于研究抗HBV感染药物及乙肝治疗性疫苗的较好动物模型.
实验结果表明, 两种乙肝基因疫苗pcDNA3.1-S1S2S、pcDNA3.1-S2S均能有效地抑制HBV DNA复制. 在接种8 wk后, 实验组HBV DNA开始降低, 同时肝细胞内HBsAg和前S2抗原表达明显受到抑制, 部分肝组织中HBsAg、前S2抗原表达接近消失; 而在此过程中, 肝组织中未见明显的炎性反应, 提示肝细胞内病毒的清除有可能通过非细胞裂解机制进行[10-11]. 与此同时, HBV转基因小鼠血清中检出抗-HBs, 抗-前S2, 显示免疫耐受被打破的征象. 上述结果表明: 乙肝基因疫苗的接种有助于解除小鼠对HBsAg和前S2抗原的长期免疫耐受状态, 可望发挥治疗性疫苗的效应, 用以清除体内慢性乙肝病毒感染. HBV基因组的前S1区和前S2区都包含HBV与肝细胞膜的亲和区, 与HBV感染、复制及感染后的免疫清除密切相关. 其中, 前S1含有多个T细胞抗原表位, 而前S2抗原分子质量小, 抗原表位少但免疫原性强[12]. 我们观察到, pcDNA3.1-S1S2S, pcDNA3.1-S2S两个实验组在转基因小鼠的免疫效果存在差异. 实验结果显示: 接种pcDNA3.1-S1S2S后, HBV转基因小鼠的血清HBV DNA下降幅度超过pcDNA3.1-S2S接种组.8 wk时, pcDNA3.1-S1S2S组甚至有1份标本完全转阴(低于检测下限). 而且pcDNA3.1- S1S2S组血清抗-HBs阳转率比pcDNA3.1-S2S明显提高, 显示S1基因表达的参与能够使乙肝基因疫苗质粒在抑制HBV DNA复制和清除病毒的作用得到增强.
编辑: 张海宁 电编: 潘伯荣
| 1. | Hong HJ, Ryu CJ, Hur H, Kim S, Oh HK, Oh MS, Park SY. In vivo neutralization of hepatitis B virus infection by an anti-preS1 humanized antibody in chimpanzees. Virology. 2004;318:134-141. [PubMed] |
| 2. | Chen X, Li M, Le X, Ma WM, Zhou BP. Recombinant hepatitis B core antigen carrying preS1 epitopes induce immune response against chronic HBV infection. Vaccine. 2004;22:439-446. [PubMed] |
| 3. | Zhao LS, Qin S, Zhou TY, Tang H, Liu L, Lei BJ. DNA-based vaccination induces humoral and cellular immune responses against hepatitis B virus surface antigen in mice without activation of C-myc. World J Gastroenterol. 2000;6:239-243. [PubMed] |
| 6. | Livingston BD, Newman M, Crimi C, McKinney D, Chesnut R, Sette A. Optimization of epitope processing enhances immunogenicity of multiepitope DNA vaccines. Vaccine. 2001;19:4652-4660. [PubMed] |
| 7. | Oka Y, Akbar SM, Horiike N, Joko K, Onji M. Mechanism and therapeutic potential of DNA-based immunization against the envelope proteins of hepatitis B virus in normal and transgenic mice. Immunology. 2001;103:90-97. [PubMed] |
| 8. | 刘 红, 姚 玉成, 葛 军辉, 李 建秀, 苏 娟, 张 钦宏, 胡 以平. HBVpreS2-S基因诱发的体液免疫引起乙肝转基因小鼠肝组织损伤. 第二军医大学学报. 2003;24:159-163. |
| 9. | Roh S, Kim K. Overcoming tolerance in hepatitis B virus transgenic mice: a possible involvement of regulatory T cells. Microbiol Immunol. 2003;47:453-460. [PubMed] |
| 10. | Webster GJ, Reignat S, Maini MK, Whalley SA, Ogg GS, King A, Brown D, Amlot PL, Williams R, Vergani D. Incubation phase of acute hepatitis B in man: dynamic of cellular immune mechanisms. Hepatology. 2000;32:1117-1124. [PubMed] |
| 11. | Maini MK, Reignat S, Boni C, Ogg GS, King AS, Malacarne F, Webster GJ, Bertoletti A. T cell receptor usage of virus-specific CD8 cells and recognition of viral mutations during acute and persistent hepatitis B virus infection. Eur J Immunol. 2000;30:3067-3078. [PubMed] |
| 12. | Sominskaya I, Paulij W, Jansons J, Sobotta D, Dreilina D, Sunnen C, Meisel H, Gerlich WH, Pumpens P. Fine-mapping of the B-cell epitope domain at the N-terminus of the preS2 region of the hepatitis B surface antigen. J Immunol Methods. 2002;260:251-261. [PubMed] |