修回日期: 2004-12-01
接受日期: 2004-12-09
在线出版日期: 2005-03-15
目的: 建立表达幽门螺杆菌(H. pylori)尿素酶B亚单位(UreB)与血溶素E(hlyE)融合蛋白的减毒沙门疫苗菌, 并利用H. pylori小鼠感染模型, 研究该疫苗菌对H. pylori感染的免疫保护作用.
方法: 利用分子克隆技术构建携带ureB/hlyE融合基因的重组原核表达质粒pTrc99A-ureB/hlyE, 经PCR及酶切鉴定后测定其基因序列, 并与GeneBank中相关序列进行同源性比较. pTrc99A-ureB/hlyE转化减毒伤寒沙门菌SL3261, 培养后筛选阳性菌落, 抽提质粒进行PCR及酶切鉴定. 表达的UreB/hlyE融合蛋白SDS-PAGE电泳和Western-blotting进行鉴定, 薄层扫描分析蛋白含量. 实验小鼠随机分成4组, 分别灌胃给予生理盐水组、减毒鼠伤寒沙门菌SL3261组、携带pTrc99A-ureB的SL3261组、携带 pTrc99A-ureB/hlyE的SL3261组. 免疫后4 wk, 予H. pylori 107CFU/只进行攻击(生理盐水组不攻击). 攻击4 wk后处死动物, 取胃组织分别行改良Giemsa染色及定量细菌培养, 观察H. pylori定植情况.
结果: 核苷酸序列测定及同源性分析证实, 原核表达质粒pTrc99A-ureB/hlyE中所含的H. pylori -ureB及hlyE基因与GeneBank中的H. pylori-ureB和hlyE基因同源性分别为97.42%(1 663/1 707)、99.78%(910/912). 重组减毒沙门氏菌可表达约100 ku的融合蛋白UreB/hlyE, 含量占全菌体蛋白含量的15%; 表达的融合蛋白能与小鼠抗H. pylori血清特异性反应, 具有良好的免疫原性. 动物实验证实, 疫苗组同空白对照组和SL3261组相比, H. pylori定植密度明显下降, 有显著性差异(P<0.05). 表达UreB/hly蛋白的疫苗株组同表达UreB蛋白的疫苗株相比, H. pylori定植密度明显下降, 差异有统计学意义(P<0.05).
结论: 重组疫苗菌对小鼠H. pylori感染具有一定免疫预防作用, hlyE可以增强疫苗株的免疫保护效果.
引文著录: 焦志勇, 陈旻湖, 朱森林, 李国庆, 胡品津. 表达ureB/hlyE融合蛋白的重组减毒鼠伤寒沙门疫苗菌预防幽门螺旋杆菌感染. 世界华人消化杂志 2005; 13(6): 787-789
Revised: December 1, 2004
Accepted: December 9, 2004
Published online: March 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(6): 787-789
- URL: https://www.wjgnet.com/1009-3079/full/v13/i6/787.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i6.787
减毒沙门菌作为载体表达可提呈外源抗原, 激发人体保护性免疫反应[1]. 活细菌载体疫苗的效率取决于他能否提呈足够的外源抗原至人体免疫系统. 然而由于外源抗原的大量合成可导致细菌代谢负担的增加和活载体细菌的适应性降低. 使免疫反应降低. 利用细菌自身的外排系统促使外源抗原在活细菌载体的表面表达、分泌可以克服这个缺点而获得更好的免疫效果. hlyE(hemolysin E)是大肠杆菌中一种可以促进靶细胞膜上形成孔道的毒素. 与hlyE融合的蛋白可以随着hlyE一起外排至细菌外, 增强活细菌载体疫苗的免疫效果[2]. 因此, 我们将H. pylori的尿素酶基因(ureB)与hlyE基因嵌合, 构建了表达融合蛋白的减毒鼠沙门菌疫苗株, 研究疫苗的株免疫效果及hlyE对疫苗株免疫效果的增强作用.
H pylor Sydney strain 1(SS1)由澳大利亚新南威尔士大学Lee教授惠赠, 改良Skirrow培养基37℃微需氧条件下培养. 活减毒鼠伤寒沙门菌LB5000(S. typhimurium LT2 Trp MetE rpsl flaA etc, R-M+ for all three systems)和SL3261(S. typhimurium WARY hisG 46 aroA del 407 Fusaricres erc, R-M+)及E. coli JM109菌株、K-12株和表达H pylor ureB亚单位的原核表达质粒pTrc99A/ureB(有ampr筛选标志)由本室构建保存.高保真Taq DNA聚合酶(Taq Plus DNA Polymerase)购自上海生工生物工程技术服务有限公司. NcoI, BamHI, T4 DNA连接酶购自宝生物工程(大连)有限公司. QIAprep Spin Miniprep Kit、QIAquick Gel Extraction Kit购自基因有限公司. 核酸序列由上海博亚生物公司测定. 二级Blab/c小鼠60只, 8周龄, 雌性, 重量17-20 g, 由中山大学北校区实验动物中心提供并饲养(广东省实验动物检验合格证号95C14).
根据载体的多克隆位点及H. pylori ureB亚单位的酶切图谱设计hlyE的引物, P1 5'-CGGTCGACACTGAAATCGTTGCAG-3', P2 5'-CGAAGCTTTCAGACTTCAGGTACCTC-3'. P1 5'端加入SalI酶切位点, 并去除启动子ATG, P2 5'端加入HindIII酶切位点, 引物由上海生工生物工程有限公司合成. 提取E. coli K-12株基因组作为模板, 以P1, P2为引物用PCR扩增hlyE. QIAquick Gel Extracton Kit回收扩增产物, SalI-HindIII酶切后与pTrc99A 的SalI-HindIII双酶切片段连接. 连接产物转化JM109, 挑选阳性克隆培养, QIAprep Spin Miniprep Kit提取原核表达质粒pTrc99A-hlyE, PCR和酶切鉴定. 原核表达质粒pTrc99A-ureB和原核表达质粒pTrc99A-hlyE均用NcoI-SalI双酶切, 分别回收ureB片段和线形化的pTrc99A-HlyE片段, T4连接酶连接, 连接产物转化JM109, 挑选阳性克隆培养, 提取质粒pTrc99A-ureB/hlyE, PCR和酶切鉴定. 原核表达质粒pTrc99A-ureB/hlyE送上海博亚生物公司进行序列测定. 测序结果与GeneBank中的基因及蛋白序列进行BLAST分析. 原核表达质粒pTrc99A-ureB/hlyE氯化钙法转化活减毒鼠伤寒沙门菌过渡菌LB5000, 筛选阳性克隆, 提取修饰后质粒进一步转化终宿主菌SL3261, 挑选阳性克隆, 用PCR(方法同上)和双酶切鉴定. 挑取重组的SL3261阳性菌落和对照的SL3261空菌落, 在LB培养液中于37℃过夜培养, 转接后加1 mmol/L IPTG诱导表达. 表达产物用100 g/L SDS-PAGE进行鉴定, 并进行薄层扫描分析和Western-blotting.
1.2.1 重组疫苗株免疫小鼠: 小鼠随机分为4组, 每组15只(表1). 所有动物均在免疫接种前禁食8 h, 禁水4 h, 免疫时先予灭菌的30 g/L, 100 μL灌喂小鼠以中和胃酸, 然后灌胃免疫(表1). 免疫4 wk后, 每只小鼠灌喂活力良好的H. pylori菌株攻击2次(1×107CFU/只), 每日1次. 再4 wk后处死所有小鼠.
| 分组 | n | 接种菌株 | 接种数量(CFU/只) |
| A | 10 | 生理盐水 | 0.3 mL |
| B | 10 | SL3261 | 107 |
| C | 10 | SL3261(pTrc99A-ureB) | 107 |
| D | 10 | SL3261(pTrc99A-ureB/hlyE) | 107 |
1.2.2 鼠胃H. pylori定植检查: 小鼠处死后, 将胃沿大弯纵行切为两半, 一半胃称重后放入盛有1 mL布氏肉汤作定量匀浆器中匀浆, 匀浆作1: 10、1: 100、1: 1 000系列倍比稀释, 每一稀释度匀浆100 μL接种于改良Skirrow选择性琼脂平板上, 37℃微需氧条件下培养细菌3 d; H pylor菌落根据生长形态、快速尿素酶试验强阳性及典型镜下形态确定. H pylor定植密度 = H. pylori菌落数×稀释度/胃重量, 稀释度取倍比稀释度中菌落计数在30-300CFU者进行最后计算. 胃组织定量H. pylori培养结果用Mann-Whitney U test进行统计学分析. P<0.05为统计学有差异. 所有检验均用SPSS10.0 for windows软件包进行.
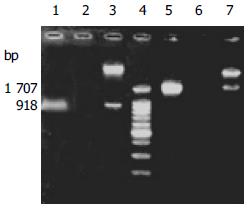
从重组活减毒鼠伤寒沙门疫苗菌提取质粒, 利用H. pylori ureB亚单位的引物和E. coli K-12株hlyE的引物经 PCR可分别扩增出918 bp和1707 bp的片段, 大小分别与H. pylori ureB和hlyE一致, 经Nco I-Sal I和SalI-HindIII分别双酶切后可见6 kb、918 bp的载体片段和目的基因片段及5 kb、1 700 bp的载体和目的片段, 目的基因片段大小与ureB和hlyE大小一致(图1).
重组质粒pTrc99A-ureB/hlyE测序及同源性分析, 结果表明重组质粒pTrc99A-ureB/hlyE中的ureB和hlyE与基因文库中H. pylori ureB和hlyE同源性分别为97.42%(1 663/1707)和99.78%(910/912). 蛋白同源性分别为97.68%(295/302)和99.65%(567/569).
重组减毒鼠伤寒沙门氏菌菌体蛋白在100 ku左右出现一新生蛋白带, 与推测的UreB/hlyE融合蛋白分子量相符, 对照空菌及转化空质粒的细菌菌体蛋白中无该条蛋白带, 薄层扫描分析显示: UreB/hlyE融合蛋白占菌体蛋白总量的15.5%(图2). Western-blotting结果表明, 目的蛋白能与小鼠抗H. pylori血清免疫着色(图3).
各组动物的H. pylori定量培养结果比较(表2), A、B和C之间差异没有统计学意义(P>0.05); D、E同A、B和C相比, H. pylori定植密度差异有统计学意义(P<0.05); D与E相比, H. pylori定量培养菌落数显著减少, 有统计学意义(P = 0.049).
| 分组 | 动物数 | 中位数 |
| A空白对照组 | 8 | 160×105 |
| B SL3261 | 10 | 126×105 |
| C SL3261(pTrc99A) | 10 | 135×105 |
| D SL3261(pTrc99A-ureB) | 10 | 24×105a |
| E SL3261(pTrc99A-ureB/hlyE) | 10 | 3.5×105ac |
利用活减毒鼠伤寒沙门菌这种新型的口服疫苗载体释放系统与传统疫苗相比具有许多优点, 如不必纯化抗原, 不需佐剂, 避免了抗原在胃内降解和变性[3]. 我们构建的表达H. pylori ureB的减毒鼠伤寒沙门菌活疫苗免疫动物取得了比较好的效果, 保护率达50%[4]. 为了进一步增强减毒鼠伤寒沙门菌活疫苗的免疫效果, 我们利用分子克隆的方法, 构建了表达ureB/hlyE融合蛋白的减毒沙门氏菌疫苗, UreB和hlyE的核苷酸序列与基因文库中相关序列的同源性为97.42%和99.78%. pTrc99A是一个高效原核表达载体, 有强大的Trp/Lac杂合启动子, 在化学诱导剂IPTG作用下表达所插入的基因. 表达ureB/hlyE融合蛋白的减毒沙门氏菌疫苗在1 mmoL/L IPTG诱导下能够高效表达大小约为100 ku的融合蛋白. hlyE是大肠杆菌中一种可以促进孔道形成的毒素. 可在细菌表面表达或分泌至细菌外并促进靶细胞膜上的孔道形成[5-6]. Galen et al将伤寒杆菌的hlyE与SacB基因融合后, 可在含150 g/l的乳糖固体培养基上生长, 而SacB基因在肠道细菌胞内单独表达时, 分解乳糖为葡萄糖后发酵导致细菌的死亡, 说明此融合蛋白可通过hlyE的外排作用外排细菌表面或完全分泌到细菌周围. 同时作者发现hlyE的外排作用还可以提高与之融合的蛋白的表达和免疫原性, 疟疾原虫的MSP-1(19)蛋白在肠道细菌中很难表达, 而与hlyE融合后不仅在减毒伤寒杆菌中表达良好而且可诱导特异性抗体的产生[7]. 组织H. pylori定量培养可以比较准确地计数H. pylorii菌落数, 更全面敏感地评价组织H. pylori定植水平[8]. 疫苗免疫小鼠的H. pylori定量培养结果显示, 表达UreB/hlyE融合蛋白重组减毒沙门菌疫苗株与表达ureB重组疫苗株相比, H. pylori定量培养的菌落数少, 差异有统计学意义(P = 0.049), 表达UreB/hlyE融合蛋白重组疫苗株的免疫保护效果高于表达ureB重组疫苗株, hlyE促进H. pylori抗原的分泌表达, 可以增强疫苗株的免疫保护作用. 疫苗株免疫后的实验小鼠胃内H. pylori定植水平虽然下降, 但仍可培养出细菌, 未出现无菌性免疫的效果. 说明疫苗株只能明显减少胃内H. pylori的定植, 还不能完全清除H. pylori; 不过H. pylori的减少也很有价值, 因为H. pylori定植水平与胃炎的严重程度和炎症细胞的浸润程度密切相关[8]. 本实验的结果证实表达ureB/hlyE融合基因的重组疫苗株可以预防H. pylori的感染, 减少胃内H. pylori的定植水平; hlyE可增强重组疫苗株的免疫效果, 可以作为提高此类疫苗免疫效果的一种方法.
编辑: 张海宁 电编: 潘伯荣
| 1. | Gomez-Duarte OG, Lucas B, Yan ZX, Panthel K, Haas R, Meyer TF. Protection of mice against gastric colonization by Helicobacter pylori by single oral dose immunization with attenuated Salmonella typhimurium producing urease subunits A and B. Vaccine. 1998;16:460-471. [PubMed] |
| 2. | del Castillo FJ, Leal SC, Moreno F, del Castillo I. The Escherichia coli K-12 sheA gene encodes a 34-kDa secreted haemolysin. Mol Microbiol. 1997;25:107-115. [PubMed] |
| 3. | Gomez-Duarte OG, Bumann D, Meyer TF. The attenuated Salmonella vaccine approach for the control of Helicobacter pylori-related diseases. Vaccine. 1999;17:1667-1673. [PubMed] |
| 5. | Wallace AJ, Stillman TJ, Atkins A, Jamieson SJ, Bullough PA, Green J, Artymiuk PJ. E. coli hemolysin E(HlyE, ClyA, SheA): X-ray crystal structure of the toxin and observation of membrane pores by electron microscopy. Cell. 2000;100:265-276. [PubMed] |
| 6. | Atkins A, Wyborn NR, Wallace AJ, Stillman TJ, Black LK, Fielding AB, Hisakado M, Artymiuk PJ, Green J. Structure-function relationships of a novel bacterial toxin, hemolysin E. The role of alpha G. J Biol Chem. 2000;275:41150-41155. [PubMed] |
| 7. | Galen JE, Levine MM. Can a flawless live vector vaccine strain be engineered? Trends Microbiol. 2001;9:372-376. [PubMed] |