修回日期: 2004-10-02
接受日期: 2004-10-11
在线出版日期: 2005-02-01
目的: 探讨甘草酸苷(SNMC)对小鼠暴发性肝损伤细胞凋亡的抑制作用.
方法: 用D-氨基半乳糖(D-galactosamin, D-Galn)1 000 mg/kg一次ip致敏, 以脂多糖(Lipopolysacharide, LPS)ip构建暴发性肝损伤(FHF)小鼠模型. 通过病理切片观察SNMC对小鼠实验性肝损伤中细胞凋亡的抑制作用, 放免法检测肿瘤坏死因子-a(TNF-α); 原位杂交法检测肝组织内caspase-3的表达. 并观察不同给药时间及用药剂量的差别.
结果: D-氨基半乳糖和脂多糖可以构建暴发性肝损伤的模型, 血清ALT和总胆红素(TBiL)水平显著升高. 6 h病理切片中可见肝细胞水肿和凋亡, 与正常对照组相比, 血清TNF-α(0.77±0.08 vs 3.75±0.50, P<0.01)水平显著升高, caspase-3表达显著增加(0vs 3). 12 h可见肝细胞大量碎屑样坏死. 给予SNMC后可以抑制细胞凋亡及减少细胞坏死, 并使血清TNF-α水平降低(F = 52.48, P<0.01), 肝组织内caspase-3表达下降(P<0.01). SNMC抑制细胞凋亡以小剂量预保护组效果最好. 三个剂量组(F = 0.051, P>0.01)及三个时间段(F = 2.043, P>0.01)之间无差异性.
结论: SNMC对小鼠暴发性肝损伤有明显的保护作用, 可以改善D-氨基半乳糖和脂多糖所致的肝细胞病理性凋亡及坏死, 并证明SNMC可能是抑制了细胞凋亡的细胞内途径.
引文著录: 杨宝山, 陈立艳, 马英骥, 毕蔓茹. 甘草酸苷对小鼠暴发性肝损伤细胞凋亡的抑制作用. 世界华人消化杂志 2005; 13(3): 325-329
Revised: October 2, 2004
Accepted: October 11, 2004
Published online: February 1, 2005
AIM: To study the effects of SNBC on inhibiting hepatocyte apoptosis in mice with fulminant hepatic failure (FHF).
METHODS: Mice were given lipopolysaccharide (LPS, ip) and D-galactosamine (D-GalN, 1 000 mg/kg, ip) to establish FHF model. Hepatocyte apoptosis was observed by pathological section. After treated with SNMC, the level of serum TNFa were tested by radioimmunoassay. The expression of caspase-3 in liver tissue was determined by in situ hybridization.
RESULTS: The level of serum ALT and total bilirubin (TBiL) remarkably increased in FHF mice. Hepatocyte apoptosis was observed at 6 hours and the level of serum TNFa and caspase-3 expression increased significantly (3.750.50 vs 0.770.08, P<0.01; 3 vs 0, P<0.01) in comparison with those in normal mice. Hepatocyte apoptosis were inhibited and hepatocyte necrosis decreased significantly after SNBC administration. And serum TNFa level and caspase-3 expression was significantly decreased as compared with those in mice of model group (P<0.01). Hepatocyte apoptosis was gradually decreased with the action time of SNMC in mice. However, there was no significant difference between groups with different action time and doses of SNMC (P>0.05).
CONCLUSION: SNMC can protected hepatocytes from apoptosis in mice with FHF and the mechanism was associated with its inhibitory effect on the pathway of hepatocyte apoptosis.
- Citation: Yang BS, Chen LY, Ma YJ, Bi MR. Effects of SNMC on inhibiting hepatocyte apoptosis in mice with fulminant hepatic failure. Shijie Huaren Xiaohua Zazhi 2005; 13(3): 325-329
- URL: https://www.wjgnet.com/1009-3079/full/v13/i3/325.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i3.325
暴发性肝损伤(FHF)是一种由于各种因素导致的急性或亚急性大块肝细胞坏死, 临床上引起凝血酶原时间显著延长及肝性脑病等为其特征. 各种急、慢性肝病的发病过程除了与细胞免疫直接导致的炎症坏死有关以外, 还与各种原因导致的肝细胞异常凋亡有着密切的关系. 以甘草酸为主要成分的甘草酸苷(SNMC)注射剂具有抗炎及抗过敏, 并具有类激素样作用[1]. 并证明SNMC有明确的肝细胞保护作用[2-3]. 但对重症肝炎治疗的研究尚未见报告. 近年来我们根据本药的药理学作用将其试用于治疗重症肝炎获得了较好的疗效. 并且通过动物实验证实应用SNMC可以显著地降低FHF小鼠转氨酶及血清中的各种细胞因子, 并且使小鼠的存活率提高到60%.我们以建立小鼠的暴发性肝衰竭模型为基础深入地探讨SNMC对FHF细胞凋亡的抑制作用及作用机制.
昆明种小白鼠, 清洁级由本校实验动物中心提供, 6-7周龄, 质量18-20 g, 雌雄各半, 雌性未孕未产. 复方甘草酸苷由日本米诺发源制药株式会社生产, 深圳健安医药有限公司总经销提供. D-氨基半乳糖和脂多糖购自Sigma公司. TNF-α放免试剂盒购自解放军总医院科技开发中心放免所. caspase-3试剂盒购自武汉博士德生物公司. ALT、IBIL、用日立7070全自动生化仪进行检测日本SANYO公司MDF-38IE超低温冰箱一台. DR-HW-1恒温水浴箱, 北京西域区医疗器械厂. Q/BL001-91离心机, 北京医学离心机厂.
昆明种小白鼠(哈尔滨医科大学附属第一医院动物实验中心提供)110只, 随机分11组. A: 正常对照组(10只)给予生理盐水0.1 mL 2次/d ip. B: 模型组(10只)给予D-GlaN 1 000 mg/kgip致敏后再给予LPS100 mg/kg ip[4,5]. C: 预保护大剂量组(10只)给予SNMC 0.36 mL(相当于人2 mL/kg) 2次/d ip预保护1 wk后给予LPS 100 mg/kg和D-GlaN 1 000 mg/kg ip. D: 预保护中剂量组(10只)给予SNMC 0.26 mL(相当于人2.9 mL/kg)2次/d ip, 预保护1 wk后给予LPS 100 mg/kg和D-GlaN1 000 mg/kg ip. E: 预保护小剂量组(10只)给予SNMC 0.18 mL(相当于人4 mL/kg)2次/d ip预保护1 wk后给予LPS 100 mg/kg和D-GlaN 1 000 mg/kg ip. F: 同时保护大剂量组(10只)给予SNMC 0.36 mL2次/d ip, 后立即给予LPS 100 mg/kg和D-GlaN 1 000 mg/kg ip. G: 同时保护中剂量组(10只)给予SNMC 0.26 mL 2次/d ip后立即给予LPS 100 mg/kg和D-GlaN 1 000 mg/kg一次ip. H: 同时保护小剂量组: (10只)给予SNMC 0.18 mL 2次/d ip后立即给予LPS 100 mg/kg和D-GlaN1 000 mg/kg ip. I: 后保护大剂量组(10只)给予LPS 100 mg/kg和D-GlaN 1 000 mg/kg ip, 8 h后给予SNMC 0.36 mL i-2次/d ip. J: 后保护中剂量组(10只)给予LPS-100 mg/kg和D-GlaN 1 000 mg/kg ip 8, 小时后给予SNMC 0.26 mL2次/d ip. K: 后保护小剂量组(10只)给予LPS 100 mg/kg和D-GlaN 1 000 mg/kg ip, 8 h后给予SNMC 0.18 m l2次/d ip各组动物摘眼球无菌无热源取血. 3 000 r/min离心10 min后吸取血清或血浆-20度冻存待检. 肝脏取肝左叶2块, 置25 g/L戊二醛中用于电镜分析和caspase-3的检测. 甘草甜素共用1 wk后观察小鼠的存活率. 观察SNMC用后8 h, 11 h, 1 d, 3 d, 7 d肝脏电镜病理变化, TNF-α水平用放免法. 按说明书操作及caspase-3表达. caspase-3寡核苷酸探针序列如下: (1)5'AGGATAATCCATTTTATAACTGTTGTCCAG3'; (2)5'TCCAGTTCTGTACCACGGCAGGCCTGAATA 3'; (3)5'GACTCAAATTCTGTTGCCACCTTTCGGTTA-3'.实验步骤按试剂盒说明书进行, 对石蜡包埋的肝组织切片进行原位杂交后DAB显色, 染色后细胞质呈棕褐色染色的为阳性细胞, 细胞质无棕褐色染色的为阴性细胞. caspase-3原位杂交阳性细胞记数分3级: 低倍(10)镜1 cm2视野阳性细胞数小于1/3为(+), 1/3-2/3为(++), 大于2/3为(+ + +).
统计学处理 数据用mean±SD, 不同组别间用SPSS12.0软件进行单因素方差分析, 并进行两两比较, P<0.05认为差异有显著性. 采用χ2检验进行caspase-3阳性表达率的比较.
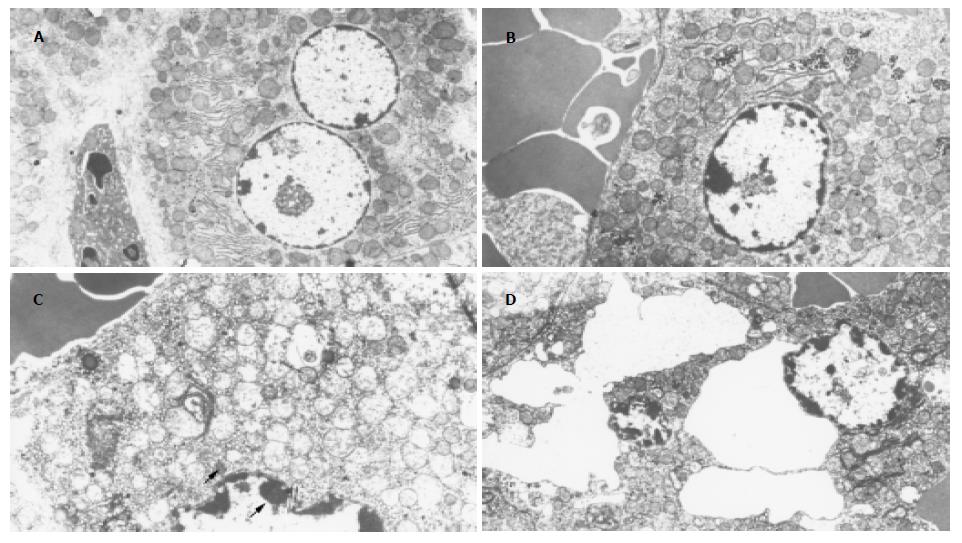
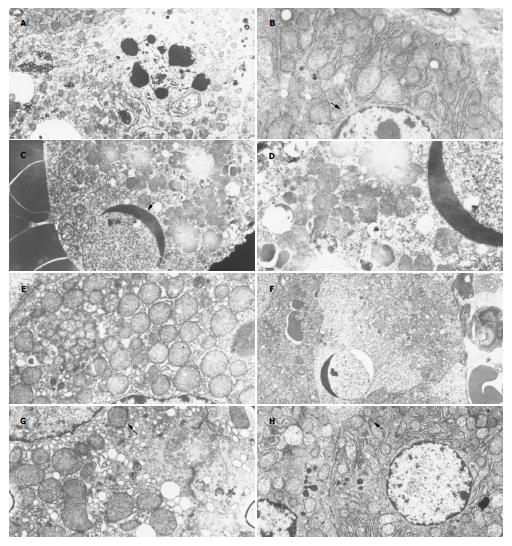
预实验结果表明, 单纯给予D-GlaN或LPS在用药24 h内无死亡发生, 且肝组织无FHF的病理变化, 给予D-GlaN+LPS后6 h电镜: 肝细胞核缩小染色质边集核膜下, 线粒体轻度肿胀, 糖元堆积. 可见部分坏死的肝细胞核崩解, 质膜和细胞内膜结构明显紊乱(图1A-B). 给予D-GlaN+LPS后8 h电镜肝细胞膜结构损伤更为明显, 部分细胞完全溶解, 细胞核固缩成小团块壮(黑色箭头), 内膜溶解, 也可见凋亡的肝细胞, 细胞核膜清晰, 核内染色质凝聚成班块状, 线粒体嵴肿胀或空泡变性(红色箭头)(图1C-D). 模型组ALT, TBil, TNF-α水平显著升高, 与正常组相比有显著差异(P<0.01). 各治疗组ALT, TBil, TNF-α水平都有不同程度的降低, 与模型组比较有显著差异(P<0.01). 但各组间比较无差异(P>0.05, 表1). 正常组caspase-3无表达, 模型组caspase-3表达明显增多, 不同治疗组caspase-3表达较模型组明显降低(P<0.01). 各治疗组间caspase-3表达无明显差异(P>0.05, 表2)电镜: 治疗组T6 h细胞坏死状态仍然很严重, 窦腔内有许多的吞噬细胞, 细胞膜结构呈溶解状态, 粗面内质网扩张脱颗粒(红色箭头), 细胞核浓缩的染色质紧靠核膜下, 造成细胞的通透功能不良(图2A-B). 治疗组T8 h细胞出现凋亡状态, 细胞核形成新月体(黑色箭头), 核膜清晰完好, 细胞内膜状态欠佳(图2C-D). 治疗组T11 h肝细胞板层结构清晰可见, 窦内可见吞噬细胞, 仍有细胞核的新月体形成, 但细胞内膜结构恢复, 线粒体单位膜结构完好, 内膜絮状变, 滑面内质网丰富, 有少量容酶体出现, 粗面内质网扩张状态脱颗粒, 但结构清晰. 肝细胞开始恢复(图2E). 治疗组T1 d肝细胞膜结构基本接近正常组, 细胞核膜下有轻度的染色质的边集, 核周可见少量脂滴的堆积, 组面内质网发达, 线粒体嵴清晰可见(图2F). 治疗组T3 d肝细胞双层核膜结构清晰, 线粒体嵴密集(黑色箭头), 基质密度适中, 毛细胆管内微绒毛和两端的紧密连接清晰可见, 窦内皮结构完好(图2G). 治疗组T7 d肝细胞膜结构同正常组, 细胞器丰富, 尤以粗面内质网发达, 数量增多(黑色箭头), 说明肝细胞合成蛋白的功能代偿性的增强, 窦内细胞膜结构完好, 狄氏间隙可见肝细胞的微绒毛伸入(图2H).
| 分组 | ALTnkat\l | TBil nkat\l | TNF-αmg\mL |
| A | 1 119±210 | 153±145 | 0.77±0.08 |
| B | 23 443±790 | 1 167±287 | 3.75±0.50 |
| C | 16 153±4 413 | 420±308 | 1.16±0.25 |
| D | 14 869±7 472 | 320±206 | 1.20±0.14 |
| E | 13 319±2 853 | 147±14 | 1.34±0.31 |
| F | 432±105 | 983±488 | 1.35±0.17 |
| G | 19 482±2 499 | 455±49 | 1.34±0.31 |
| H | 405±133 | 36±12 | 1.27±0.27 |
| I | 1 661±508 | 36±12 | 1.30±0.25 |
| J | 10 263±2 802 | 210±86 | 1.43±0.24 |
| K | 19 064±1 895 | 453±95 | 1.25±0.09 |
| F = 63.60 | F = 16.32 | F = 52.48 |
| 组别 | 表达(+ + +) | 表达(+ +) | 表达(+ ) | 表达(-) |
| A | 0 | 0 | 0 | 3 |
| B | 3 | 0 | 0 | 0 |
| C | 1 | 2 | 2 | 0 |
| D | 1 | 2 | 2 | 0 |
| E | 1 | 2 | 2 | 0 |
| F | 1 | 1 | 1 | 0 |
| G | 1 | 1 | 2 | 0 |
| H | 0 | 1 | 1 | 0 |
| I | 2 | 1 | 3 | 0 |
| J | 2 | 1 | 3 | 0 |
| K | 2 | 2 | 3 | 0 |
LPS与D-GaLN联合应用时可复制出类似人类暴发性肝衰竭的损伤模型, 并且在肝脏损伤过程中有细胞凋亡的发生, 尤其在损伤的早期凋亡特别明显[6-7]. 细胞凋亡(apoptosis)是一系列高度的半胱氨酸蛋白酶caspase级联反应事件的结果. 经典的细胞凋亡途径有两条, 分别为细胞外途径(或称细胞表面死亡受体途径)和细胞内途径(或称线粒体引发途径)[8-9]. 在细胞外途径中caspase-3与其他下游的caspase成员是凋亡事件的真正执行者[10-11]. 受体介导是肝细胞凋亡细胞外途径的最主要途径之一. 目前已知参与肝肝细胞凋亡在开始时必须有肝细胞表达的死亡基因受体(death domain receptor)和淋巴细胞表达的相应配体结合才能开始. 这其中包括肿瘤坏死因子(TNF)及其受体TNFR[12-13]. TNF在肝衰竭的发病机制中具有重要的作用意义. 肝衰竭患者血清中TNF含量比正常人及其他类型肝炎患者显著升高, 外周血单核细胞产生TNF的活性也显著升高. 肝衰竭时, 引起TNF升高的因素很多. TNF虽然参与了肝细胞的损坏, 但并不能引起明显肝细胞坏死, 他需要其他因素的协同作用在暴发性肝损伤时. 如FHF中所产生的细胞因子及其所介导的炎症反应和免役损伤[14-15].
结果表明, 甘草酸苷不但能减低转氨酶和胆红素, 最主要的是他能够降低TNF及caspase-3, 既降低了细胞凋亡中细胞外途径的开始因素和执行者, 最终抑制了细胞凋亡. 本实验单纯从细胞凋亡的细胞外途径角度进行了研究. 但甘草酸苷治疗FHF的作用是非常复杂的, 他不光是对于细胞凋亡有抑制作用, 很可能也抑制FHF过程中各种细胞因子和内毒素(LPS)的产生, 以及FHF中肝血窦内微血栓形成及肝内微循环障碍的发生. 从而减轻了FHF中的免疫损伤和LPS对肝细胞二次损伤作用. 即使抑制细胞凋亡也不能排除有细胞内途径的参与. 因此还需进行更深入的研究和探讨.
编辑: 潘伯荣 审读:张海宁
| 4. | Yarovinsky TO, Powers LS, Butler NS, Bradford MA, Monick MM, Hunninghake GW. Adenoviral infection decreasesmortality from lipopolysaccharid-induced liver failurevia induction of TNF-αlpha tolerance. J Immunol. 2003;171:2453-2460. [PubMed] [DOI] |
| 5. | Inoue T, Horiai H, Aoki C, Kawamura I, Ota M, Mizuhara H, Tomoi M, Mutoh S. Insulin-like growth factor-I preventslethal acute liver failure induced by D-galacto and lipopolysacchride in rats. In Vivo. 2003;17:293-299. [PubMed] |
| 6. | Ogasawara J, Watanabe-Fukunaga R, Adachi M, Yamauchi K, Yonehara S, Nagata S, Hayashi N. Lethal effect ofthe anti-Fas antibody in mice. Nature. 1993;3664:806. [PubMed] [DOI] |
| 7. | Ryo K, Kamogawa Y, Ikeda I. Significance of Fas antigen-mediated apoptosis in human fulminant hepatic failure. Am J Gastroenterol. 2000;95:2047: 2055. [PubMed] |
| 8. | 汪 爱莲, 李 懿萍, 苏 宁, 邓 红. 线粒体和凋亡. 国外医学临床生物化学与检验学分册. 2000;21:27-30. |
| 11. | 何 志巍, 姚 开泰. Caspases与细胞凋亡研究进展. 国外医学生理、病理科学与临床分册. 1999;19:15-19. |
| 12. | 郑 昕, 杨 东亮, 郝 连杰. 肝细胞凋亡机制及调控因素的研究进展. 国外医学·生理、病理科学与临床分册. 2000;1:22-25. |