修回日期: 2005-09-25
接受日期: 2005-11-12
在线出版日期: 2005-12-28
目的: 用裸鼠人肝癌模型探讨多烯紫杉醇(docetaxel)对人肝细胞肝癌(HCC)生长抑制影响和在体内对HCC放射增敏作用及其分子机制.
方法: 用裸鼠制作HCC模型, 用药加照射组给药24, 48 h后分别在室温下用137Cs放射源按分割剂量照射局部肿瘤, 实时定量PCR检测多烯紫杉醇作用于肝癌细胞后bcl-2和p21基因表达变化. 以肿瘤生长延迟(absolute growth delay, AGD)时间即单纯用药组肿瘤从平均0.8 cm生长至1.4 cm所需要天数减去空白对照组达到同样大小所需要天数评价多烯紫杉醇抗肿瘤效应. 以校正过的生长延迟(normalized growth delay, NGD)时间即用药加照射组肿瘤从0.8 cm到1.4 cm所需要天数减去单纯用药组达到同样大小所需要天数以及放射增敏因子(EF, enhancement factor, 即NGD与单纯放射组AGD之比), 评价多烯紫杉醇放射增敏效应.
结果: 在裸鼠体内用药组肿瘤从平均0.8 cm到1.4 cm需要35 d, 空白对照组肿瘤从平均0.8 cm到1.4 cm需要23 d, AGD为12 d, 单纯照射组为29 d, 用药和照射联合处理组需要47 d, 单纯用药组为35 d, EF为2.0. 20 d时, 单纯用药组、用药和照射联合处理组肿瘤明显小于对照组(P = 0.008, 0.005), 用药和照射联合处理组肿瘤也明显小于单纯照射组(P = 0.002). 多烯紫杉醇作用于SMMC-7721细胞后在10 nmol/L和0.5 nmol/L大部分时间点引起p21基因表达上调, 但用10 nmol/L多烯紫杉醇分别作用6 h使p21基因mRNA水平短暂下降, 0.5 nmol/L浓度作用36 h后p21基因mRNA水平表达也出现下降.
结论: 多烯紫杉醇在体内具有较强抗HCC作用和放射增敏作用使SMMC-7721细胞p21表达上调, bcl-2下调.
引文著录: 耿长新, 曾昭冲, 周长宏, 王吉耀, 亓玉琴. 多烯紫杉醇体内对肝癌放化疗及其对p21和bcl-2表达影响. 世界华人消化杂志 2005; 13(24): 2848-2852
Revised: September 25, 2005
Accepted: November 12, 2005
Published online: December 28, 2005
AIM: To investigate the anti-human hepatocellular carcinoma (HCC) activity of docetaxel and determine the potential radiosensitizing effect of docetaxel in vivo, and to further explore the mechanism of docetaxel-induced cell growth inhibition, apoptosis and radiosensitization at gene level.
METHODS: Nude mice bearing HCC with a diameter of about 0.8 cm in the leg received 33 mg/kg docetaxel intraperitoneally, 10 Gy (5 Gy once) tumor irradiation, or both (radiation given 24 and 48 h after docetaxel treatment). The regression and regrowth of the tumors were followed until the tumor diameter reached 1.4 cm approximately. Absolute growth delay (AGD), which was defined as the time in days for tumors treated with docetaxel to grow from 0.8 to 1.4 cm in diameter minus the time in days for untreated tumors to reach the same size, was used to evaluate the antitumor effect of docetaxel. Normalized growth delay (AGD), which was defined as the time in days for tumors treated with both docetaxel and irradiation to grow from 0.8 to 1.4 cm in diameter minus the time in days for tumors treated with docetaxel alone to reach the same size, and the enhancement factor (ratio of NGD to AGD for irradiation alone) was used to assess the effect of the combined docetaxel plus radiation treatment. Real-time qutitative reverse transcription-polymerase chain reaction (RT-PCR) was performed to detect the expression of bcl-2 and p21 genes in HCC cells before and after decetaxel treatment.
RESULTS: The tumors in docetaxel treated alone and irradiation treated alone groups needed 35 and 29 d to reach 14 cm in diameter, respectively, while the ones in the control group needed 23 d. So the AGD was 12 and 6 d, respectively. The combined administration of docetaxel and irradiation resulted in significant growth delay (47 d), and the EF was 2.0, indicating that docetaxel enhanced tumor radioresponse. At 20 d, the sizes of the tumors in docetaxel treated alone group and combination of docetaxel and irradiation group were significantly smaller than those in the controls (P = 0.008, P = 0.005), and the size in the combination group was also smaller than that in the irradiation alone group (P = 0.002). Real time quantitative RT-PCR analyses revealed that mRNAs of p21 in the docetaxel treated SMMC-7721 cells at most of the time points were increased, as compared with those in the control cells. In contrast, bcl-2 expression in the docetaxel treated SMMC-7721 cells was suppressed as compared with that in the controls.
CONCLUSION: Docetaxel can inhibit the growth of HCC and enhance the tumor response to fractionated irradiation in vivo by down-regulation of bcl-2 expression and up-regulation of p21 expression..
- Citation: Geng CX, Zeng ZC, Zhou CH, Wang JY, Qi YQ. Antitumor and radiosensitizing effect of docetaxel on human hepatocellular carcinoma and its mechanisim in vivo. Shijie Huaren Xiaohua Zazhi 2005; 13(24): 2848-2852
- URL: https://www.wjgnet.com/1009-3079/full/v13/i24/2848.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i24.2848
转移复发是HCC死亡率居高不下的一个主要原因[1,2], 而全身化疗效果较差. 放射治疗是治疗HCC一种重要方法, 但放射治疗后也发生肝内其它部位复发和肝外转移[3,4], 为此放疗和具有放疗增敏作用化疗药物联合已经引起重视. 探索对HCC具有放疗增敏化疗药物既能对肝内外微转移灶起杀灭作用又增强对HCC病灶放射作用, 有助于提高HCC患者生存率. 我们对多烯紫杉醇体内对肝癌放化疗及其对p21和bcl-2表达影响进行了探索.
SMMC-7721 HCC细胞株由复旦大学肝癌研究所提供; 多烯紫杉醇: 安万特公司产品; 新生牛血清: 杭州四季青生物工程公司产品; 裸小鼠: 购于复旦大学上海医学院实验动物中心, 并在该中心饲养; Light Cycler-DNA Master SYBER Green 1试剂盒: Roche Diagnostics K.K; TRIzol: GIBCOL BRL; mRNA逆转录试剂盒: 上海生工生物工程公司; Light Cycler-DNA Master SYBER Green 1 试剂盒: Roche Diagnostics K.K; Light Cycler: Roche Diagnostics K.K.
1.2.1 细胞培养: SMMC-7721 细胞株培养于含100 mL/L 新生牛血清RPMI 1640培养液中, 每2-3 d传代1次.
1.2.2 细胞接种: 将对数生长期SMMC-7721细胞制成单细胞悬液, 接种于裸小鼠大腿皮下. 待肿瘤长至直径约1.5-2.0 cm时, 处死裸鼠, 取出肿瘤组织, 用PBS缓冲液漂洗后放于含培养液培养皿中, 切成2 mm×2 mm×2 mm瘤组织小块待用.
1.2.3 肿瘤移植: 采用BALB/c-nu/nu雌性裸鼠, 4-6周龄, 体质量18-20 g. 腿部用5 g/L碘伏消毒, 将上述瘤组织小块吸入套管针内, 然后将瘤块接种于右腿部皮下, 术后观察肿瘤生长情况.
1.2.4 给药和照射: 当裸鼠肿瘤生长至平均0.8 cm时将它们随机分组, 分别为空白对照组(n = 9)、单纯给药组(n = 10)、给药加放射组(n = 10)、单纯放射组(n = 10). 单纯给药组、给药加放射组分别给予 30 mg/kg 多烯紫杉醇ip, 24、48 h后给药加放射组和单纯放射组在室温下用137Cs放射源照射局部肿瘤, 照射按分割照射每次分别给予5 Gy, 总剂量为10 Gy. 观察肿瘤生长情况, 一直当肿瘤生长至1.4 cm大小. 以肿瘤生长延迟(absolute growth delay, AGD)时间即单纯用药组肿瘤从平均0.8 cm生长至1.4 cm所需要天数减去空白对照组达到同样大小所需要天数评价多烯紫杉醇抗肿瘤效应. 以校正过的生长延迟(normalized growth delay, NGD)时间即用药加照射组肿瘤从0.8 cm到1.4 cm所需要天数减去单纯用药组达到同样大小所需要天数以及放射增敏因子(EF, enhancement factor, 即NGD与单纯放射组AGD之比)[3], 评价多烯紫杉醇放射增敏效应.
1.2.5 bcl-2和p21 mRNA定量检测: (1)引物序列bcl-2上游引物: 5'-CTGGTGGGAGCTTGCATCAC-3',下游引物: 5'-ACAGCCTGC AGCTTTGTTTC-3', p21上游引物: 5'-CTGCCCAAGCTCTACCTTCC-3',下游引物: 5'-CAGGTCCACATGGTCTTCCT-3', GAPDH上游引物: 5'-TGGGCTACACTGAGCACCAG-3',下游引物: 5'-CAGCGTCAAAGGTGGAGGAG-3' (2)bcl-2和p21 PCR检测: 用100 mL培养瓶培养的指数生长期细胞弃去培养液分别给予含多烯紫杉醇10 nmol/L的培养液继续培养6、12、24 h和含多烯紫杉醇0.5 nmol/L的培养液继续培养12、24、36 h后终止培养. 空白对照组不给任何浓度药物处理, 每个剂量时间点均重复三次. 加TrizoL 1 mL后吹打、混匀、按照TrizoL试剂说明书步骤提取总RNA, 溶于无RNase酶水中, 用紫外分光光度仪测定RNA浓度和纯度, 按照mRNA逆转录试剂盒说明转录成cDNA, 然后按照Light Cycler-DNA Master SYBER Green 1试剂盒用Light Cycler进行上述基因扩增, 反应条件为: 95 ℃ 0 s, 65 ℃ 5 s, 72℃ 10 s, 40 ℃ 30 s, 共40个循环. 实时连续测定基因扩增过程中产生的荧光, 以达到指数扩增时的循环周期数(Ct值)作为计算依据. 基因表达水平以倍数变化即2x来表示, x为以对照组Ct值平均数减去各实验组Ct值平均数差值, 对照组的倍数即为1.
统计学处理 20 d时各组肿瘤大小比较, 基因表达水平mean±SD 比较用t检验, P<0.05为差异有显著性.
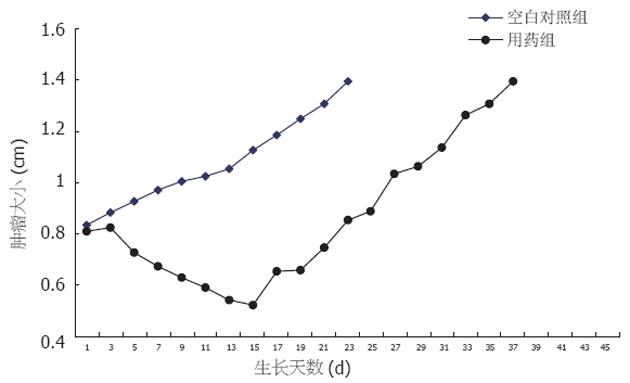
空白对照组肿瘤从平均0.8 cm到1.4 cm所需要天数为23 d, 单纯用药组肿瘤从0.8 cm到1.4 cm所需要天数为35 d, AGD为12 d(图1).
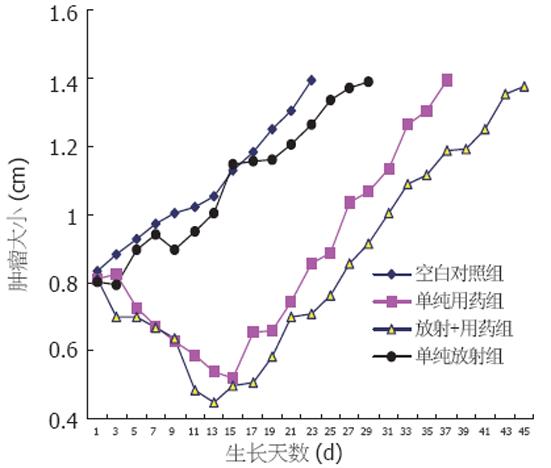
空白对照组肿瘤从平均0.8 cm到1.4 cm所需要天数为23 d, 单纯用药组肿瘤从0.8 cm到1.4 cm所需要天数为35 d, AGD为12 d, 单纯照射组为29 d, 用药和照射联合处理组为47 d, 单纯用药组为35 d, EF(enhancement factor)为2.0(图2). 20 d时对照组肿瘤为1.3±0.1 cm, 单纯用药组为0.75±0.2 cm, 用药和照射联合处理组为0.7±0.1 cm, 单纯照射组为1.2±0.1 cm, 单纯用药组和用药和照射联合处理组肿瘤明显小于对照组(P = 0.008, 0.005), 用药和照射联合处理组肿瘤也明显小于单纯照射组(P = 0.002).
多烯紫杉醇作用于SMMC-7721细胞后引起bcl-2基因表达下调, 用10 nmol/L多烯紫杉醇分别作用6、12、24 h后bcl-2基因mRNA水平下降至正常对照组的55%±19%、79%±10%、39%±4%, 而用0.5 nmol/L多烯紫杉醇12、24、36 h后bcl-2基因mRNA水平下降至正常对照组的50%±6%、47%±12%、50%±5%(P = 0.16, 0.36, 0.04, 0.07, 0.08, 0.07). 多烯紫杉醇作用于SMMC-7721细胞后在10 nmol/L和0.5 nmol/L大部分时间点与对照组比较引起p21基因表达上调, 但用10 nmol/L多烯紫杉醇分别作用6 h和0.5 nmol/L多烯紫杉醇作用36hp21基因mRNA水平出现下降. 倍数变化为0.71±0.08, 1.40±0.22, 1.42±0.27, 1.48±0.35, 2.66±0.53, 0.49±0.05(P = 0.14, 0.24, 0.27, 0.30, 0.04, 0.03).
多烯紫杉醇作为一种作用于微管抗肿瘤新药, 在其它肿瘤中进行了研究[5,6]. 我们在体外实验发现多烯紫杉醇具有抗HCC作用[7], 为此我们建立裸鼠HCC模型, 进一步观察在体内对HCC生长抑制作用. 结果表明多烯紫杉醇对裸鼠HCC抗肿瘤作用明显, 从肿瘤生长曲线可以看出用药后数日首先生长迟滞, 然后几乎呈直线性缩小, 在用药组10个裸鼠模型中有5个肿瘤几乎消失, 20 d后恢复生长, 可能此时残存肿瘤细胞开始分裂增殖, 进入细胞分裂周期, 如果继续用药将会给残存肿瘤更大杀伤. 在临床上对其它肿瘤用药方案是每3 wk用药1次, 这一点与我们建立的裸鼠HCC模型肿瘤恢复生长时间相似, 值得临床研究时借鉴. 实验和临床均证实多烯紫杉醇对其它肿瘤有放射增敏作用但不加重正常组织放射损伤[8-10]. 作者在体外已发现多烯紫杉醇对SMMC-7721细胞具有放射增敏作用[11], 因此我们进一步用裸鼠HCC模型进行了体内研究. 从图2中可以看出未处理组肿瘤基本呈线性生长, 单纯照射组经过小幅缩小和短暂生长迟滞后恢复缓慢生长, 而用药加放射组肿瘤则大幅度缩小, 恢复生长到同样大小所要时间比单纯放射组和单纯用药组都迟缓, 增敏因子达到了2.0, 其中用药加放射组的生长延迟效应已经扣除了药物影响. 我们证实多烯紫杉醇在裸鼠HCC模型具有显著放射增敏作用. 因为动物模型试验条件非常接近人体, 另外我们采用分割照射方法也模仿目前临床常用放疗方法, 本实验结果对在临床多烯紫杉醇应用于 HCC放疗增敏研究具有指导和借鉴意义. 另有体内研究发现多烯紫杉醇能够增加肿瘤血管直径和降低肿瘤组织间隙液压, 从而增加了肿瘤内血流量和用以交换的血管表面积, 增加局部氧供应[12]. 众所周知氧是最强的放射增敏剂, 肿瘤局部氧含量增加可直接增强放射增敏效应, 提高肿瘤放疗疗效. 由于我们已经证实在体外多烯紫杉醇对HCC具有明显抗肿瘤作用[7], 肿瘤负荷减少可以减少局部氧耗, 这是否与多烯紫杉醇在体内对HCC放射增敏有关值得进一步探讨.
具有抑制各种原因所致细胞凋亡的作用, 能够抑制多种因素(如化疗药物、放射线、癌基因等)介导的细胞凋亡, 影响肿瘤对凋亡诱导治疗的敏感性. 同时既往认为bcl-2可能与凋亡促进基因bax拮抗, 抑制细胞凋亡, 但是bcl和bax能够独立调节细胞凋亡, bcl-2转基因在bax不存在的情况下同样可以阻断凋亡, 而bax在bcl-2不存在的情况下也可以促进凋亡. 在bcl-2对放射增敏研究方面, 有人发现Didox(一种新的核糖核苷酸还原酶抑制剂)可以通过抑制放射引起的bcl-2基因表达实现对无p53基因表达的前列腺癌细胞株PC-3的放射增敏, 另外还有人观察到13-顺式-视黄酸和α-干扰素可明显引起宫颈癌细胞株ME-180放射增敏和凋亡, 但是当ME-180转染bcl-2基因后上述放射增敏和凋亡现象被抑制. Nehme et al发现多烯紫杉醇在引起前列腺癌细胞凋亡过程中, 伴有bcl-2、Cdc2、MAPK磷酸化、失活, 这种作用可以被全反式视黄酸抑制. 由于bcl-2与化疗药物和放射线引起的细胞凋亡关系密切, 为了探讨多烯紫杉醇对人肝癌细胞SMMC-7721作用机制, 我们对用药后SMMC-7721细胞内bcl-2 mRNA进行了实时定量PCR检测, 结果表明多烯紫杉醇在生长抑制、诱导凋亡和放射增敏浓度作用不同时间bcl-2表达都下降. 由于bcl-2促进细胞增殖和抑制凋亡, bcl-2表达下调可抑制SMMC-7721细胞增殖和促进凋亡, 同时对放射线引起的细胞凋亡具有促进作用. 因此我们认为bcl-2参与了多烯紫杉醇对HCC细胞SMMC-7721的生长抑制、诱导凋亡以及放射增敏过程.
p21是Cdk(周期素依赖性蛋白激酶)2和Cdk4抑制基因, 在G1期对细胞周期起负调控作用. 在体外它抑制各种Cyclin-Cdk(周期素-周期素依赖性蛋白激酶)复合物激酶活性, 近来研究发现出现应激时通过p53依赖途径和非依赖途径诱导p21表达, 而p21表达可导致细胞周期阻滞, 作为一种生长抑制基因p21被认为在预防肿瘤发生方面起重要作用. 将表达p21的重组腺病毒注入p53阴性的哺乳动物肿瘤内引起细胞凋亡, 减少细胞增殖, 同时减少肿瘤生长伴有Cdk2、 Cdk4、 Cdk6活性降低.
作为一种促凋亡上游基因p21参与了与多烯紫杉醇作用机制一致的抗肿瘤药物紫杉醇引起的细胞凋亡过程[13]. 在A549细胞进行的研究表明低浓度紫杉醇(3-6 nmol/L)可以完全抑制细胞增殖, 只是不足以引起有丝分裂阻滞, 但在此过程中诱导了p53和p21的表达, 引起了G1、G2期阻滞另外p21参与了抗病毒药物 Cidofovir对宫颈癌的放射增敏作用[14]. 由于p21与细胞周期和凋亡有关, 我们推测多烯紫杉醇对人肝癌细胞株SMMC-7721的作用机制是否与此有关. 为此我们对用药后细胞内p21 mRNA水平进行了检测, 结果表明多烯紫杉醇在生长抑制、诱导凋亡和放射增敏浓度作用不同时间多数时间点p21表达上调, 从而提示p21可能参与了多烯紫杉醇对HCC的生长抑制、诱导凋亡以及放射增敏过程. p21表达增加可能促进多烯紫杉醇和放射线引起的肝癌细胞生长抑制、凋亡.
电编: 张勇 编辑: 潘伯荣 审读: 张海宁
| 1. | Wu MC. Clinical research advances in primary liver cancer. World J Gastroenterol. 1998;4:471-474. [PubMed] [DOI] |
| 2. | Qin LX, Tang ZY. The prognostic significance of clinical and pathological features in hepatocellular carcinoma. World J Gastroenterol. 2002;8:193-199. [PubMed] |
| 3. | Mason KA, Kishi K, Hunter N, Buchmiller L, Akimoto T, Komaki R, Milas L. Effect of docetaxel on the therapeutic ratio of fractionated radiotherapy in vivo. Clin Cancer Res. 1999;5:4191-4198. [PubMed] |
| 4. | Matsuura M, Nakajima N, Arai K, Ito K. The usefulness of radiation therapy for hepatocellular carcinoma. Hepato-gastroenterology. 1998;45:791-796. [PubMed] |
| 5. | Nabholtz JM, Senn HJ, Bezwoda WR, Melnychuk D, Deschenes L, Douma J, Vandenberg TA, Rapoport B, Rosso R, Trillet-Lenoir V. Prospective randomized trial of docetaxel versus mitomycin plus vinblastine in patients with metastatic breast cancer progressing despite previous anthracycline-containing chemotherapy. 304 Study Group. J Clin Oncol. 1999;17:1413-1424. [PubMed] [DOI] |
| 6. | Sjostrom J, Blomqvist C, Mouridsen H, Pluzanska A, Ottosson-Lonn S, Bengtsson NO, Ostenstad B, Mjaaland I, Palm-Sjovall M, Wist E. Docetaxel compared with sequential methotrexate and 5-fluorouracil in patients with advanced breast cancer after anthracycline failure: a randomised phase III study with crossover on progression by the Scandinavian Breast Group. Eur J Cancer. 1999;35:1194-1201. [PubMed] [DOI] |
| 7. | Geng CX, Zeng ZC, Wang JY. Docetaxel inhibits SMMC-7721 human hepatocellular carcinoma cells growth and induces apoptosis. World J Gastroenterol. 2003;9:696-700. [PubMed] [DOI] |
| 8. | Creane M, Seymour CB, Colucci S, Mothersill C. Radiobiological effects of docetaxel (Taxotere): a potential radiation sensitizer. Int J Radiat Biol. 1999;75:731-737. [PubMed] [DOI] |
| 9. | Pradier O, Rave-Frank M, Lehmann J, Lucke E, Boghun O, Hess CF, Schmidberger H. Effects of docetaxel in combination with radiation on human head and neck cancer cells (ZMK-1) and cervical squamous cell carcinoma cells (CaSki). Int J Cancer. 2001;91:840-845. [PubMed] [DOI] |
| 10. | Wu HG, Bang YJ, Choi EK, Ahn YC, Kim YW, Lim TH, Suh C, Park K, Park CI. Phase I study of weekly docetaxel and cisplatin concurrent with thoracic radiotherapy in Stage III non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 2002;52:75-80. [PubMed] [DOI] |
| 11. | Geng CX, Zeng ZC, Wang JY, Xuan SY, Lin CM. Docetaxel shows radiosensitization in human hepatocellular carcinoma cells. World J Gastroenterol. 2005;11:2990-2993. [PubMed] [DOI] |
| 12. | Griffon-Etienne G, Boucher Y, Brekken C, Suit HD, Jain RK. taxane-induced apoptosis decompresses blood vessels and lowers interstitial fluid pressure in solid tumors clinical implications. Cancer Res. 1999;59:3776-3782. [PubMed] |