修回日期: 2005-11-01
接受日期: 2005-11-04
在线出版日期: 2005-12-15
目的: 探讨以TIMP-2为靶基因, 应用反义寡核苷酸(asON)技术抑制其在肝组织中的表达对大鼠肝纤维化发展的影响.
方法: 22只大鼠分为治疗组(n = 6)、模型组(n = 6)和正常对照组(n = 10). 以人血白蛋白免疫攻击方法制备免疫诱导型肝纤维化大鼠模型. 模型制备过程中, 治疗组大鼠以尾静脉注射方式给予针对TIMP-2的硫代反义寡核苷酸. RT-PCR、原位杂交、免疫组化、ELISA等方法检测TIMP-2的转录以及表达水平. 用病理学检查以及Ⅰ、Ⅳ型胶原的免疫组化结果分析肝纤维化发展程度. 通过胶原纤维特殊染色及电镜等观察asON对大鼠肝纤维化的影响.
结果: 治疗组病理学分级状况优于模型组(u = 2.071, P<0.05). 治疗组血清TIMP-2低于模型组(T = 55, P<0.05), 高于正常对照组(T = 55, P<0.05). 治疗组肝组织TIMP-2 mRNA表达弱于模型组(t = 3.332, P<0.05), 高于正常对照组(t =5.550, P<0.05). Ⅳ型胶原免疫组化图像定量分析结果显示, 治疗组与模型组有显著差异(t = 2.310, P<0.05), 其表达较低, 但仍高于正常对照组(t = 3.623, P<0.05). 治疗组Ⅰ型胶原免疫组化图像扫描结果与模型组相比, 其数值亦较低(t = 2.845, P<0.05). 治疗组肝窦基底膜胶原沉积较轻, 与模型组无明显差异.
结论: 抑制TIMP-2在肝组织中的表达可以减缓大鼠肝纤维化发展.
引文著录: 聂青和, 张亚飞, 谢玉梅, 邵彬, 李军, 苟艳子, 周永兴. 实验性肝纤维化大鼠肝脏中 TIMP-2 基因及蛋白表达阻断研究. 世界华人消化杂志 2005; 13(23): 2742-2747
Revised: November 1, 2005
Accepted: November 4, 2005
Published online: December 15, 2005
AIM: To investigate the inhibitory effect of tissue inhibitor of metalloproteinase-2 (TIMP-2) targeted antisense oligonucleotide (asON) on the progress of experimental liver fibrosis in rats.
METHODS: Twenty-two rats were divided into asON treatment (n = 6), model (n = 6), and normal control group (n = 10). The liver fibrosis model was induced by human serum albumin (HSA). During modeling, the rats were treated with antisense oligonucleotides via tail vein. The level of TIMP-2 expression was detected by reverse transcription polymerase chain reaction (RT-PCR), in situ hybridization, immunohistochemical staining and enzyme linked immunosorbent assay (ELISA). The effect of asON on liver fibrosis was analyzed by histopathological exami-nation, immunohistochemical staining of collagenⅠand Ⅳ, and special staining of collagen fiber as well as electron microscopy.
RESULTS: The pathological grading was notably im-proved in asON group than that in model group (u = 2.071, P <0.05). The serum and tissue expression of TIMP-2 were lower in asON group than those in model group (T = 55, P <0.05; t = 3.332, P <0.05), but higher than those in the control (T = 55, P <0.05; t = 5.550, P <0.05). Image quantitative analysis for immunohistochemical staining of collagen Ⅳ showed that the value was significant decreased in asON group as compared with that in model group (t = 2.310, P <0.05), but still higher than that in the control (t = 3.623, P <0.05); The value for collagenⅠwas also decreased in asON group as compared with that in model group (t = 2.845, P <0.05). Less collagen deposition was found in the hepatic sinusoid of asON group, which was not significantly different from that of model group.
CONCLUSION: TIMP-2 targeted asON can inhibit the progress of experimental liver fibrosis in rats.
- Citation: Nie QH, Zhang YF, Xie YM, Shao B, Li J, Gou YZ, Zhou YX. Antisense oligonucleotides-based inhibition of gene and protein expression of tissue inhibitor of metalloproteinase-2 on experimental liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2005; 13(23): 2742-2747
- URL: https://www.wjgnet.com/1009-3079/full/v13/i23/2742.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i23.2742
肝纤维化是肝组织受损伤后细胞外基质(ECM), 尤其是Ⅰ、Ⅲ、Ⅳ型胶原过度增生沉积和降解减少造成的病理性结果[1,2]. 近年来, 随着对其发生机制的深入研究, 特别是对ECM合成与降解分子生物学的了解, 许多学者针对ECM的代谢, 尤其是胶原合成与降解上的不同环节, 提出了多种治疗措施[3]. 基质金属蛋白酶(matrix metalloproteinases, MMPs)是一组能降解ECM的蛋白分解酶, 其活性与其特异性抑制因子--金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinases, TIMPs)在组织中的表达密切相关[4,5]. 正常状态下, TIMPs与MMPs处于动态平衡, 调节肝内ECM的生成和降解[6]. 在病理状态下, 肝星状细胞(HSC)活化, TIMPs表达增加, 其与组织中活性MMPs以1∶1摩尔比结合, 形成复合体, 从而抑制其降解ECM的能力[7]. 目前已发现的4种TIMP中, TIMP-1和TIMP-2在肝组织中表达, 被认为与肝纤维化密切相关[8,9]. 我们前期应用反义寡核苷酸(asON)技术, 以TIMP-1为靶基因, 研究TIMP-1在肝组织中的抑制性表达对肝纤维化发展的影响, 证实了TIMP-1在纤维化肝组织中表达的抑制可以减缓甚至逆转肝纤维化的发展[10]. TIMP-1和TIMP-2对MMPs的抑制活性, 因MMPs种类的不同, 其敏感性存在显著差异[11], TIMP-2与TIMP-1相比, 不具备对MMP-1等Ⅰ、Ⅱ、Ⅲ型胶原酶的抑制能力, 但其为MMP-2(Ⅳ型胶原酶)的主要抑制因子[12]. 肝纤维化时, 肝内胶原蛋白主要为Ⅰ、Ⅲ型胶原, 其中Ⅰ型胶原的增生最为明显, Ⅳ型胶原的增生沉积并不占主要地位[13,14]. 但研究证实, 肝纤维化时, Ⅳ型胶原的过度沉积可使肝窦毛细血管化, 肝血流和结构改变, 从而加剧肝脏病变[15]. 因此, 在肝纤维化组织中抑制TIMP-2的表达, 间接增强MMP-2的活性, 改变Ⅳ型胶原在肝脏中的沉积, 亦有可能减缓肝纤维化的发展.
1.1.1 反义寡核苷酸的设计与合成: 根据大鼠TIMP-2的全基因cDNA序列设计[16]. 针对TIMP-2基因组的调控序列、结构蛋白、编码区序列等分析, 设计2组不同的反义寡核苷酸, 序列如下:
DNA Seq1 5'-GCAAACGTTACGTCTACATC-3'
Seq2 5'-GATCAGCTCTTGAGGACGAA-3'
20-聚硫代磷酸脱氧核苷的化学合成在美国ABI公司391A PCRMATE EP DNA合成仪上自动进行, 硫代修饰asON采用TETD/乙氰法, 高效薄层色谱法纯化[17], 纯化后纯度>99%, 由北京军事医学科学院二所王升启研究员协助完成.
1.1.2 动物实验: Wistar大鼠, ♀, 体质量150-180 g, 22只, 购自第四军医大学动物中心. 随机将22只大鼠分为3组: 治疗组和模型组, 每组6只, 正常对照组10只. 参照王宝恩 et al[18]应用的人血白蛋白免疫攻击方法制备免疫诱导型肝纤维化大鼠模型. 在尾静脉攻击剂量维持期间, 治疗组大鼠于每次尾静脉注射白蛋白24 h后给予硫代反义寡核苷酸(20 μg/g, 尾静脉注射, 共20次); 模型组6只大鼠于每次尾静脉注射白蛋白24 h后尾静脉注射等量无菌生理盐水; 10只同等条件下饲养的Wistar大鼠为正常对照组.
1.1.3 血清标本的制备: 治疗组自维持剂量攻击的第2 wk始, 于每周第二次给予硫代反义寡核苷酸前, 采血0.5 mL, 离心后取血清, -70℃保存, 共9次. 其他2组大鼠在同样时间同样方式采血. 所有大鼠处死时亦取血清标本. 血清标本全部采集完成后统一检测.
1.1.4 肝组织标本的采集: 尾静脉攻击结束1 wk后, 所有大鼠麻醉后活杀, 取肝脏标本, 统一备检.
1.2.1 病理学观察: 常规HE染色观察肝组织学改变. 病理组织学判定标准按照王宝恩 et al[19]的标准, 根椐病理切片中胶原纤维增生程度, 将肝纤维化、肝硬化分为6级. 无胶原纤维增生的正常肝组织为0级. 每张切片随机选取5个视野, 分别记录病理分级, 并取其平均值(4舍5入)作为该肝组织切片的病理分级. Von Gieson、Masson胶原纤维特殊染色观察肝组织胶原沉积情况.
1.2.2 血清TIMP-2的检测: 利用双夹心ELISA方法定量测定血清中TIMP-2[20]. TIMP-2单克隆抗体购于美国Maxim生物技术公司, 产品编号为MAB-0283. 应用ELISA读数仪(ELx800, Bio-Tek Instruments, INC. USA)在450 nm波长处测吸光度.
1.2.3 RT-PCR法检测肝组织TIMP-2 mRNA的表达: 用Promega公司生产的Total RNA Isolation System提取肝组织总RNA. PCR反应体系内含cDNA 2 μL、10×buffer 2 μL、4×dNTP(2 mmol/L)2 μL, TIMP-2、b-actin引物(10 mmol/L)各2 μL, Taq酶16.67 nkat, 超重水补至20 μL. 治疗组、模型组及正常对照组共22份标本各取1 μg总RNA抽提物加入此反应体系, 反应参数为: 97℃预变性2 min; 94℃变性30 s, 56℃退火30 s, 72℃延伸50 s, 30个循环; 最后72℃延伸7 min. 取PCR扩增产物10 μL加入20 g/L的琼脂糖凝胶孔中在TAE缓冲液, 电压50 V电泳1 h, 溴化乙锭显色后成像定量分析, 用TIMP-2/b-actin比值表示TIMP-2表达水平. 各组各取一份标本(治疗组、模型组均取自肝纤维化等级为Ⅳ的大鼠肝组织标本, 正常对照组随机), 在检测TIMP-2 mRNA的同时检测MMP-2 mRNA的表达(TIMP-2和MMP-2引物序列[21]见表1, 2).
| 引物 | 核苷酸序列 | 产物位置 (bp) | |
| TIMP-2 | 正义链 | 5'-GTTTTGCAATGCAGATGTAG-3' | 540 |
| 反义链 | 5'-ATGTCGAGAAACTCCTGCTT-3' | ||
| β-actin | 正义链 | 5'-ACCCCCACTGAAAAA-3' | 120 |
| 反义链 | 5'-ATCTTCAAACCTCCATGATG-3' | ||
| 引物 | 核苷酸序列 | 产物位置 (bp) | |
| MMP-2 | 正义链 | 5'-TTCTTCAAGGACCGGTTTATTTGG-3' | 330 |
| 反义链 | 5'-CTTCTTCACTTCATTGTATCTCCA-3' | ||
1.2.4 原位杂交法检测TIMP-2 mRNA: TIMP-2 cDNA探针及原位杂交试剂盒购自武汉博士德生物工程有限公司. 应用我们既往开展的地高辛标记探针原位杂交法进行操作[22], 结果经计算机图象灰度扫描数字转换后, 进行统计学处理.
1.2.5 TIMP-2相关抗原、Ⅰ、Ⅳ型胶原的免疫组化: 所用试剂盒分别购自福州迈新生物技术开发公司和武汉博士德生物工程有限公司, 操作按试剂盒说明书进行. TIMP-2相关抗原、Ⅰ型胶原免疫组化结果经计算机图象灰度扫描数字转换后, 进行统计学处理. Ⅳ型胶原免疫组化染色每个标本制作3张切片, 随机选择5个不同视野, 测定标准测量窗口中肝窦壁阳性区域的面积比.
1.2.6 肝组织羟脯氨酸测定: 肝组织经脱脂、脱水、干燥后, 于6 mol/L HCl 121℃水解3 h, 再用对二甲氨基苯甲醛显色法测定[23]. 肝组织总蛋白中羟脯氨酸含量以"mg Hyp/g"表示.
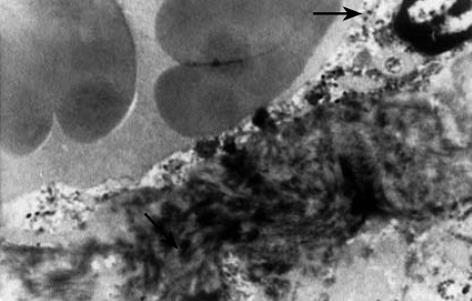
1.2.7 电镜观察: 常规制备肝组织电镜标本, 送本校电镜室透射电镜(日本Jeol公司JEM-100SX型)观察.
统计学处理 对肝纤维化病理学分级和血清TIMP-2检测结果应用Wilcoxon秩和检验和Wilcoxon符号秩检验进行分析, 其他实验结果应用两样本t检验进行分析. 上述检验方法均采用SPSS 10.0统计软件处理.
治疗组病理学分级状况优于模型组(Wilcoxon秩和检验, u = 2.071, P<0.05)(表3). Von Gieson、Masson胶原纤维特殊染色可见治疗组纤维间隔较纤细.
| 组别 | n | 肝纤维化病理学分级 | ||||||
| 0 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | ||
| 正常对照组 | 10 | 10 | 0 | 0 | 0 | 0 | 0 | 0 |
| 治疗组 | 6 | 0 | 0 | 0 | 2 | 2 | 1 | 1 |
| 模型组 | 6 | 0 | 0 | 0 | 0 | 1 | 2 | 3 |
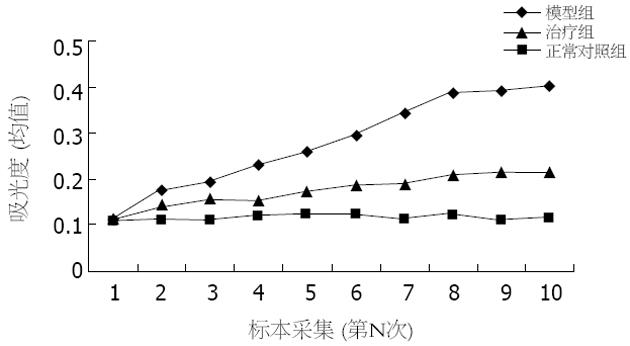
理论上, ELISA读数仪读数(吸光度)与TIMP-2蛋白量成比例关系, 能较好的反映血清TIMP-2水平[24]. 血清TIMP-2检测结果显示, 治疗组低于模型组(Wilcoxon符号秩检验, T = 55, P<0.05), 高于正常对照组(T = 55, P<0.05)(图1).
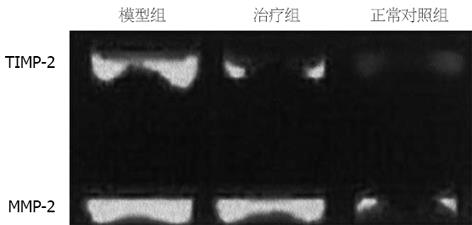
治疗组TIMP-2 mRNA表达弱于模型组(t = 3.332, P<0.05), 高于正常对照组(t = 5.550, P<0.05), 表明以TIMP-2为靶基因的asON确可在一定程度上抑制TIMP-2 mRNA的转录水平(表4). MMP-2 mRNA RT-PCR结果显示治疗组与模型组没有显著差异, 图2显示各实验组各取一份标本所做RT-PCR结果.
| 组别 | n | TIMP-2 |
| 正常对照组 | 10 | 0.36±0.08 |
| 治疗组 | 6 | 0.69±0.16 |
| 模型组 | 6 | 1.06±0.22 |
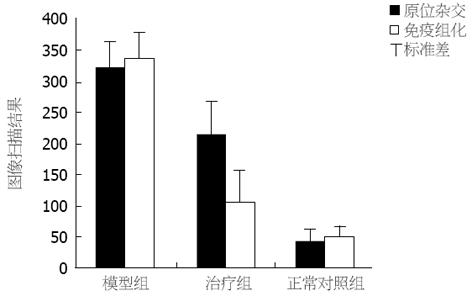
治疗组图像扫描结果均低与模型组(P<0.05), 且免疫组化图像扫描结果差异性更为显著(免疫组化t = 8.391 vs 原位杂交t = 3.803)(图3).
Ⅳ型胶原免疫组化图像定量分析结果显示, 治疗组与模型组有显著差异(t = 2.310, P<0.05), 其表达较低, 但仍高于正常对照组(t = 3.623, P<0.05). 治疗组Ⅰ型胶原免疫组化图像扫描结果与模型组相比, 其数值亦较低(t = 2.845, P<0.05)(表5).
| 组别 | n | Ⅰ型胶原灰度扫描结果 | Ⅳ型胶原阳性面积比 |
| 正常对照组 | 10 | 57.7±18.04 | 4.26±1.13 |
| 治疗组 | 6 | 319.5±76.62 | 6.47±1.26 |
| 模型组 | 6 | 499.9±134.88 | 8.26±1.42 |
肝纤维化是肝细胞坏死或损伤后常见的反应, 可由多种因素引起, 包括肝脏感染(病毒, 细菌, 真菌, 寄生虫)、酒精中毒、药物性肝炎以及一些先天性疾病等, 其中, 病毒性肝炎是国内肝纤维化最主要的原因, 其发病机制复杂, 常迁延不愈, 若不经治疗, 最终可发展至肝硬化、肝衰竭甚至肝癌, 严重危害人类健康[25,26]. 研究认为, 病毒性肝炎引起的纤维化是机体对病毒感染引起的广泛性肝脏炎症的修复反应, 其中, 病毒感染是病因, 纤维化是病理基础, 由此, 临床上将对病毒性肝炎的治疗分为两种策略: 抗病毒治疗和阻止肝纤维化的发展. 在抗病毒治疗方面, 经多年的努力, 已有多种药物应用于临床, 但因病毒变异等因素, 其治疗效果总是不尽人意[27]. 因此, 研究肝纤维化发生的具体机制, 并进而针对性地进行治疗, 阻止其发展, 对提高病毒性肝炎治疗效果有着极为重要的意义.
根据核苷酸杂交原理, 寡核苷酸可特异性地结合基因组DNA/RNA, 从而在基因水平上干扰致病蛋白质的产生过程, 这一寡核苷酸被称为反义寡核苷酸(asON). asON具有特异、高效、易人工合成等优势, 通过适当修饰, 可增强透膜性、稳定性及生物利用度, 从而使其做为药用成为可能[28,29]. 目前已有17种反义寡核苷酸药物进入临床试验, 其中一种用于治疗巨细胞病毒性视网膜炎和艾滋病人并发巨细胞视网膜炎的反义寡核苷酸药物Vitravene已上市, 临床应用也已取得较好效果[30]. 在肝纤维化方面, 以TGF-β1为靶基因的反义寡核苷酸药物也已被证实有较好的抑制肝纤维化发展的作用[31,32]. 我们前期利用硫代修饰asON特异性阻断TIMP-1的基因和蛋白表达, 证实TIMP-1在纤维化肝组织中表达的抑制亦可减缓甚至逆转肝纤维化的发展[10,17].
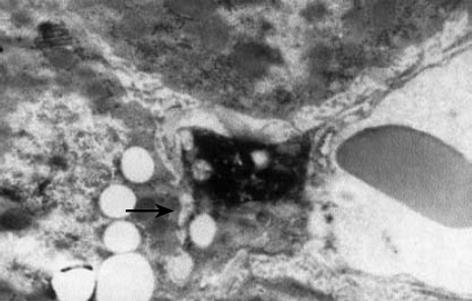
TIMP-2是肝内Ⅳ型胶原酶MMP-2的主要抑制因子, TIMP-2/MMP-2系统对Ⅳ型胶原的增生沉积和降解起着重要的调节作用[33]. 在肝纤维化组织中, Ⅳ型胶原并不是肝脏内沉积胶原的主要成分, 但其主要表达于肝窦基底膜, 其过度沉积增生可导致肝窦毛细血管化(hepatic sinusoid capillarization), 影响肝内外物质交换, 加重肝功能损害[34]. 因此, 抑制肝组织中TIMP-2的表达, 间接增强MMP-2的活力, 有助于分解过多沉积在肝窦基底膜内的Ⅳ型胶原, 改善肝细胞与血液间的物质交换, 降低肝细胞功能的损害. 实验结果表明, 我们所设计的针对TIMP-2基因的反义寡核苷酸可有效的抑制TIMP-2 mRNA的转录及相关蛋白在肝组织内的表达, Ⅳ型胶原免疫组化染色结果也显示抑制TIMP-2的表达可增强MMP-2对Ⅳ型胶原的降解. 电镜观察显示虽治疗组肝星状细胞活化与模型组无显著差异, 但其肝窦基底膜处胶原沉积较弱, 肝窦失窗口现象也较弱, 这一结果表明治疗组肝窦功能受损较弱, 肝细胞物质交换尚可, 肝功能受损程度也较轻. 肝组织Ⅰ型胶原及羟脯氨酸含量的检测结果亦显示治疗组纤维化程度低于模型组.
我们对MMP-2 mRNA的检测结果显示, TIMP-2转录水平的降低对MMP-2 mRNA的转录没有明显影响, 说明在肝脏纤维化过程中, MMP-2的表达可能并不存在TIMP-2的正反馈调整. 此外, 我们在实验中观察到, 治疗组大鼠肝纤维化组织中TIMP-2蛋白表达的抑制程度较其mRNA转录水平的抑制程度更为明显, 其原因尚需进一步探讨.
电镜观察显示虽治疗组肝星状细胞活化与模型组无显著差异, 但其肝窦基底膜处胶原沉积较弱, 肝窦失窗口现象也较弱, 这一结果表明治疗组肝窦功能受损较弱, 肝细胞物质交换尚可, 肝功能受损害程度也较轻.
总之, 针对TIMP-2设计的硫代反义寡核苷酸对实验性免疫性肝纤维化大鼠模型有一定抗肝纤维化作用, 但较针对TIMP-1设计的硫代反义寡核苷酸为弱, 若单独应用, 可能效果不甚明显. 但我们认为, 其抗纤维化机制与阻断TIMP-1表达的抗纤维化机制并不重复. 因此, 我们认为在选用TIMP-1为基因治疗的靶基因时, 同时设计针对TIMP-2的反义寡核苷酸, 联合应用, 应能提高抗肝纤维化的疗效.
电编: 张敏 编辑: 潘伯荣 审读: 张海宁
| 2. | Nakamuta M, Kotoh K, Enjoji M, Nawata H. Effects of fibril- or fixed-collagen on matrix metalloproteinase-1 and tissue inhibitor of matrix metalloproteinase-1 production in the human hepatocyte cell line HLE. World J Gastroenterol. 2005;11:2264-2268. [PubMed] [DOI] |
| 3. | Wang QC, Nie QH, Feng ZH. RNA interference: antiviral wea-pon and beyond. World J Gastroenterol. 2003;9:1657-1661. [PubMed] [DOI] |
| 4. | Abraham D, Ponticos M, Nagase H. Connective tissue rem-odeling: cross-talk between endothelins and matrix metallo- proteinases. Curr Vasc Pharmacol. 2005;3:369-379. [PubMed] [DOI] |
| 5. | Schuppan D, Ruehl M, Somasundaram R, Hahn EG. Matrix as a modulator of hepatic fibrogenesis. Semin Liver Dis. 2001;21:351-372. [PubMed] [DOI] |
| 6. | Murawaki Y, Ikuta Y, Idobe Y, Kitamura Y, Kawasaki H. Tissue inhibitor of metalloproteinase-1 in the liver of patients with chronic liver disease. J Hepatol. 1997;26:1213-1219. [PubMed] [DOI] |
| 7. | Nie QH, Duan GR, Luo XD, Xie YM, Luo H, Zhou YX, Pan BR. Expression of TIMP-1 and TIMP-2 in rats with hepatic fibrosis. World J Gastroenterol. 2004;10:86-90. [PubMed] |
| 9. | Iredale JP. Cirrhosis: new research provides a basis for rational and targeted treatments. BMJ. 2003;327:143-147. [PubMed] [DOI] |
| 10. | Nie QH, Cheng YQ, Xie YM, Zhou YX, Cao YZ. Inhibiting effect of antisense oligonucleotides phosphorthioate on gene expression of TIMP-1 in rat liver fibrosis. World J Gastroenterol. 2001;7:363-369. [PubMed] [DOI] |
| 11. | Brew K, Dinakarpandian D, Nagase H. Tissue inhibitors of metalloproteinases: evolution, structure and function. Biochim Biophys Acta. 2000;1477:267-283. [PubMed] [DOI] |
| 12. | Yoshizaki T, Sato H, Furukawa M. Recent advances in the reg-ulation of matrix metalloproteinase 2 activation: from basic research to clinical implication (Review). Oncol Rep. 2002;9:607-611. [PubMed] |
| 13. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 14. | Senoo H. Structure and function of hepatic stellate cells. Med Electron Microsc. 2004;37:3-15. [PubMed] [DOI] |
| 16. | Santoro M, Battaglia C, Zhang L, Carlomagno F, Martelli ML, Salvatore D, Fusco A. Cloning of the rat tissue inhibitor of metalloproteinases type 2 (TIMP-2) gene: analysis of its express-ion in normal and transformed thyroid cells. Exp Cell Res. 1994;213:398-403. [PubMed] [DOI] |
| 20. | Walsh KM, Timms P, Campbell S, MacSween RN, Morris AJ. Plasma levels of matrix metalloproteinase-2 (MMP-2) and tissue inhibitors of metalloproteinases -1 and -2 (TIMP-1 and TIMP-2) as noninvasive markers of liver disease in chronic hepatitis C: comparison using ROC analysis. Dig Dis Sci. 1999;44:624-630. [PubMed] [DOI] |
| 21. | 谢 玉梅, 聂 青和, 周 永兴, 黄 长形, 康 文臻, 张 岩, 郝 春秋, 王 九平, 朱 晓慧. 中药双甲五灵冲剂对免疫性肝纤维化大鼠肝组织中TIMPs蛋白及基因表达的影响. 世界华人消化杂志. 2003;11:199-203. [DOI] |
| 23. | Sakaida I, Hironaka K, Uchida K, Suzuki C, Kayano K, Okita K. Fibrosis accelerates the development of enzyme-altered lesions in the rat liver. Hepatology. 1998;28:1247-1252. [PubMed] [DOI] |
| 24. | Nie QH, Cheng YQ, Xie YM, Zhou YX, Bai XG, Cao YZ. Meth-odologic research on TIMP-1, TIMP-2 detection as a new diagnostic index for hepatic fibrosis and its significance. World J Gastroenterol. 2002;8:282-287. [PubMed] |
| 25. | Tsukuma H, Tanaka H, Ajiki W, Oshima A. Liver cancer and its prevention. Asian Pac J Cancer Prev. 2005;6:244-250. [PubMed] |
| 30. | Crooke ST. Antisense strategies. Curr Mol Med. 2004;4:465-487. [PubMed] [DOI] |
| 31. | Ueberham E, Low R, Ueberham U, Schonig K, Bujard H, Gebhardt R. Conditional tetracycline-regulated expression of TGF-beta1 in liver of transgenic mice leads to reversible inter-mediary fibrosis. Hepatology. 2003;37:1067-1078. [PubMed] [DOI] |
| 33. | Nie QH, Zhou YX, Xie YM. Expression and significance of tissue inhibitors of metallproteinases-1 and -2 in serum and liver tiss-ue of patients with liver cirrhosis. Zhonghua YiXue ZaZhi. 2001;81:805-807. [PubMed] |
| 34. | Xu B, Broome U, Uzunel M, Nava S, Ge X, Kumagai-Braesch M, Hultenby K, Christensson B, Ericzon BG, Holgersson J. Capillarization of hepatic sinusoid by liver endothelial cell-reactive autoantibodies in patients with cirrhosis and chronic hepatitis. Am J Pathol. 2003;163:1275-1289. [PubMed] [DOI] |