修回日期: 2005-09-25
接受日期: 2005-09-30
在线出版日期: 2005-11-15
目的: 用表面增强激光解吸离子化飞行时间质谱(SELDI-TOF-MS)技术研究人巨细胞病毒(hCMV)感染致婴儿肝炎综合征患儿血清蛋白质谱的差异表达, 寻找特异性蛋白标志物, 为研究hCMV感染引起婴儿肝炎综合征的蛋白质组学发病机制奠定基础.
方法: 实验组为hCMV感染所致的婴儿肝炎综合征患儿20例; 对照组Ⅰ为感染hCMV但未发生婴儿肝炎者5例; 对照组Ⅱ为hCMV感染阴性的婴儿肝炎10例; 对照组Ⅲ为健康对照10例. 采集全血, 分离血清, 用SELDI-TOF-MS技术和WCX2芯片检测各组蛋白质谱的表达.
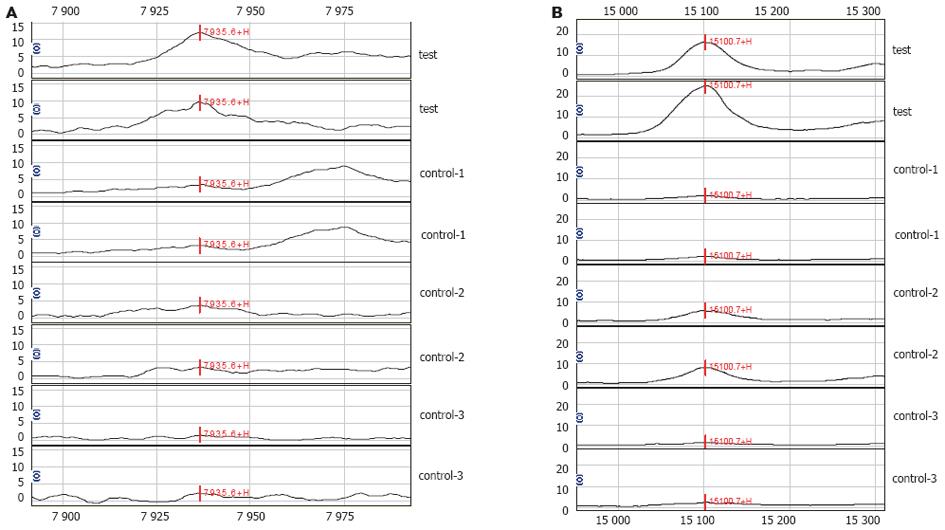
结果: hCMV感染引起的婴儿肝炎综合征组与其他对照组比较, 血清中有4个蛋白质表达水平发生明显变化, 分别为Mr 4 349.8、Mr 5 808.7、Mr 7 935.6和Mr 8 885.9的蛋白峰. hCMV感染的两个组与未感染的对照组婴儿比较, 血清中共有5个蛋白质表达水平发生明显变化, 分别为Mr 3 266.8、Mr 5 638.5、Mr 5 909.1、Mr 7 771.4和Mr 15 835.6的蛋白峰. hCMV感染但未发生婴儿肝炎组与其他组婴儿比较, 血清中有2个蛋白质表达水平发生明显变化, 分别为Mr 4 600.1和Mr 5 704.3的蛋白峰. 两个婴儿肝炎组与肝功能正常的另两组婴儿比较, 血清中有4个蛋白质表达水平发生明显变化, 分别为Mr 7 567.0、Mr 13 744.8、Mr 15 100.7和Mr 15 915.0的蛋白峰.
结论: 一些特定的血清蛋白质分子如肝再生增强因子、前白蛋白和结合珠蛋白是与肝功能密切相关的因子; 细胞因子β-防御素31, β-防御素8和巨细胞源性趋化因子等, 可能与hCMV感染、感染后发病及感染后保护相关.
引文著录: 张妍, 刘华林, 王斌, 钱冬萌, 闫志勇, 丁守怡, 宋旭霞, 宋广辉. 利用SELDI-TOF-MS技术研究巨细胞病毒感染致婴儿肝炎综合征的血清蛋白标志物. 世界华人消化杂志 2005; 13(21): 2549-2553
Revised: September 25, 2005
Accepted: September 30, 2005
Published online: November 15, 2005
AIM: To identify the serum protein biomarkers in infants with hepatitis syndrome resulted from congenital human cytomegalovirus (hCMV) infected using Surface enhanced laser desorption/ionization-time of flight mass spectrometry (SELDI-TOF-MS).
METHODS: Serum samples were collected from 20 hCMV infected hepatitis infants and 25 controls. Of the 25 infants, 5 were infected with hCMV but without hepatitis, 10 with hepatitis but no hCMV infection, and 10 were healthy infants. The proteomic expression in the serum was detected by WCX2 chips and SELDI-TOF-MS.
RESULTS: Fifteen protein peaks were distinctly di-fferent among the four groups in the mass range of Mr 2 000-20 000. Of the 15 peaks, four at Mr 4 349.8, Mr 5 808.7, Mr 7 935.6 and Mr 8 885.9 were significantly di-fferent between the congenital hCMV infected hepatitis infants and the controls. Five peaks were distinctly up-regulated in the infants with hCMV infection (Mr 3 266.8, Mr 5 638.5, Mr 5 909.1, Mr 7 771.4 and Mr 15 835.6) as compared with those in the infants without hCMV infec-tion. In comparison with other infants, two proteins at Mr 4 600.1 and Mr 5 704.3, respectively, were up-regulated in the infants with hMCV infection but no hepatitis. Four protein peaks were markedly different (Mr 7 567.0, Mr 13 744.8, Mr 15 100.7 and Mr 15 915.0) between the infants with hepatitis and other controls.
CONCLUSION: Some specific serum protein such as au-gmenter of liver regeneration, prealbu min, and hap-toglobin were closely related to liver function. Cytokines such as beta-defensin 31, 8, and macrophage-derived chemokine, and etc were involved in the hMCV infection and the pathogenesis hMCV-induced hepatitis in infants.
- Citation: Zhang Y, Liu HL, Wang B, Qian DM, Yan ZY, Ding SY, Song XX, Song GH. Identification of serum biomarkers in human cytomegalovirus infected hepatitis infants by SELDI-TOF-MS. Shijie Huaren Xiaohua Zazhi 2005; 13(21): 2549-2553
- URL: https://www.wjgnet.com/1009-3079/full/v13/i21/2549.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i21.2549
婴儿肝炎综合征(infant hepatitis syndrome, 简称婴肝)指1岁以内婴儿未明病因引起的以肝功能损害及病理性肝脏体征为主要表现的临床征候群,可伴有黄疸(直接胆红素升高)或无黄疸; 是一组多病因, 主要是病毒感染引起的一种综合征[1].其中hCMV感染为病毒感染的首位病因, 但其导致婴肝的确切致病机制仍然不明,许多临床病例显示hCMV感染阳性的小儿并无婴肝的症状表现, 因此需要用新的研究手段和方法去探讨hCMV感染与婴肝之间的确切关系.蛋白组学研究近年取得长足的进展,尤其是表面增强激光解吸离子化飞行时间质谱技术(SELDI-TOF- MS)的出现为全世界寻找多种疾病的标志物提供了新的技术平台, 同时也为研究许多疾病的致病机理提供了新的手段.本研究采用SELDI技术和WCX2芯片对hCMV引起的婴肝患儿与三组对照组婴儿的血清标本进行检测, 寻找各组间蛋白表达谱的差异, 从而为从血清蛋白质组水平研究hCMV引起婴肝的发病机制、治疗和预后监控奠定基础.
实验组: 2004-11/2005-7住院的hCMV感染引起的婴肝20例, 男10例, 女10例,年龄1-8mo (平均2.5 mo).对照组Ⅰ为感染hCMV但未发生婴肝5例; 对照组Ⅱ为hCMV感染阴性的婴肝, 10例; 对照组Ⅲ为健康对照10例. 肝功能检测用dade behring公司的自动生化分析仪检测ALT、AST、总胆红素、直接胆红素、间接胆红素、总蛋白、白蛋白、球蛋白、总胆汁酸等.肝炎全套检测使用相应试剂盒. 尿CMV基因定量检测使用hCMV核酸扩增(PCR)荧光检测试剂盒(深圳市匹基生物工程股份有限公司), 严格按照操作说明书进行.
采集全血1-2 mL, 立即放入4℃, 静置4h, 4℃ 4000 r/ min 离心30 min,每管20 μL分装后置-86℃冰箱保存备用.使用前取出血清样品,冰上融化后,4℃ 10000 r/min 离心10 min,除去血清中的不溶物.在标记好的1.5 mLEp管中依次加入20 μL U9缓冲液(9 mol/L urea,20 g/L CHAPS,50 mmol/L Tris-HCl, pH9.0, 10 g/L DTT)和10 μL血清样品,将样品混匀后500 r/ min冰浴振荡30 min.然后向30 μL稀释样品中加入360 μL醋酸钠缓冲液(50 mmol/L, pH4.0),迅速混匀后加样.将WCX2芯片安装于加样器(bioprocessor)内,每加样孔加入醋酸钠缓冲液200 μL,室温500r/ min 振荡5 min, 弃去缓冲液,重复上述操作1次.每孔加入稀释后的血清样品100 μL,室温500 r/ min 振荡孵育1h.甩去液体,每孔加入醋酸钠缓冲液200 μL,室温振荡5 min,洗去未结合样品.弃去缓冲液后,重复上述操作1次.每孔加入HPLC水200 μL,立刻弃去.卸下加样器,待芯片表面自然晾干后,每点各加饱和SPA 0.5 μL,待芯片表面风干后, 重复1次. 采用PBSⅡc型蛋白芯片阅读仪读取芯片信息,仪器用标准多肽校正, 系统的质量偏差为0.1%.芯片阅读仪参数设置如下: 激光强度180,检测灵敏度8 ,优化范围Mr 2 000-20 000,最高分子质量Mr 50 000,芯片上的每个点采集130次. 用Ciphergen ProteinChip 3.1.1软件自动采集数据. 结果用Biomarker Wizard 软件将2 000-20 000的质荷比峰首先用信噪比(S/N)大于5和大于2各过滤1次.筛出的质荷比峰在10%以上的样品中同时存在, 且同一质荷比峰在不同样品中的偏差小于0.3%, 以去除原始数据中的噪音.分析hCMV引起的婴肝组与各对照组婴儿的血清蛋白质谱的差异.
实验组20例转氨酶均升高, 其中有16例同时有胆红素升高, 且以直接胆红素升高为主, 且临床表现为黄疸及肝大, 符合黄疸型婴肝; 另外4例胆红素正常, 且无黄疸表现, 为非黄疸型婴肝.对照组Ⅱ中10例转氨酶均高于正常值.对照组Ⅰ, Ⅲ各例肝功能各项指标均在正常范围内.肝炎全套检测结果示: 实验组及各对照组肝炎全套检测结果均为阴性, 排除了其他肝炎病毒感染的可能. 尿CMV基因定量检测实验组及对照组Ⅰ的基因定量均为阳性(2.0×107-1.17×109 copy/L).对照组Ⅱ, Ⅲ基因定量结果均为阴性.
用Ciphergen Biomarker Wizard软件对各组样品进行质谱分析, 在分子质量Mr 2 000~20 000范围内, 寻找各组之间的差异蛋白.其中hCMV引起的婴儿肝炎综合征组与三个对照组比较,分子质量为Mr 4349.8、Mr 8885.9的蛋白峰表达明显下调, 分子质量为Mr 5808.7、Mr 7935.6的蛋白峰表达明显上调(表1, 图1A).hCMV感染的两个组与未感染的对照组比较, 分子质量为Mr 3266.8、Mr 5638.5、Mr 5909.1、Mr 7771.4及Mr 15835.6的蛋白峰表达均明显上调(表1).hCMV感染但未发生婴肝组与其他组比较, 分子质量为Mr 4600.1、Mr 5704.3的蛋白峰明显上调(表1).两个婴肝组与肝功能正常的两组比较, 分子质量为Mr 7567.0、Mr 15100.7的蛋白峰明显上调, 且hCMV感染导致的婴肝组较hCMV感染阴性的婴肝组上调更明显.分子质量为Mr 13744.8、Mr 15100.7的蛋白峰明显下调(表1,图1B).
| 蛋白峰分子质量(Mr) | 实验组 | 对照组Ⅰ | 对照组Ⅱ | 对照组Ⅲ |
| 4349.8 | 0 | ↑ | ↑ | ↑ |
| 5808.7 | ↑ | 0 | 0 | 0 |
| 7935.6 | ↑ | 0 | 0 | 0 |
| 8885.9 | 0 | ↑ | ↑ | ↑ |
| 3266.8 | ↑ | ↑ | 0 | 0 |
| 5638.5 | ↑ | ↑ | 0 | 0 |
| 5909.1 | ↑ | ↑ | 0 | 0 |
| 7771.4 | ↑ | ↑ | 0 | 0 |
| 15835.6 | ↑ | ↑ | 0 | 0 |
| 4600.1 | 0 | ↑ | 0 | 0 |
| 5704.3 | 0 | ↑ | 0 | 0 |
| 7567.0 | ↑↑ | 0 | ↑ | 0 |
| 13744.8 | 0 | ↑ | 0 | ↑ |
| 15100.7 | ↑↑ | 0 | ↑ | 0 |
| 15915.0 | 0 | ↑ | 0 | ↑ |
蛋白质组(proteome)是对应于一个基因组的所有蛋白质构成的整体. 蛋白质组学(proteomics)以蛋白质组为研究对象, 从整体的角度, 分析细胞内外动态变化的蛋白质组成与活动规律[2-5]. SELDI结合蛋白质芯片能对原始样品进行高通量检测, 检测分子质量在Mr 500-500 000之间的蛋白或多肽, 而且所需样本体积小(0.5-400 µL). 由于其具有高分辨力, 应用简便, 敏感性高得到越来越广泛的应用[6-10]. 目前SELDI蛋白质芯片技术主要用于检测血清中的肿瘤蛋白质标志物, 已经发现了膀胱癌[11,12], 卵巢癌[13,14], 前列腺癌[15,16], 乳腺癌[17,18]以及其他癌症特异的标志分子. Ho研究小组[19]用SELDI技术研究艾滋病与正常人血清时发现并确定了一种相关蛋白-防御素1,2,3, 从而为艾滋病的研究与治疗提供了一定的基础. 婴肝病因复杂, 其中病毒感染是其主要病因之一. HCMV感染则是首位的病毒学病因. HCMV是宫内病毒感染最常见的原因. 母亲孕期原发性hCMV感染或再感染可将病毒传播给胎儿, 而导致胎儿先天性hCMV感染. 10%先天性hCMV感染的婴儿将出现严重的临床表现, 常见的有肝脾肿大、黄疸、小头畸形、体重低下、紫癜、先天畸形等[20,21], 但其导致婴肝的确切致病机制仍然不明. 有报道在母亲原发感染期间, 白细胞携带病毒到达微脉管上皮细胞[22-24], 微脉管上皮细胞与锚在母体微动脉绒毛上的细胞滋养层直接相联, 被感染的滋养层细胞将继而感染绒毛核心下的组织, 包括成纤维细胞和胎儿内皮细胞, 这样病毒就感染了胎儿. 原发感染时的另外一种传播机制可能是感染了的母体白细胞通过破坏合体滋养层而感染绒毛层的基质[25]. 同时, 合体滋养层细胞可以直接被病毒感染[26]. 另外病毒感染机体后可抑制机体的免疫功能, 特别是细胞介导的免疫反应, 如巨噬细胞及CD14+单核细胞等均参与机体对hCMV的免疫应答反应[26]. 尽管近年来对hCMV的研究颇多, 但对于其导致婴儿肝脏损伤的机制仍不十分明确, 因此在本实验中我们采用Seldi-TOF-MS技术, 意图从蛋白质水平发现与hCMV感染及致病有关的蛋白标志物, 进而揭示hCMV感染引起婴儿肝炎综合征的致病机制.
我们首先进行了肝炎全套检测, 排除了其他肝炎病毒感染的可能. 然后对各组婴儿进行尿CMV基因定量检测, 结合肝功能检测结果及临床表现(如黄疸、肝脾肿大等)将所有标本分为4个组, 检测各组之间血清中蛋白表达谱的差异. 我们根据发现的差异蛋白的分子质量及等电点(WCX2芯片捕获的蛋白质PI>4)在Swiss蛋白数据库中检索(http://us.expasy.org/tools/tagident.htmL), 得到一些趋化因子和细胞因子, 在等点电和分子质量上与我们得到的蛋白差异峰非常接近. 结合结果分析, 我们发现在hCMV引起的婴儿肝炎综合征组与3个对照组之间存在4个蛋白差异峰, 则这4种蛋白是与hCMV感染并且导致婴肝的发病密切相关的. 在数据库中检索到分子质量为Mr 5 808.7和Mr 7 935.6的蛋白峰分别与b-防御素8和巨噬细胞源性趋化因子(MDC)[27,28]两种蛋白非常接近; 将hCMV感染的两个组与无hCMV感染的两个组血清蛋白表达谱比较, 发现有5个蛋白峰在hCMV感染的组是增高的, 提示这5个蛋白峰与hCMV感染相关. 其中Mr 7 771.4和Mr 15 835.6的蛋白峰分别与血小板因子4(CXCL4)和白细胞介-25(IL-25)非常接近; 将hCMV感染但未发生婴肝的婴儿与其他组婴儿血清蛋白质表达谱比较, 发现有2个蛋白峰表达明显上调, 则这2种分子质量的蛋白质的作用可能是保护感染后的机体, 使之有效对抗病毒对机体的侵害, 是一种对机体具有保护性的细胞因子. 其中Mr 5 704.3的蛋白峰能够在Swiss数据库中检索到与b-防御素31非常接近; 将肝功能异常的两个组与肝功能正常的组比较发现4个蛋白峰表达有明显差异, 则这4种蛋白是与肝脏损伤修复有关的蛋白质. 其中分子质量为Mr 7 567.0和Mr 15 100.7的两种蛋白峰在hCMV感染引起的婴肝组增高较非hCMV感染的婴肝组更高. 在数据库中检索到Mr 15 100.7的蛋白峰与人肝再生增强因子(hALR)[29,30]非常接近, 该细胞因子恰是与肝脏的损伤后再生密切相关的, 从而提示了hCMV感染对婴儿肝脏的损伤较其他损伤更为严重. 另外两种蛋白峰相对应的前白蛋白、结合珠蛋白等也是反映肝脏功能的蛋白, 其在肝脏损伤时的变化均与我们的实验结果一致.
综上所述, 我们在实验中发现的这些与hCMV感染及感染后婴儿肝炎综合征的发病与否相关的血清蛋白因子, 以及根据这些因子的分子质量对照已知的细胞因子数据库分析可能参与hCMV感染及感染致婴肝的相关细胞因子, 将有助于我们从血清蛋白质组水平上探讨hCMV引起的婴肝的发病机制, 如巨噬细胞源性趋化因子, 白细胞介素-25等可能是参与机体免疫反应的白细胞在机体对hCMV感染后的免疫应答过程中产生的. 本结果仍需要更进一步的分析及实验来验证, 为揭示巨细胞病毒导致婴肝的机制提供蛋白质组学的分子基础.
电编: 张敏 编辑: 潘伯荣 审读: 张海宁
| 2. | Peng J, Gygi SP. Proteomics: the move to mixtures. J Mass Spectrom. 2001;36:1083-1091. [PubMed] [DOI] |
| 3. | 丁 守怡, 钱 冬萌, 闫 志勇, 宋 旭霞, 牟 文凤, 王 斌. 蛋白质芯片飞行质谱技术检测体外培养的肝癌细胞株与转染HBV的肝癌细胞株蛋白质的差异表达. 世界华人消化杂志. 2005;13:1684-1687. [DOI] |
| 4. | Anderson NL, Anderson NG. Proteome and proteomics ,new technologies ,new concepts and new words. J Electrophoresis. 1998;19:1853-1861. [PubMed] [DOI] |
| 5. | Kavallaris M, Marshall GM. Proteomics and disease: opportunities and challenges. Med J Aust. 2005;182:575-579. [PubMed] |
| 6. | Seibert V, Ebert MP, Buschmann T. Advances in clinical cancer proteomics: SELDI-ToF-mass spectrometry and biomarker discovery. Brief Funct Genomic Proteomic. 2005;4:16-26. [PubMed] [DOI] |
| 7. | Persidsky Y, Gendelman HE. Mononuclear phagocyte immunity and the neuropathogenesis of HIV-1 infection. J Leukoc Biol. 2003;74:691-701. [PubMed] [DOI] |
| 8. | Seibert V, Wiesner A, Buschmann T, Meuer J. Surface-enhanced laser desorption ionization time-of-flight mass spectrometry (SELDI TOF-MS) and ProteinChip technology in proteomics research. Pathol Res Pract. 2004;200:83-94. [PubMed] [DOI] |
| 9. | Merchant M, Weinberger SR. Recent advancements in surface-enhanced laser desorption/ionization-time of flight-mass spectrometry. Electrophoresis. 2000;21:1164-1177. [PubMed] [DOI] |
| 10. | Bischoff R, Luider TM. Methodological advances in the discovery of protein and peptide disease markers. J Chromatogr B Analyt Technol Biomed Life Sci. 2004;803:27-40. [PubMed] [DOI] |
| 11. | Verma M,Wright GL Jr,Hanash SM,Gopal-Srivastava R,Srivastava S. Proteomic approaches within the NCI early detection research network for the discovery and identification of cancer biomarkers. Ann N Y Acad Sci. 2001;945:103-115. [PubMed] [DOI] |
| 12. | Ord JJ, Streeter E, Jones A, Le Monnier K, Cranston D, Crew J, Joel SP, Rogers MA, Banks RE, Roberts IS. Phase I trial of intravesical Sura min in recurrent superficial transitional cell bladder carcinoma. Br J Cancer. 2005;92:2140-2147. [PubMed] [DOI] |
| 13. | Fung ET, Yip TT, Lomas L, Wang Z, Yip C, Meng XY, Lin S, Zhang F, Zhang Z, Chan DW. Classification of cancer types by measuring variants of host response proteins using SELDI serum assays. Int J Cancer. 2005;115:783-789. [PubMed] [DOI] |
| 14. | Moshkovskii SA, Serebryakova MV, Kuteykin-Teplyakov KB, Tikhonova OV, Goufman EI, Zgoda VG, Taranets IN, Makarov OV, Archakov AI. Ovarian cancer marker of 11.7 kDa detected by proteomics is a serum amyloid A1. Proteomics. 2005;5:3790-3797. [PubMed] [DOI] |
| 15. | Srinivas PR, Srivastava S, Hanash S, Wright GL Jr. Proteomics in early detection of cancer. J Clinical Chemistry. 2001;47:10: 1901-1911. [PubMed] |
| 16. | Semmes OJ, Feng Z, Adam BL, Banez LL, Bigbee WL, Campos D, Cazares LH, Chan DW, Grizzle WE, Izbicka E. Evaluation of serum protein profiling by surface-enhanced laser desorption/ionization time-of-flight mass spectrometry for the detection of prostate cancer: I. Assessment of platform reproducibility. Clin Chem. 2005;51:102-112. [PubMed] [DOI] |
| 17. | Hu Y, Zhang S, Yu J, Liu J, Zheng S. SELDI-TOF-MS: the proteomics and bioinformatics approaches in the diagnosis of breast cancer. Breast. 2005;14:250-255. [PubMed] [DOI] |
| 18. | Pawlik TM, Fritsche H, Coombes KR, Xiao L, Krishnamurthy S, Hunt KK, Pusztai L, Chen JN, Clarke CH, Arun B. Significant differences in nipple aspirate fluid protein expression between healthy women and those with breast cancer demonstrated by time-of-flight mass spectrometry. Breast Cancer Res Treat. 2005;89:149-157. [PubMed] [DOI] |
| 19. | Zhang L, Yu W, He T, Yu J, Caffrey RE, Dalmasso EA, Fu S, Pham T, Mei J, Ho JJ. Contribution of Human Defensin 1,2,and 3 to the Anti-HIV-1 Activity of CD8 Antiviral Factor. SCIENCE. 2002;298:995-1000. [PubMed] [DOI] |
| 20. | Azam AZ, Vial Y, Fawer CL, Zufferey J, Hohlfeld P. Prenatal diagnosis of congenital cytomegalovirus infection. Obstet Gynecol. 2001;97:443-448. [PubMed] [DOI] |
| 21. | Revello MG, Gerna G. Diagnosis and management of human cytomegalovirus infection in the mother, fetus, and newborn infant. Clin Microbiol Rev. 2002;15:680-715. [PubMed] [DOI] |
| 22. | Gerna G, Percivalle E, Sarasini A, Revello MG. Human cytomegalovirus and human umbilical vein endothelial cells: restriction of primary isolation to blood samples and susceptibilities of clinical isolates from other sources to adaptation. J Clin Microbiol. 2002;40:233-238. [PubMed] [DOI] |
| 23. | Revello MG, Percivalle E, Arbustini E, Pardi R, Sozzani S, Gerna G. In vitro generation of human cytomegalovirus pp65 antigenemia, viremia, and leukoDNAemia. J Clin Invest. 1998;101:2686-2692. [PubMed] [DOI] |
| 24. | Revello MG, Zavattoni M, Sarasini A, Percivalle E, Simoncini L, Gerna G. Human cytomegalovirus in blood of immunocompetent persons during primary infection: prognostic implications for pregnancy. J Infect Dis. 1998;177:1170-1175. [PubMed] [DOI] |
| 25. | Hem mings DG, Kilani R, Nykiforuk C, Preiksaitis J, Guilbert LJ. Permissive cytomegalovirus infection of primary villous term and first trimester trophoblasts. J Virol. 1998;72:4970-4979. [PubMed] |
| 26. | Soderberg-Naucler C, Fish KN, Nelson JA. Reactivation of latent human cytomegalovirus by allogeneic stimulation of blood cells from healthy donors. Cell. 1997;91:119-126. [PubMed] [DOI] |
| 27. | Jahnz-Rozyk K, Targowski T, Paluchowska E, Owczarek W, Kucharczyk A. Serum thymus and activation-regulated chemokine, macrophage-derived chemokine and eotaxin as markers of severity of atopic dermatitis. Allergy. 2005;60:685-688. [PubMed] [DOI] |
| 28. | Shimauchi T, Imai S, Hino R, Tokura Y. Production of thymus and activation-regulated chemokine and macrophage-derived chemokine by CCR4+ adult T-cell leukemia cells. Clin Cancer Res. 2005;11:2427-2435. [PubMed] [DOI] |
| 29. | Liu Q, Wang Z, Luo Y. The cDNA clone and sequence analysis of the coding region of human augmenter of liver regeneration (hALR) gene. Zhonghua Gan Zang Bing Za Zhi. 1999;7:156-158. [PubMed] |
| 30. | Liu Q, Yu HF, Sun H, Ma HF. Expression of human augmenter of liver regeneration in pichia pastoris yeast and its bioactivity in vitro. World J Gastroenterol. 2004;Nov 1; 10:3188-3190. [PubMed] [DOI] |