修回日期: 2005-08-20
接受日期: 2005-08-26
在线出版日期: 2005-09-28
目的: 探讨肿瘤坏死因子-α(TNF-α)、细胞间黏附分子-1(ICAM-1)在扑热息痛肝损害中的作用.
方法: 应用扑热息痛(AAP)建立Sprague Dawley(SD)大鼠肝损害模型; 分别于给药后3、6、12、24 h处死大鼠, AAP组和对照组分别测定ALT水平, HE染色光镜下观察肝脏病理的改变, 放射免疫分析法测定血清TNF-α水平、RT-PCR方法检测肝组织ICAM-1 mRNA的表达.
结果: AAP组给药后24 h血清TNF-α(µg/L)水平显著高于对照组(5.69 ± 0.46 vs 2.64 ± 0.27, P<0.01),且与血清ALT水平呈显著的正相关(r = 0.773, P<0.01), 肝组织ICAM-1 mRNA表达在各时间点均显著高于对照组(3、6、12、24 h的值分别为: 1.58 ± 0.21 vs 0.62± 0.05, 1.24 ± 0.09 vs0.63 ± 0.04, 0.88 ± 0.08 vs 0.32± 0.06, 0.55 ± 0.14 vs 0.28 ± 0.03, P < 0.01), 于3 h达高峰, 24 h时仍高于正常水平, 同时血清ALT(nkat/L)进行性升高(3、6、12、24 h的值分别为: 1166.90±151.03 vs 586.78±89.35, 2153.84±254.55 vs 573.45±75.18, 4220.84±928.52 vs750.15±81.68,13202.64±1392.78 vs 780.16±161.37, P < 0.01)和肝脏病理损伤进行性加剧, 于24 h达高峰.
结论: TNF-α、ICAM-1在扑热息痛肝损害的发生、发展过程中发挥着关键作用.
引文著录: 田丰, 王颖, 吴作艳, 王学清, 李岩. 肿瘤坏死因子-a、细胞间黏附分子-1与扑热息痛肝损害. 世界华人消化杂志 2005; 13(18): 2222-2226
Revised: August 20, 2005
Accepted: August 26, 2005
Published online: September 28, 2005
AIM: To investigate the effect of tumor necrosis factor-α(TNF-α) and intercellular adhesion molecule-1 (ICAM-1)on the acetaminophen-induced liver damages.
METHODS: The Sprague Dawley(SD) rat model of acetaminophen-induced liver damages was established using acetaminophen(AAP). The rats were killed at 3, 6, 12, and 24 h after the administration, respectively. The activity of serum alanine aminotransferase(ALT) was detected in the rats, and the pathological changes of the liver were observed by hematoxylin and eosin(HE) staining under light microscope. The level of serum TNF-α was examined by radioimmunoassay, and the expression of ICAM-1 mRNA in the liver tissues was measured by reverse transcription polymerase chain reaction(RT-PCR).
RESULTS: Twenty four hours after AAP administration, the level of serum TNF-α in AAP group was significantly higher than that in the controls (5.69 ± 0.46 µg/Lvs 2.64 ± 0.27 µg/L, P < 0.01), and it was positively related to the level of serum ALT (r = 0.773, P < 0.01). The expression of ICAM-1 mRNA in the hepatic tissues in AAP group were significantly higher than those in the controls at 3, 6, 12, and 24 h (1.58 ± 0.21 vs 0.62 ± 0.05, 1.24 ± 0.09 vs 0.63 ± 0.04, 0.88 ± 0.08 vs 0.32 ± 0.06, 0.55 ± 0.14 vs 0.28 ± 0.03, all P < 0.01), and it reached the peak value at 3 h. Meanwhile, the activities of serum ALT (nkat/L) progressively increased as compared with those in the controls (1 166.90 ± 151.03 vs 586.78 ± 89.35, 2 153.84 ± 254.55 vs 573.45 ± 75.18, 4 220.84 ± 928.52 vs 750.15 ± 81.68, 13 202.64 ± 1 392.78 vs 780.16 ± 161.37, P < 0.01, for 3, 6, 12, 24 h, respectively), and the hepatic pathological injury aggravated progressively, which reached the peak at 24 h.
CONCLUSION: TNF-α and ICAM-1 play key roles in the occurrence and development of acetaminophen-induced liver damages.
- Citation: Tian F, Wang Y, Wu ZY, Wang XQ, Li Y. Association of tumor necrosis factor-a and intercellular adhesion molecule-1 with acetaminophen-induced liver damages. Shijie Huaren Xiaohua Zazhi 2005; 13(18): 2222-2226
- URL: https://www.wjgnet.com/1009-3079/full/v13/i18/2222.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i18.2222
肝脏是药物代谢的主要器官. 近年来随着新药的不断面世, 药物性肝损害的发生率也日益增高. 在所有药物不良反应中, 肝损害的发生率仅次于皮肤损害和药物热, 居第三位, 约占10-15%[1]. 因此, 对于药物性肝损害发病机制研究有着非常重要的意义. 近来, 炎症反应在药物性肝损害中的作用引起人们的重视. 中性粒细胞(polymorphonuclear leukocyte, PMN)的聚集、浸润是炎症反应发生的关键步骤[2]. 各种药物可以通过不同途径激活肝枯否氏细胞和内皮细胞, 产生肿瘤坏死因子-α(TNF-α)等促炎因子, TNF-α对PMN无直接趋化作用, 但可以上调黏附分子和趋化因子的表达[3]. 趋化因子和黏附分子协同作用导致PMN黏附、集聚并过度活化, 释放氧自由基和蛋白酶, 对组织细胞造成损害. 细胞间黏附分子-1(intercellular adhesion molecule-1 ICAM-1)是重要的黏附因子. 我们应用扑热息痛(Acetaminophen AAP)建立Sprague Dawley(SD)大鼠药物性肝损害模型, 放免法检测血清中TNF-α的含量, RT-PCR方法检测肝组织中ICAM-1mRNA的表达, 以探讨两者在扑热息痛肝损害中的作用.
实验动物5-6周龄的雌性Sprague Dawley (SD)大鼠, 体质量180-240 g, 购自中国医科大学动物实验中心. 大鼠实验前于本院动物实验中心饲养1 wk, 昼夜交替12 h, 在室温及稳定湿度条件下, 用平衡饲料喂养. AAP购自Sigma公司, TNF-α放射免疫分析试剂盒购自北京福瑞生物工程公司, Trizol变性液购自晶美生物工程有限公司, RT-PCR试剂盒和逆转录酶购自TaKaRa Taq大连宝生物工程有限公司, PCR引物由上海博亚生物技术有限公司合成, DNA Marker DL2000购自大连博瑞得生物技术有限责任公司, 自动生物化学分析仪(日本岛津公司), 普通光学显微镜(日本Olympus公司), FT-613自动放免测量仪(北京核仪器厂), 低温高速离心机(HERMLE Z-383K, 德国), 电泳仪(Bio-RAD, 美国), 紫外分光光度计(Shimadzu UV-1201, 日本), 凝胶成像分析系统(Kodak 1D, 美国).
1.2.1 实验分组和处理: 40只♀SD大鼠随机分为正常对照组和AAP组, 每组20只. 试验前1夜禁食水, 2 d上午给药. AAP溶于37 ℃ PBS液(pH7.4)中(100 g/L), AAP组给予AAP(1 g/kg)腹腔注射[4], 正常对照组给予等量PBS液腹腔注射, 给药后自由进食水. 于给药后3、6、12、24 h(每时点各组分别有5只大鼠)用10%水合氯醛(5 mL/kg)腹腔注射麻醉, 心脏穿刺取血, 分离血清, -20 ℃保存; 后用锋利的手术刀于肝脏中叶取1块肝组织, 置于40 g/L甲醛中固定, 后立即取下余下肝组织, 置于液氮中, -80 ℃保存.
1.2.2 ALT测定: 用自动生物化学分析仪进行.
1.2.3 病理检测: 取肝中叶组织一块, 用40 g/L甲醛溶液固定, 石蜡包埋, 5 μm厚切片, 常规HE染色, 光镜下观察其病理改变.
1.2.4 血清TNF-α水平测定: 采用放射免疫分析法进行.
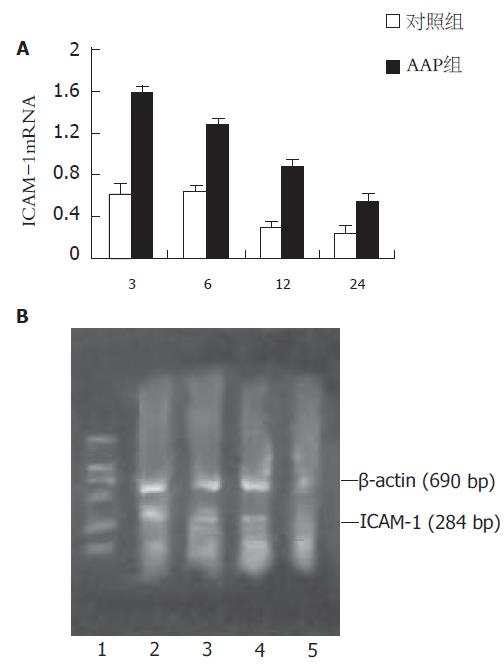
1.2.5 RT-PCR检测: 按产品说明书应用Trizol试剂提取肝脏组织总RNA. 每份组织取2 μL总RNA按产品说明书进行逆转录合成cDNA链. PCR扩增(1)ICAM-1的扩增: 取3 μL cDNA作为模板, 反应体系25 μL. 含cDNA 3 μL、ddH2O 17.1 μL、10×反应缓冲液2.5 μL、2.5 mmol/L dNTPs 2 μL、5×106 U/L Taq酶0.2 μL、ICAM-1的上、下游引物各0.1 μL. 经94 ℃变性3 min后进入循环; 包括94 ℃变性45 s,52 ℃退火1 min,72 ℃延伸1 min, 35个循环; 72 ℃最后延伸7 min. ICAM-1引物序列为: 上游5'TACTGAAACTTGCTGCCTATT3'; 下游: 5'ACTGTACCTGGTGACCTTGA3'; 产物长度为284 bp. (2)内参照物β-actin的扩增: 取3 μL cDNA作为模板, 反应体系25 μL. 含cDNA 3 μL、ddH2O 17.1 μL、10×反应缓冲液2.5 μL、2.5 mmol/L dNTPs 2 μL、5×106 U/L Taq酶 0.2 μL、β-actin的上、下游引物各0.1 μL. 经94 ℃变性3 min后进入循环; 包括94 ℃变性30 s, 55 ℃退火1 min, 72 ℃延伸2 min, 35个循环; 72 ℃最后延伸7 min. β-actin引物序列为: 上游5'CACCCTGTGCTGCTCACCGAAGCC3'; 下游5'CCACACAGATGACTTGCCCTCAGG3'; 产物长度为690 bp. 取10 μl PCR扩增产物与内参照物β-actin及DNA Marker DL2000在20 g/L的琼脂糖凝胶电泳, 溴化乙锭(EB)染色, 经凝胶成像分析系统摄影, 扫描PCR产物强度, 以PCR产物密度/β-actin密度来表示检测指标mRNA的相对含量, 进行半定量分析.
统计学处理 数据用均数±标准差(mean±SD)表示, 各组间均数比较用t检验, 用SPSS11.0统计软件进行分析.
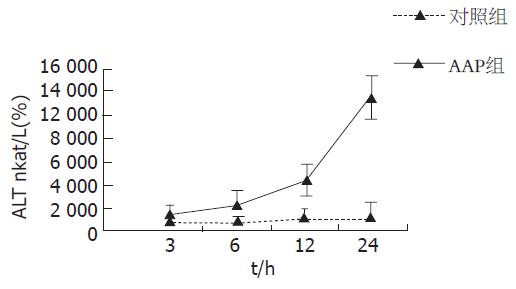
各时间点AAP组血清ALT(nkat/L)水平较对照组均显著升高(给药后3、6、12、24 h分别为: 1 166.90±151.03 vs 586.78±89.35, 2 153.84±254.55 vs 573.45±75.18, 4 220.84±928.52 vs 750.15±81.68, 13 202.64±1 392.78 vs 780.16±161.37, (P<0.01), 且随时间进行性升高, 24 h达高峰(图1).
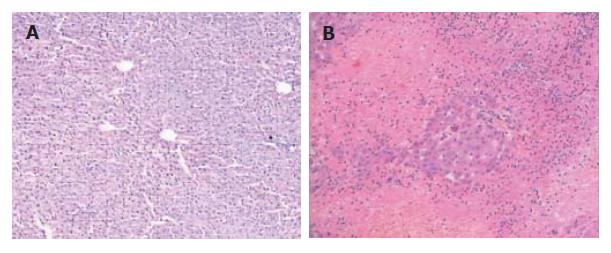
AAP组肝脏明显肿大、充血, 镜下: 轻者表现为肝细胞点状坏死、重者表现为小叶中心肝细胞广泛的炎性细胞侵润、出血、带状坏死, 且随时间进行性加重, 24 h达高峰. 对照组未见异常(图2).
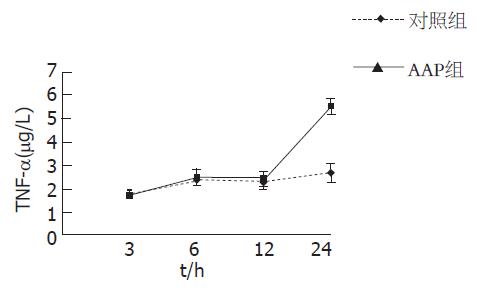
给药后24 h, AAP组血清TNF-α(µg/L)水平显著高于对照组(5.69±0.46 vs 2.64±0.27, P<0.01)且与血清ALT水平呈显著的正相关(r = 0.773, P<0.01)余时间点两组间无显著性差异(图3).
肝组织ICAM-1 mRNA的表达 AAP组各时间点肝组织ICAM-1 mRNA表达均显著高于对照组(P<0.01), 于给药后3 h达高峰, 24 h时仍高于正常水平(图4).
AAP是目前世界上广泛使用的解热镇痛药, 在治疗剂量下使用是比较安全的, 而过量使用将导致严重的肝损害. 在正常情况下, 健康成人口服治疗剂量AAP, 90%以上通过与葡萄糖醛酸和硫酸结合由尿排泄, 仅有不到5%由细胞色素P-450系统代谢成亲电子的毒性中间代谢产物乙酰苯醌亚胺(N-acetyl-P-benzoquinone imine, NAPQI), NAPQI通过与谷胱甘肽结合迅速被清除[5]. 但在AAP过量的情况下, 可导致葡萄糖醛酸化和硫酸化道路饱和, 大量的AAP转由细胞色素P-450系统氧化, 结果导致谷胱甘肽储备的耗竭, 并剩下多余的不能与谷胱甘肽结合的NAPQI. NAPQI与肝细胞的蛋白共价结合, 产生肝毒性[6-8]. 这是目前普遍接受的AAP引起肝损害的机制. 近来, 炎症反应在AAP肝损害中的作用引起人们的重视.
TNF-α主要是由激活的肝脏枯否氏细胞释放的重要的促炎因子[9]. 它的产生被认为是肝脏炎症反应中最早出现的表现之一. TNF-α导致其它促炎因子级联样的释放, 引起各种炎症细胞的侵润和激活[10-11]. TNF-α还可以直接引起细胞毒性, 而导致细胞的坏死和调亡[12-13]. TNF-α的生物活性是由两个结构相关, 但功能不同的TNF-α受体所调节, 即: TNFR1(p55)和TNFR2(p75)[10]. TNF-α主要通过TNFR1的途径引起炎反应[14], TNFR1的表达在枯否氏细胞和肝细胞上相对较高, 而且这种受体的表达在各种肝脏炎症损伤模型中明显上调, 说明TNF-α是导致肝毒性的一个主要促炎因子[15]. 本实验结果表明AAP引起肝损害时, 血清TNF-α水平显著升高, 且与血清ALT水平呈显著的正相关, 说明TNF-α在AAP引起肝损害中发挥着关键作用, 与国内外报道相似.
AAP引起的损伤可以激活肝枯否氏细胞和内皮细胞[16], 产生促炎因子, 如IL-1、IL-6、TNF-α等, 但它们对PMN无直接趋化作用, 而是通过上调黏附分子和趋化因子的表达, 引起PMN、巨噬细胞和单核细胞在肝脏的侵润和激活, 最终导致氧化应激和过氧化亚硝酸盐形成, 造成肝损害. ICAM-1是目前研究较为深入和广泛的一种细胞黏附分子, 其配体是淋巴细胞相关抗原-1(LFA-1)和巨噬细胞抗原复合体-1(MAC-1). 在炎症状态下, ICAM-1参与白细胞与肝窦周内皮细胞的黏附, 完成其跨膜迁移, 黏附并损伤肝细胞等病理过程. 在正常肝组织内, 窦周肝细胞有不同程度的ICAM-1表达, 而肝细胞无表达, TNF-α、TNF-β、IL-1等细胞因子均能增加肝组织内ICAM-1的表达[17-20]. 陆伦根 et al[21]证实不同的肝损害因素均可通过TNF-α、TNF-β、IL-1等细胞因子引起ICAM-1在肝细胞及窦周肝细胞表达增强, 表明尽管引起肝脏损伤的病因不同, 但造成肝组织损伤可能都是通过ICAM-1在肝细胞的表达而实现的. 当肝细胞表达ICAM-1时, 炎症细胞通过ICAM-1/LFA-1或ICAM-1/MAC-1结合而介导肝细胞和窦周细胞损伤, 缺乏ICAM-1表达时, 肝损伤不会发生. 有文章报道, 在肝脏缺血再灌注损伤时, 由于TNF-α, IL-1等作用, ICAM-1表达上调, 增加了PMN与内皮细胞的黏附[22]. ICAM-1的单克隆抗体则可明显减少PMN的浸润, 有效减轻肝功能损害, 并促进ATP水平的迅速恢复[23]. 本组实验证实SD大鼠腹腔注射AAP后, 肝组织ICAM-1 mRNA表达显著高于对照组, 于3 h达高峰, 24 h时仍高于正常水平, 同时伴随着血清ALT进行性升高和病理损伤进行性加剧, 于24 h达到高峰, 与Bauer I et al[4]报道相似. 说明ICAM-1 mRNA表达在AAP肝损害的发生、发展过程发挥着关键的作用. 此外, 本组实验结果显示: 肝组织ICAM-1 mRNA表达高峰明显提前于血清TNF-α水平的显著升高, 由此可见TNF-α可能是通过自分泌或旁分泌作用, 而非内分泌作用引起ICAM-1 mRNA表达的增加. 总之, AAP可以通过激活肝枯否氏细胞和内皮细胞, 产生TNF-α等促炎因子, 使肝组织ICAM-1 mRNA表达增加, 而引起肝损害, 提示我们有可能通过在转录水平抑制ICAM-1 mRNA表达或使用相应的拮抗剂来预防和治疗AAP肝损害, 相关研究有待进一步进行.
电编: 李琪 编辑:潘伯荣 审读:张海宁
| 1. | Davids M. Hepatic disorders. Oxford: Oxford University Press 1977; 146-172. |
| 2. | DeGraba TJ. The role of inflammation after acute stroke: utility of pursuing anti-adhesion molecule therapy. Neurology. 1998;51:S62-S68. [PubMed] [DOI] |
| 4. | Bauer I, Vollmar B, Jaeschke H, Rensing H, Kraemer T, Larsen R, Bauer M. Transcriptional activation of heme oxygenase-1 and its functional significance in acetaminophen-induced hepatitis and hepatocellular injury in the rat. J Hepatol. 2000;33:395-406. [PubMed] [DOI] |
| 5. | Dahlin DC, Miwa GT, Lu AY, Nelson SD. N-acetyl-p-benzoquinone imine: a cytochrome P-450-mediated oxidation product of acetaminophen. Proc Natl Acad Sci USA. 1984;81:1327-1331. [PubMed] [DOI] |
| 6. | Cohen SD, Hoivik DJ, Khairallah EA. Acetaminophen-induced hepatotoxicity. Toxicology of the Liver.2nded. Washington: Taylor & Francis 1998; 159-186. |
| 7. | Jollow DJ, Mitchell JR, Potter WZ, Davis DC, Gillette JR, Brodie BB. Acetaminophen-induced hepatic necrosis. II. Role of covalent binding in vivo. J Pharmacol Exp Ther. 1973;187:195-202. [PubMed] |
| 8. | Hinson JA, Pumford NR, Roberts DW. Mechanisms of acetaminophen toxicity: immunochemical detection of drug-protein adducts. Drug Metab Rev. 1995;27:73-92. [PubMed] [DOI] |
| 9. | Decker K. Biologically active products of stimulated liver macrophages (Kupffer cells). Eur J Biochem. 1990;192:245-261. [PubMed] [DOI] |
| 10. | Bradham CA, Plümpe J, Manns MP, Brenner DA, Trautwein C. Mechanisms of hepatic toxicity. I. TNF-induced liver injury. Am J Physiol. 1998;275:G387-G392. [PubMed] |
| 11. | Luster MI, Simeonova PP, Gallucci RM, Bruccoleri A, Blazka ME, Yucesoy B. Role of inflammation in chemical-induced hepatotoxicity. Toxicol Lett. 2001;120:317-321. [PubMed] [DOI] |
| 12. | Bohlinger I, Leist M, Gantner F, Angermüller S, Tiegs G, Wendel A. DNA fragmentation in mouse organs during endotoxic shock. Am J Pathol. 1996;149:1381-1393. [PubMed] |
| 13. | Wang GH, Redmond HP, Watson RWG. Role of lipopolysaccharide and tumor necrosis factor-a in induction of hepatocyte necrosis. Am J Physiol. 1995;269:297-304. |
| 14. | Douni E, Akassoglou K, Alexopoulou L, Georgopoulos S, Haralambous S, Hill S, Kassiotis G, Kontoyiannis D, Pasparakis M, Plows D. Transgenic and knockout analyses of the role of TNF in immune regulation and disease pathogenesis. J Inflamm. 1995;47:27-38. [PubMed] |
| 15. | Faubion WA, Gores GJ. Death receptors in liver biology and pathobiology. Hepatology. 1999;29:1-4. [PubMed] [DOI] |
| 16. | Laskin DL, Pilaro AM. Potential role of activated macrophages in acetaminophen hepatotoxicity. I. Isolation and characterization of activated macrophages from rat liver. Toxicol Appl Pharmacol. 1986;86:204-215. [PubMed] |
| 17. | Albelda SM, Smith CW, Ward PA. Adhesion molecules and inflammatory injury. FASEB J. 1994;8:504-512. [PubMed] |
| 18. | Hellerbrand , Wang SC, Tsukamoto H, Brenner DA, Rippe RA. Expression of intracellular adhesion molecule 1 by activated hepatic stellate cells. Hepatology. 1996;24:670-676. [PubMed] [DOI] |
| 19. | Bautista AP. Chronic alcohol intoxication induces hepatic injury through enhanced macrophage inflammatory protein-2 production and intercellular adhesion molecule-1 expression in the liver. Hepatology. 1997;25:335-342. [PubMed] [DOI] |
| 20. | Kvale D, Brandtzaeg P. Immune modulation of adhesion molecules ICAM-1 (CD54) and LFA-3 (CD58) in human hepatocytic cell lines. J Hepatol. 1993;17:347-352. [PubMed] [DOI] |
| 22. | Ohira H, Ueno T, Shakado S, Sakamoto M, Torimura T, Inuzuka S, Sata M, Tanikawa K. Cultured rat hepatic sinusoidal endothelial cells express intercellular adhesion molecule-1 (ICAM-1) by tumor necrosis factor-alpha or interleukin-1 alpha stimulation. J Hepatol. 1994;20:729-734. [PubMed] [DOI] |
| 23. | Nishimura Y, Takei Y, Kawano S, Goto M, Nagano K, Tsuji S, Nagai H, Ohmae A, Fusamoto H, Kamada T. The F(ab')2 fragment of an anti-ICAM-1 monoclonal antibody attenuates liver injury after orthotopic liver transplantation. Transplantation. 1996;61:99-104. [PubMed] [DOI] |