修回日期: 2004-07-09
接受日期: 2004-07-15
在线出版日期: 2004-09-15
目的: 探讨Pax3(pairedbox3)和Cx43(connexin43)基因在先天性巨结肠(Hirschsprungs disease, HD)中突变及表达的意义, 分析HD与Pax3和Cx43基因异常的关系.
方法: 应用半定量逆转录聚合酶链反应(RT-PCR)和银染单链构像多态性(SSCP)方法检测Pax3和Cx43基因突变和mRNA表达情况.
结果: 正常人38例肠段对照组织中DNA未发现Cx43 SSCP异常泳动带, 而仅有3例(7.9%)出现Pax3 PCR产物单链异常泳动带; HD38例肠管组织中17例(44.7%)出现Pax3 PCR产物单链异常泳动带, 11例(28.9%)出现Cx43 PCR产物单链异常泳动带. HD各段肠管组织中均有Pax3基因mRNA的表达, 痉挛段、移行段和扩张段肠管组织中Pax3 mRNA高表达, 表达率分别为92.1%, 86.8%和76.3%(mean±SD=1.63±0.37; 1.42±0.41和1.25±0.17); 而正常肠段组织中Pax3 mRNA无表达, 有显著性差异(aP<0.05). Cx43基因mRNA在痉挛段、移行段肠管组织中低表达, 表达率为23.7%和18.4%(mean±SD=0.62±0.11和0.51±0.07); 而扩张段肠管组织中Cx43有较高表达, 表达率为55.3%(mean±SD=1.37±0.19). 38名正常人肠段对照组织中无1例Cx43 mRNA阳性表达.
结论: HD组织中Pax3和Cx43基因突变及表达异常可能与HD的发生相关密切, Pax3和Cx43突变可能造成信息传递缺陷, 扰乱了神经嵴细胞的迁移, 从而导致HD的发生.
引文著录: 高红, 张志波, 王维林, 黄英. 先天性巨结肠Pax3和Cx43基因突变及表达. 世界华人消化杂志 2004; 12(9): 2254-2256
Revised: July 9, 2004
Accepted: July 15, 2004
Published online: September 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2254-2256
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2254.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2254
先天性巨结肠(Hirschsprungs disease, HD)是家族性遗传病, 是新生儿期低位肠梗阻最常见的原因之一, 发病率约1/5 000. 在胚胎发育过程中, 由原始干细胞分化、增生形成各种特定组织细胞过程是各种细胞因子共同作用、精确调控的结果. Pax3 (pairedbox3)是胚胎发育中生肌前体细胞移行、增生、分化及神经胚层发育的重要调控因子, 是转录因子基因家族的成员之一, 具有高度的结构[1]. 间接连接蛋白Cx43(connexin43)是一种主要的细胞间隙连接蛋白, 是一抑癌基因[2], Cx基因的表达状态与胚胎发育、细胞诱导、分化、生长控制、细胞程序性死亡及衰老死亡等生物过程有着十分密切的关系. 我们从基因突变和mRNA表达2个层次对HD Pax3和Cx43基因异常进行研究如下.
HD38例组织取自1999-2003年手术切除离体后30 min内获得标本. 男27例, 女11例. 按照病理形态学改变留取痉挛段、移行段和扩张段标本; 38名正常对照取自正常人肠段组织, 迅速保存于-76 ℃冰箱中. 用Trizol Total RNA(美国GIBCO)提取标本总RNA, 经20 g/L琼脂糖凝胶电泳及紫外分光光度计, 测定A260/A280, 确定RNA浓度和纯度, 纯度在1.75-2.0.
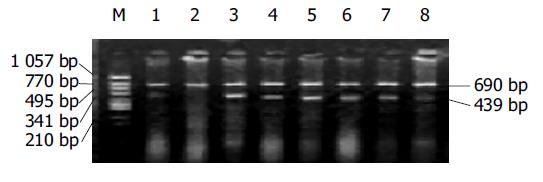
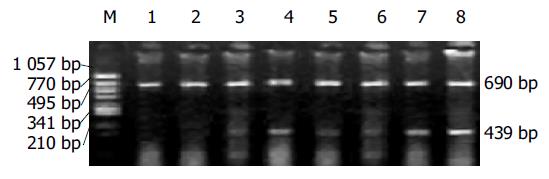
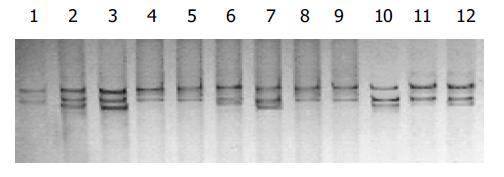
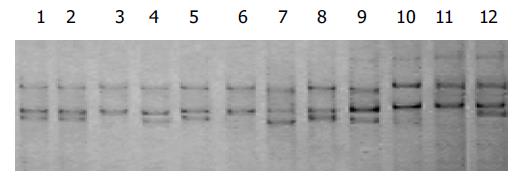
在20 mL逆转录体系中, 含有总RNA1 mg, 0.5 mmol/L dNTPs, 2.2 mmol/L oligo(dT)15, 3 mmol/L MgCl2, 1.5 MU/L RNasin, 15 MU/L M-MLVRT的溶液, 补充DD H2O至总体积20 mL, 经65 ℃1 min, 30-65 ℃ 30 min, 60 ℃30 min, 98 ℃5 min, 5℃5 min合成cDNA. 引物设计应用电脑软件Primer 5.0版, Pax3-F 5'-CAA CCA CAT CCG CCA CAA-3', Pax3-R 5'-GCT TAC CTC GCT CGC TCA-3', 片段长度437 bp; Cx43-F 5'-TTC AAG GGC GTT AAG GAT-3', Cx43-R 5'-CCA GGA GGA GAC ATA GGC-3', 片段长度158 bp; β-actin-F 5'-GAT TGC CTC AGG ACA TTT CTG-3', β-actin-R 5'-GAT TGC TCA GGA CAT TTC TG-3', 片段长度690 bp. 以各标本样品为cDNA模板, β-actin基因为内参照, 对Pax3和Cx43基因mRNA进行定量分析: 25 mL反应体系中, 加入cDNA产物3 mL, 10×PCR缓冲液2.5 mL, 8 mmol/L dNTPs, 15 mmol/L的Pax3和Cx43和β-actin引物, Taq DNA聚合酶3 U, Pax3, Cx43, β-actin PCR条件: 94 ℃3 min (94 ℃ 40 s, 56 ℃ 1 min, 72 ℃ 1 min)35循环, 72 ℃ 7 min. 所得产物10 mL经20 g/L琼脂糖凝胶电泳, 5 g/L溴乙锭荧光染色10 min后, 凝胶成像扫描系统扫描拍照. 经1D KODAK图像分析仪扫描出底片中Pax3, Cx43和β-actin基因RT-PCR扩增带的信号强度(图1, 2), 样品的Pax3 mRNA相对表达强度: Pax3/β-actin强度之比; 样品的Cx43 mRNA相对表达强度: Cx43/β-actin强度之比. 在25 mL反应体系中, 加入cDNA产物3 mL, 10×PCR缓冲液2.5 mL, 8 mmol/L dNTPs, Taq DNA聚合酶2 U, 15 mmol/L的Pax3和Cx43, PCR条件与上述RT-PCR扩增一致. PCR产物进行SSCP银染分析: 取PCR产物10 mL, 加入甲酰胺变性液10 mL, 96℃变性10 min, 冰中冷却立即上样, 80 g/L PAG, 300V电泳4 h, 凝胶经银染后拍照(图3, 4).
统计学处理 数据以均数±标准差(mean±SD)表示, 组间差异比较采用统计分析软件Excel进行配对t检验, aP<0.05为差异有统计学意义.
以β-actin作内参照, 发现痉挛段、移行段和扩张段肠管组织中Pax3 mRNA高表达(图1, 表1); 以β-actin作内参照, 发现Cx43在痉挛段、移行段肠管组织中低表达; 而在扩张段肠管组织中Cx43较高表达(图2, 表1). 38例正常对照肠段组织中无1例Pax3和Cx43mRNA阳性表达, 具有显著性差异(aP <0.05).
| 肠管段 | 阳性例数 | 吸光度A值 | 阳性率(%) | |||
| Pax3 | Cx43 | Pax3 | Cx43 | Pax3 | Cx43 | |
| 正常人肠管段 | 0 | 0 | 0.23±0.09 | 0.30±0.17 | 0 | 0 |
| 痉挛段 | 35 | 9 | 1.63±0.37 | 0.62±0.11 | 92.1 | 23.7 |
| 移行段 | 33 | 7 | 1.42±0.41 | 0.51±0.07 | 86.8 | 18.4 |
| 扩张段 | 29 | 21 | 1.25±0.17 | 1.37±0.19 | 76.3 | 55.3 |
Pax3是一类重要的转录调控因子, 在胚胎发育过程中对组织和器官的特异化起着重要的调控作用. Pax3突变, 可直接影响中枢神经系统及神经嵴细胞衍生组织的发育[3], 造成胚胎发育异常[4]. Cx43是与神经管的发育形成密切相关的结构基因[5], 在7.5 d的小鼠胚胎中即开始表达, Cx43基因过表达或Cx43基因敲除鼠子代胚胎神经管缺陷畸形发生率明显升高[6-7]. Pax3等基因的表达具有时间上的二相性, 即在未分化的细胞中高表达, 在细胞分化过程中表达下降, 而在终端分化的细胞中表达上调[8].
HD是一种最常见的先天畸形, 是遗传因素和环境因素综合作用的结果. 目前主要认为是神经嵴细胞源性疾病和多基因遗传病.本研究发现Pax3与HD的发生有着密切的关系, 本研究显示Pax3基因mRNA在痉挛段、移行段和扩张段阳性检出率分别为92.1%、86.8%和76.3%; 明显高于正常段肠管组织(aP<0.05). 这种表达的差异在来自同一患者的肠管组织标本及正常肠管对照组织的配对资料中更为显著. 这提示, Pax3基因可能影响其胚胎发育, 神经节细胞发育不全, 而导致HD的原因之一. 本结果还证实, 在HD肠管组织中存在比较高的Pax3基因突变, 突变型标本中的SSCP条带除异常泳动带外, 具有与同一对照标本相同的泳动带, 提示在HD中Pax3基因的突变是杂合性的. 而正常对照出现的极少Pax3 SSCP异常泳动带可能是由于其他原因引起, 需进一步测序证实.
目前认为, 连接蛋白(Connexin, Cx)基因家族是一抑癌基因家族. Cx43是一种主要的细胞间隙连接蛋白, 其表达异常与多种疾病的发生有关. 近来研究表明, 多种癌细胞中都有Cx43 表达下降, Cx43基因表现出肿瘤抑制基因的特点[2]. 在神经系统和循环系统尚未建立或未发育完善的早期胚胎, 长距离信息传递难以进行, 胚胎各部分细胞的增生, 分化与生长发育离不开细胞间化学信息的交换.Maass et al[9]发现Cx43无义突变可造成信息传递缺陷, 影响神经细胞的迁移、增生及细胞凋亡过程. Bronner-Fraser et al观察了神经嵴细胞迁移过程中的细胞直接接触, 发现细胞间黏附改变扰乱了神经嵴细胞的迁移, 从而导致神经管缺陷(neural tube defects, NTDs)[8]的发生. Huang et al[10]报道, 转染的Cx43cDNA的人胶质瘤细胞Cx43mRNA表达水平升高, 生长速度减慢, 转染Cx43基因的细胞增生活性明显下降, 凋亡现象并未增加, 提示Cx43基因主要通过抑制细胞增生, 而不是通过诱导凋亡调控细胞生长. 本结果与之相似, Cx43在扩张段肠管中高表达(55.3%), 而在痉挛段和移行段肠管中低表达(23.7%, 18.4%). 由于Pax3是调控基因, Cx43是结构基因, 我们认为Cx43可能是Pax3的负表达调控基因, HD可抑制Cx43的表达, 使其对Cx43基因的转录抑制增高, 使Cx43低表达, 造成缝隙连接紊乱, 进而发生HD. Cx43在HD肠管组织中出现SSCP异常泳动带, 同时也提示Cx43基因的突变是杂合性的. 关于HD的发生机制及预防措施是目前研究的热点, Pax3和Cx43在消化道神经丛内的发育过程中十分重要, Pax3和Cx43表达水平的改变则可引起HD, 其机制可能有: 细胞凋亡、氧自由基的参与及引起调控基因表达的改变. Pax3和Cx43基因突变与HD的分子生物学基础研究还需扩大样本数量以及完善随访资料有待深入研究.
| 1. | Chi N, Epstein JA. Getting your Pax straight: Pax proteins in development and disease. Trends Genet. 2002;18:41-47. [PubMed] |
| 2. | Krysko DV, Mussche S, Leybaert L, D'Herde K. Gap junctional communication and connexin43 expression in relation to apoptotic cell death and survival of granulosa cells. J Histochem Cytochem. 2004;52:1199-1207. [PubMed] |
| 3. | Milewski RC, Chi NC, Li J, Brown C, Lu MM, Epstein JA. Identification of minimal enhancer elements sufficient for Pax3 expression in neural crest and implication of Tead2 as a regulator of Pax3. Development. 2004;131:829-837. [PubMed] [DOI] |
| 4. | Roberts C, Sutherland HF, Farmer H, Kimber W, Halford S, Carey A, Brickman JM, Wynshaw-Boris A, Scambler PJ. Targeted mutagenesis of the Hira gene results in gastrulation defects and patterning abnormalities of mesoendodermal derivatives prior to early embryonic lethality. Mol Cell Biol. 2002;22:2318-2328. [PubMed] |
| 5. | Bukauskas FF, Jordan K, Bukauskiene A, Bennett MV, Lampe PD, Laird DW, Verselis VK. Clustering of connexin 43-enhanced green fluorescent protein gap junction channels and functional coupling in living cells. Proc Natl Acad Sci USA. 2000;97:2556-2561. [PubMed] |
| 6. | Teunissen BE, Jansen AT, van Amersfoorth SC, O'Brien TX, Jongsma HJ, Bierhuizen MF. Analysis of the rat connexin 43 proximal promoter in neonatal cardiomyocytes. Gene. 2003;322:123-136. [PubMed] |
| 7. | Montecino-Rodriguez E, Dorshkind K. Regulation of hematopoiesis by gap junction-mediated intercellular communication. J Leukoc Biol. 2001;70:341-347. [PubMed] |
| 8. | Wiggan O, Fadel MP, Hamel PA. Pax3 induces cell aggregation and regulates phenotypic mesenchymal-epithelial interconversion. J Cell Sci. 2002;115:517-529. [PubMed] |
| 9. | Maass K, Ghanem A, Kim JS, Saathoff M, Urschel S, Kirfel G, Grümmer R, Kretz M, Lewalter T, Tiemann K. Defective epidermal barrier in neonatal mice lacking the C-terminal region of connexin43. Mol Biol Cell. 2004;15:4597-4608. [PubMed] |
| 10. | Huang RP, Fan Y, Hossain MZ, Peng A, Zeng ZL, Boynton AL. Reversion of the neoplastic phenotype of human glioblastoma cells by connexin 43 (cx43). Cancer Res. 1998;58:5089-5096. [PubMed] |