修回日期: 2004-06-29
接受日期: 2004-07-15
在线出版日期: 2004-09-15
目的: 分别构建巨细胞病毒(cytomegalovirus, CMV)通用启动子和甲胎蛋白(a-fetoprotein, AFP)杂合启动子[HRE]AF调控的PNP基因表达载体并检测、分析二者的差异表达.
方法: 将[HRE]AF启动子插入载体pcDNA3.0, 构建肝癌细胞特异表达载体p[HRE]AF; 将PNP基因分别插入pcDNA3.0和p[HRE]AF, 构建两种启动子调控的PNP基因表达载体pcDNA3.0/PNP和p[HRE]AF/PNP; 经酶切、PCR及测序鉴定各重组体. 用脂质体介导法将两PNP基因载体转染不同细胞株, RT-PCR检测PNP基因在各细胞株中表达, 分析二者表达的特点.
结果: 各目的片段均成功插入相应载体中, CMV启动子调控的PNP基因在各株细胞中均实现了表达, 而[HRE]AF启动子调控的PNP基因则在AFP阳性和阴性肝癌细胞中实现了组织特异性表达.
结论: 两PNP基因表达载体是肝癌基因治疗中新型、高效的治疗载体, p[HRE]AF/PNP还实现了在AFP阳性, 尤其是AFP阴性肝癌细胞中的靶向性表达.
引文著录: 蔡晓坤, 林菊生, 刘址忠, 周鹤俊, 梁扩寰. 两种启动子调控下PNP基因载体的构建和差异性表达. 世界华人消化杂志 2004; 12(9): 2036-2040
Revised: June 29, 2004
Accepted: July 15, 2004
Published online: September 15, 2004
AIM: To construct two expression vectors carrying PNP gene under a cytomegalovirus (CMV) promoter and a hybrid a-fetoprotein (AFP) tissue-specific promoter, and to detect and analyze their expression in different cell lines.
METHODS: [HRE]AF promoter was inserted into pcDNA3.0 vector, and a recombinant vector controlled by the hybrid AFP promoter, p[HRE]AF, was constructed. Inserting PNP gene into pcDNA3.0 and p[HRE]AF vectors separately, two PNP gene expression vectors driven by two different promoters, pcDNA3.0/PNP and p[HRE]AF /PNP, were constructed by using recombinant DNA techniques. The recombinants were analyzed and identified by restriction enzymes, PCR and sequencing. pcDNA3.0/PNP and p[HRE]AF/PNP were transfected into human hepatocellular carcinoma cell lines by liposome-mediated method. The expression of PNP gene in four different cell lines was detected by RT-PCR method.
RESULTS: All target fragments were separately cloned into corresponding vectors. We detected the expression of PNP gene under the control of CMV promoter in all cell lines, and the tissue-specific expression of PNP gene under the control of [HRE]AF promoter in AFP positive and negative hepatocellular carcinoma cell line was positive.
CONCLUSION: Two expression vectors harboring PNP gene are novel effective vectors for human hepatocellular carcinoma gene therapy, and p[HRE]AF/PNP is a target-expressing vector in AFP positive, especially in AFP negative hepatocellular carcinoma cells.
- Citation: Cai XK, Lin JS, Liu ZZ, Zhou HJ, Liang KH. Construction of two vectors harboring PNP gene under control of two different promoters and their expression. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2036-2040
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2036.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2036
PNP/Mep-dR系统是一种新型的自杀基因/前药系统, 其旁观者效应是所有已知系统中最强大的[1-5], 将其应用于肝癌基因治疗将有效克服传统自杀基因系统表达产物旁观者效应弱的难题. 我们首先利用该系统构建了一个PNP基因真核表达载体-pcDNA3.0/PNP.而如何实现自杀基因的在AFP阳性, 尤其是AFP阴性肝癌细胞中的靶向表达则是该研究需要解决的另一难题. AF0.3则是AFP特异启动子调控基因转录所必须的最短序列[6]. 他和人血管内皮细胞生长因子启动子上游的增强子序列-缺氧反应元件(HRE)[7-12]融合而成的甲胎蛋白杂合启动子[HRE]AF调控的自杀基因能够实现在AFP阳性, 尤其是阴性肝癌组织中的靶向性表达. 因此, 我们尝试将[HRE]AF与PNP基因结合, 构建含特异启动子[HRE]AF的表达载体p[HRE]AF和该启动子调控的PNP基因表达载体p[HRE]AF/PNP;同时检测和分析了两个PNP基因载体在不同细胞中的差异性表达, 预测了他们在肝癌基因治疗中的应用前景, 国内尚未见类似报道.
真核表达载体pcDNA3.0购自Invitrogen公司, 含[HRE]AF启动子的逆转录病毒载体pLN[HRE]AFTK由日本Kyoto大学Akio Ido教授赠送, 携PNP基因质粒pTyr-PNP-2美国Pittsburgh 大学David Barlett教授惠赠; 大肠杆菌DH5a菌株由本所保存; 人AFP阳性及阴性肝癌细胞株HepG2和SMMC7721, 人纤维肉瘤细胞株HT1080, 人宫颈癌细胞株Hela均购自中国典型培养物保藏中心(CCTCC). 实验中所用的各种限制性内切酶、T4DNA连接酶、逆转录酶、高保真Taq酶、DNA片段回收试剂盒以及质粒纯化试剂盒均购自Takara公司; G418、胎牛血清、DMEM培养基购自Gibco/BRL公司, 总RNA提取试剂盒Trizol、脂质体Lipofectamine 2000购自Invitrogen公司; 各对引物均按Genebank公布序列加以设计, 引物中含相应酶切位点, PNP基因上游引物起始密码子前掺入Kozak规则(方框内)[13-19]. PNP基因上游引物5'-GTCGACGA AGCTTACCATGGCTACCCCACACATTA-3', 下游引物5'-GTTGTGGATCCTCACTCTTTA TCGCCCAGCAGAAC-3' . [HRE]AF启动子片段上游引物5'-GTATATATACGTAGAG CTCTGGGCAGCTGGCCTAC-3', 下游引物5'-GTATGTGGGTACCTGTTATTGGCAGTGGT GGAAGC-3'.
感受态制备, 目的基因酶切、回收和连接, 重组体转化, 内切酶图谱分析, 均按分子克隆[20]所述进行.
1.2.1 含[HRE]AF特异启动子表达载体的构建: 将pcDNA3.0用BglⅡ和HindⅢ酶切后回收约4.6 kb片段, 以pLN[HRE]AFTK为模板, 利用[HRE]AF引物行PCR反应, 所获[HRE]AF片段经BglⅡ和HindⅢ酶切后回收0.7 kb片段, 按载体:目的基因为1:5的比例混合, T4DNA连接酶16 ℃连接过夜, 转化大肠杆菌DH5a, 快提质粒作酶切和PCR鉴定, 筛选出正确插入了[HRE]AF启动子的重组载体p[HRE]AF.
1.2.2 CMV通用启动子调控下PNP基因表达载体的构建: 以pTyr-PNP-2为模板, PNP引物扩增PNP基因. PCR产物经EcoRⅠ和XhoⅠ酶切后回收约720 bp的片段, 同样用EcoRⅠ和XhoⅠ酶切pcDNA3.0, 回收5.4 kb片段, 连接、转化和鉴定方法同前, 筛选出正确插入了PNP基因的重组载体pcDNA3.0/PNP.
1.2.3 [HRE]AF启动子调控下PNP基因表达载体的构建: 分别扩增含pcDNA3.0/ PNP和p[HRE]AF的重组菌, 小提两种质粒, 经EcoRⅠ和XhoⅠ酶切pcDNA3.0/PNP后回收约720 bp的片段, 同样用EcoRⅠ和XhoⅠ酶切p[HRE]AF, 回收约5.3 kb的大片段, 以同样方法进行连接和转化, 筛选出正确插入PNP基因的表达载体p[HRE]AF/PNP.
1.2.4 测序及序列分析: 酶切及PCR鉴定正确的含p[HRE]AF和pcDNA3.0/PNP单菌落由上海申友生物技术公司测序, 然后用Primer2.0软件分析GeneBank报道序列与克隆序列的差异.
1.2.5 细胞培养及DNA转染: 四株细胞均在含50 mL/L胎牛血清的DMEM培养基中培养, 并于37 ℃, 50 mL/L CO2、饱和湿度条件下生长. 用质粒纯化试剂盒提取pcDNA3.0/PNP和p[HRE]AF/PNP两种质粒, 二者的含量和纯度测定按分子克隆所述. DNA转染: 各株细胞均以2×105 /孔接种于24孔板, 加入无抗生素培养液500 mL, 使转染时细胞达到90%融合. DNA转染: 载体1 mg稀释于无血清DMEM至终体积50 mL, 取Lipofectamine 2000 2 mL稀释于无血清DMEM 48 mL, 轻轻振摇5 min, 混合二者, 室温下静置20 min.无血清DMEM洗细胞2次, 加入不含血清DMEM0.4 mL, 按100 mL/孔逐滴加入复合物, 同时轻轻振摇培养板, 充分混匀液体. 37℃、50 mL/L CO2、饱和湿度下培养6 h. 吸弃培养液, 无血清培养液洗涤一次. 每孔加入等体积200 ml/L胎牛血清的培养液, 继续培养至48 h.
1.2.6 抗性克隆的筛选: 48 h后, 吸弃培养液, 各孔改用分别添加了各株细胞相应筛选浓度G418的常规培养液稀释细胞, 继续培养. 同时各细胞株设立未转染DNA的对照组. 各孔每隔2-4 d换液/次, 12-15 d后, 各株细胞对照组陆续完全死亡. 收获各株细胞的抗性克隆, 传代培养.
1.2.7 RT-PCR检测PNP基因在各株细胞中的表达: 将各细胞株的2种抗性克隆分为正常和缺氧组[6], 均按2×105细胞/孔接种于24孔板, 每个克隆设4个复孔, 于含G418维持浓度的常规培养液中37 ℃, 50 mL/L培养至细胞80%融合. 正常组继续在原有条件下培养, 缺氧组则移至10 mL/L O2, 50 mL/L CO2, 940 mL/L N2条件下培养. 24 h后用Trizol抽提各孔细胞的总RNA, 以Oligo(dT)为引物合成cDNA. 然后以cDNA为模板, PNP基因上下游引物行PCR, β-actin为内参, 上游引物5'-TCCTCCCTGGAGAAGAGCTA-3', 下游引物5'-AGTACTTGCGCTCAGGAGGA-3'.
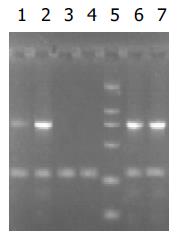
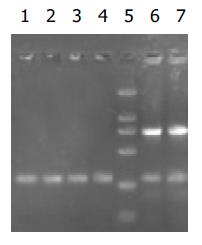
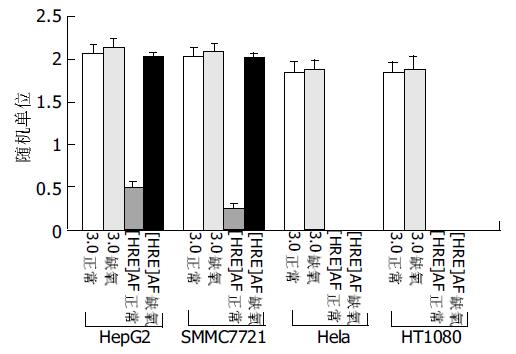
统计学处理 采用双样本假设t 检验, 用SAS6.12 for Windows软件进行统计学分析. 结果显示: 在pcDNA3.0/PNP中, CMV启动子调控下的PNP基因在四株细胞系中均顺利实现表达. 缺氧条件下, pcDNA3.0/ PNP中PNP基因的表达在各株细胞中较正常条件变化均不明显. p[HRE]AF/PNP中的PNP基因则在AFP阳性(HepG2)和阴性(SMMC7721)肝癌细胞都中实现了靶向性表达, 在其他两株细胞中均未检测到PNP基因表达. 正常条件下, [HRE]AF仅调控PNP基因在两株肝癌细胞株中微弱表达, 而在缺氧条件下, 其调控的基因表达在HepG2和SMMC7721细胞中分别较正常条件提高了3倍(P <0.01)和7.4倍(P <0.01), 均接近于CMV启动子调控的基因表达水平(表1).
| 细胞类型 | 随机单位(%, mean±SD) | |||
| pcDNA3.0/PNP | p[HRE]AF/PNP | |||
| 正常 | 缺氧 | 正常 | 缺氧 | |
| HepG2 | 208.13±10.82 | 214.06±11.50 | 50.43±4.83 | 204.55±6.00 |
| SMMC7721 | 204.13±8.73 | 210.38±9.39 | 24.38±3.98 | 202.88±5.90 |
| Hela | 185.74±13.68 | 190.27±10.07 | 0 | 0 |
| HT1080 | 184.62±9.84 | 188.51±10.54 | 0 | 0 |
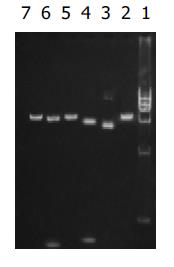
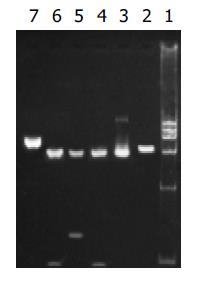
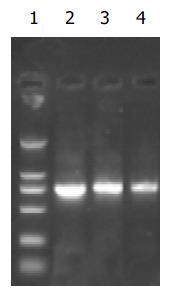
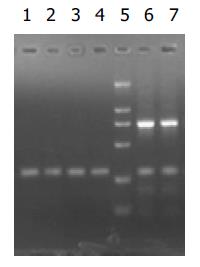
NdeⅠ, HindⅢ, BglⅡ分别酶切p[HRE]AF和pcDNA3.0, 产生的酶切片段(图1), 说明[HRE]AF片段已经正确插入pcDNA3.0中. BglⅡ、NotⅠ、XhoⅠ酶切pcDNA3.0/PNP和 pcDNA3.0, p[HRE]AF/PNP和p[HRE]AF(图2,3), 表明PNP基因已经正确插入pcDNA3.0和p[HRE]AF中.
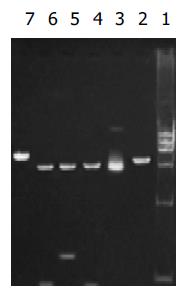
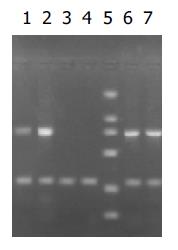
以p[HRE]AF为模板, [HRE]AF引物行PCR, 扩增[HRE]AF片段, 条件同前; 以pcDNA3.0/PNP和p[HRE]AF/PNP为模板, PNP引物行PCR, 扩增PNP基因, 条件同前; 图4,5说明各片段均已正确插入载体中.
经双向测序表明, 各重组体中都插入了相应的目的片段, pcDNA3.0/PNP中所克隆的PNP基因EcoRⅠ位点和起始密码子间掺入了Kozak规则. Primer2.0软件分析报道序列与克隆序列的差异: PNP基因DNA序列663位的碱基C突变为A.在PNP基因全长序列中无终止密码子出现, 可以翻译成为连续的氨基酸, 基因可以表达. 而[HRE]AF片段的序列与GeneBank报道一致.
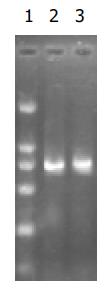
RT-PCR的产物各取3 mL行20g/L琼脂糖凝胶电泳(图6-9). 应用UVP凝胶图像扫描系统对PNP基因及β-actin条带进行灰度扫描并计算二者的比值(表1, 图10)以随机单位=Apnp/Aβ-actin×100%表示.
在我国, 肝癌是一种高发的恶性肿瘤[21-23], 现有治疗技术对其难以取得理想疗效, 因而基因治疗作为治疗肝癌的新手段成为人们的研究热点. 自杀基因疗法是肿瘤基因治疗的重要途径之一[24-27]. 运用该疗法治疗肝癌时, 旁观者效应的强弱是决定其疗效的一个关键性因素. 目前应用最为广的自杀基因系统是单纯疱疹病毒胸苷激酶(HSV-tk)基因/GCV系统和大肠杆菌胞嘧啶脱氨酶(CD)基因/5-FC系统, 治疗肝癌已取得了一定的进展. 但两系统共同缺陷就在于旁观者效应较弱, 对周围未转染的肿瘤细胞不能产生广泛的旁杀伤, 使大多数瘤细胞得以存活, 疗效有限. 因此, 我们采用了一种新型的自杀基因系统-PNP/Mep-dR系统, 他是目前已知的旁观者效应最为强大的自杀基因/前药系统, 首先构建了通用启动子CMV调控的PNP基因表达载体-pcDNA3.0/PNP. 肝癌自杀基因疗法有待突破的另一难点是实现自杀基因在肝癌组织, 尤其是AFP阴性肝癌组织中的靶向性表达. 通用启动子调控的自杀基因在杀伤肝癌细胞的同时也会杀伤转染了该基因的正常肝细胞, 副作用较大. 而传统AFP启动子调控的自杀基因对AFP阳性肝癌细胞有较好杀伤效果, 但对AFP阴性肝癌细胞则缺乏疗效. 为此, 我们又构建了HRE增强子[7-12]和AF0.3片段融合而成甲胎蛋白杂合启动子[HRE]AF调控下的PNP基因表达载体-p[HRE]AF/PNP, 并比较了他与pcDNA3.0/PNP在四细胞株中的差异性表达. 从基因转染后各细胞株中目的基因表达情况看(图6-10): 在CMV调控下, PNP基因在四细胞株中均可表达. 如将其应用于肝癌的治疗, 杀伤作用是非特异的, 在杀伤癌细胞的同时, 还可能会累及周围正常组织. 而[HRE]AF调控的PNP基因则在AFP阳性和阴性肝癌细胞中都实现了特异性表达, 在其他细胞中则未检测到表达, 提示[HRE]AF仅在肝癌细胞中具转录活性. 因此, p[HRE]AF/PNP的将实现对不同类型肝癌细胞的杀伤, 大大拓展了AFP启动子应用于肝癌靶向性基因治疗的范围.
肝癌在体内生长时, 血管生成速度不及癌细胞生长速度, 癌细胞长期处于缺氧状态. 在本实验中, 我们将一组细胞置于缺氧(O2 10 mL/L)条件培养, 以模拟肝癌在体内实际生长状况并观察两载体在缺氧条件下的转录活性变化[6]. 结果表明, CMV对缺氧状态不敏感, 而[HRE]AF转录活性在缺氧条件下却显著提高, 这一点在AFP阴性肝癌细胞中尤为明显. 这可能是由于HRE的活性在缺氧条件下显著提高[7-12], 而AFP启动子的转录活性又主要取决于其5'增强子的活性[6]. 在缺氧条件下, HRE活性大为提高, 激活下游AFP启动子. 因此, 在缺氧条件下, [HRE]AF调控的自杀基因能够在两种肝癌细胞中靶向、高效表达[6], 这一特性在[HRE]AF启动子应用于肝癌的体内治疗时将尤其有意义.
为避免PCR过程中出现突变, 我们采用了高保真Taq酶, 结果令人满意: 克隆的PNP基因中虽有一个位点发生突变, 但他位于密码子第三位碱基, 对氨基酸的翻译无影响, 二者均为苏氨酸; 克隆的[HRE]AF片段与文献报道序列一致.
在利用自杀基因治疗肿瘤时, 自杀基因的高表达对于疗效的提高同样至关重要. 为此, 我们在克隆的PNP基因的起始密码子之前掺入了Kozak规则, 他能在翻译水平调控基因表达, 使目的基因在真核细胞中的表达显著提高[13-19]. CMV是目前最强的启动子, 而[HRE]AF在常规条件下虽然较CMV启动子为弱, 但在缺氧条件下, 其转录活性将显著提高. 同时, 考虑到PNP/Mep-dR系统本身的强大的杀伤效应及Kozak序列对基因表达的显著促进作用, 将有效保证pcDNA3.0/PNP和p[HRE]AF /PNP的杀伤效能. 总之, 本研究初步建立了两个新型PNP自杀基因载体, 为进一步拓宽AFP启动子和PNP/Mep-dR系统在肝癌的靶向性基因治疗中的应用范围打下了坚实的基础.
| 1. | Deharvengt S, Wack S, Uhring M, Aprahamian M, Hajri A. Suicide gene/prodrug therapy for pancreatic adenocarcinoma by E. coli purine nucleoside phosphorylase and 6-methylpurine 2'-deoxyriboside. Pancreas. 2004;28:E54-E64. [PubMed] [DOI] |
| 2. | Gadi VK, Alexander SD, Waud WR, Allan PW, Parker WB, Sorscher EJ. A long-acting suicide gene toxin, 6-methylpurine, inhibits slow growing tumors after a single administration. J Pharmacol Exp Ther. 2003;304:1280-1284. [PubMed] [DOI] |
| 3. | McCart JA, Wang ZH, Xu H, Hu Y, Park B, Alexander HR, Bartlett DL. Development of a melanoma-specific adenovirus. Mol Ther. 2002;6:471-480. [PubMed] [DOI] |
| 4. | Krohne TU, Shankara S, Geissler M, Roberts BL, Wands JR, Blum HE, Mohr L. Mechanisms of cell death induced by suicide genes encoding purine nucleoside phosphorylase and thymidine kinase in human hepatocellular carcinoma cells in vitro. Hepatology. 2001;34:511-518. [PubMed] [DOI] |
| 5. | Gadi VK, Alexander SD, Kudlow JE, Allan P, Parker WB, Sorscher EJ. In vivo sensitization of ovarian tumors to chemotherapy by expression of E. coli purine nucleoside phosphorylase in a small fraction of cells. Gene Ther. 2000;7:1738-1743. [PubMed] [DOI] |
| 6. | Ido A, Uto H, Moriuchi A, Nagata K, Onaga Y, Onaga M, Hori T, Hirono S, Hayashi K, Tamaoki T. Gene therapy targeting for hepatocellular carcinoma: selective and enhanced suicide gene expression regulated by a hypoxia-inducible enhancer linked to a human alpha-fetoprotein promoter. Cancer Res. 2001;61:3016-3021. [PubMed] |
| 7. | Wakisaka N, Kondo S, Yoshizaki T, Murono S, Furukawa M, Pagano JS. Epstein-Barr virus latent membrane protein 1 induces synthesis of hypoxia-inducible factor 1 alpha. Mol Cell Biol. 2004;24:5223-5234. [PubMed] [DOI] |
| 8. | Yang L, Cao Z, Li F, Post DE, Van Meir EG, Zhong H, Wood WC. Tumor-specific gene expression using the survivin promoter is further increased by hypoxia. Gene Ther. 2004;11:1215-1223. [PubMed] [DOI] |
| 9. | Roth U, Jungermann K, Kietzmann T. Modulation of glucokinase expression by hypoxia-inducible factor 1 and upstream stimulatory factor 2 in primary rat hepatocytes. Biol Chem. 2004;385:239-247. [PubMed] [DOI] |
| 10. | Goyal P, Weissmann N, Grimminger F, Hegel C, Bader L, Rose F, Fink L, Ghofrani HA, Schermuly RT, Schmidt HH. Upregulation of NAD(P)H oxidase 1 in hypoxia activates hypoxia-inducible factor 1 via increase in reactive oxygen species. Free Radic Biol Med. 2004;36:1279-1288. [PubMed] [DOI] |
| 11. | Lee MJ, Kim JY, Suk K, Park JH. Identification of the hypoxia-inducible factor 1 alpha-responsive HGTD-P gene as a mediator in the mitochondrial apoptotic pathway. Mol Cell Biol. 2004;24:3918-3927. [PubMed] [DOI] |
| 12. | Takahashi R, Kobayashi C, Kondo Y, Nakatani Y, Kudo I, Kunimoto M, Imura N, Hara S. Subcellular localization and regulation of hypoxia-inducible factor-2alpha in vascular endothelial cells. Biochem Biophys Res Commun. 2004;317:84-91. [PubMed] [DOI] |
| 13. | Qin S, Tang H, Zhao LS, He F, Lin Y, Liu L, He XM. Cloning of HBsAg-encoded genes in different vectors and their expression in eukaryotic cells. World J Gastroenterol. 2003;9:1111-1113. [PubMed] [DOI] |
| 14. | Houston FA, Wilson V, Jennings CE, Owen CJ, Donaldson P, Perros P, Pearce SH. Role of the CD40 locus in Graves' disease. Thyroid. 2004;14:506-509. [PubMed] [DOI] |
| 15. | Ozelo MC, Origa AF, Aranha FJ, Mansur AP, Annichino-Bizzacchi JM, Costa FF, Pollak ES, Arruda VR. Platelet glycoprotein Ibalpha polymorphisms modulate the risk for myocardial infarction. Thromb Haemost. 2004;92:384-386. [PubMed] |
| 16. | FitzGerald PC, Shlyakhtenko A, Mir AA, Vinson C. Clustering of DNA sequences in human promoters. Genome Res. 2004;14:1562-1574. [PubMed] [DOI] |
| 17. | Yang L, Chen J, Chang CC, Yang XY, Wang ZZ, Chang TY, Li BL. A stable upstream stem-loop structure enhances selection of the first 5'-ORF-AUG as a main start codon for translation initiation of human ACAT1 mRNA. Acta Biochim Biophys Sin (Shanghai). 2004;36:259-268. [PubMed] [DOI] |
| 18. | Takeda M, Obayashi K, Kobayashi A, Maeda M. A unique role of an amino terminal 16-residue region of long-type GATA-6. J Biochem. 2004;135:639-650. [PubMed] [DOI] |
| 19. | Nakajima Y, Kimura T, Suzuki C, Ohmiya Y. Improved expression of novel red- and green-emitting luciferases of Phrixothrix railroad worms in mammalian cells. Biosci Biotechnol Biochem. 2004;68:948-951. [PubMed] [DOI] |
| 20. | Maniatis T, Fritisch E, Sambrook J. Molecular cloning A laboratory Manual 3rd ed. Cold Spring Harbor Laboratory Press. 2000;1-40. |
| 24. | Wang J, Lu XX, Chen DZ, Li SF, Zhang LS. Herpes simplex virus thymidine kinase and ganciclovir suicide gene therapy for human pancreatic cancer. World J Gastroenterol. 2004;10:400-403. [PubMed] |
| 25. | Zhang JH, Wan MX, Yuan JY, Pan BR. Construction and identification of recombinant vectors carrying herpes simplex virus thymidine kinase and cytokine genes expressed in gastric carcinoma cell line SGC7901. World J Gastroenterol. 2004;10:26-30. [PubMed] |
| 26. | Shi ZX, Wang HL, Hu K, Feng EL, Yao X, Su GF, Huang PT, Huang LY. Identification of alkA gene related to virulence of Shigella flexneri 2a by mutational analysis. World J Gastroenterol. 2003;9:2720-2725. [PubMed] [DOI] |
| 27. | Kan QC, Yu ZJ, Lei YC, Hao LJ, Yang DL. Lethiferous effects of a recombinant vector carrying thymidine kinase suicide gene on 2.2.15 cells via a self-modulating mechanism. World J Gastroenterol. 2003;9:2216-2220. [PubMed] [DOI] |