修回日期: 2004-05-01
接受日期: 2004-05-13
在线出版日期: 2004-08-15
目的: 探讨亚治疗剂量免疫抑制剂他克莫司(FK506)和来氟米特(leflunomide, LEF)联和应用预防猪对鼠异种胰岛移植排斥反应的效果.
方法: 实验分对照组、FK506组、LEF组、FK506+LEF组, 每组7只糖尿病大鼠, 将分离纯化获得的新鲜成年猪胰岛(adult pig islets, APIs)立即植入四氧嘧啶诱导的糖尿病大鼠肾被膜下(20 000 IEQ/kg), 通过血糖测定、病理组织学观察和免疫组化分析, 研究胰岛有功能存活及排斥反应的情况.
结果: 移植术后四组胰岛有功能存活时间分别为(5.4±1.3 d)、(13.7±2.5 d)、(17.3±2.5 d)、(31.7±4.2 d), FK506 (2 mg/(kg/d))和LEF(10 mg/(kg/d))组胰岛移植物有功能存活时间较对照组明显延长(P<0.01). FK506+LEF组较单纯用药组效果更好(P<0.01). 术后第5 d移植肾脏病理组织学和免疫组化检查显示FK506+LEF组有更多的大量结构完整APIs存活, 少有CD4+、CD8+T细胞及ED1+、ED2+巨噬细胞浸润, 内分泌组织完整.
结论: 在猪对鼠异种胰岛移植模型中, 亚治疗剂量的FK506和LEF单独和联合应用均明显有效地抑制异种胰岛细胞移植的排斥反应, 联合应用效果更佳, 表现出良好的协同作用.
引文著录: 黄跃南, 田素礼, 郭欣, 吴德全, 单世光, 齐忠全. 异种胰岛移植联合应用免疫抑制剂FK506和LEF的实验研究. 世界华人消化杂志 2004; 12(8): 1868-1871
Revised: May 1, 2004
Accepted: May 13, 2004
Published online: August 15, 2004
AIM: To evaluate the effects of the sub-therapy dose of FK506 and LEF in preventing islet xenograft rejection in pig to rat models.
METHODS: The alloxan-induced diabetic rats were randomly divided into control group (n = 7), FK506 group (n = 7), LEF group (n = 7) and FK506 + LEF group (n = 7). This study adopted isolated and purified the adult pig islets (APIs). APIs were transplanted immediately under the kidney capsule of the diabetic rats. The effect of FK506 and LEF were evaluated by blood glucose, pathology and immunohistochemistry.
RESULTS: The graft survival time was 5.4±1.3 d, 13.7±2.5 d, 17.3±2.5 d and 31.7±4.2 d, respectively. The graft survival time in FK506 (2 mg/(kg/d)) + LEF (10 mg/(kg/d)) group was significantly longer than that in other groups (P < 0.01). Histomorphological studies showed that a lot of intact APIs and little of lymphoid cells and macrophage infiltration were seen in FK506+LEF group, and the endocrine tissue was almost intact. Immunohistochemical studies showed that a little of CD4+, CD8+ T-lymphoid cells and ED1+, ED2+ macrophage infiltration were seen in FK506+LEF group.
CONCLUSION: The sub-therapy dose of FK506 and LEF has immuno-suppressive effects in preventing islet xenograft rejection in pig to rat models, and combined use of FK506 and LEF produces the best synergistic effect.
- Citation: Huang YN, Tian SL, Guo X, Wu DQ, Shan SG, Qi ZQ. Pancreatic islet xenotransplantation with immunosuppressive drugs FK506 and LEF. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1868-1871
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1868.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1868
胰岛移植将是比较彻底的治疗Ⅰ型和部分Ⅱ 型糖尿病方法, 人类胰岛组织来源匮乏和免疫移植排斥反应是目前移植成功的主要障碍[1]. 异种胰岛如猪胰岛可能是最合适的供体[2]. 探寻和选择合理的免疫抑制剂是解决移植免疫排斥反应的主要方法之一, 我们采用成年猪胰岛(adult pig islets, APIs) 作为异种胰岛移植供体, 选择亚治疗剂量的免疫抑制剂FK506和LEF合用预防异种胰岛移植排斥反应, 旨在研究这两种免疫抑制剂联合应用预防猪对鼠异种胰岛移植排斥反应的效果及其协同作用.
供体成年猪12-24月龄, 体质量150 kg以上, 市肉联厂提供. 受体Wistar大鼠, 体质量 200-300 g, 由黑龙江省实验动物基地提供. FK506由德国Fujisuwa公司提供, LEF由美国欣凯公司提供. FK506溶解于羧甲基纤维素钠溶液中, 配制成终浓度2 g/L, -20 ℃冻存. LEF悬浮于羧甲基纤维素钠溶液中, 配制成终浓度2 g/L, 4 ℃保存. 糖尿病大鼠参照经典化学性糖尿病模型制作方法(四氧嘧啶法)制备. 注射药物前将Wistar大鼠禁食24 h, 乙醚开放麻醉, 用新鲜配制10 g/L四氧嘧啶水溶液60 mg/kg尾静脉注射, 造成大鼠?胰岛细胞不可逆损伤引起化学性糖尿病. 注射药物72 h后连续2 wk非禁食血糖维持在22.2 mmoL/L以上, 尿糖持续阳性(++~+++)者, 确定为糖尿病模型. 成年猪胰岛的制备[6-7], 猪被屠宰放血后, 在无菌条件下, 仔细地取出整个胰腺, 在冰浴托盘上快速去除胰周组织、脂肪、血管等, 修剪后胰腺用4 ℃ HBSS液冲洗干净, 从胰体狭窄处切开, 找到胰管, 用20号套管针插入, 用丝线系牢, 并结扎远端体尾部断端, 每次取约15 g组织进行区段性灌注, 用注射器通过插管注入未预温含钙(7.5 mmoL/L)的复合胶原酶溶液(1.5 g/L), 注入量(mL) = 胰重(g)2, 可见胰腺膨大, 灌注速度约为7 mL/min, 灌注时间3-4 min, 将灌注后胰腺置入4 ℃冰箱内静置10 min, 结束后, 放入38.5 ℃水浴锅中震荡消化36-48 min. 每4 min取样1次以动态观察胰岛消化情况, 若见大多数胰岛已从外分泌组织中脱落下来, 就立即用4 ℃HBSS 200 mL(含50 mL/L小牛血清)终止消化, 洗涤, 64 g力离心3 min弃上清, 再用4 ℃HBSS离心洗涤2次, 纯化用Dextran不连续密度梯度离心法, 将混悬液离心弃上清, 用10 mL密度1.100 Dextran液与沉淀充分混匀, 在其上分别缓慢加入密度1.090, 1.076, 1.037 Dextran各10 mL. 80 g离心5 min, 加速至400 g离心15 min. 用Pasteur管吸收上两层胰岛. 纯化后在显微镜下用巴氏吸管检出外分泌组织细胞进一步增加胰岛纯度, 用RPMI1640洗涤两次, 弃上清. 将沉淀同RPMI1640 10 mL混匀, 取样镜检, 观察胰岛形态、纯度、数量及成活率. 吸取纯化后胰岛放入培养板中, 每10个胰岛当量(每1个胰岛当量相当于直径150 um的胰岛细胞团, IEQ)的APIs置入一个培养孔, 6孔一组, 共3组. 每组分别置入含5.6 mmoL/L葡萄糖(低糖)、16.7 mmoL/L葡萄糖(高糖)、16.7 mmoL/L葡萄糖+10 mmoL/L茶碱(高糖+茶碱)的RPMI 1640培养液中, 置于37 ℃、含50 mL/L CO2 的培养箱中孵育4 h, 收集培养液用胰岛素放免试剂盒(中科院原子能研究所)测定胰岛素含量.
糖尿病鼠采用戊巴比妥钠ip麻醉(40 mg/kg), 满意后打开腹腔, 探查右肾无异常后, 用7号针头小心游离起部分肾被膜, 将离心后的胰岛集聚在微量加样器黄色吸头的尖端, 用吸头小心缓慢将胰岛移至游离起的肾被膜下, 穿刺处用0号丝线结扎, 防止漏出, 确保20000IEQ猪胰岛/kg全部移入肾被膜下并将其均匀的平铺在肾表面, 术后常规青霉素治疗3 d (20万u /d). 移植后糖尿病鼠随机分成4组, 每组7只, 对照组移植后未用免疫抑制剂; FK506组移植后当日开始给药, 药量 2 mg/(kg/d), 用药前摇匀, ip; LEF组移植后当日开始给药, 药量 10 mg/(kg/d), 用药前摇匀, 管饲法喂药; FK506+LEF组移植后当日开始给药, 药量 2 mg/(kg/d) FK506+10 mg/(kg/d) LEF, 用药前摇匀, 用法同前. 受体1-2 wk每天测1次非禁食血糖, 之后每周测3次. 移植后血糖降至11.1 mmoL/L以下时, 认为胰岛开始有功能存活, 血糖连续2次超过11.1 mmoL/L认为排斥反应已经发生, 以第1次作为移植物排斥时间. 随机选取对照组, 单独用药组和联合用药组的动物各2只, 于术后5 d切取胰岛移植物进行检查. 免疫组化采用SABC法, 首先应用单克隆小鼠抗大鼠抗体(英国Setotec公司)进行免疫组化染色, 然后再与兔抗小鼠抗体(Dako/s丹麦Glostrup公司)及小鼠过氧化物酶抗过氧化物酶(DACDA/S, 丹麦Glostrup公司)培养30 min, 该过程每一步骤操作后切片均用磷酸盐缓冲液洗涤, 切片应用HE染色检测ED1+, ED2+巨噬细胞和CD4+, CD8+T细胞浸润情况, 以胞质染成棕黄色者为阳性细胞, 在高倍镜下计数, 根据浸润细胞数量用半定量法分为4个级别组: 0 = 无; + = 偶见/少见; ++ = 中等量; +++ = 大量. 病理组织学采用石蜡切片, 行HE染色分析异种胰岛被排斥情况.
统计学处理 数据用均数±标准差(mean±SD)表示. 胰岛移植物有功能存活时间采用t检验进行比较.
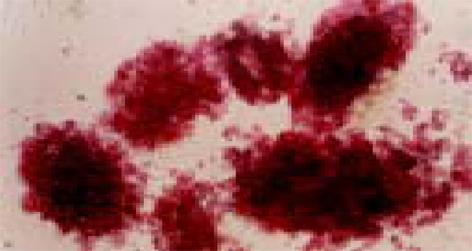
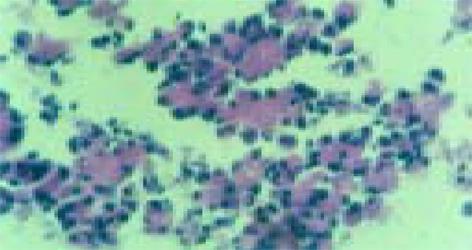
热缺血时间12±3 min, 冷缺血时间240±15 min, 38.5 ℃水浴震动消化用时42±6 min. 本组实验共30例, 均不同程度分离纯化出功能较好的胰岛, 纯化后胰岛数量为2115±252 IEQ/g, 手检后双硫棕(DTZ)染色示纯度为80%±5%(图1), 台盼蓝染色示胰岛的成活率均在80%以上, 病理组织学检查显示胰岛结构完整(图2), 结果满意. 胰岛素释放试验结果显示, 猪胰岛在高糖和茶碱刺激条件下胰岛素释放量为高糖组的1.56倍和2.33倍, 为低糖组的2.24倍和3.35倍. 统计学均有显著性差异(P<0.01) , 提示分离纯化后胰岛功能良好.
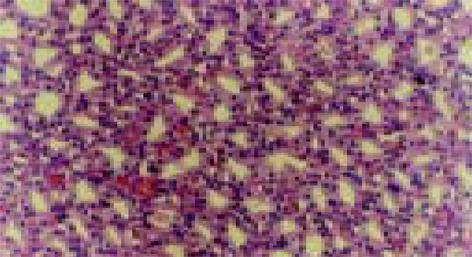
对照组, 未使用免疫抑制剂的情况下, 大鼠在(5.4±1.3 d)排斥了APIs. FK506治疗组在2 mg/(kg/d) 用药剂量时, 明显延缓了急性排斥的发生, 延长了移植物的存活时间到(13.7±2.5 d). LEF治疗组在10 mg/(kg/d)用药剂量时, 也明显地延长异种胰岛存活期到 (17.3±2.5 d). FK506 2mg/(kg/d)与LEF 10 mg/(kg/d)联合应用时能进一步地延长胰岛存活期到(31.7±4.2 d), 最长移植物存活达42 d, 均明显好于FK506和LEF单独应用(P<0.01). 这种平均存活期的增加提示这两种药物有协同作用. 胰岛移植术后第5 d移植肾脏病理组织学检查和免疫组化显示对照组APIs异种移植物己被完全排斥掉, 见不到完整的内分泌细胞, 大量淋巴细胞和巨噬细胞浸润. 单独用药组可见有中等量CD4+, CD8+T细胞和ED1+, ED2+巨噬细胞散在的分布于移植物外部, APIs异种移植物结构基本完整. FK506+LEF组有更多的大量结构完整APIs存活, 仅有少量CD4+T细胞及ED2+巨噬细胞浸润, 内分泌组织完整(图3)浸润细胞主要位于移植物边缘近肾实质侧(表1).
| Group | APIs | Cell infiltration in immunohistochemic study | |||
| ED1 | ED2 | CD4 | CD8 | ||
| Control | 0 | +++ | +++ | +++ | ++ |
| FK506 | ++ | + | + | ++ | + |
| LEF | ++ | + | + | + | + |
| Fk506+LEF | +++ | 0 | 0/+ | + | 0 |
胰岛移植极有希望成为治疗Ⅰ型糖尿病的首选方法, 其前景广阔. 猪胰岛作为异种组织供体来源受到重视, 因为猪胰岛素多年来用于治疗人类糖尿病患者, 与人胰岛素结构相似, 仅有一个氨基酸不同, 特别从1990年以来, 使用猪胰岛进行异种移植的研究已成为热门课题之一. 猪胰岛的分离和纯化比较困难, 成年猪胰腺结构复杂、较多结缔组织、猪胰岛周围缺乏被膜保护、猪的品系, 年龄及冷热缺血时间、消化过程中胶原的产生均是影响胰岛产量的主要因素[3-5]. 我们采用复合胶原酶和蛋白酶混和进行消化, 同时控制好消化时间和pH值, 可以使胰岛充分与外分泌组织分离并减少胶原对胰岛的捕获, 明显的提高了胰岛的收获量(2115±252 IEQ/g), 同国内外同类研究相比较[6-7], 处于较高水平.
选择亚治疗剂量的FK506和LEF联合应用旨在猪对鼠异种胰岛移植中获得高效低毒抗排斥作用, 目前国内外尚无这两种药物联合应用预防猪对鼠异种胰岛移植排斥反应的研究报道, 具有较好的创新性和实用价值. FK506主要抑制细胞和体液免疫反应及移植物抗原刺激的T、B淋巴细胞激活和增生, 有较好抑制移植免疫作用, 但高浓度FK506肾毒性和神经毒性较高, 更重要的是其抑制胰岛素mRNA的转录从而抑制胰岛素的分泌, 低浓度FK506对胰岛移植物无明显毒性损害, 且免疫效果较好[8]. LEF的免疫抑制作用是源于他的主要活性代谢产物A77-1726, 其抑制T、B淋巴细胞的增生, 抑制特异性抗体的产生及干扰细胞黏附, 虽然主要的分子作用机制不能够解释A77-1726的全部作用, 但仍然认为他通过抑制酪氨酸蛋白激酶和二氢乳清酸脱氢酶, 从而抑制嘌呤全程生物合成, 导致其直接抑制T、B淋巴细胞的增生, 许多同种异体和异种移植体内体外的实验均显示A77-1726可防止抗体的产生. 药物体内实验表明LEF不影响胰岛的功能[9], 对胰岛无毒性作用.
本结果显示FK506 2mg/(kg/d)、和LEF 10 mg/(kg/d)组胰岛移植物有功能存活时间较对照组明显延长(P<0.01). FK506+LEF组较单纯用药组效果更好(P<0.01). 胰岛移植术后第5 d移植肾脏病理组织学检查和免疫组化显示对照组APIs异种移植物己被完全排斥, 见不到完整的内分泌细胞, 大量淋巴细胞和巨噬细胞浸润. 单独用药组可见有中等量CD4+, CD8+T细胞和ED1+, ED2+巨噬细胞散在地分布于移植物外部, APIs异种移植物结构基本完整. FK506+LEF组有更多的大量结构完整APIs存活, 仅有少量CD4+T细胞及ED2+巨噬细胞浸润, 内分泌组织完整, 浸润细胞主要位于移植物边缘近肾实质侧. 此结果证明FK506和LEF在各自单独应用时均明显的延长异种胰岛存活期, 当两种药物联合应用时, 药物的副作用并未累加并产生了协同作用, 效果优于任何一种药物的单独应用. FK506和LEF的免疫抑制作用机制不同, FK506是在细胞质内与免疫菲林即FK506亲和蛋白结合竞争性抑制钙调素的活性, 阻断钙依赖性信号的传递, 抑制IL-2的合成与分泌, 从而抑制辅助性T淋巴细胞的功能. LEF影响淋巴因子如IL-2的分泌作用甚微, 但他能阻断T细胞在细胞分裂周期中G1期进入S期的进程. 两药间的不同作用机制可能解释FK506和LEF合用时出现的协同或附加作用.
编辑: N/A
| 1. | Berney T, Bühler L, Caulfield A, Oberholzer J, Toso C, Alejandro R, Cooper DK, Ricordi C, Morel P. Transplantation of islets of Langerhans: new developments. Swiss Med Wkly. 2001;131:671-680. [PubMed] |
| 2. | Krickhahn M, Meyer T, Bühler C, Thiede A, Ulrichs K. Highly efficient isolation of porcine islets of Langerhans for xenotransplantation: numbers, purity, yield and in vitro function. Ann Transplant. 2001;6:48-54. [PubMed] |
| 3. | Allison AC. Immunosuppressive drugs: the first 50 years and a glance forward. Immunopharmacology. 2000;47:63-83. [PubMed] [DOI] |
| 4. | Wozel G, Pfeiffer C. [Leflunomide--a new drug for pharmacological immunomodulation]. Hautarzt. 2002;53:309-315. [PubMed] [DOI] |
| 5. | Nielsen TB, Yderstraede KB, Beck-Nielsen H. Isolation, transplantation, and functional studies of adult porcine islets of Langerhans. Comp Med. 2002;52:127-135. [PubMed] |
| 6. | O'Neil JJ, Stegemann JP, Nicholson DT, Gagnon KA, Solomon BA, Mullon CJ. The isolation and function of porcine islets from market weight pigs. Cell Transplant. 2001;10:235-246. [PubMed] [DOI] |
| 7. | Swanson CJ, Olack BJ, Goodnight D, Zhang L, Mohanakumar T. Improved methods for the isolation and purification of porcine islets. Hum Immunol. 2001;62:739-749. [PubMed] [DOI] |
| 8. | Krook H, Wennberg L, Hagberg A, Song Z, Groth CG, Korsgren O. Immunosuppressive drugs in islet xenotransplantation: a tool for gaining further insights in the mechanisms of the rejection process. Transplantation. 2002;74:1084-1089. [PubMed] [DOI] |
| 9. | Guo Z, Chong AS, Shen J, Foster P, Sankary HN, McChesney L, Mital D, Jensik SC, Gebel H, Williams JW. In vivo effects of leflunomide on normal pancreatic islet and syngeneic islet graft function. Transplantation. 1997;63:716-721. [PubMed] [DOI] |