修回日期: 2004-02-12
接受日期: 2004-02-13
在线出版日期: 2004-08-15
目的: 研究小鼠胚胎干细胞ES-D3诱生的胰岛素分泌细胞(IPCs)分泌胰岛素的能力及其所分泌的胰岛素的活性.
方法: 将ES-D3细胞培养于经处理的鼠胚成纤维细胞滋养层上保持未分化状态扩增, 对数生长期时转入无血清含bFGF的DMEM液进行诱导, 隔天换液, 21 d后, 采用DTZ染色、免疫细胞化学染色和ELISA等方法检测胰岛素的生成与分泌情况; 用RT-PCR法检测PDX-1、Insulin1、Insulin2和Glut2等胰岛素分泌细胞相关基因mRNA的表达, 并通过动物实验研究生成的IPCs所分泌的胰岛素的降糖活性.
结果: 在诱导21 d, DTZ染色法观察到被DTZ染成洋红色的IPCs; 免疫细胞化学染色法显示诱导体系中有胰岛素特异性免疫反应阳性的细胞群; ELISA法测定结果表明IPCs受高糖刺激后分泌胰岛素, 动物实验证明所分泌的胰岛素具有降糖活性; RT-PCR法检测到有Insulin2 和PDX-1 mRNA的表达, Insulin1呈弱表达, Glut2不表达.
结论: 小鼠胚胎干细胞ES-D3诱生的IPCs能够合成并分泌胰岛素, 而且分泌的胰岛素具有降糖活性.
引文著录: 刘星霞, 缪兵, 李府, 马秀峰, 时庆, 沈柏均. 胚胎干细胞诱生的胰岛素分泌细胞分泌胰岛素的研究. 世界华人消化杂志 2004; 12(8): 1857-1860
Revised: February 12, 2004
Accepted: February 13, 2004
Published online: August 15, 2004
AIM: To study the insulin secretion of insulin-producing cells (IPCs) induced from embryonic stem cells (ESCs).
METHODS: ESCs were allowed to grow on mouse fetal fibroblast feeder layer to keep undifferentiated state, and then transferred into serum-free DMEM supplemented with bFGF to form outgrowths in the culture. At day 21 after induction, the outgrowths were incubated in DTZ solution (final concentration, 100 mg/L) for 15 minutes before being observed microscopically. In addition, insulin production was examined immunohistochemically, and its secretion was determined using ELISA. The gene expression of endocrine pancreatic markers, including PDX-1, insulin1, insulin2 and Glut2, was also analyzed by RT-PCR, and the activity of secreted insulin was determined by glucose-reducing experiment on mice.
RESULTS: ESCs grew and formed embryoid bodies at day 4, and the addition of bFGF promoted the differentiation of ESCs into IPCs. The induced IPCs self-assembled to form three-dimentional clusters, and were stained crimson red by DTZ at day 21 after differentiation. They were found to be immunoreactive to insulin, express pancreatic-duodenal homeobox 1 (PDX1) and insulin2 mRNA. They were also able to secrete detectable amounts of active insulin, which could reduce mouse blood glucose significantly.
CONCLUSION: ES cell-induced IPCs can synthesize and secrete active insulin that is able to reduce blood glucose significantly.
- Citation: Liu XX, Miao B, Li F, Ma XF, Shi Q, Shen BJ. Insulin production by insulin-producing cells induced from embryonic stem cells. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1857-1860
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1857.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1857
糖尿病(diabetes mellitus, DM)发病率不断上升, I型糖尿病及部分Ⅱ型糖尿病患者往往终生需要胰岛素注射治疗, 但胰岛素注射疗法的疗效并不理想. 对于已经丧失胰岛β细胞功能的糖尿病患者来说, 胰岛的异体移植虽是非常有效的治疗方法, 但供源严重缺乏[1-6]. 所以, 探索移植治疗所需的胰岛素分泌细胞(insulin-producing cells, IPCs)新供源迫在眉睫[7-11]. 胚胎干细胞(embryonic stem cells, ESCs)具有无限增生和多向分化的潜能, 从理论上讲, ESCs可以无限地提供移植所需的各种特异细胞类型[12-15], 从而在帕金森氏病、血液病和糖尿病等多种因细胞缺损或功能障碍引起的疾病的移植治疗中具有广阔的应用前景, 所以, 如何从ESCs获得用于移植所需的特定细胞类型是目前研究的焦点. 自2000年Soria et al[16] 首次报道成功地从小鼠胚胎干细胞ES-R1分化获得IPCs以来, Lumelsky et al[17-18] 少数实验室也相继报道从不同来源的小鼠胚胎干细胞E14.1和EB3诱导生成IPCs, 但从小鼠胚胎干细胞ES-D3诱导生成IPCs的研究在国内外尚未见报道. 我们的实验如下.
ES-D3细胞系购自中科院上海细胞生物化学研究所. DMEM、胎牛血清及非必需氨基酸购自Gibco公司; Serum Replacement 3, Dithizone(DTZ)购自Sigma公司; 重组鼠碱性纤维母细胞生长因子(rm-bFGF)购自R and D System公司; 鼠胰岛素ELISA试剂盒购自Lifekey BioMeditech公司. Balb/c小鼠, SPF级, 由山东大学实验动物中心提供.
取孕13 d Balb/c小鼠胚胎, 常规方法制备滋养层细胞. 所用培养基为DMEM(含高糖, 谷氨酰胺, 不含丙酮酸钠)加100 mL/L小牛血清. 临用前, 用10 mg/L丝裂霉素处理. 将复苏后的ES-D3细胞种植于原代鼠胚成纤维细胞滋养层上保持未分化状态扩增, 种植密度为5×108/L. 所用培养基为DMEM(含高糖, 谷氨酰胺, 不含丙酮酸钠), 添加200 mL/L胎牛血清, 10 g/L非必需氨基酸, 0.1 mmoL/L 2-巯基乙醇(2-ME), 1 mmoL/L谷氨酰胺. 将对数生长期的保持未分化状态的ES-D3细胞用胰酶-EDTA消化后, 悬浮培养于无滋养层细胞的12孔细胞培养板使其分化. 所用诱导培养基为DMEM(含高糖, 谷氨酰胺, 不含丙酮酸钠), 添加200 mL/L Serum Replacement 3, 10 g/L非必需氨基酸, 0.1 mmoL/L 2-ME, 1mmol/L谷氨酰胺, 5 μg/L rm-bFGF.
1.2.1 诱生的IPCs分泌胰岛素的检测: 将50 mg DTZ溶于5 mL二甲基亚砜(DMSO)中, 混匀, 抽滤除菌, 备用. 在诱导的21 d进行DTZ染色[19], 染色时, 向每1 mL分化培养体系中加入10 μL DTZ染色液, 于37 ℃孵箱内继续培养15 min, 吸取染色孔内的细胞少许, 用PBS洗涤2次, 显微镜下观察. 取21 d的诱生细胞涂片, 40 g/L甲醛常规固定后行免疫细胞化学染色. 一抗使用抗鼠胰岛素抗体, 其余步骤参照试剂盒说明书. 取诱导21 d的细胞, 用含5.5 mmoL/L葡萄糖的条件培养液(不含血清和Serum Replacement 3的高糖刺激液)洗2次, 继续高糖刺激培养2 h, 然后, 收集培养上清液, 用ELISA法检测其中胰岛素的含量.
1.2.2 RT-PCR法检测胰岛β细胞相关基因mRNA的表达: 分别取诱导分化4 d和28 d的培养细胞离心, 弃去上清液, 应用Trizol试剂一步法抽提总mRNA, 经凝胶电泳检查质量, 紫外分光光度计检测浓度和纯度; cDNA合成的逆转录反应体系包括: 总RNA 1 μg, MMLV 1 μL, 逆转录反应体系7 μL, 下游引物1 μL, 去RNase水10 μL. 37 ℃反应1 h, 95 ℃反应10 min; PCR反应在100 μL反应体系中, 含逆转录反应产物20 μL, PCR反应体系19 μL, 上游引物1 μL, 去RNase水58 μL, Taq DNA聚合酶2 μL. PCR反应扩增条件为94 ℃预变性5 min后, 进行下列循环: 94 ℃变性1 min, 58 ℃退火1 min, 72 ℃延伸1 min, 共35个循环, 最后72 ℃延伸7 min. 取目的产物10 μL在10 g/L琼脂糖凝胶上进行电泳, 紫外透射仪下检测所获条带并摄像. 各用于检测的上下游引物为: Insulin1: 5'-TAGTGACCAGCTATAATCAGAG-3', 5'-ACGCCAAGGTCTGAAGGTCC-3'(288 bp); Insulin2: 5'-CCCTGCTGGCCC TGCTCTT-3', 5'-AGGTCTGAAGGTCACCTGCT-3'(212 bp); Glut2: 5'-CCACCCAGTTTACAAGCTC-3', 5'-TGTAGGCAGTACGGGT CCTC-3'(325 bp); PDX-1: 5'-TGTAGGCAGTACGGGTCCTC-3', 5'-CCACCC CAGTTTACAAGCTC-3'(325 bp); β-actin: 5'-ATGGATGACGATATCGCT-3', 5'-ATGAGGTAGTCTGTCAGGT-3'(569 bp).
1.2.3 诱生的IPCs分泌的胰岛素的降糖活性: ♂Balb/c小鼠24只, 6-8周龄, 体质量202 g, 随机均分为4组, 组1各鼠经尾静脉注射分化21 d诱导培养上清液0.3 mL, 组2各鼠经尾静脉注射分化43 d诱导培养上清液0.3 mL, 组3各鼠经尾静脉注射生理盐水0.3 mL作为阴性对照, 组4各鼠经尾静脉注射标准胰岛素溶液0.3 mL作为阳性对照. 用LifeScan血糖仪分别于注射前、注射后10, 30 min检测各组小鼠各时间点的血糖水平.
统计学处理 采用两样本均数比较的假设检验(t检验), 所有数据均用mean±SD表示, α = 0.0 500(单侧).
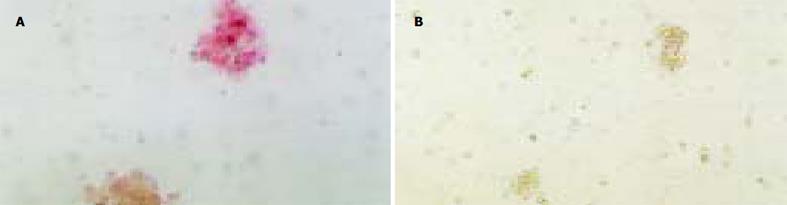
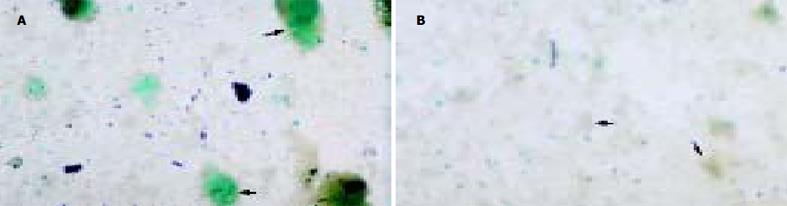
在诱导培养21 d, 用DTZ染色法检测诱导体系, 观察到诱导生成的IPCs聚集成三维立体细胞簇, 他们被DTZ染成洋红色(图1A); 而未分化的ESCs不着色(图1B). 免疫细胞化学染色结果, 示与胰岛素抗体呈特异性免疫反应的细胞群(胰岛素阳性细胞群)被染成蓝色(图2A), 而未分化的ESCs未见染成蓝色的胰岛素阳性细胞群(图2B). ELISA法检测胰岛素分泌的结果表明, 21 d诱导生成的IPCs经高糖刺激培养2 h后, 检测到有胰岛素的分泌, 其分泌量为43.7±6.2 mU/L (n = 6). 而自发分化对照组的ES-D3细胞(培养体系中含200 mL/L胎牛血清, 不含Serum Replacement 3和bFGF)仅测得微量胰岛素(2.3±0.6 mU/L, n = 6).
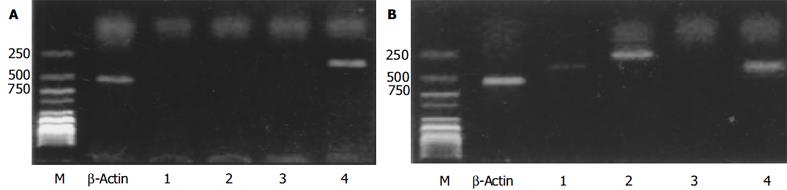
在诱导培养4 d的分化细胞, 仅检测到有PDX-1基因mRNA的表达, Insulin1, Insulin2和 Glut2基因均不表达(图3A), 说明此时已分化出能够发育成熟为IPCs的前体细胞, 但这些细胞尚未成熟为功能性的IPCs; 在诱导培养28 d的IPCs, 检测到有Insulin2 和PDX-1
血糖1为各组小鼠尾静脉注射相应溶液前的血糖水平, 血糖2和3分别为各组注射相应溶液后10 min和30 min时的血糖水平. 结果显示, 21 d诱导培养上清液注射给小鼠后, 小鼠血糖水平与注射前比较, 在注射后10 min和30 min都显著降低(P<0.05); 分化43 d培养上清液注射给小鼠后, 小鼠血糖水平基本不变; 标准胰岛素对照组小鼠血糖水平与注射前比较, 在注射后10 min和30 min均显著降低(P<0.05); 生理盐水对照组小鼠在注射前后血糖水平基本不变. 该结果说明: 诱导生成的IPCs所分泌的胰岛素具有降糖活性. 此外, 21 d诱导培养上清液能显著降低受鼠血糖水平; 而43 d诱导培养上清液不能降低受鼠血糖, 说明诱导生成的IPCs分泌胰岛素的能力具有时程变化(表1).
ESCs可诱导分化为神经细胞、心肌细胞和造血细胞等[20-23]. 我们选择胚胎干细胞系ES-D3, 采用含bFGF的无血清悬浮培养体系进行了ES-D3体外诱导分化为IPCs的研究. 与自发分化不同, 该诱导体系通过采用含serum replacement 3的无血清培养基, 促进胰岛前体细胞的生成, 有利于ES-D3向IPCs分化[17]; 另一方面, 诱导培养体系中加入的bFGF对ES-D3向IPCs分化亦起了非常重要的作用[18], 因为FGF信号参与了胰岛β细胞的成熟、分化和扩增[24].
关于诱导生成的IPCs所分泌的胰岛素, 我们发现, 在诱导21 d, 观察到被DTZ染成洋红色的IPCs细胞簇, 而对于未分化的ESCs, DTZ染色始终呈阴性(图1), 这与Shiroi et al[19] 的结果一致. 将21 d的诱生细胞染色后, 观察到与胰岛素抗体呈特异性免疫反应、被染成蓝色的胰岛素特异性细胞群, 而未分化的ESCs对照组未见胰岛素免疫反应阳性的细胞群(图2). 在诱导培养4 d的分化细胞, 仅检测到有PDX-1基因mRNA的表达, 说明此时已分化出能够发育成熟为IPCs的前体细胞, 但这些细胞尚未成熟为功能性的IPCs; 在诱导培养28 d的IPCs, 检测到有Insulin2 和PDX-1基因的表达, 说明此时已分化出成熟的功能性的IPCs(图3).
众所周知, 胰岛β细胞的特点之一是经葡萄糖刺激后产生胰岛素. 所以, 我们接下来对诱导分化21 d生成的IPCs受高糖刺激后能否分泌胰岛素的能力进行了测定. 采用鼠胰岛素ELISA试剂盒, 我们成功地检测到胰岛素的分泌. 结果表明, 诱生的IPCs用含5.5 mmoL/L葡萄糖的条件培养基刺激培养2 h后, 分泌胰岛素(43.7±6.2 mU/L, n = 6), 而自发分化对照组仅测得微量胰岛素(2.3±0.6 mU/L, n = 6). 这不仅说明诱导培养体系中有IPCs的存在, 而且也表明该IPCs经葡萄糖刺激后具有分泌胰岛素的能力. 在此基础上, 我们进一步对所分泌的胰岛素的降糖活性进行了研究. 结果显示, 21 d诱导培养上清液能显著降低受鼠血糖水平; 而43 d诱导培养上清液不能降低受鼠血糖水平, 这说明诱导生成的IPCs所分泌的胰岛素与标准胰岛素一样具有降糖活性, 能够显著降低正常鼠的血糖水平, 同时也说明该IPCs分泌胰岛素的能力具有时程变化(表1).
总之, 我们从DTZ染色、免疫细胞化学染色、ELISA、RT-PCR和动物实验等角度对ES-D3诱生的IPCs分泌胰岛素及其所分泌的胰岛素的降糖活性进行了较为系统的研究. 我们的实验结果表明, 鼠胚胎干细胞ES-D3在无血清含bFGF的DMEM培养体系中诱导生成的IPCs具有类似在体β细胞的生物学特征, 即在体外受高糖刺激后能够分泌胰岛素, 而且其分泌的胰岛素具有降糖活性. 这不但为今后将人胚胎干细胞诱导生成的胰岛素分泌细胞用于临床治疗糖尿病提供了有力的实验证据, 同时也对以胚胎干细胞诱导分化为基础的临床移植治疗其他疾病提供了借鉴.
编辑: N/A
| 1. | Scharfmann R. Alternative sources of beta cells for cell therapy of diabetes. Eur J Clin Invest. 2003;33:595-600. [PubMed] [DOI] |
| 2. | Street CN, Rajotte RV, Korbutt GS. Stem cells: a promising source of pancreatic islets for transplantation in type 1 diabetes. Curr Top Dev Biol. 2003;58:111-136. [PubMed] [DOI] |
| 3. | Shapiro AM, Lakey JR, Ryan EA, Korbutt GS, Toth E, Warnock GL, Kneteman NM, Rajotte RV. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 2000;343:230-238. [PubMed] [DOI] |
| 4. | Halvorsen T, Levine F. Diabetes mellitus-cell transplantation and gene therapy approaches. Curr Mol Med. 2001;1:273-286. [PubMed] [DOI] |
| 5. | Ball SG, Barber TM. Molecular development of the pancreatic beta cell: implications for cell replacement therapy. Trends Endocrinol Metab. 2003;14:349-355. [PubMed] [DOI] |
| 6. | Engelgau MM, Narayan KM, Saaddine JB, Vinicor F. Addressing the burden of diabetes in the 21st century: better care and primary prevention. J Am Soc Nephrol. 2003;14:S88-S91. [PubMed] [DOI] |
| 7. | Bonner-Weir S. Stem cells in diabetes: what has been achieved. Horm Res. 2003;60 Suppl 3:10. [PubMed] |
| 8. | Roche E, Sepulcre MP, Enseñat-Waser R, Maestre I, Reig JA, Soria B. Bio-engineering inslulin-secreting cells from embryonic stem cells: a review of progress. Med Biol Eng Comput. 2003;41:384-391. [PubMed] [DOI] |
| 9. | He Q, Li J, Bettiol E, Jaconi ME. Embryonic stem cells: new possible therapy for degenerative diseases that affect elderly people. J Gerontol A Biol Sci Med Sci. 2003;58:279-287. [PubMed] [DOI] |
| 10. | Shamblott MJ, Clark GO. Cell therapies for type 1 diabetes mellitus. Expert Opin Biol Ther. 2004;4:269-277. [PubMed] [DOI] |
| 12. | Yamashita J, Itoh H, Hirashima M, Ogawa M, Nishikawa S, Yurugi T, Naito M, Nakao K, Nishikawa S. Flk1-positive cells derived from embryonic stem cells serve as vascular progenitors. Nature. 2000;408:92-96. [PubMed] [DOI] |
| 13. | Lee SH, Lumelsky N, Studer L, Auerbach JM, McKay RD. Efficient generation of midbrain and hindbrain neurons from mouse embryonic stem cells. Nat Biotechnol. 2000;18:675-679. [PubMed] [DOI] |
| 14. | Reubinoff BE, Pera MF, Fong CY, Trounson A, Bongso A. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat Biotechnol. 2000;18:399-404. [PubMed] [DOI] |
| 15. | Odorico JS, Kaufman DS, Thomson JA. Multilineage differentiation from human embryonic stem cell lines. Stem Cells. 2001;19:193-204. [PubMed] [DOI] |
| 16. | Soria B, Roche E, Berná G, León-Quinto T, Reig JA, Martín F. Insulin-secreting cells derived from embryonic stem cells normalize glycemia in streptozotocin-induced diabetic mice. Diabetes. 2000;49:157-162. [PubMed] [DOI] |
| 17. | Lumelsky N, Blondel O, Laeng P, Velasco I, Ravin R, McKay R. Differentiation of embryonic stem cells to insulin-secreting structures similar to pancreatic islets. Science. 2001;292:1389-1394. [PubMed] [DOI] |
| 18. | Assady S, Maor G, Amit M, Itskovitz-Eldor J, Skorecki KL, Tzukerman M. Insulin production by human embryonic stem cells. Diabetes. 2001;50:1691-1697. [PubMed] [DOI] |
| 19. | Shiroi A, Yoshikawa M, Yokota H, Fukui H, Ishizaka S, Tatsumi K, Takahashi Y. Identification of insulin-producing cells derived from embryonic stem cells by zinc-chelating dithizone. Stem Cells. 2002;20:284-292. [PubMed] [DOI] |
| 20. | Nonaka M, Yoshikawa M, Nishimura F, Yokota H, Kimura H, Hirabayashi H, Nakase H, Ishizaka S, Wanaka A, Sakaki T. Intraventricular transplantation of embryonic stem cell-derived neural stem cells in intracerebral hemorrhage rats. Neurol Res. 2004;26:265-272. [PubMed] [DOI] |
| 21. | Kaufman DS, Hanson ET, Lewis RL, Auerbach R, Thomson JA. Hematopoietic colony-forming cells derived from human embryonic stem cells. Proc Natl Acad Sci U S A. 2001;98:10716-10721. [PubMed] [DOI] |
| 22. | Gerecht-Nir S, Itskovitz-Eldor J. Human embryonic stem cells: a potential source for cellular therapy. Am J Transplant. 2004;4 Suppl 6:51-57. [PubMed] [DOI] |