修回日期: 2004-04-10
接受日期: 2004-05-11
在线出版日期: 2004-07-15
目的: 探讨丙型肝炎病毒(HCV)非结构蛋白NS3对硫氧还蛋白还原酶1(TXNRD1)启动子转录的激活作用.
方法: 以HCV非结构蛋白NS3反式调节基因的基因表达谱芯片结果为基础, 利用生物信息学技术确定TXNRD1的启动子区域(TXNRD1p), 聚合酶链反应(PCR)扩增TXNRD1p, 克隆至真核报告载体pCAT3-Basic中, 构建pCAT3-TXNRD1p报告载体; 以该质粒转染肝癌细胞系HepG2细胞系, 用酶联免疫黏附法(ELISA)检测氯霉素乙酰转移酶(CAT)的表达活性; 并与pcDNA3.1(-)-NS3共转染HepG2细胞系, 用ELISA法检测CAT的表达活性.
结果: 成功获得TXNRD1启动子的正确克隆. pCAT3-TXNRD1p和pcDNA3.1(-)-NS3瞬时转染的HepG2细胞的CAT表达活性是pCAT3-Basic空载体的9.0倍, pCAT3-TXNRD1p的2.0倍, 进一步验证了利用基因表达谱技术研究HCV NS3蛋白反式激活作用的结果.
结论: TXNRD1启动子有顺式激活下游基因的活性; HCV的NS3蛋白具有对TXNRD1的反式激活作用.
引文著录: 纪冬, 成军, 郭江, 董菁, 王建军, 刘妍. 丙型肝炎病毒非结构蛋白NS3上调硫氧还蛋白还原酶1基因的表达. 世界华人消化杂志 2004; 12(7): 1555-1558
Revised: April 10, 2004
Accepted: May 11, 2004
Published online: July 15, 2004
AIM: To investigate the transactivating effect of HCV NS3 protein on TXNRD1 gene promoter and the molecular biological mechanisms of HCV NS3 protein in HCV pathogeneicity.
METHODS: Polymerase chain reaction (PCR) technique was employed to amplify the sequence of TXNRD1 promoter from HepG2 genomic DNA, and the product was subcloned into pCAT3-Basic by Kpn I and Xho I, named pCAT3-TXNRD1p. pCAT3-TXNRD1p was transfected into the hepatoblastoma cell line HepG2, then cotransfected with pcDNA3.1(-)-NS3 by FuGENE 6 transfection reagents. The HepG2 cells transfected with pCAT3-Basic was used as negative control. The activity of CAT in HepG2 cells transfected was detected by an ELISA kit after 48 hours, which reflected the transactivating function of HCV NS3 protein to TXNRD1 gene promoter.
RESULTS: The expression vector pcDNA3.1(-)-NS3 and report vector pCAT3-TXNRD1p were constructed and confirmed by restriction enzyme digestion and sequencing. The expression of CAT in HepG2 cells co-transfected with pCAT3-TXNRD1p and pcDNA3.1(-)-NS3 is 9 times as higher as that of pCAT3-Basic, and twice as higher as that of pCAT3-TXNRD1p.
CONCLUSION: HCV NS3 protein can transactivate TXNRD1 promoter, and therefore up-regulate the expression of TXNRD1 gene.
- Citation: Ji D, Cheng J, Guo J, Dong J, Wang JJ, Liu Y. Hepatitis C virus NS3 protein up-regulates expression of thioredoxin reductase 1 gene. Shijie Huaren Xiaohua Zazhi 2004; 12(7): 1555-1558
- URL: https://www.wjgnet.com/1009-3079/full/v12/i7/1555.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i7.1555
丙型肝炎病毒(HCV)的感染是严重的医学和社会经济学问题[1-10]. HCV为单股正链RNA病毒, 具有一个大的开放阅读框(ORF), 编码约3 010个氨基酸(aa)的多聚蛋白前体, 这个蛋白前体通过宿主和病毒蛋白酶的裂解作用产生至少10个蛋白[11-12]. 其中NS3蛋白具有丝氨酸蛋白酶、三磷酸核苷酶 (NTPase) 和解旋酶(helicase) 的功能, 在HCV多聚蛋白的成熟和病毒复制过程中发挥重要作用, 并且对于宿主多种基因具有反式激活作用, 影响了细胞的功能, 诸如细胞增生、凋亡, 甚至是HCV致癌作用[13-19]. 我们采用分子克隆技术构建TXNRD1基因启动子的真核报告载体和HCV NS3基因的真核表达载体, 瞬时转染HepG2细胞系的结果表明, 克隆得到的TXNRD1启动子具有启动子活性; HCV NS3蛋白可以激活TXNRD1启动子, 使下游的CAT基因的表达增强, 为研究NS3蛋白的生物学功能, 特别是他的反式激活作用提供新的线索.
重组表达载体pcDNA3.1(-)-NS3为本室构建, 人肝母细胞瘤细胞系HepG2细胞及大肠杆菌JM109菌株为本室保存. Tag DNA聚合酶、T4 DNA连接酶及限制性内切酶均购自Takara公司.质粒DNA提取试剂盒, 中间载体pGEM-T及报告质粒pCAT3-Basic均购自Promega公司; CAT-ELISA检测试剂盒及质粒DNA转染试剂盒购自Roche公司. 玻璃奶纯化试剂盒购自博大公司. 其他生化试剂购自Sigma公司.
1.2.1 TXNRD1启动子的结构分析及聚合酶链反应扩增: 根据GenBank中TXNRD1以及其启动子的基因序列[20], 确定TXNRD1的翻译起始点(ATG), 选取其上游-1 057至-122 bp为目的片段, 设计并由上海博亚公司合成引物, 在上下游引物的5'-端分别加上Kpn I和Xho I. 上游引物: 5'-GGT ACC AGC TGG AGT TAA AAG ACA CTC TGA G-3', 下游引物: 5'-CTC GAG TCA GAC ACG CCT TAA AAT ATC TTC C-3'. 以HepG2细胞基因组为模板, 进行聚合酶链反应(PCR)反应(PE9600 PCR 仪), 扩增条件: 94 ℃预变性5 min, 94 ℃变性1 min, 62 ℃退火1 min, 72 ℃延伸1 min, 循环35次后, 72 ℃保温10 min. PCR产物经10 g/L琼脂糖凝胶电泳, 切胶, 玻璃奶法回收纯化.
1.2.2 pCAT3-TXNRD1p的瞬时转染及报告基因CAT活性检测: 回收产物在T4 DNA连接酶的作用下, 与pGEM-T载体连接, 转化大肠杆菌JM109感受态细胞, 挑取在选择平皿(Amp, X-gal/IPTG)生长的白色菌落提取质粒, 经酶切(Kpn I/Xho I)鉴定. Kpn I/Xho I双酶切重组质粒pGEM-T-TXNRD1p, 玻璃奶纯化回收酶切产物, 定向克隆至pCAT3-Basic载体, 构建成重组质粒pCAT3-TXNRD1p, 经酶切及DNA测序鉴定(上海博亚公司). 磁珠法提取质粒以备转染. HepG2细胞系在含100 mL/L胎牛血清的DMEM中培养. 于35 mm平皿中生长至50%-80%融合时采用脂质体转染法, 具体转染方法参照FuGENE6 Transfection Reagent说明书进行, pCAT3-TXNRD1p转染剂量为1 g. 设置pCAT3-Basic(1 g)为阴性对照组, pCAT3-promoter (1 g)为阳性对照组, 转染24 h后收获细胞, 用于CAT活性检测以验证所克隆的片段具有启动子活性. 选用不同剂量的重组报告质粒pCAT3-TXNRD1p (0.029, 0.044, 0.059, 0.088, 0.117 g)分别转染HepG2细胞, 设置pCAT3-Basic(1 g)为阴性对照组, 转染24 h后收获细胞, 检测CAT含量, 并绘制效量-效应曲线图. 根据剂量曲线, 选择恰当的pCAT3-TXNRD1p剂量(0.029 g)与pcDNA3.1(-)-NS3 (1 g)以脂质体法共转染HepG2细胞系.设置pCAT3-Basic(1 g)为阴性对照组, pCAT3-TXNRD1p(0.029 g)为阳性对照组, 转染24 h后收获细胞. 收集细胞裂解液, 用于CAT活性检测. 所有实验严格平行操作. 取1.0 g/L 的CAT标准品(试剂盒提供)及细胞裂解液200 L, 加入已包被抗体的96孔板中, 37 ℃温育1 h, 再依次加入第一抗体(地高辛标记的抗-CAT)、第二抗体(耦联有过氧化物酶的地高辛抗体抗-DIG-POD)各200 L, 37 ℃温育1 h后, 加入过氧化物酶的底物室温显色20 min. 用酶标仪检测标本在415 nm检测波长, 490 nm参考波长下的吸光度(A)值, 其数值反映细胞提取物中的CAT表达水平.
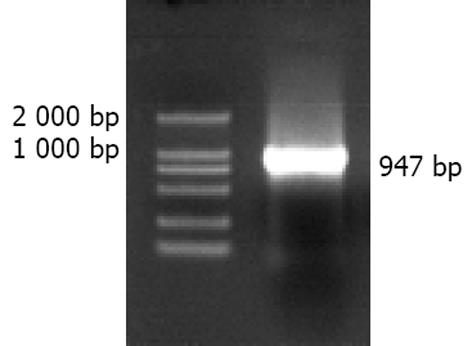
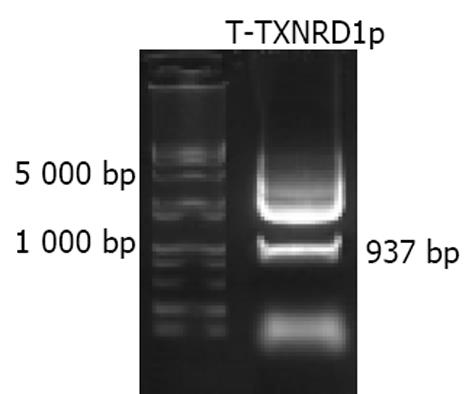
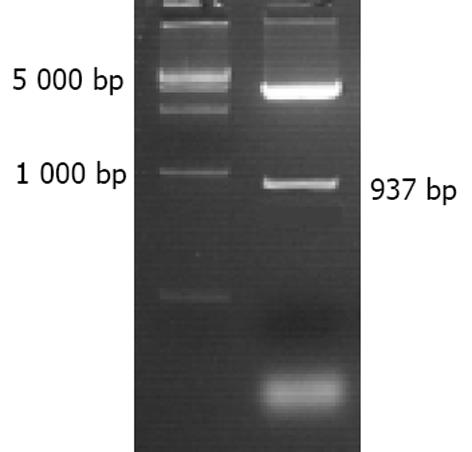
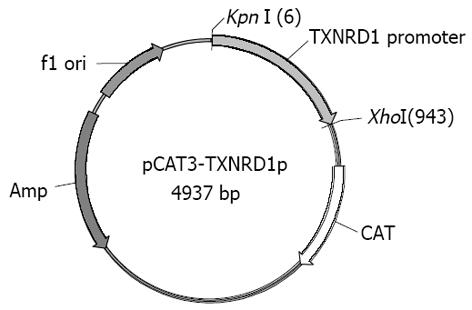
利用自行设计的引物成功扩增出TXNRD1的基因启动子序列, 经10 g/L琼脂糖凝胶电泳分析显示扩增片段约950 bp, 与预期片段符合(图1). 将扩增产物与pGEM-T载体连接, 双酶切鉴定, 10 g/L琼脂糖凝胶电泳分析显示两条带(3 000 bp的pGEM-T载体和937 bp的TXNRD1启动子DNA片段), 与预期一致(图2). 将双酶切产物与pCAT3-Basic载体连接, 双酶切鉴定如图3所示(4 000 bp的pCAT3-Basic载体和937 bp的TXNRD1p DNA片段), DNA测序结果和GenBank中TXNRD1启动子的基因序列完全一致. 图4为pCAT3-TXNRD1p质粒结构图.
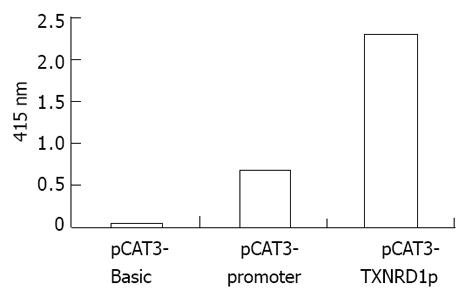
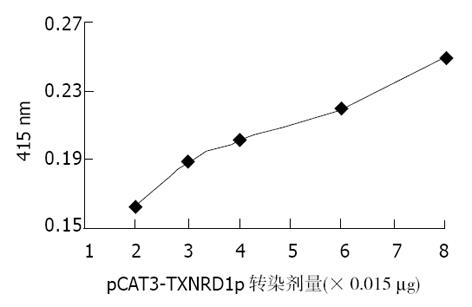
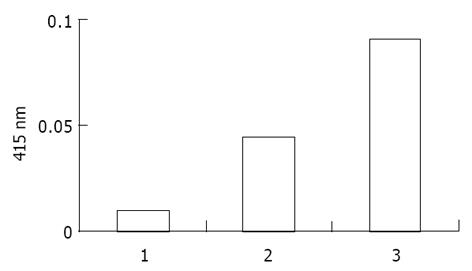
将重组质粒pCAT3-TXNRD1p转染HepG2细胞, CAT ELISA检测吸光度, 空载体对照组pCAT3-Basic的吸光度为0.050, 阳性对照组pCAT3-promoter为0.675, pCAT3-TXNRD1p为2.310(图5), 表明pCAT3-TXNRD1具有很强的启动子活性. 由于pCAT3-TXNRD1p 1 g转染剂量时其上调CAT表达很强, 故将原液稀释30倍后分别取用2, 3, 4, 6, 8 L进行转染, 转换为质量数为0.029, 0.044, 0.059, 0.088, 0.117 g, 以获得较好的曲线关系, 其CAT吸光度值分别为: 0.162, 0.189, 0.201, 0.220, 0.250(图6), 说明TXNRD1启动子的顺式激活效应具有剂量依赖性. 选择恰当的pCAT3-TXNRD1p剂量(0.029 g)与pcDNA3.1(1)-NS3(1 g)重组质粒共转染HepG2细胞及检测CAT的表达. pCAT3-Basic的CAT的吸光度值为0.010, pCAT3-TXNRD1p的CAT的吸光度值为0.044, 共转染pCAT3-TXNRD1p/pcDNA3.1(-)-NS3的吸光度值为0.090, 较实验对照质粒明显升高, 是pCAT3-Basic空载体的9.0倍, 是pCAT3-TXNRD1p的2.0倍, 说明HCV NS3蛋白对TXNRD1基因启动子有反式激活作用, 使其下游CAT基因的表达增强(图7).
哺乳类硫氧还蛋白(Trx)通过TXNRD还原后参与了脱氧核糖核苷酸的合成, 转录因子氧化还原作用的调控, 过氧化物的还原以及凋亡的调控. Trx的氧化状态非常的重要, TXNRD的活性对于细胞增生或者是免疫性疾病非常重要. TXNRD是一类含有硒代半胱氨酸的氧化还原酶, 以二聚体的形式存在. TXNRD酶的羧基(C)-末端的-甘氨酸-半胱氨酸-硒代半胱氨酸-甘氨酸-COOH序列形成了一个硫化硒/巯化硒氧化还原活性域, 这个结构域可以接受来自于氨基(N)-末端的-半胱氨酸-缬氨酸-天门冬酰胺-缬氨酸-甘氨酸-半胱氨酸基序所提供的电子, 从而调节其下游的多种细胞内的氧化还原敏感的蛋白[21-23], 包括凋亡信号调节激酶1, 亚砜蛋氨酸还原酶以及一些转录因子. 最近的研究表明哺乳类共有3种类型的TXNRD, 他们分别是位于所有细胞胞质内的TXNRD1, 位于线粒体的TXNRD3和只存在于睾丸的TGB[24]. TXNRD1和其底物硫氧还蛋白1(Trx1)组成了一个氧化还原系统, TXNRD1促进了Trx1的还原, 调节氧化应激, 还影响了细胞信号转导途径, 如核因子NF-κB、蛋白酪氨酸磷酸酶(PTP)和抗氧化物酶等. TXNRD1具有重要的抗氧化和氧化还原调节作用, 他的mRNA水平是通过AUUUA基序(AU-富含元件AREs)在转录后进行调整的[25-27]. 这里我们克隆并鉴定了947 bp的TXNRD1近端启动子, 其核心启动子GC含量高而缺少TATA和CCAAT盒, 通过实验证明所得到的序列具有很强的启动子活性.
HCV NS3蛋白对细胞信号转导途径, 尤其是血清应答元件(SRE)、激活蛋白1(AP-1)、血清应答因子(SRF)等信号转导途径具有增强作用. Sakamuro et al 研究显示, NS3 cDNA能够使转染的小鼠成纤维细胞NIH 3T3具有转化特性, 且转化细胞移植入裸鼠体内可形成纤维肉瘤灶, 直接证明了HCV NS3蛋白的恶性转化潜能. NS3还可能通过解旋酶活性诱导肝细胞基因组的不稳定性, 甚至发生突变. 另外, NS3能与蛋白激酶A(PKA)催化亚单位特异结合, 可能干扰RNA与细胞内信号转导过程, 严重干扰细胞正常功能. 刘妍 et al[28]研究表明NS3基因重组表达载体在HepG2细胞中表达相应的蛋白, 对SV40早期启动子具有反式激活作用, 从而使SV40启动子下游的CAT基因表达增强. 这些都是HCV NS3通过反式激活作用对于靶细胞中细胞周期调节机制干扰的结果, 说明HCV NS3蛋白的反式激活功能在HCV致病中发挥重要的作用.
我们运用基因表达谱芯片技术进一步研究了NS3蛋白反式激活作用的靶基因, 发现NS3蛋白可上调TXNRD1基因的表达. 为了验证NS3蛋白对TXNRD1的反式激活作用, 根据GenBank中TXNRD1及其启动子的序列, 确定TXNRD1的转录起始点, 选取其上游-1057至-122 bp序列进行克隆, 并构建含报告基因CAT的重组质粒, 结果发现NS3蛋白对TXNRD1的表达确有激活作用, 证实了基因表达谱芯片的结果. 而且TXNRD1的多种功能使得NS3蛋白的功能也变得更加的复杂, 说明了其在宿主细胞内涉及了极其广泛的信号调控过程, 从而参与了HCV的致病(癌)过程, 其中具体的机制尚需要进一步进行详细的研究.
编辑: N/A
| 1. | Thelu MA, Drouet E, Hilleret MN, Zarski JP. Lack of clinical significance of variability in the internal ribosome entry site of hepatitis C virus. J Med Virol. 2004;72:396-405. [PubMed] [DOI] |
| 3. | Lucas M, Vargas-Cuero AL, Lauer GM, Barnes E, Willberg CB, Semmo N, Walker BD, Phillips R, Klenerman P. Pervasive influence of hepatitis C virus on the phenotype of antiviral CD8+ T cells. J Immunol. 2004;172:1744-1753. [PubMed] [DOI] |
| 5. | Wang QC, Nie QH, Feng ZH. RNA interference: antiviral weapon and beyond. World J Gastroenterol. 2003;9:1657-1661. [PubMed] [DOI] |
| 6. | Bahr MJ, el Menuawy M, Boeker KH, Musholt PB, Manns MP, Lichtinghagen R. Cytokine gene polymorphisms and the susceptibility to liver cirrhosis in patients with chronic hepatitis C. Liver Int. 2003;23:420-425. [PubMed] [DOI] |
| 7. | He QQ, Cheng RX, Sun Y, Feng DY, Chen ZC, Zheng H. Hepatocyte transformation and tumor development induced by hepatitis C virus NS3 c-terminal deleted protein. World J Gastroenterol. 2003;9:474-478. [PubMed] [DOI] |
| 8. | Woitas RP, Petersen U, Moshage D, Brackmann HH, Matz B, Sauerbruch T, Spengler U. HCV-specific cytokine induction in monocytes of patients with different outcomes of hepatitis C. World J Gastroenterol. 2002;8:562-566. [PubMed] [DOI] |
| 9. | Zhou HC, Xu DZ, Wang XP, Zhang JX, Huang Y, Yan YP, Zhu Y, Jin BQ. Identification of the epitopes on HCV core protein recognized by HLA-A2 restricted cytotoxic T lymphocytes. World J Gastroenterol. 2001;7:583-586. [PubMed] [DOI] |
| 10. | Sako K, Komorizono Y, Oketani M, Hasegawa S, Yamasaki N, Shibatou T, Maeda M, Kohara K, Shigenobu S, Yasunari H. Outcome of patients with hepatitis C virus-related single, small hepatocellular carcinoma. Anticancer Res. 2003;23:4191-4196. [PubMed] |
| 12. | Tardif KD, Mori K, Siddiqui A. Hepatitis C virus subgenomic replicons induce endoplasmic reticulum stress activating an intracellular signaling pathway. J Virol. 2002;76:7453-7459. [PubMed] [DOI] |
| 13. | 牟 劲松, 刘 妍, 王 刚, 成 军, 段 惠娟, 李 克, 陆 荫英, 王 琳, 王 惠芬. 应用抑制性消减杂交技术克隆丙型肝炎病毒非结构蛋白NS3反式激活的相关基因. 世界华人消化杂志. 2003;11:399-403. [DOI] |
| 16. | 刘 妍, 成 军, 牟 劲松, 陆 荫英, 王 建军, 杨 倩, 王 琳, 张 玲霞. 丙型肝炎病毒非结构蛋白NS3与乙型肝炎病毒X蛋白协同反式激活作用的研究. 解放军医学杂志. 2003;28:47-49. |
| 18. | 纪 冬, 成 军, 王 建军, 刘 妍, 杨 倩, 王 春花, 党 晓燕. 丙型肝炎病毒非结构蛋白NS3反式激活基因1的克隆化研究. 胃肠病学和肝病学杂志. 2003;12:237-240. |
| 19. | 党 晓燕, 成 军, 刘 妍, 邓 红, 杨 倩, 王 建军, 纪 冬, 王 春花. 丙型肝炎病毒非结构蛋白NS3反式激活基因2的克隆化研究. 胃肠病学和肝病学杂志. 2003;12:241-244. |
| 20. | Rundlöf AK, Carlsten M, Arnér ES. The core promoter of human thioredoxin reductase 1: cloning, transcriptional activity, and Oct-1, Sp1, and Sp3 binding reveal a housekeeping-type promoter for the AU-rich element-regulated gene. J Biol Chem. 2001;276:30542-30551. [PubMed] [DOI] |
| 21. | Karimpour S, Lou J, Lin LL, Rene LM, Lagunas L, Ma X, Karra S, Bradbury CM, Markovina S, Goswami PC. Thioredoxin reductase regulates AP-1 activity as well as thioredoxin nuclear localization via active cysteines in response to ionizing radiation. Oncogene. 2002;21:6317-6327. [PubMed] [DOI] |
| 22. | Xia L, Nordman T, Olsson JM, Damdimopoulos A, Björkhem-Bergman L, Nalvarte I, Eriksson LC, Arnér ES, Spyrou G, Björnstedt M. The mammalian cytosolic selenoenzyme thioredoxin reductase reduces ubiquinone. A novel mechanism for defense against oxidative stress. J Biol Chem. 2003;278:2141-2146. [PubMed] [DOI] |
| 23. | Zhang J, Svehlíková V, Bao Y, Howie AF, Beckett GJ, Williamson G. Synergy between sulforaphane and selenium in the induction of thioredoxin reductase 1 requires both transcriptional and translational modulation. Carcinogenesis. 2003;24:497-503. [PubMed] [DOI] |
| 24. | Osborne SA, Tonissen KF. Genomic organisation and alternative splicing of mouse and human thioredoxin reductase 1 genes. BMC Genomics. 2001;2:10. [PubMed] [DOI] |
| 25. | Sakurai A, Yuasa K, Shoji Y, Himeno S, Tsujimoto M, Kunimoto M, Imura N, Hara S. Overexpression of thioredoxin reductase 1 regulates NF-kappa B activation. J Cell Physiol. 2004;198:22-30. [PubMed] [DOI] |
| 26. | Anestål K, Arnér ES. Rapid induction of cell death by selenium-compromised thioredoxin reductase 1 but not by the fully active enzyme containing selenocysteine. J Biol Chem. 2003;278:15966-15972. [PubMed] [DOI] |
| 27. | Ma X, Hu J, Lindner DJ, Kalvakolanu DV. Mutational analysis of human thioredoxin reductase 1. Effects on p53-mediated gene expression and interferon and retinoic acid-induced cell death. J Biol Chem. 2002;277:22460-22468. [PubMed] [DOI] |