修回日期: 2004-03-09
接受日期: 2004-03-24
在线出版日期: 2004-06-15
目的: 探讨肝癌及癌旁组织中MIB-1和bcl-2的表达及意义.
方法: 采用S-P法对40例肝细胞癌及癌旁组织进行MIB-1和bcl-2免疫组化染色, 并作HE染色, 进行肝癌组织学分级(I-IV级, Edmondson-Kondo标准)和癌旁肝细胞结构不良分类(大细胞LCD和小细胞LCD, Anthyony-Watanabe标准).
结果: (1)40例肝细胞癌I级3例, II级20例, III级13例, IV级4例; 癌旁有肝硬化改变者32例, 3例有纤维化, 10例呈气球样变和/或碎屑状坏死病变, 大细胞LCD和小细胞LCD改变者各12例, 上述改变常多种同时混合存在; (2)肝癌组织中MIB-1均呈核阳性, MIB-1平均增生指数为27.61±13.26%, 而癌旁肝细胞阳性者甚少, 增生指数1.24±1.67%, 差异十分显著(P<0.001). 肝癌MIB-1表达与其分级有关, 分化越差, 增生指数越高(P<0.01). 癌旁组织中小细胞性LCD的MIB-1增生指数明显高于大细胞LCD、气球样变和正常肝组织; (3)癌旁bcl-2阳性率为77.5% (31/40), 呈簇状和或片状分布, 癌组织中bcl-2阳性率为17.5% (7/40), 且阳性细胞数较癌旁少得多, 多数呈碎点状; (4)癌组织bcl-2阳性病例的MIB-1增生指数与癌组织bcl-2阴性者的MIB-1增生指数无明显区别.
结论: (1)MIB-1表达可反映肝癌细胞的增生及恶性程度; (2)小细胞LCD中MIB-1高表达提示其比大细胞LCD、气球样变和正常肝组织增生活跃, 发展为癌的可能性大; (3)bcl-2在肝细胞癌变过程中所起的作用可能不是直接引起细胞增生, 而是通过表达水平下降参与肝癌细胞的凋亡调控.
引文著录: 周金莲, 张建中, 赵尔增, 张卫国, 吴继华. MIB-1和bcl-2在肝癌及癌旁组织中的表达. 世界华人消化杂志 2004; 12(6): 1280-1283
Revised: March 9, 2004
Accepted: March 24, 2004
Published online: June 15, 2004
AIM: To investigate the effects of MIB-1 and bcl-2 proteins expression in the primary hepatocellular carcinoma(HCC) and their paracarcinomatous tissues.
METHODS: The expression of MIB-1 and bcl-2 proteins was evaluated in paraffin-embedded tissue by immunohistochemical techniques (S-P) in 40 cases of hepatocellular carcinoma.
RESULTS: The positive expression of MIB-1 was located in nucleus. The mean MIB-1 positive rate in HCCs was 27.61±13.26%, while MIB-1 positive cells in paracarcinomatous tissues were 1.24±1.67% (P < 0.001). The expression of MIB-1 in HCCs was related to the cancer grading, the lower the differentiation of HCCs, the higher the MIB-1 proliferation index (P < 0.01). As for the paracarcinomatous tissues the MIB-1 proliferation index of small liver cell dysplasia (LCD) was higher than that of its adjacent liver tissue. However, in larger cell LCD, the MIB-1 index had no significant difference compared with that of its adjacent tissue. The positive rates of bcl-2 in cancer and paracarcinomatous tissues were 17.5% (7/40) and 77.5% (31/40) respectively. The bcl-2 expression was located in cytoplasm and its positive signals were strong and cluster-like in paracarcinomatous tissues, while the number of the bcl-2 positive cell was sporadic and the signals were weak and "piece-meal like" in HCCs.
CONCLUSION: This study shows that the MIB-1 proliferation index reflects the proliferation speed and the degree of anaplasia in HCCs. The higher expression of MIB-1 in small cell LCD suggests that its proliferation is faster than that of large cell LCD and their adjacent liver tissues, so the small cell LCD is more approximate to HCCs. The study also shows that bcl-2 may not directly play a role in liver cell proliferation during the processes of liver cell carcinogenesis, but it may take part in liver cell apoptosis regulated by the reduction of bcl-2 protein level.
- Citation: Zhou JL, Zhang JZ, Zhao EZ, Zhang WG, Wu JH. Expression of MIB-1 and bcl-2 in hepatocellular carcinoma and paracarcinomatous tissues. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1280-1283
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1280.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1280
近年来, 随着细胞凋亡概念的确立, 人们对肿瘤的发生和发展产生了新的认识. 肿瘤发生不仅与细胞过度增生有关, 也与细胞凋亡减少有关. MIB-1(Ki-67)是检测细胞增生活性的有效客观指标, 能反映肿瘤细胞增生水平和肿瘤分化程度[1-7]. 抗凋亡基因bcl-2是从B淋巴细胞中首先分离出的一种原癌基因, 其产物可抑制淋巴细胞的凋亡过程, 导致肿瘤的发生.现在已知bcl-2在一些非淋巴组织中也发挥类似作用, 被认为是广义的抗凋亡癌基因[8-21]. 本研究采用免疫组织化学方法检测肝癌及癌旁组织中MIB-1及bcl-2蛋白表达, 旨在探讨其与肝细胞癌发生、发展的关系.
自中国人民解放军第306医院病理科档案材料手术切除的肝癌标本40例, 用甲醛固定, 常规组织处理, 石蜡包埋, 4mm厚切片, 全部病例作HE染色. 40例肝癌标本均带有癌旁组织.
MIB-1和bcl-2单克隆抗体及S-P试剂盒系Santa Cruz 公司产品. 切片经常规脱蜡至水后, 3% H2O2处理10 min. 将切片放入盛有0.01 M枸橼酸盐缓冲液(pH 6.0)的容器中, 置微波炉内加热, 温度保持92-98 ℃持续10 min, 室温冷却, PBS洗涤. 第一抗体(MIB-1 1:1 000, bcl-2 1:100) 4 ℃孵育过夜, 然后经S-P试剂盒染色, DAB显色, 苏木素复染, 封片. 用扁桃体组织作阳性对照, 磷酸盐缓冲液(PBS)代替第一抗体作阴性对照.
MIB-1以核内有明显的棕色颗粒为阳性. 每张切片的癌和癌旁组织各随机计数5个高倍镜视野, 每个视野数100个肝癌细胞或肝细胞. 结缔组织细胞和增生的小胆管细胞不计. 切片边缘视野不计, 以排除"边缘效应"的干扰.取5个高倍视野500个细胞的平均MIB-1阳性细胞百分率作为MIB-1指数. 计数癌旁LCD的MIB-1指数时, 从每个病灶中选取典型的高倍镜视野, 共数100或200个细胞, 取平均值. 计算LCD周围正常肝细胞MIB-1阳性率时, 固定计算其右侧一个高倍镜视野不足100个细胞时则以顺时针方向扩大视野.
少于1%细胞着色为阴性(-), 1-50%细胞阳性为弱阳性(+), 50-70%细胞阳性为中度阳性(++), 75%以上细胞阳性为强阳性(+++).
统计学处理 分析肝癌分级与MIB-1阳性率的关系采用Student't检验统计学处理, 以P<0.05为有统计学意义.
40例肝癌按上述Edmondson-Kondo标准进行分级, 结果为: I级3例, II级20例, III级13例, IV级4例. 40例肝癌中癌旁有肝硬化改变者32例, 3例有纤维化, 10例呈气球样变和/或碎屑状坏死病变, 大细胞LCD和小细胞LCD改变者各12例, 上述改变常多种同时混合存在.
40例肝癌组织中MIB-1均呈核阳性, 阳性信号分布于整个细胞核, 各切片中阳性的发生率、分布和染色强度均不一致.
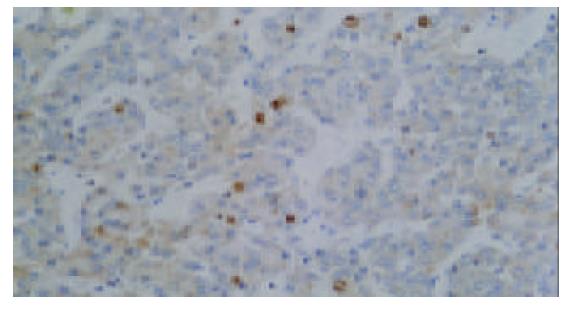
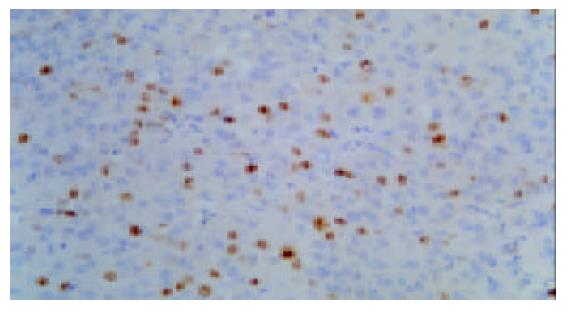
2.2.1 MIB-1指数与肝癌分级的关系: 40例肝癌各级平均MIB-1阳性细胞百分比为: 肝癌I级的MIB-1阳性细胞数占12.1±2.8%, II级为18.6±6.4%(图1), III级为36.8±8.9%(图2), IV级为54.50±20.3%. 将分化较好的肝癌(I级与II级)与分化较差者(III和IV级)进行比较, MIB-1表达有明显的差别, 前者MIB-1指数为17.6±5.25%, 后者为40.9±15.2% (t = 6.052, P<0.01).
2.2.2 癌与癌旁组织MIB-1结果比较: 肝癌组织中MIB-1平均增生指数为27.61±13.26%, 而癌旁肝细胞阳性者甚少, 增生指数1.24±1.67%. 癌组织MIB-1指数与癌旁组织MIB-1指数有非常明显的差异(t = 12.474, P<0.001).
2.2.3 癌旁LCD与其周围正常组织MIB-1表达的比较: 本组标本癌旁组织中小细胞LCD灶和大细胞LCD灶各有12例, 每例的LCD灶数目不等, 共有36个小细胞LCD灶和12个大细胞LCD灶可供分析. 大细胞LCD平均MIB-1指数为0.2±0.17%, 其周围正常肝组织为0.4±0.23%, 二者无显著性差异(P>0.05).小细胞LCD平均MIB-1百分比为2.4±1.89%, 而其周围正常肝组织为1.0±1.24%, 二者有显著性差异(t = 3.917, P<0.05), 显示小细胞LCD的增生较为活跃.
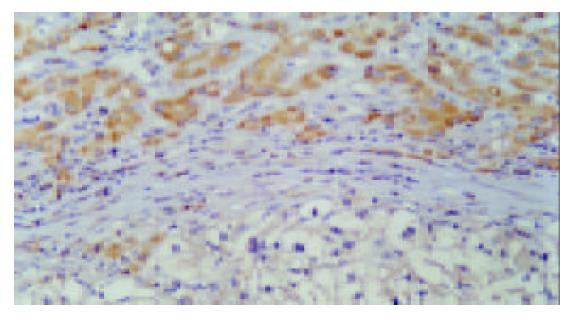
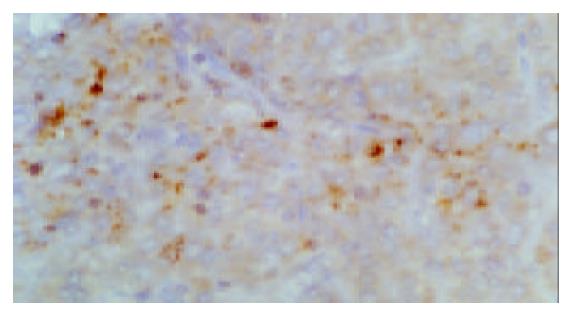
肝癌及癌旁肝组织中bcl-2阳性反应产物主要位于细胞胞质内, 呈棕黄色细颗粒状, 染色强度深浅不一, 分布亦不规则, 无核阳性. 癌旁肝组织中bcl-2阳性信号绝大多数充满细胞质, 染色深, 且阳性细胞呈簇状或大片状分布(图3). 癌组织bcl-2阳性切片中, bcl-2信号稀少, 为碎点状撒落于胞质, 与癌旁阳性表现明显不同(图4). 癌旁肝硬化组织小胆管细胞质阳性, 新生的假胆管强表达. 所有病例中间质淋巴细胞染色阳性. 40例标本中癌旁bcl-2阳性者31例(77.5%), 癌组织中bcl-2阳性者7例(17.5%), 此7例癌旁组织亦阳性, 没有单独癌组织阳性而癌旁阴性者.31例癌旁阳性者, 其中13例轻度阳性, 11例中度阳性, 7例强阳性.而7例癌组织阳性切片中阳性信号均呈轻度阳性反应.统计表明癌组织bcl-2表达低于癌旁组织, 有显著性差异(χ2 = 26.53, P<0.005).
7例bcl-2阳性表达病例由MIB-1代表的细胞增生指数为24.61±6.51%, 33例bcl-2阴性病例由MIB-1代表的细胞增生指数为23.69±4.74%, 两组比较无明显差异(P>0.05).
肿瘤的增生速度一直被认为与肿瘤发展有关. 迄今为止, 有诸多方法被用来检测肿瘤的增生水平. Ki-67是一种敏感而特异的增生细胞标记物, 但其抗体只限于冰冻新鲜标本, 不便推广使用. 单克隆MIB-1抗体同样可以识别Ki-67核抗原, 并适用于石蜡包埋组织, 从而使大量回顾性研究得以实施. MIB-1增生指数是较多被用于衡量细胞增生水平的指标.肿瘤细胞增生水平与肿瘤分化有关[1-7]. 本文结果显示MIB-1指数与肝癌的分级明显相关, 肝癌分化愈差, MIB-1指数愈大, 说明MIB-1可反映肝癌细胞的增生程度和恶性程度, 可作为肝细胞癌恶性程度和分级的标记物.
bcl-2是一种原癌基因, 其编码一个26 kD的蛋白, 定位于细胞内质网膜、线粒体膜和核膜上, 是一种膜定位蛋白, 促进细胞由G1期向S期转化并修复染色体损伤, 或在细胞分化早期通过对抗前凋亡分子bax延长细胞的生存期, 使细胞永生化, 与肿瘤的早期形成有关[8-21]. Nakapoulou et al报道, 肝细胞癌组织低表达bcl-2蛋白, 有时阳性率低于癌旁组织, 与其他多种肿瘤不同, bcl-2 在肝细胞癌细胞凋亡调控中的作用可能具有一定特殊性[9]. 本研究发现, bcl-2在肝癌及癌旁肝组织中均有表达, 癌组织中bcl-2阳性率为17.5%, 与文献[10-11]报道近似, 但其癌旁肝组织bcl-2阳性率高达77.5%.针对免疫组织化学法检测bcl-2蛋白阳性率较低的情况, Fiorentino et al[12]对肝细胞癌组织应用免疫组织化学法检测bcl-2蛋白(阳性率为20.0%)的同时, 使用原位杂交法检测bcl-2基因的mRNA, 其阳性率为65.0%, 说明肝细胞癌的bcl-2蛋白表达水平较低, 但是具有一定水平的bcl-2转录, 这在肝癌发生过程的调控中可能具有一定的意义. 肝细胞癌组织中bcl-2弱阳性表达, 并且有时阳性率低于癌旁组织, 提示在癌形成后分化异常的癌细胞对bcl-2蛋白合成减少即转录后水平下降[25]. 本研究还观察到bcl-2蛋白在肝癌和癌旁组织中信号强弱及形态表现有一定的特殊性, 癌旁阳性信号绝大多数充满细胞质, 染色深, 且阳性细胞呈簇状或大片状分布, 而癌组织阳性切片中, 阳性信号稀少, 为碎点状撒落于胞质中, 与癌旁bcl-2阳性表现有明显不同. 这种量和形态上的不同, 我们认为可能为组织癌变后bcl-2基因发生了突变, 以至分子结构出现变异, 造成bcl-2蛋白表达变化而显示与癌旁者不同. 这一点需作分子水平的抗原分析才能进一步证实.笔者分析MIB-1与Bcl-2的关系, 未发现他们之间有相关性, 提示bcl-2在HCC的发生发展过程中并不直接引起细胞增生, 只是通过阻止细胞凋亡和延长细胞存活, 使细胞数量增多. 细胞增生可能是多种因素作用的结果.
肝细胞肝癌的发病机制尚未明确, 普遍认为HCC的发生是一个多因素、多步骤的演变过程. 越来越多的学者认为, LCD的出现与肝硬变及肝细胞癌等多种肝病的发生发展有关, LCD是HCC 的癌前病变; 小细胞LCD的核浆比值处于正常肝细胞核浆比值和肝癌细胞核浆比值之间, 而大细胞LCD的核浆比值与正常者相同, 故认为作为癌前病变, 小细胞LCD更为重要[26-30]. 本文将小细胞LCD、大细胞LCD、及其旁正常肝细胞的MIB-1指数进行相互比较, 结果发现小细胞LCD的MIB-1指数比大细胞LCD及其旁正常肝细胞的MIB-1指数高, 而大细胞LCD的MIB-1指数与其旁正常肝细胞的MIB-1指数无差异, 说明小细胞LCD的增生活跃, 发展成癌的可能性更大, 此结果支持小细胞LCD更接近癌变的说法.
| 1. | Cattoretti G, Becker MH, Key G, Duchrow M, Schlüter C, Galle J, Gerdes J. Monoclonal antibodies against recombinant parts of the Ki-67 antigen (MIB 1 and MIB 3) detect proliferating cells in microwave-processed formalin-fixed paraffin sections. J Pathol. 1992;168:357-363. [PubMed] [DOI] |
| 2. | Moul JW, Bettencourt MC, Sesterhenn IA, Mostofi FK, McLeod DG, Srivastava S, Bauer JJ. Protein expression of p53, bcl-2, and KI-67 (MIB-1) as prognostic biomarkers in patients with surgically treated, clinically localized prostate cancer. Surgery. 1996;120:159-166; discussion 166-167. [PubMed] [DOI] |
| 3. | Nolte M, Werner M, Nasarek A, Bektas H, von Wasielewski R, Klempnauer J, Georgii A. Expression of proliferation associated antigens and detection of numerical chromosome aberrations in primary human liver tumours: relevance to tumour characteristics and prognosis. J Clin Pathol. 1998;51:47-51. [PubMed] [DOI] |
| 4. | Tiniakos DG, Brunt EM. Proliferating cell nuclear antigen and Ki-67 labeling in hepatocellular nodules: a comparative study. Liver. 1999;19:58-68. [PubMed] [DOI] |
| 5. | Yeh TS, Chen TC, Chen MF. Dedifferentiation of human hepatocellular carcinoma up-regulates telomerase and Ki-67 expression. Arch Surg. 2000;135:1334-1339. [PubMed] [DOI] |
| 6. | Kalogeraki A, Garbagnati F, Santinami M, Zoras O. DNA fragmentation and cell proliferation correlated with tumor grade in patients with hepatocellular carcinoma. Cancer. 2002;96:301-305. [PubMed] [DOI] |
| 8. | Walker C, Robertson L, Myskow M, Dixon G. Expression of the BCL-2 protein in normal and dysplastic bronchial epithelium and in lung carcinomas. Br J Cancer. 1995;72:164-169. [PubMed] [DOI] |
| 9. | Nakopoulou L, Stefanaki K, Vourlakou C, Manolaki N, Gakiopoulou H, Michalopoulos G. Bcl-2 protein expression in acute and chronic hepatitis, cirrhosis and hepatocellular carcinoma. Pathol Res Pract. 1999;195:19-24. [PubMed] [DOI] |
| 10. | Singh BB, Chandler FW Jr, Whitaker SB, Forbes-Nelson AE. Immunohistochemical evaluation of bcl-2 oncoprotein in oral dysplasia and carcinoma. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;85:692-698. [PubMed] [DOI] |
| 12. | Fiorentino M, D'Errico A, Altimari A, Barozzi C, Grigioni WF. High levels of BCL-2 messenger RNA detected by in situ hybridization in human hepatocellular and cholangiocellular carcinomas. Diagn Mol Pathol. 1999;8:189-194. [PubMed] [DOI] |
| 15. | 杨 仕明, 房 殿春, 杨 金亮, 罗 元辉, 鲁 荣, 刘 为纹. hTRT反义基因对胃癌细胞端粒酶及凋亡相关基因表达的影响. 世界华人消化杂志. 2002;10:149-152. [DOI] |
| 19. | Li HL, Chen DD, Li XH, Zhang HW, Lu YQ, Ye CL, Ren XD. Changes of NF-κB, p53, Bcl-2 and caspase in apoptosis induced by JTE-522 in human gastric adenocarcinoma cell line AGS cells: role of reactive oxygen species. World J Gastroenterol. 2002;8:431-435. [PubMed] [DOI] |
| 20. | Cui RT, Cai G, Yin ZB, Cheng Y, Yang QH, Tian T. Transretinoic acid inhibits rats gastric epithelial dysplasia induced by N-methyl-N-nitro-N-nitrosoguanidine: influences on cell apoptosis and expression of its regulatory genes. World J Gastroenterol. 2001;7:394-398. [PubMed] [DOI] |
| 21. | Chiu CT, Yeh TS, Hsu JC, Chen MF. Expression of Bcl-2 family modulated through p53-dependent pathway in human hepatocellular carcinoma. Dig Dis Sci. 2003;48:670-676. [PubMed] [DOI] |
| 22. | EDMONDSON HA, STEINER PE. Primary carcinoma of the liver: a study of 100 cases among 48,900 necropsies. Cancer. 1954;7:462-503. [PubMed] [DOI] |
| 23. | Anthony PP, Vogel CL, Barker LF. Liver cell dysplasia: a premalignant condition. J Clin Pathol. 1973;26:217-223. [PubMed] [DOI] |
| 24. | Watanabe S, Okita K, Harada T, Kodama T, Numa Y, Takemoto T, Takahashi T. Morphologic studies of the liver cell dysplasia. Cancer. 1983;51:2197-2205. [PubMed] [DOI] |
| 25. | Berney CR, Downing SR, Yang JL, Russell PJ, Crowe PJ. Evidence for post-transcriptional down-regulation of the apoptosis-related gene bcl-2 in human colorectal cancer. J Pathol. 2000;191:15-20. [PubMed] [DOI] |
| 28. | Lee RG, Tsamandas AC, Demetris AJ. Large cell change (liver cell dysplasia) and hepatocellular carcinoma in cirrhosis: matched case-control study, pathological analysis, and pathogenetic hypothesis. Hepatology. 1997;26:1415-1422. [PubMed] [DOI] |
| 29. | Szczepański W. Liver cell dysplasia in liver cirrhosis and hepatocellular carcinoma. Pol J Pathol. 1997;48:147-157. [PubMed] |
| 30. | Marchio A, Terris B, Meddeb M, Pineau P, Duverger A, Tiollais P, Bernheim A, Dejean A. Chromosomal abnormalities in liver cell dysplasia detected by comparative genomic hybridisation. Mol Pathol. 2001;54:270-274. [PubMed] [DOI] |