修回日期: 2003-12-09
接受日期: 2003-12-22
在线出版日期: 2004-05-15
目的: 构建幽门螺杆菌vacA毒性片段(v)与hpaA融合基因的原核表达载体, 并诱导表达, 为制备具有治疗与预防作用的疫苗奠定基础.
方法: 通过设计带有编码IL-3N端12个氨基酸引物, 用PCR技术从pQE30-V质粒扩增出有接头的v基因, 克隆至质粒pTrc99A-HpaA中与hpaA融合. 将融合基因插入原核表达载体pQE30, 再将pQE30-V-HpaA转化大肠杆菌DH5a, 经IPTG 诱导表达, SDS-PAGE分析表达结果, Western blotting鉴定其抗原性.
结果: 融合蛋白的相对分子量约为65 000, 能与幽门螺杆菌感染的人阳性血清发生抗原抗体反应.
结论: 重组表达质粒pQE30-V-HpaA表达成功, 为进一步研究其免疫学活性及制备疫苗提供了材料.
引文著录: 刘淼, 杨致邦, 林珊珊, 吴利先. 幽门螺杆菌vacA毒性片段与hpaA融合基因的原核表达. 世界华人消化杂志 2004; 12(5): 1096-1099
Revised: December 9, 2003
Accepted: December 22, 2003
Published online: May 15, 2004
AIM: The prokaryotic expression vector of the fusion gene with v segment of the vacuolating cytotoxin and hpaA of Helicobacter pylori (H. pylori) was constructed and expressed. It would lay a foundation for prophylaxis and therapy of H. pylori infection.
METHODS: By using the primer with a fragment encoding 12 amino acids of N-terminal of human interleukin-3 (IL-3), the vacuolating cytotoxin gene of Hp with linker was amplified from pQE30-V plasmid by PCR. The gene was cloned into plasmid pTrc99A-HpaA and fused with the hpaA gene. The fusion gene was cloned into prokaryotic expression vector pQE30. The recombinant plasmid of pQE30-V-HpaA was transformed into E.coli. DH5a and expressed in the presence of IPTG. The expression product was analyzed by SDS-PAGE, its antigenicity of the expression product was identified by Western blotting.
RESULTS: Mr of recombinant protein was about 65 000 and represented 35% total protein of E.coli. Western blotting showed the recombinant protein could be recognized by the antiserum against H. pylori.
CONCLUSION: The fusion gene and its prokaryotic expression vector pQE30-V-HpaA is constructed and expressed in DH5asuccessfully. It provides the antigen basis for further studying the biological function of fusion protein and obtaining vaccine against the infection of H. pylori.
- Citation: Liu M, Yang ZB, Lin SS, Wu LX. Prokaryotic expression of fusion gene of vacuolating segment of vacA and hpaA in Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1096-1099
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1096.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1096
胃部疾病的发生、复发和幽门螺杆菌(Helicobacter pylori, H. pylori)感染有关[1-19]. 由于H. pylori的感染途径尚未完全明了, 目前尚无阻止感染的有效措施. H. pylori在胃内定植的关键环节是黏附, 由黏附素受体系统介导, 依赖于黏附分子上某些特定的氨基酸位点与胃黏膜细胞上的受体特异性结合. 鞭毛N-乙酰神经胺乳糖结合凝集素是H. pylori的主要定植因子. 编码该因子的基因序列已基本明了, 其中黏附素(Helicobacter pylori adhesin A, HpaA)基因为H. pylori特有, 长783 bp, 较保守, 编码H. pylori与胃黏膜细胞结合的亚单位蛋白, Mr 29 000. 并有良好的免疫原性[20-23]. VacA是H. pylori引起细胞损伤的重要致病物质, 与消化性溃疡及胃癌的细胞病变有关, VacA也具有良好的免疫原性[24-32]. VacA与HpaA均能刺激机体产生保护性免疫, 为此, 我们构建vacA与hpaA融合基因的原核表达载体. 为维持两种抗原各自的空间构象, 融合基因中被加上编码IL-3N端12个氨基酸中间接头序列, 并在E.coli中表达, 以期获得V-HpaA融合蛋白, 为制备既能阻止H. pylori黏附又能中和VacA毒性的集治疗和预防为一体的疫苗提供有效抗原.
E.coliTop10, DH5a菌株和pQE30载体, 为本校病毒性肝炎研究所惠赠, pTrc99A-HpaA质粒(含H. pylori黏附蛋白DNA序列), pQE30-V 质粒(含H. pylori细胞空泡毒素毒性DNA序列)为本室构建、保存. T4 DNA连接酶和Sal1, BamH1, NcoⅠ, EcoRⅠ购自宝生物公司, Pfu酶为MBI公司产品. dNTP为上海生工生物工程公司产品. DNA marker为MBI公司售品, 蛋白质marker为医科院售品, 质粒提取试剂盒、胶回收试剂盒等为上海华舜公司售品, PCR纯化试剂盒为Omega公司售品.
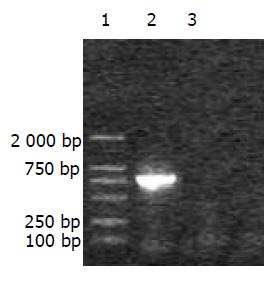
1.2.1 H. pylori v基因的PCR扩增: 用引物设计软件premier 5.0设计v基因引物, 由上海博亚生物公司合成. 配制为20 mM 贮存液.引物序列是: 上游引物引入NcoⅠ切点, 即5'-CGACCATGGATGCATTATTGGGTCAAA G-3'. 下游引物去掉终止密码子, 引入IL-3 5'端36nt及EcoRⅠ酶切位点. 即: 5'-ATGAATTCCAGGAGCAGGACGGGCAGGCGGCTCATGTTTGGATCGTTACTATCTTGTTT-3'. 以pQE30-V 质粒为模版, 反应体系共50 mL, 条件为: 94 ℃ 5 min, 94 ℃ 50 s, 57 ℃ 45 s, 72 ℃ 60 s, 72 ℃ 7 min, 共35个循环.取4 mL PCR产物10 g/L琼脂糖电泳, 在紫外灯下切下约为750 bp大小含DNA的胶块, 回收产物.
1.2.2 重组载体pTrc99A-HpaA-V的构建: 纯化的PCR产物v基因和pTrc99A-HpaA质粒分别以NcoⅠ和EcoRⅠ双酶切, 并用PCR纯化试剂盒进行纯化, 将酶切纯化的目的基因和载体pTrc99A-HpaA按6:1(浓度比)进行连接. 反应体系20 mL, 16 ℃连接2 h. 连接产物用CaCl2法转化至大肠杆菌Top10, 氨苄青霉素抗性及质粒少量抽提电泳筛选, 酶切鉴定, 得到阳性重组子pTrc99A-HpaA-V.
1.2.3 融合基因v-hpaA PCR扩增: 以pTrc99A-HpaA-V为模版扩增融合基因v-hpaA. 引物序列是: 上游引物引入BamHI酶切位点, 即5'CCGGATCCATGCATTATTGGGTCAAAGG-3'. 下游引物引入SalI 酶切位点, 即5'CGGTCGACTTCTTATGCGTTATTTGT-3'.反应体系共50mL, 条件为: 94 ℃ 5 min, 94 ℃ 50 s, 53 ℃ 50 s, 72 ℃ 90 s, 72 ℃ 7 min, 共35个循环. 取PCR产物4 mL进行10 g/L琼脂糖电泳, 在紫外灯下切下约为1 550 bp大小含DNA的胶块. 回收产物.
1.2.4 重组载体pQE30-V-HpaA构建: 纯化的V-HpaA PCR产物和pQE30分别以BamH1和Sal1双酶切, 并用PCR纯化试剂盒进行纯化, 酶切纯化的目的基因和载体pQE30按6:1(浓度比)进行连接. 反应体系20 mL, 16 ℃ 2 h. 连接产物用CaCl2法转化至大肠杆菌DH5a表达, 氨苄青霉素抗性及质粒少量抽提电泳筛选, 酶切鉴定, 得到阳性重组子. 将鉴定后的重组质粒送上海博亚生物有限公司进行测序. 以酶切鉴定的重组载体转化E.coli DH5a, 随后挑选含重组载体的单个菌落接种于盛有LB培养基的6支试管(含氨苄青霉素100 mg/L)中, 与DH5a/ pQE-30菌一起.于37 ℃培养至A600 = 0.4-0.6时, 加入终浓度分别为0.5 mmoL/L的IPTG, 诱导表达4 h, 以10 000 r/min离心2 min. 收集菌体, 加入蛋白上样缓冲液煮沸5 min, 然后120 g/L SDS-PAGE电泳鉴定.
1.2.5 Western blotting 检测重组蛋白的抗原性: 将诱导菌的全菌做120 g/L SDS-PAGE. 使凝胶靠近阴性一侧, NC膜靠近阳性一侧, 在150V条件下转移2 h, 电转移后, 取出NC膜, 用PBS洗涤4次, 每次5 min, 加封闭液, 室温封闭非特异性位点, 洗膜同前述. 然后, 依次加上H. pylori全菌抗血清, 37 ℃作用2 h, 同法洗膜. 再加HRP标记的羊抗人二抗, 37 ℃作用2 h, 洗膜. 最后, 将NC膜浸泡于DAB显色剂中10-15 min, 再用双蒸水冲洗, 以终止染色.
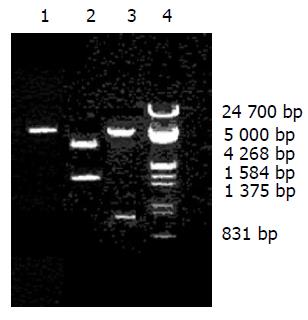
v基因的PCR产物经10 g/L琼脂糖电泳, 在750bp有一条带, 大小与预想一致(图1). 重组质粒pTrc99A-V-HpaA与pTrc99A-HpaA用NcoⅠ和EcoRⅠ双酶切后, 经10 g/L琼脂糖电泳, 可见pTrc99A-V-HpaA被切下750 bp左右的一条带, 大小与预想一致(图2).
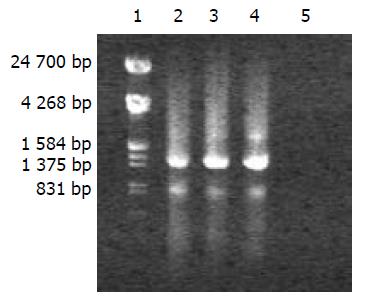
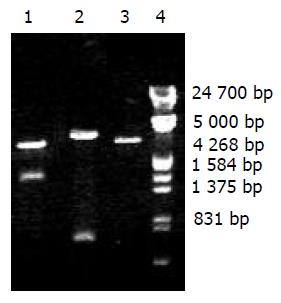
v-hpaA的PCR产物经10 g/L琼脂糖电泳, 在1 548 bp有一条带, 大小与预想一致(图3). 重组质粒pQE30-V-HpaA与pQE30用BamHI和SalI双酶切后, 经10 g/L琼脂糖电泳, 可见pQE30-V-HpaA被切下1 548 bp的一条带, 大小与预想一致(图4 ).
利用通用引物对重组质粒进行测序分析, 所得hpaA , v和接头序列均完整, 在同一ORF内, 无突变, 与预期一致.
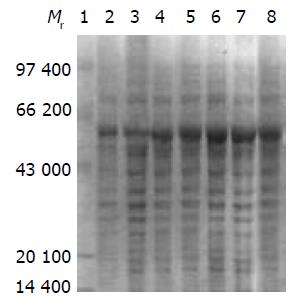
将鉴定正确的重组质粒pQE30-V-HpaA转化至大肠杆菌DH5a, 经IPTG诱导表达, IPTG 的浓度为0.5 mmoL/L, 诱导4 h, 全菌蛋白SDS-PAGE图谱如图5, 薄层扫描分析表明, 目的蛋白表达量为35%以上(图5). 将以12%SDS-PAGE分离的重组菌电转移到NC膜上, 依次加上H. pylori全菌抗血清和HRP标记的羊抗人二抗, 显色后出现一条和预期大小一致的带(图6).
如果一种蛋白能够包括H. pylori的两种或多种有效抗原成分, 其刺激机体将会产生多重免疫保护性反应, 有利于防治H. pylori的感染[33-35]. 为了实现这个目的, 我们构建了融合基因, 进而表达融合蛋白. 朱森林et al利用减毒活鼠伤寒沙门菌能表达异种抗原, 在哺乳动物中经口、鼻、直肠和阴道黏膜途径免疫能诱导强大而特异的免疫反应的, 将载有hpaA基因的重组表达质粒导入减毒鼠伤寒沙门菌SL3216, 构建成表达HpaA重组减毒鼠沙门疫苗菌, 发现HpaA能在疫苗中以二聚体形式稳定表达, 表达量为全菌体蛋白的17%, 并证实具有免疫原性[36-39]. 研究表明, vacA基因和HpaA基因的原核表达产物均有免疫原性, 并在治疗和预防H. pylori感染中起到良好作用. 我们将vacA的毒性片段v和HpaA基因连接, 表达融合蛋白, 若不影响免疫原性, 制备抗VacA和HpaA抗体, 将既能中和已感染的H. pylori产生的VacA, 使其不引起细胞病变, 又能阻止H. pylori在胃内定植, 防止H. pylori的再感染, 起到预防和治疗作用. 此类融合蛋白和疫苗, 尚未见报道.
由于融合蛋白作为一个整体, 其一级结构已经改变, 而一级结构是决定蛋白质空间构象的基础. 因此融合蛋白就有可能具有与单独的蛋白不同的空间构象, 从而影响各组分蛋白各自功能的发挥. 一般认为以接头连接可以比直接连接融合蛋白减少上述影响. 我们构建HpaA-V融合蛋白的原核表达载体, 中间加上IL-3N端的接头12个氨基酸, 期望HpaA与V互不干扰而形成各自的天然构象, 从而同时获得具有两种抗原特性的重组蛋白, 达到预期的效果.
我们表达的融合蛋白必须具有单独HpaA与VacA免疫原性, 才能使机体产生针对HpaA与VacA的免疫, 成为制备疫苗的有效抗原. Western blotting分析表明, 表达的蛋白能与H. pylori阳性血清反应, 有良好的抗原性, 但是否同时具有HpaA与VacA二者的免疫原性尚需进一步鉴定.
| 1. | Vandenplas Y. Helicobacter pylori infection. World J Gastroenterol. 2000;6:20-31. [PubMed] [DOI] |
| 10. | Xue FB, Xu YY, Wan Y, Pan BR, Ren J, Fan DM. Association of H. pylori infection with gastric carcinoma: a Meta analysis. World J Gastroenterol. 2001;7:801-804. [PubMed] [DOI] |
| 15. | Wang RT, Wang T, Chen K, Wang JY, Zhang JP, Lin SR, Zhu YM, Zhang WM, Cao YX, Zhu CW. Helicobacter pylori infection and gastric cancer: evidence from a retrospective cohort study and nested case-control study in China. World J Gastroenterol. 2002;8:1103-1107. [PubMed] [DOI] |
| 16. | Hu GY, Yu BP, Dong WG, Li MQ, Yu JP, Luo HS, Rang ZX. Expression of TFF2 and Helicobacter pylori infection in carcinogenesis of gastric mucosa. World J Gastroenterol. 2003;9:910-914. [PubMed] [DOI] |
| 18. | Mitani K, Tatsuta M, Iishi H, Yano H, Uedo N, Iseki K, Narahara H. Helicobacter pylori infection as a risk factor for gastric ulceration. Hepatogastroenterology. 2004;51:309-312. [PubMed] |
| 20. | Mao YF, Yan J, Li LW, Li SP. Construction of hpaA gene from a clinical isolate of Helicobacter pylori and identification of fusion protein. World J Gastroenterol. 2003;9:1529-1536. [PubMed] [DOI] |
| 21. | 毛 亚飞, 严 杰, 李 立伟. 幽门螺杆菌临床菌株HpaA基因的克隆和表达及鉴定. 浙江大学学报(医学版). 2003;32:9-12. |
| 22. | Voland P, Hafsi N, Zeitner M, Laforsch S, Wagner H, Prinz C. Antigenic properties of HpaA and Omp18, two outer membrane proteins of Helicobacter pylori. Infect Immun. 2003;71:3837-3843. [PubMed] [DOI] |
| 23. | Lundstrom A, Bolin I, Bystrom M, Nystrom S. Recombinant HpaA purified from Escherichia coli has biological properties similar to those of native Helicobacter pylori HpaA. APMIS. 2003;111:389-397. [PubMed] [DOI] |
| 24. | 王 虹, 高 建萍, 金 秀芬, 何 伟, 周 磊, 赵 子仪, 李 泽民. 胃十二指肠疾病对Hp cagA, vacA基因产物的体液免疫应答. 世界华人消化杂志. 2001;9:504-507. [DOI] |
| 26. | 徐 克强, 张 万岱, 王 继德, 李 子旭, 周 殿元, 张 亚历, 黄 文峰, 姜 泊, 孙 勇. 幽门螺杆菌细胞毒素促进胃黏膜分泌白介素8作用. 世界华人消化杂志. 2002;10:907-911. [DOI] |
| 28. | Müller I, Medina-Selby A, Palacios JL, Martinez P, Opazo P, Bruce E, Mancilla M, Valenzuela P, Yudelevich A, Venegas A. Cloning and comparison of ten gene sequences of a Chilean H. pylori strain with other H. pylori strains revealed higher variability for VacA and CagA virulence factors. Biol Res. 2002;35:67-84. [PubMed] [DOI] |
| 29. | Pessina A, Bayo M, Croera C, Meringolo F, Neri MG, Montesissa L, Raimondi A. In vitro sensitivity of human gastric cancer cells (HGC-27) to Helicobacter pylori cytotoxin. Scand J Gastroenterol. 2003;38:1228-1234. [PubMed] [DOI] |
| 30. | Tabel G, Hoa NT, Tarnawski A, Chen J, Domek M, Ma TY. Helicobacter pylori infection inhibits healing of the wounded duodenal epithelium in vitro. J Lab Clin Med. 2003;142:421-430. [PubMed] [DOI] |
| 31. | Willhite DC, Blanke SR. Helicobacter pylori vacuolating cytotoxin enters cells, localizes to the mitochondria, and induces mitochondrial membrane permeability changes correlated to toxin channel activity. Cell Microbiol. 2004;6:143-154. [PubMed] [DOI] |
| 32. | Boncristiano M, Paccani SR, Barone S, Ulivieri C, Patrussi L, Ilver D, Amedei A, D'Elios MM, Telford JL, Baldari CT. The Helicobacter pylori vacuolating toxin inhibits T cell activation by two independent mechanisms. J Exp Med. 2003;198:1887-1897. [PubMed] [DOI] |
| 34. | Jiang Z, Tao XH, Huang AL, Wang PL. A study of recombinant protective H.pylori antigens. World J Gastroenterol. 2002;8:308-311. [PubMed] |
| 35. | Lehours P, Ménard A, Dupouy S, Bergey B, Richy F, Zerbib F, Ruskoné-Fourmestraux A, Delchier JC, Mégraud F. Evaluation of the association of nine Helicobacter pylori virulence factors with strains involved in low-grade gastric mucosa-associated lymphoid tissue lymphoma. Infect Immun. 2004;72:880-888. [PubMed] [DOI] |