修回日期: 2003-10-25
接受日期: 2003-11-19
在线出版日期: 2004-03-15
目的: 研究四氯化碳(CCl4)诱导肝纤维化大鼠肝脏转化生长因子β1(TGFβ1)及其Ⅰ, Ⅱ型受体(TGFR)、Smad3、Smad7的定位及表达.
方法: 将24只大鼠随机分为正常对照组与模型组, 模型组大鼠予以40%四氯化碳皮下注射8 wk后处死. RT-PCR检测肝组织TGFβ1, TGFRⅠ与TGFRⅡ; 免疫组化技术检测TGFβ1, Smad3, Smad7在肝脏的表达及细胞内的定位; 放射免疫方法检测透明质酸, 肝组织病理检查.
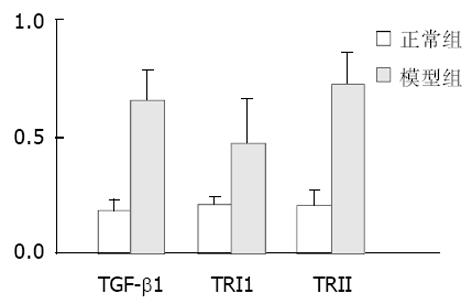
结果: 与正常组大鼠比较, RT-PCR显示模型组大鼠肝内TGFβ1、TGFRⅠ与TGFRⅡ mRNA表达明显增高; 免疫组化结果显示TGFβ1与Smad3 表达增加, 而Smad7的表达降低, TGFβ1与Smad3的免疫阳性反应信号主要位于纤维间隔中的细胞质, Smad7主要在肝细胞质表达(正常组与模型组大鼠TGFβ1、Smad、Smad7平均光度分别0.61±0.33与1.57±0.53, 0.248±0.042与0.785±0.904, 4.674±1.143与0.470±0.097, P<0.05; 模型组大鼠血清透明质酸水平明显增高(正常组大鼠78.4±19.2 g/L, 模型组263.2±107.0 g/L, P<0.01), 肝组织HE染色支持肝纤维化改变.
结论: 肝内TGFβ1, TGFRⅠ, TGFRⅡ, Smad3表达增强, Smad7表达减弱, 提示TGFβ1及其受体与Smad信号通道蛋白参与了肝纤维化的发生发展, 可作为防治肝纤维化发生发展的新途径之一.
引文著录: 宋仕玲, 龚作炯, 张全荣. 实验性大鼠肝纤维化TGFβ1及其受体mRNA 与Smad3, 7的表达. 世界华人消化杂志 2004; 12(3): 676-679
Revised: October 25, 2003
Accepted: November 19, 2003
Published online: March 15, 2004
AIM: To investigate the expression of TGFβ1, TGFRⅠ,TGFR Ⅱ, Smad3, Smad7 in fibrotic liver induced by the exposure of carbon tetrachloride (CCl4) in rats.
METHODS: A total of 24 Wistar rats were randomly allocated into two study groups: normal group and model group-CCl4 rats. The latter group was administered with CCl4 solution to induce liver fibrosis. All the rats were killed after 8 wks. The level of TGFβ1, TGFR Ⅰand TGFRⅡmRNA were examined by RT-PCR. The expression of TGF-1, Smad3 and Smad7 were detected by immunohistochemical staining in liver tissue. The serum hyalauronic acid (HA) and the liver histopathology were also examined by RIA and HE staining respectively.
RESULTS: In comparison with the normal group, TGFβ1, TGFR Ⅰ and TGFRⅡmRNA were significantly increased in model rats, the expression of TGF-1 and Smad3 was increased and the expression of Smad7 was decreased in livers of the model group (TGF-1, Smad3 and Smad7 in normal and model group were 0.61±0.33 vs 1.57±0.53, 0.248±0.042 vs 0.785±0.904, 4.674±1.143 vs 0.470±0.097 respectively, P < 0.05). The content of serum HA was increased in model rats (HA in normal and model group was(78.4±19.2 g/L) vs (263.2±107.0) g/L, P < 0.01). The histological changes of fibrosis were also remarkable.
CONCLUSION: TGFβ1/TGF receptors /Smad signaling involve the formation and development of liver fibrosis. The TGFβ1 /Smad signal pathway plays key roles in liver fibrogensis. It may be a new pathway for the treatment of liver fibrosis.
- Citation: Song SL, Gong ZJ, Zhang QR. Expression of TGFβ1 and its receptors, Smad3 andSmad7 in rats with experimental liver fibrosis. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 676-679
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/676.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.676
转化生长因子1(transforming growth factor 1, TGF-1)是致肝纤维化的最重要的细胞因子[1-5], 具有促进肝脏细胞外基质(extracellular matrix, ECM)合成与沉积作用[6-8]. TGF-1通过其Ⅰ, Ⅱ型受体(transforming growth factor receptor, TR)以及细胞内Smad信号通道蛋白发挥作用, 以四氯化碳(CCl4)诱导大鼠肝纤维化, 并观察TGF-1及其受体和胞内Smad信号通道蛋白的变化, 探讨TGF-1及其受体与信号通道蛋白Smad之间的相互关系以及各自在肝纤维化中的可能作用机制.
CCl4分析纯购自武汉亚法生物技术有限公司, 以食用色拉油配制成400 mL/L溶液; Catrimox-14TM RNA提取试剂盒, Random primer, Ribonaclease inhibitor, Reverse transcriptase(AMV), Taq DNA多聚酶, Marker等均为Takara公司产品; Genbank检索引物序列, 委托大连Takara公司合成(表1). 抗TGF-1mAb购自北京中山生物技术有限公司; 抗Smad3, 抗Smad7多克隆抗体购自美国Santa Cruza公司; 链霉素抗生物素蛋白-过氧化酶免疫染色试剂盒购自福州迈新生物技术开发公司; 透明质酸(hyaluronic acid, HA)试剂盒购自上海海军医学研究所. 清洁级Wistar大鼠24只, 由武汉大学人民医院实验动物中心提供, 质量200±20 g, 雌雄各半. CCl4肝纤维化大鼠模型制作参照Wang et al[1]方法略加改进. 大鼠随机分为2组: A组为正常对照组12只, B组为肝纤维化模型组12只. A组予以生理盐水3 mL/kg sc, B组按3 mL/kg sc 400 mL/L CCl4, 2次/wk. 所有大鼠于第8 wk处死, 处死前称体重. 摘眼球采血, 分离血清-20 ℃冰箱保存. 断颈椎, 剖腹取1 cm×1 cm×1 cm肝左叶组织1块10%中性甲醛固定, 其余肝左叶组织-70 ℃冰箱保存.
| 名称 | 引物 | 序列 | 扩增长度(bp) |
| TGFβ1 | 正义序列 | 5'-CACCATCCATGACATGAACC-3' | 404 |
| 反义序列 | 5'-TCATGTTGGACAACTGCTCC-3' | ||
| TGF receptor I | 正义序列 | 5'-ATGGACTCAGCTGTGGTTGG-3' | 501 |
| 反义序列 | 5'-TCAACGGATGGATCAGAAGG-3' | ||
| TGF receptor II | 正义序列 | 5'-CTACAAGGCCAAGCTGAAGC-3' | 580 |
| 反义序列 | 5'-AGCCATGGAGTAGACATCCG-3' | ||
| GAPDH | 正义序列 | 5'-TCCCTCAACATTGTCAGCAA-3' | 309 |
| 反义序列 | 5'-AGCTCCACAACGGATACATT-3' |
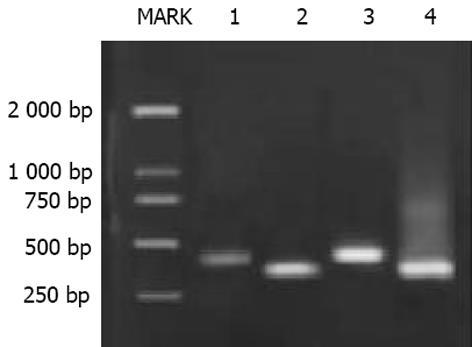
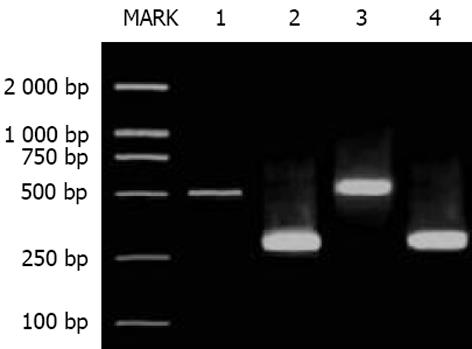
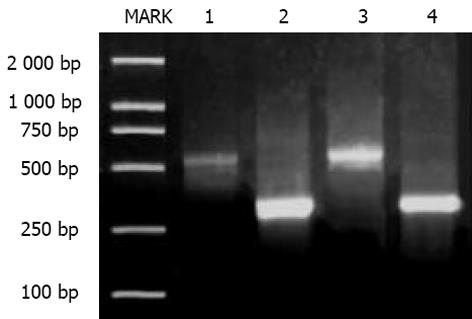
大鼠肝脏TGF-1, TRⅠ与TRⅡ mRNA的RT-PCR分析 总RNA提取参照试剂盒说明书进行, 每样本取1 g 总RNA作逆转录模板合成cDNA. 循环温度与时间为: 94 ℃ 3 min; 94 ℃ 1 min, 54 ℃ 1 min, 72 ℃ 1 min, 共30个循环; 72 ℃ 10 min. 产物经20 g/L琼脂糖凝胶电泳和溴化乙腚显色, 采用HPIAS-2000型图像分析系统测定平均光度, 各指标平均光度与内参照GAPDH的比值代表其mRNA相对水平. 大鼠肝脏TGF-1, Smad3与Smad7免疫组织化学采用SP法检测, 具体操作参照说明书进行. PBS缓冲液代替一抗作阴性对照. 阳性组织呈棕色, 阴性组织呈蓝色. 在全自动图像分析系统上, 采用HPIAS-2000型图像分析软件进行定量分析, 随机选取每张切片10个视野(×400倍)测定阳性细胞占面积及平均光度, 乘积值越大表明组织中该抗原含量越多. 放射免疫分析法检测血清HA含量, 由专业人员按说明操作. 常规HE染色光镜下观察肝组织病理学改变. 肝纤维化病理学分级参照《肝纤维化诊断及诊疗评估共识》[2].
统计学处理 用SPSS统计软件(11.5版)进行统计分析, 计量资料以mean±SD表示, 并进行组间t检验. 等级资料采用R×C表资料的x2检验.
TGF-1, TRⅠ与TRⅡmRNA的表达: 半定量分析显示, B组肝脏TGF-1、TRⅠ与TRⅡ mRNA比A组表达明显增高, 二者之间差异有显著性(P<0.05, 图1-4). TGFβ1、Smad3及Smad7的表达 A组: Smad3在正常肝细胞内几乎无表达, 在汇管区基质及间质细胞内Smad3可见少量表达, TGFβ1在上述部位以及肝窦间隙表达较明显. Smad7在肝细胞内表达十分明显, 部分肝细胞核膜也有表达, 在汇管区及Disse间隙内少量表达; B组: 大鼠肝内TGFβ1与Smad3表达明显增强, 主要见于纤维化汇管区及纤维间隔里的梭状细胞类间质细胞中, TGFβ1表达最为明显, 在近纤维间隔的肝血窦也有梭形细胞阳性着色, 但在肝细胞内无明显表达. 本组肝组织内Smad7表达极少, 阳性颗粒集中在少数肝细胞及纤维间隔内的梭状细胞内, 阳性细胞着色淡, 纤维间隔中的Smad7表达较正常组增多. 三种物质阳性表达均位于细胞质与少量胞膜. 各组阴性对照未见阳性表达, 证实免疫组化检测结果具有特异性. 半定量分析表明, B组肝内TGFβ1及Smad3含量明显高于A组, 而Smad7在A组肝内含量高于B组, 两组间分别比较差异有显著性(P<0.05, 表2). 纤维化模型组大鼠血清HA(263.2±107.0 g/L)明显高于正常对照组(78.4±19.2 g/L)(P<0.01). A组肝脏肝小叶结构正常, 肝细胞索排列规则有序, 未见变性、坏死, 肝窦与汇管区成纤维细胞少; B组正常肝小叶结构紊乱, 肝细胞索排列紊乱, 肝细胞肿胀、坏死, 可见嗜酸性小体, 间质中有炎性细胞浸润, 坏死区及汇管区纤维结缔组织增生形成细小的条索, 纤维宽窄不一, 呈星芒状向肝小叶内延伸. 肝纤维化分期: A组(全为0)与B组(2, 3, 4期分别为2, 7, 1例)之间病理学分期差异有非常显著性(P<0.01).
TGF-在肝内异常表达可导致各种肝病的发生[6], 在诱导肝星状细胞(hepatic stellate cells, HSC)转化为肌成纤维细胞(myofibroblast, MFB)的致肝纤维化过程中作用更显著[7-9]; TGF-可抑制肝细胞再生, 诱导肝细胞凋亡[10-11]; TGF-在转录与翻译水平上促进肝脏胶原、纤维连接蛋白等合成, 同时抑制等多种水解酶的合成与分泌, 增加TIMP等蛋白酶抑制剂的表达, 具有拮抗ECM降解, 促使肝内结缔组织增多的作用[12]. TGF-1是TGF-超家族中对ECM合成与沉积失调而导致组织纤维化最重要的调节因子, 多种器官纤维化、硬化、动脉粥样硬化都与之相关[13-16]. TGF-必须活化并与其效应细胞上的受体结合才能发挥作用[17], 他首先在细胞外与TRⅢ形成复合物, 将TGF-传递给TRⅡ, 或TGF-直接与TRⅡ结合, 随后活性TRⅡ的蛋白激酶使Ⅰ型受体磷酸化, 后者直接使TGF-的信号通道蛋白Smad2、3 MH2结构域的SSXS基序磷酸化, 与Smad4形成异源寡聚体复合物, 该复合物转移到胞核调节相应靶基因转录, 在细胞水平介导TGF-的生物学效应[18-20]. 抑制型Smad6, 7是细胞中TRⅠ型受体丝氨酸/苏氨酸激酶的拮抗蛋白[3], 能牢固的与TRⅠ型受体结合, 抑制Smad2, 3磷酸化, 完全阻断TGF-的信号转导[21], 抑制活化Smad复合物在核内移动, 减少Ⅰ型胶原合成, 在TGF-信号转导中构成负反馈调节环路.
HSC与成纤维细胞内在自分泌与旁分泌的TGF不断刺激下, HSC活化并转化为MFB, 促进胶原合成增生[22], 两种细胞内TRⅠ和TRⅡ表达都明显增高[23]. 我们发现, 与正常组大鼠相比, 肝纤维化大鼠肝内TGFβ1 及其Ⅰ, Ⅱ型受体mRNA高表达, 说明CCl4具有刺激TGF分泌增加, 同时也诱导TRⅠ和TRⅡ表达的作用, TGF通过与不同受体结合发挥生理病理作用. 免疫组化结果显示, 肝纤维化大鼠肝内TGFβ1及Smad3表达明显增高, 主要分布在纤维间隔、汇管区的不规则细胞胞质内, 肝细胞内无明显表达, 表明TGF通过激活TRⅠ后, 结合Smad3等下游分子, 作用于肝脏非实质细胞, 刺激胶原合成; 也说明Smad3与TGF在纤维化肝脏的表达模式相似, 都在肝纤维化时表达上调. 研究证实[24], 活化的HSC中Ⅰ型胶原的大量表达需要Smad3参与; 同时发现在正常大鼠肝内Smad7表达明显, 主要位于肝细胞内, 说明在生理状态时, Smad7主要存在于数量众多的肝细胞内, 对维持肝脏生理平衡状态有重要意义. 有研究发现TGF-可快速诱导静止期HSC中 Smad7和α2(Ⅰ)型胶原mRNA的表达, 由HSC转化的MFB失去TGF-诱导下的Smad7表达上调敏感性, 而Smad2, 3表达有增加[22,25-26]. 我们亦发现, 与正常肝脏相比较, 纤维化肝脏的肝细胞内Smad7表达明显减少, 而在肝间质细胞内表达增多, 可能与纤维化时, 聚集在纤维组织中的活化HSC中大量分泌TGF-诱导Smad7表达有关, 故Smad7表达显著部位随着疾病出现而相应改变. 在Smad7的低水平表达时, Smad2、Smad3磷酸化作用增加, 使TGF-与TR1持续激活, 刺激HSC不断增生、合成分泌ECM, 并不断激活周围静止的HSC活化并转化为MFB, 是TGF-致肝纤维化作用的主要原因[3,27].
本研究表明, TGF-, TR1, TRⅡ及其细胞内信号分子在肝纤维化形成发展中作用显著, 可针对TGF-产生、与受体结合、以及下游Smad分子等活化的各个阶段采取相应对策, 阻断其生物和活性, 抑制HSC活化, 从而拮抗肝纤维化[28-30]. 已经有研究证实[31], 可溶性TRⅡ(soluble TGF-beta type II receptor , STR)对四氯化碳诱导的小鼠肝纤维化模型具抑制TGF-和拮抗纤维化作用, STR降低Ⅰ型胶原mRNA含量, 并具有明显的剂量依赖性. 对单侧肾小管阻塞大鼠采用转基因Smad7治疗, 可增加Smad7表达, 完全抑制Smad2, 3活性, 明显减少Ⅰ, Ⅱ型胶原mRNA及蛋白表达[32]. 封闭TGF-/Smad信号通路, 采用腺病毒电穿孔基因转导Smad7注射入肾纤维化大鼠体内, 免疫组化检测发现肾髓质中有明显的Smad7沉积, 并显著抑制肾纤维化发生[33]. 由于在机体多组织多细胞都有TGF-及其受体参与发挥生理作用, 长期完全阻断TGF-以治疗肝纤维化必须考虑安全性问题.
编辑: N/A
| 1. | Wang YQ, Ikeda K, Ikebe T, Hirakawa K, Sowa M, Nakatani K, Kawada N, Kaneda K. Inhibition of hepatic stellate cell proliferation and activation by the semisynthetic analogue of fumagillin TNP-470 in rats. Hepatology. 2000;32:980-989. [PubMed] |
| 3. | Tahashi Y, Matsuzaki K, Date M, Yoshida K, Furukawa F, Sugano Y, Matsushita M, Himeno Y, Inagaki Y, Inoue K. Differential regulation of TGF-beta signal in hepatic stellate cells between acute and chronic rat liver injury. Hepatology. 2002;35:49-61. [PubMed] |
| 4. | Chang JK, Chuang LY, Ho ML, Wang GJ. Effects of nonsteroidal anti-inflammatory drugs on transforming growth factor-beta expression and bioactivity in rat osteoblast-enriched culture. Kaohsiung J Med Sci. 2003;19:278-288. [PubMed] |
| 5. | Fortunel NO, Hatzfeld JA, Monier MN, Hatzfeld A. Control of hematopoietic stem/progenitor cell fate by transforming growth factor-beta. Oncol Res. 2003;13:445-453. [PubMed] |
| 6. | 许 君望, 龚 均, 冯 新利, 苌 新明, 罗 金燕, 董 蕾, 贾 皑, 徐 贵平. 雌二醇对肝纤维化大鼠I, III型胶原及TGF beta1表达的影响. 世界华人消化杂志. 2003;11:1185-1188. [DOI] |
| 7. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] |
| 10. | Schuster N, Krieglstein K. Mechanisms of TGF-beta-mediated apoptosis. Cell Tissue Res. 2002;307:1-14. [PubMed] |
| 11. | Si XH, Yang LJ. Extraction and purification of TGFbeta and its effect on the induction of apoptosis of hepatocytes. World J Gastroenterol. 2001;7:527-531. [PubMed] |
| 12. | Dooley S, Delvoux B, Streckert M, Bonzel L, Stopa M, ten Dijke P, Gressner AM. Transforming growth factor beta signal transduction in hepatic stellate cells via Smad2/3 phosphorylation, a pathway that is abrogated during in vitro progression to myofibroblasts. TGFbeta signal transduction during transdifferentiation of hepatic stellate cells. FEBS Lett. 2001;502:4-10. [PubMed] |
| 13. | Xiong LJ, Zhu JF, Luo DD, Zen LL, Cai SQ. Effects of pentoxifylline on the hepatic content of TGF-beta1 and collagen in Schistosomiasis japonica mice with liver fibrosis. World J Gastroenterol. 2003;9:152-154. [PubMed] |
| 14. | Jones SE, Kelly DJ, Cox AJ, Zhang Y, Gow RM, Gilbert RE. Mast cell infiltration and chemokine expression in progressive renal disease. Kidney Int. 2003;64:906-913. [PubMed] |
| 15. | Yu L, Border WA, Huang Y, Noble NA. TGF-beta isoforms in renal fibrogenesis. Kidney Int. 2003;64:844-856. [PubMed] |
| 16. | Wen FQ, Kohyama T, Sköld CM, Zhu YK, Liu X, Romberger DJ, Stoner J, Rennard SI. Glucocorticoids modulate TGF-beta production by human fetal lung fibroblasts. Inflammation. 2003;27:9-19. [PubMed] |
| 17. | Lu JP, Mao JQ, Li MS, Lu SL, Hu XQ, Zhu SN, Nomura S. In situ detection of TGF betas, TGF beta receptor II mRNA and telomerase activity in rat cholangiocarcinogenesis. World J Gastroenterol. 2003;9:590-594. [PubMed] |
| 18. | Blobe GC, Schiemann WP, Pepin MC, Beauchemin M, Moustakas A, Lodish HF, O'Connor-McCourt MD. Functional roles for the cytoplasmic domain of the type III transforming growth factor beta receptor in regulating transforming growth factor beta signaling. J Biol Chem. 2001;276:24627-24637. [PubMed] |
| 19. | Fortuno ES 3rd, LeSueur JA, Graff JM. The amino terminus of Smads permits transcriptional specificity. Dev Biol. 2001;230:110-124. [PubMed] |
| 20. | Calabrese F, Valente M, Giacometti C, Pettenazzo E, Benvegnu L, Alberti A, Gatta A, Pontisso P. Parenchymal transforming growth factor beta-1: its type II receptor and Smad signaling pathway correlate with inflammation and fibrosis in chronic liver disease of viral etiology. J Gastroenterol Hepatol. 2003;18:1302-1308. [PubMed] |
| 21. | Mori Y, Chen SJ, Varga J. Expression and regulation of intracellular SMAD signaling in scleroderma skin fibroblasts. Arthritis Rheum. 2003;48:1964-1978. [PubMed] |
| 22. | Inagaki Y, Mamura M, Kanamaru Y, Greenwel P, Nemoto T, Takehara K, Ten Dijke P, Nakao A. Constitutive phosphorylation and nuclear localization of Smad3 are correlated with increased collagen gene transcription in activated hepatic stellate cells. J Cell Physiol. 2001;187:117-123. [PubMed] |
| 23. | Roberts AB, Russo A, Felici A, Flanders KC. Smad3: a key player in pathogenetic mechanisms dependent on TGF-beta. Ann N Y Acad Sci. 2003;995:1-10. [PubMed] |
| 24. | Liu C, Gaça MD, Swenson ES, Vellucci VF, Reiss M, Wells RG. Smads 2 and 3 are differentially activated by transforming growth factor-beta (TGF-beta) in quiescent and activated hepatic stellate cells. Constitutive nuclear localization of Smads in activated cells is TGF-beta-independent. J Biol Chem. 2003;278:11721-11728. [PubMed] |
| 25. | Schnabl B, Kweon YO, Frederick JP, Wang XF, Rippe RA, Brenner DA. The role of Smad3 in mediating mouse hepatic stellate cell activation. Hepatology. 2001;34:89-100. [PubMed] |
| 26. | Dooley S, Hamzavi J, Breitkopf K, Wiercinska E, Said HM, Lorenzen J, Ten Dijke P, Gressner AM. Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats. Gastroenterology. 2003;125:178-191. [PubMed] |
| 27. | Liu YK, Shen W. Inhibitive effect of cordyceps sinensis on experimental hepatic fibrosis and its possible mechanism. World J Gastroenterol. 2003;9:529-533. [PubMed] |
| 28. | Liu XJ, Yang L, Mao YQ, Wang Q, Huang MH, Wang YP, Wu HB. Effects of the tyrosine protein kinase inhibitor genistein on the proliferation, activation of cultured rat hepatic stellate cells. World J Gastroenterol. 2002;8:739-745. [PubMed] |
| 29. | García L, Hernández I, Sandoval A, Salazar A, Garcia J, Vera J, Grijalva G, Muriel P, Margolin S, Armendariz-Borunda J. Pirfenidone effectively reverses experimental liver fibrosis. J Hepatol. 2002;37:797-805. [PubMed] |
| 30. | Lin JS, Song YH, Kong XJ, Li B, Liu NZ, Wu XL, Jin YX. Preparation and identification of anti-transforming growth factor beta1 U1 small nuclear RNA chimeric ribozyme in vitro. World J Gastroenterol. 2003;9:572-577. [PubMed] |
| 31. | Yata Y, Gotwals P, Koteliansky V, Rockey DC. Dose-dependent inhibition of hepatic fibrosis in mice by a TGF-beta soluble receptor: implications for antifibrotic therapy. Hepatology. 2002;35:1022-1030. [PubMed] |
| 32. | Lan HY, Mu W, Tomita N, Huang XR, Li JH, Zhu HJ, Morishita R, Johnson RJ. Inhibition of renal fibrosis by gene transfer of inducible Smad7 using ultrasound-microbubble system in rat UUO model. J Am Soc Nephrol. 2003;14:1535-1548. [PubMed] |
| 33. | Terada Y, Hanada S, Nakao A, Kuwahara M, Sasaki S, Marumo F. Gene transfer of Smad7 using electroporation of adenovirus prevents renal fibrosis in post-obstructed kidney. Kidney Int. 2002;61:S94-S98. [PubMed] |