修回日期: 2003-08-25
接受日期: 2003-09-18
在线出版日期: 2004-02-15
目的: 建立一种富集胃癌患者外周血中癌细胞的有效方法.
方法: 先将不同浓度胃癌MGC-803细胞加入到健康人外周血中, 再用淋巴细胞分离液收集单核细胞, 然后等分成3份, 并用3种方法处理-A方法, 用CD45磁珠去除白细胞; B方法, 用Ber-EP4磁珠富集癌细胞; C方法, 先后使用上述2磁珠. 最后用定量RT-PCR检测看家基因β2微球蛋白(β2MG)mRNA的量. 同法检测30例胃癌患者外周血.
结果: β2MG mRNA扩增曲线的交叉点(crossing point, Cp)数值与癌细胞数间有良好的负相关(方法A, P<0.05, 方法B或C, P<0.01). 方法C检测到的Cp值为3种方法中最大的; 其灵敏度为1 mL血中含有1个癌细胞. 用A、B和C方法检测30例胃癌患者外周血癌细胞的阳性率分别为70.00%, 60.00%和36.57%(C与A比较, χ2 = 5.79, P<0.05; C与B比较, χ2 = 4.92, P<0.05).
结论: 在检测胃癌患者外周血癌细胞的实验中, 联用阴性和阳性免疫磁珠可减少来自外周血白细胞的污染.
引文著录: 陈健, 郭俊明, 金之瑾, 肖丙秀. 3种富集胃癌患者外周血中胃癌细胞方法的比较. 世界华人消化杂志 2004; 12(2): 461-464
Revised: August 25, 2003
Accepted: September 18, 2003
Published online: February 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 461-464
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/461.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.461
现代肿瘤学认为, 实体恶性肿瘤的血道转移是一相对早期事件[1]. 在外周血中发现瘤细胞的患者应采取有效的监测措施. 胃癌是人类最常见的恶性肿瘤之一, 建立检测外周血胃癌细胞的有效方法显得非常必要. 免疫磁珠技术是近年来发展起来的一种新技术, 已被应用于肿瘤学领域中[2-4]. 为建立一种较为理想的富集外周血实体瘤细胞的方法, 本研究比较了采用阴性、阳性免疫磁珠和联用2磁珠富集胃癌患者外周血癌细胞的情况.
胃癌30例取自2002-08/2003-03在宁波大学医学院附属医院的住院患者, 均经病理确诊. 男19例, 女11例, 年龄65±12岁. 临床分期: Ⅰ期3例, Ⅱ期6例, Ⅲ期8例和Ⅳ期13例. 人胃黏膜腺癌细胞系MGC-803购自中国科学院上海细胞库. RPMI-1640培养液为美国Gibco BRL公司产品. 小牛血清为杭州四季青公司产品. 抗人CD45免疫磁珠和抗人Ber-EP4免疫磁珠分别购自宁波新芝生物科技股份有限公司和挪威Dynal公司. RNeasy Mini RNA 提取试剂盒和SYBR Green一步法逆转录-PCR (reverse transcriptase-polymerase chain reaction, RT-PCR) 试剂盒均由德国Qiagen公司生产. LightCycler 荧光定量PCR仪由德国Roche公司生产.
1.2.1 胃癌细胞稀释实验: MGC-803细胞置于含100 mL/L小牛血清的RPMI-1640培养液中, 37℃、50 mL/L CO2培养. 细胞用0.5 g/L EDTA消化后准确计数. 用磷酸盐缓冲液(PBS)将细胞稀释后加入到健康人血中, 使每毫升含癌细胞数分别为1×104, 1×103, 1×102, 1×101, 1.
1.2.2 单核细胞分离: 取患者外周血或上述制备的含胃癌细胞的血液4 mL, EDTA抗凝. 用等体积Hank's液稀释, 然后用淋巴细胞分离液分离单核细胞(mononuclear cells, MNC).
1.2.3 实验方法分类: 获得的MNC等分成3份, 分别进行处理: (1)A方法(阴性磁珠法): 加入25 μL(1×107)抗人CD45免疫磁珠, 室温下混匀30 min. 在磁场中吸取上清, 1 000 r/min室温下离心5 min, 收集细胞. (2)B方法(阳性磁珠法): 加入25 μL (1×107)上皮细胞特异性的抗人Ber-EP4免疫磁珠, 混匀30 min (4 ℃). 在磁场中放置3 min(4 ℃), 弃上清. 加800 μL PBS清洗磁珠5次. (3)C方法(联用阴性和阳性磁珠法): 先后使用CD45磁珠和Ber-EP4磁珠. 然后常规制作细胞涂片和HE染色. 按照Mattsson et al[5]报道的方法, 细胞结合3个及以上的磁珠为阳性.
1.2.4 总RNA提取: 按RNeasy Mini RNA 提取试剂盒说明书提取.
1.2.5 引物: 扩增看家基因β2微球蛋白(β2 mircoglobulin, β2MG)mRNA 的引物序列为: ACCCCCACTGAAAAAGATGA (正义链) 和ATCTTCAAACCTCCATAGTG (反义链) [6].
1.2.6 荧光定量RT-PCR 用SYBR Green一步法RT-PCR 试剂盒在LightCycler 荧光定量PCR仪上进行. 20 μL反应体积中含有2 μL RT-PCR反应混合物, 引物10 pmol, RNA 8 μL. 逆转录反应在50 ℃进行20 min, 随后95 ℃保温15 min. PCR反应的参数为: 94 ℃15 s, 50 ℃ 25 s, 72 ℃ 20 s, 共40个循环. β2MG mRNA的定量以扩增曲线的交叉点(crossing point, Cp)的数值来表示. 产物特异性经解链曲线分析确定.
统计学处理 应用SPSS(10.0)统计学软件对结果进行分析. 通过计算相关系数r来确定Cp值与细胞数的关系, 阳性率比较采用χ2检验. 以P<0.05有统计学意义.
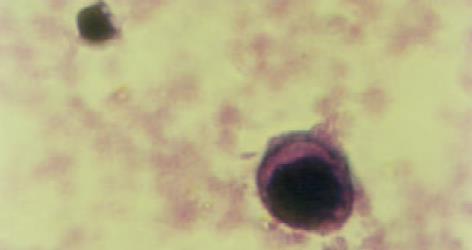
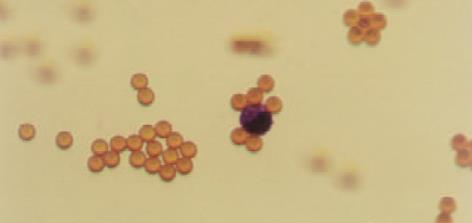
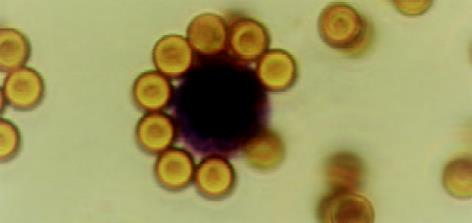
健康人血中加入MGC-803细胞, 经阴性磁珠筛选去除了绝大多数白细胞, 保留了癌细胞和少量白细胞(图1). 用阳性筛选和联用阴、阳性磁珠富集的癌细胞与磁珠呈玫瑰花样结合(图2, 3). 中间直径大者为胃癌细胞, 其余为白细胞.
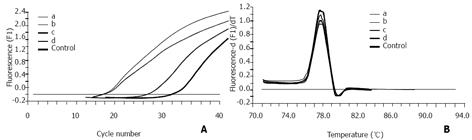
MGC-803细胞加入到正常人外周血中, 经3种方法富集癌细胞, 然后用RT-PCR检测β2MG mRNA的量(图4A). 经解链曲线分析各方法扩增产物的Tm值一致, 并与阳性对照的Tm值吻合(图4B). 说明RT-PCR的特异性好. 阴性对照均未见扩增, 表明无污染(图4). β2MG mRNA的Cp值与细胞数成负相关(A方法, r = 0.848, P<0.05; B方法, r = 0.988, P<0.01; C方法, r = 0.959, P<0.01; 表1). 在含相等癌细胞的血液中, C方法的Cp值均大于A和B方法的Cp值, 其灵敏度为每mL血含1个癌细胞(表1).
由于细胞数与Cp值呈负相关(表1), 故以各方法的最低检测灵敏度的Cp值作为阳性结果判断的临界值. 30例胃癌患者的结果显示, A、B和C方法的阳性率分别为70.00%、60.00%和36.67%. C与A比较, χ2 = 5.79, P<0.05; C与B比较, χ2 = 4.92, P<0.05. C方法阳性病例与病期的关系为: Ⅰ期0.00% (0/3), Ⅱ期33.33%(2/6), Ⅲ期37.50%(3/8), Ⅳ46.15%(6/13).
外周血肿瘤微转移的检测对于治疗方案的选择具有重要意义, 而瘤细胞的富集可提高RT-PCR、免疫组织化学、端粒酶活性分析和流式细胞术等分析肿瘤细胞方法的灵敏度和特异度[2,7-8]. 免疫磁珠可应用于富集外周血、淋巴结、胸腹水、尿液等中的癌细胞, 可分为阳性筛选和阴性筛选[4]. 对于上皮性肿瘤来说, Ber-EP4磁珠和CD45磁珠分别为阳性磁珠和阴性磁珠[4,7,9].
根据荧光定量RT-PCR的原理, 扩增曲线的Cp值与被检测mRNA的拷贝数呈负相关, 可以代表mRNA的拷贝数[10]. 有多项研究认为β2MG是最合适的参照基因[11-13]. 定量检测β2MG mRNA已成功用于微量残留白血病的监测中[11]. 本研究的胃癌微转移的模型实验结果显示, β2MG mRNA扩增曲线的Cp值与细胞数间有良好的相关性, 尤其是联用2类磁珠时相关性更好(表1). 荧光定量RT-PCR在封闭的毛细管中进行, 无需扩增后的产物分析(如: 电泳), 可避免产物对反应的污染; 实验结果通过Cp值来反映, 不受循环数的影响.
使用免疫磁珠富集外周血中的肿瘤细胞时, 有可能存在一定数目的血细胞的污染. de Cremoux et al[7]报道, 大约有100个白细胞的污染. 本研究结果显示, 在正常人外周血中混入胃癌细胞后, 用联用磁珠方法检测到的β2MG mRNA的Cp值明显比相应的单用阳性或阴性磁珠测出的值大(表1); 涂片镜检也发现阴性筛选后仍可见少数白细胞(图1). 这说明单用免疫磁珠有白细胞的污染. Ikeguchi et al[14]以细胞角蛋白20 mRNA作为胃癌细胞的分子标志, 发现癌细胞的阳性率为33.3%. 此结果明显低于本实验单独使用一种磁珠的结果. 提示单独使用一种免疫磁珠会造成白细胞的污染. 因外周血微转移的检测对于肝癌[15-17]、胃癌[18]和肠癌[19-20]等的诊断、判断转移和指导预后等有较大的临床意义, 所以, 本文报道的方法对进一步提高实体瘤血道微转移检测水平可能有较大的应用价值.
编辑: N/A
| 1. | Heiss MM, Allgayer H, Gruetzner KU, Funke I, Babic R, Jauch KW, Schildberg FW. Individual development and uPA-receptor expression of disseminated tumour cells in bone marrow: a reference to early systemic disease in solid cancer. Nat Med. 1995;1:1035-1039. [PubMed] [DOI] |
| 2. | Nakamura T, Yasumura T, Hayashi K, Eguchi R, Ide H, Takasaki K, Kasajima T. Immunocytochemical detection of circulating esophageal carcinoma cells by immunomagnetic separation. Anticancer Res. 2000;20:4739-4744. [PubMed] |
| 3. | Denis MG, Lipart C, Leborgne J, LeHur PA, Galmiche JP, Denis M, Ruud E, Truchaud A, Lustenberger P. Detection of disseminated tumor cells in peripheral blood of colorectal cancer patients. Int J Cancer. 1997;74:540-544. [DOI] |
| 4. | Zigeuner RE, Riesenberg R, Pohla H, Hofstetter A, Oberneder R. Immunomagnetic cell enrichment detects more disseminated cancer cells than immunocytochemistry in vitro. J Urol. 2000;164:1834-1837. [PubMed] [DOI] |
| 5. | Mattsson L, Bondjers G, Wiklund O. Isolation of populations from arterial tissue, using monoclonal antibodies and magnetic microspheres. Atherosclerosis. 1991;89:25-34. [DOI] |
| 6. | Burchill SA, Bradbury MF, Pittman K, Southgate J, Smith B, Selby P. Detection of epithelial cancer cells in peripheral blood by reverse transcriptase-polymerase chain reaction. Br J Cancer. 1995;71:278-281. [PubMed] [DOI] |
| 7. | de Cremoux P, Extra JM, Denis MG, Pierga JY, Bourstyn E, Nos C, Clough KB, Boudou E, Martin EC, Müller A. Detection of MUC1-expressing mammary carcinoma cells in the peripheral blood of breast cancer patients by real-time polymerase chain reaction. Clin Cancer Res. 2000;6:3117-3122. [PubMed] |
| 8. | Soria JC, Gauthier LR, Raymond E, Granotier C, Morat L, Armand JP, Boussin FD, Sabatier L. Molecular detection of telomerase-positive circulating epithelial cells in metastatic breast cancer patients. Clin Cancer Res. 1999;5:971-975. [PubMed] |
| 9. | Iinuma H, Okinaga K, Adachi M, Suda K, Sekine T, Sakagawa K, Baba Y, Tamura J, Kumagai H, Ida A. Detection of tumor cells in blood using CD45 magnetic cell separation followed by nested mutant allele-specific amplification of p53 and K-ras genes in patients with colorectal cancer. Int J Cancer. 2000;89:337-344. [PubMed] [DOI] |
| 10. | Emig M, Saussele S, Wittor H, Weisser A, Reiter A, Willer A, Berger U, Hehlmann R, Cross NC, Hochhaus A. Accurate and rapid analysis of residual disease in patients with CML using specific fluorescent hybridization probes for real time quantitative RT-PCR. Leukemia. 1999;13:1825-1832. [PubMed] [DOI] |
| 11. | Degan M, Mazzocco FT, Di Francia R, Rossi FM, Pinto A, Gattei V. Normalizing complementary DNA by quantitative reverse transcriptase-polymerase chain reaction of beta2-microglobulin: molecular monitoring of minimal residual disease in acute promyelocytic leukemia. Diagn Mol Pathol. 2000;9:98-109. [PubMed] [DOI] |
| 12. | Lupberger J, Kreuzer KA, Baskaynak G, Peters UR, le Coutre P, Schmidt CA. Quantitative analysis of beta-actin, beta-2-microglobulin and porphobilinogen deaminase mRNA and their comparison as control transcripts for RT-PCR. Mol Cell Probes. 2002;16:25-30. [PubMed] [DOI] |
| 13. | Schmittgen TD, Zakrajsek BA. Effect of experiment treatment on housekeeping gene expression: validation by real-time, quantitative RT-PCR. J Biochem Biophys Methods. 2000;46:69-81. [DOI] |
| 14. | Ikeguchi M, Ohro S, Maeda Y, Fukuda K, Yamaguchi K, Shirai H, Kondo A, Tsujitani S, Kaibara N. Detection of cancer cells in the peripheral blood of gastric cancer patients. Int J Mol Med. 2003;11:217-221. [PubMed] [DOI] |