修回日期: 2003-08-10
接受日期: 2003-09-24
在线出版日期: 2004-02-15
目的: 采用多对型特异性引物, 通过巢式PCR法检测湖南省乙肝患者血清中乙型肝炎病毒(HBV)基因型的分布情况.
方法: 根据从前S1基因到S基因中的保守序列设计出10条内外引物, 并将其中8条内引物分成A、B两组, 分别扩增A、B、C和D、E、F型HBV, 然后将第2轮PCR的两组产物分别用3%琼脂糖进行电泳, 根据PCR产物片断大小直接判定HBV基因型. 与目前常用的PCR-RFLP法进行了比较, 并做重复试验以证实该方法的可靠性和准确性. 用此法检测了220例湖南籍慢性乙肝血清中的HBV基因型, 以了解湖南人群的HBV基因型分布情况.
结果: 多对型特异性引物巢式PCR与PCR-RFLP法的检测结果完全一致, 重现率(100%); 湖南人群HBV基因分型结果为B型190例(86.4%)、C型30例(13.6%).
结论: 这种新的巢式PCR分型法能清晰直观地辨别HBV基因型, 结果准确可靠. 用此法证实了湖南人群的HBV优势基因型以B型为主, C型次之.
引文著录: 温志立, 谭德明. 多对型特异性引物巢式PCR检测湖南省乙肝病毒基因型. 世界华人消化杂志 2004; 12(2): 332-335
Revised: August 10, 2003
Accepted: September 24, 2003
Published online: February 15, 2004
AIM: To determine the genotypes of hepatitis B virus (HBV) in Hunan Province of China by nested PCR with multiplex pairs of genotype-specific primers.
METHODS: Ten outer and inner primers were designed on the basis of the conserved nature of nuleotide sequences in regions of the Pre-S1 through S genes, in which 8 inner primers were devided into mix A and B to amplify HBV of genotype A, B, C and D, E, F respectively. The two different products from one sample in second-round PCR were separately electrophoresed on a 3% agarose gel. Genotypes of HBV were determined directly by the size of PCR products. To test its reliability and veracity, we compared new nested PCR with popular PCR-RFLP, followed by repeated experiments. This nested PCR was also used in the genotyping of HBVs in 220 Hunan patients with chronic hepatitis B to know the distribution of HBV genotype in Hunan Province of China.
RESULTS: The results showed complete concordence between the two assays and 100% recurrence in the repeated experiments. Of the 220 Hunan patients, 190 (86.4%) were genotype B and 30 (13.6%) were genotype C.
CONCLUSION: This new nested PCR can help to determine HBV genotypes clearly and directly with reliable and accurate results. With the application of this new method, the predominant HBV genotypes in Hunan are confirmed to be genotypes B and C.
- Citation: Wen ZL, Tan DM. Detection for genotypes of hepatitis B virus in Hunan Province of China by nested PCR with multiplex pairs of primers. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 332-335
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/332.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.332
乙型肝炎病毒(HBV)是引起慢性肝炎的最常见病毒之一, [1-12] 目前全世界至少有3.5亿慢性乙肝患者[13-16]. HBV具有环状双链DNA结构, 3.2 kb长的基因组中含有4个开放读码框架. 根据HBV基因序列的差异可将其分为A-F六种基因型. HBV的基因型具有明显的地理分布特点, 如A型主要在北欧和非洲, B型和C型主要在东亚, D型在中东、北非和南欧, E型在非洲, F型仅在南美[17]. 近年研究发现HBV基因型的类别与HBV传播方式、临床疾病谱、预后判断及抗病毒治疗的选择都有一定的相关性. 目前诊断HBV基因型的方法有全基因分析[18]或S基因测序法[19]、聚合酶链反应(PCR)法[20-21]、聚合酶链反应-限制性片段长度多态性(PCR-RFLP)法[22-27]、微板核酸杂交ELISA法[28-29]等. 在大规模检测方面, PCR因为具有简单快速的特点而使用普遍, 而巢式PCR使检测的特异性又进一步增高. 我们利用巢式PCR这一特性, 并采用多对型特异性引物同时进行扩增, 通过PCR产物片断的大小直接判定HBV基因型. 该法简捷快速, 准确性和特异性都很高, 便于大批量标本的检测. 用此法检测了湖南省HBV基因型的分布情况, 结果如下.
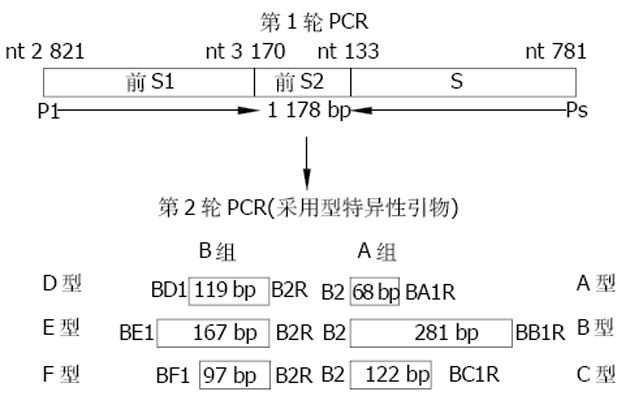
PCR扩增仪(美国SABC公司); 高速冷冻离心机(美国Beckman公司, 型号GS-15R); 稳压稳流电泳仪和紫外分析仪均为上海Tanon公司产品, 型号分别为EPS-300和UV-2000; 血清DNA抽提所用试剂盒购自上海申友公司; dNTP、PCR缓冲液、超纯型Taq Plus多聚酶、Marker(DGL2000)、琼脂糖均为北京鼎国公司产品; 引物由上海申友公司合成; 限制型内切酶StyI和BsrI分别为日本TaKaRa公司和美国MBI公司产品; 所用水均为已灭菌的二次蒸馏水(DDW). 2002-06/2003-03中南大学湘雅医院传染科门诊和住院部的湖南籍慢性乙肝血清, 经传染科检验室荧光PCR鉴定HBV-DNA为阳性者220例. 引物设计参照文献[30], 根据从前S1基因到S基因中的保守序列设计出10条引物(外引物2条, 内引物8条), 包含6种基因型在内. 每条内引物均具有型特异性, 同时还能使每种基因型最终PCR产物的片段大小各不相同, 以便通过琼脂糖电泳能辨别出来(表1).
| 引物 | 序列(位点, 特异性, 方向) |
| 第1轮PCR(外引物) | |
| P1 | 5'-TCA CCA TAT TCT TGG GAA CAA GA-3'(nt 2821-2843, 通用, 正义) |
| Ps | 5'-AGA TGT TGT ACA GAC TTG G-3'(nt 763-781, 通用, 反义) |
| 第2轮PCR(内引物) | |
| A组 | |
| B2 | 5'-GGC TCC AGT TCA GGA ACA GT-3'(nt 65-84, A-E型特异, 正义) |
| BA1R | 5'-CTC GCG GAG ATT GAC GAG ATG T-3' (nt 111-132, A型特异, 反义) |
| BB1R | 5'-CAG GTT GGT GAG TGA CTG GAG A-3'(nt 322-343, B型特异, 反义) |
| BC1R | 5'-GGT CCT AGG AAT CCT GAT GTT G-3'(nt163-184, C型特异, 反义) |
| B组 | |
| BD1 | 5'-GCC AAC AAG GTA GGA GCT-3'(nt 2977-2994, D型特异, 正义) |
| BE1 | 5'-CAC CAG AAA TCC AGA TTG GGA CCA-3'(nt2953-2976, E型特异, 正义) |
| BF1 | 5'-GCT ACG GTC CAG GGT TAC CA-3'(nt 3030-3049, F型特异, 正义) |
| B2R | 5'-GGA GGC GGA TCT GCT GGC AA-3'(nt 3076-3095, D-F型特异, 反义) |
血清DNA提取按照试剂盒说明书进行, 采用浓缩裂解法, 略改动, 即取浓缩液50 μL到0.5 mL离心管中, 再加入待测血清50 μL, 振荡混匀后静置2 min, 8 000 r/min离心5 min, 弃上清. 加入裂解液10 μL, 剧烈振荡至无沉淀后短暂离心, 沸水浴10 min, 14 000 r/min离心15 min, 取上清液2 μL做多对型特异性引物巢式PCR(图1), PCR按Naito et al[30]方法进行, 稍作改动. 首先用一对外引物(P1、Ps)进行第1轮PCR, 在0.5 mL离心管中依次加入P1(50 pmol/μL)1 μL、Ps(50 pmol/μL) 1 μL、dNTP(10 mmol/L) 1 μL、Taq聚合酶(2 u/μL) 1 μL、10碢CR缓冲液(含20 mM Mg2+) 5 μL、血清DNA提取物2 μL, 加DDW至50 μL, 混匀后加40 μL石蜡油覆盖液面. 扩增条件为94 ℃预变性5 min, 94 ℃变性60 s, 55 ℃退火45 s, 72 ℃延伸90 s, 30个循环后72 ℃再延伸5 min. 然后分别以A组(B2、BA1R、BB1R、BC1R)和B组 (B2R、BD1、BE1、BF1)为内引物进行第2轮PCR, 分别检测A-C型和D-F型HBV, PCR反应体系中除引物外的其余成分同第1轮. 扩增条件为95 ℃预变性10 min, 94 ℃变性20 s, 58 ℃退火20 s, 72 ℃延伸30 s, 40个循环后72 ℃再延伸10 min. 最后将两组PCR产物分别在3%琼脂糖中进行电泳, 同时加入低分子量Marker, 通过产物片断的大小来判断基因型. 随机选取30份已用多对型特异性引物巢式PCR鉴定基因型的血清, 再用目前常用的PCR-RFLP法检测这些血清中HBV的基因型, 方法参照文献[26]. 由于我国的HBV基因型以B、C、D型为主, 故只选取其中检测B-D三型的方法进行检测. 用引物对YS1(nt205-223, 5'-GCG GGG TTT TTC TTG TTG A-3')和YS2(nt769-789, 5'-GGG ACT CAA GAT GTT GTA CAG-3')扩增出585 bp大小的S基因片段, 限制性内切酶StyI和BsrI分别仅在C型第456位和B型第329位有酶切位点, S基因片段分别被切成252 bp, 333 bp和125 bp, 460 bp两个片段, 可区别B、C两型. 用引物对YP1(nt 2 820-2 841, 5'-CAC CAT ATT CTT GGG AAC AAG A-3')及YP2(nt 3 024-3 042, 5'- GCC CGA ATG CTC CCA CTC C-3')扩增前S1基因片段, 非D基因型长度为223 bp, D基因型由于在nt 2 852后(即前S1启始密码子ATG之后)连续缺失33个碱基, 只有190 bp大小, 可以此鉴定D基因型. 随机选取30份已用多对型特异性引物巢式PCR鉴定过基因型的血清样品, 再次采用此种巢式PCR法进行检测, 以了解该方法的重现性和准确性.
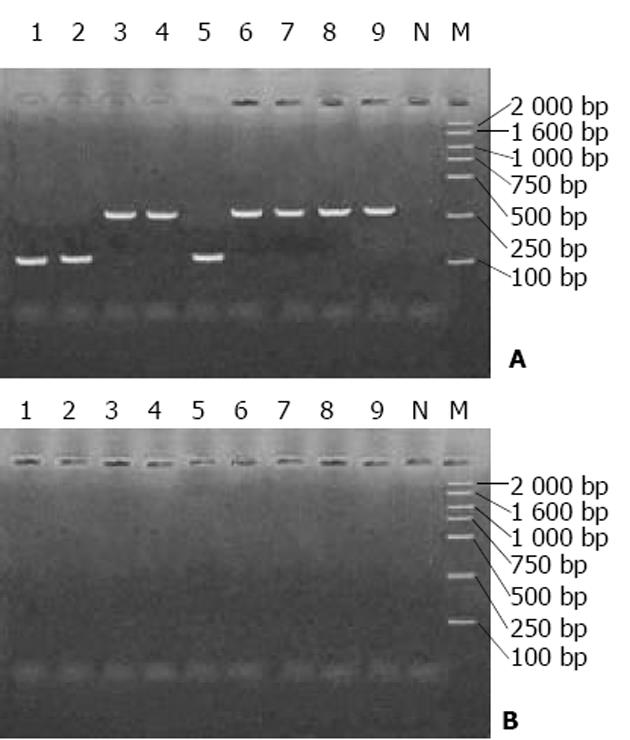
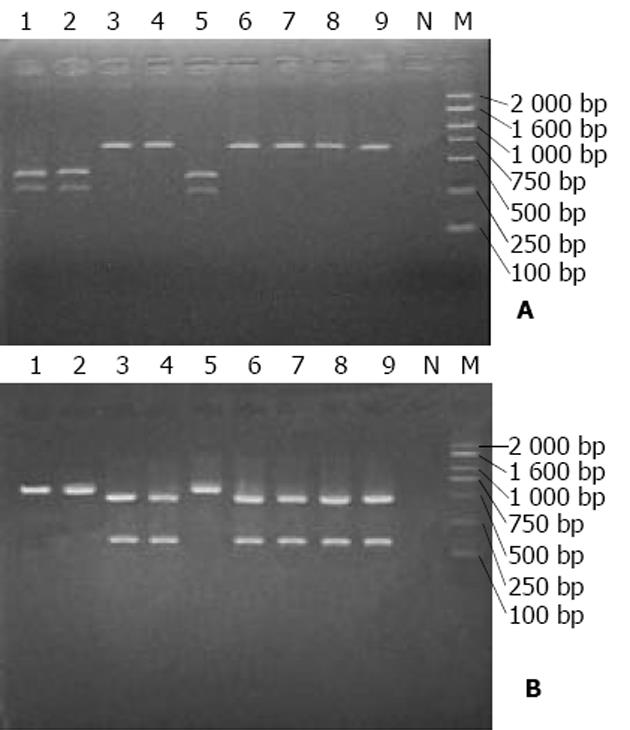
通过两轮PCR进行扩增, 能清晰直观地辨别出HBV的基因型(图2). 实验中还发现有些血清样品第一轮扩增为阴性, 但在第2轮呈阳性, 表明此种巢式PCR的特异性较高, 可减少假阴性和假阳性的发生. 已用多对型特异性引物巢式PCR法鉴定基因型的30份血清样品中, 有5例PCR产物为阴性, 无法进行分型, 可能为样品中HBV浓度较低的原因所致, 其余25例样品的分型结果与多对型特异性引物巢式PCR完全一致, 相符率达100%(图3). 随机选取的30份血清样品经2次多对型特异性引物巢式PCR重复扩增, 其结果均一致, 重现率100%, 表明该法准确性和可靠性较高. 此次对220例湖南籍慢性乙肝患者进行HBV基因分型, 结果为B型190例(86.4%), C型30例(13.6%), 未检测到A、D、E、F型. 结果提示湖南人群携带的乙肝病毒大多数为B型, 少数为C型.
HBV基因型与乙肝的传播方式、临床疾病谱、预后判断及抗病毒治疗的选择都有一定的相关性, 因此对HBV基因型的检测意义重大. 目前现有的分型方法尚有一些不足之处, 如测序法价格昂贵, 需反复比较分析才能得出结论, 无法进行大规模检测; 一般的PCR或巢式PCR大多也是扩增后再测序, 比直接测序法也只稍微节省成本, 或用型特异性引物进行单引物对PCR, 1份标本需做6次PCR才能鉴定基因型, 试剂用量大, 操作繁琐; 微板核酸杂交ELISA法虽然特异性较高, 但杂交后需复杂的显色步骤, 杂交背景也很容易受各种因素的干扰.
我们采用多对型特异性引物, 经两轮PCR分别扩增A-C和D-F型HBV, 从PCR产物片段的大小即可直接判定HBV基因型, 方法简便易行、特异性高. 通过与PCR-RFLP法进行对比, 显示两种方法分型结果完全一致, 重复试验也表明该方法重现性良好, 重现率达100%, 表明这种型特异性引物对巢式PCR的分型结果准确、稳定、可靠. 同时需要指出的是, PCR-RFLP法虽然由于限制型内切酶对酶切位点的严格选择性而有很好的特异性, 但有少量样品由于HBV浓度较低等原因呈假阴性而导致无法分型, 且由于酶切不完全等原因, 可能会出现较复杂的带型, 不利于结果判断, 尤其当同一标本混有两种基因型时更无能为力, 而且由于HBV基因变异的多样性和酶切位点单一性之间的矛盾, PCR-PFLP分型法不能鉴定100%的样品. 本方法通过合理设计型特异性引物, 理论上可鉴定100%的样品, 且不需酶切步骤, 因此本文认为此法优于PCR- RFLP法. 采用此种多对型特异性引物巢式PCR法检测了220例湖南籍慢性乙肝患者的HBV基因型, 发现B型190例(84.6%)、C型30例(13.6%), 未检测到A、D、E、F型, 与文献[31]报道的HBV湖南优势基因型相同, 但与其B型73.5%、C型26.5%略有出入. 考虑到HBV基因型与临床表型有关, 可能为二者采集的标本结构组成不同所致, 有待进一步研究证实.
编辑: N/A
| 5. | 李 永纲, 刘 明旭, 王 福生, 金 磊, 洪 卫国. 汉族人IL-12b和IL-10启动子区基因多态性与HBV感染的相关性. 世界华人消化杂志. 2003;11:1139-1143. [DOI] |
| 6. | 张 忠东, 成 军, 钟 彦伟, 杨 倩, 王 业东, 董 菁, 杨 艳杰, 张 树林. 羧肽酶N调节乙型肝炎病毒核心启动子表达活性的研究. 世界华人消化杂志. 2003;11:1131-1134. [DOI] |
| 7. | 陆 荫英, 陈 天艳, 成 军, 梁 耀东, 王 琳, 刘 妍, 张 健, 邵 清, 李 克, 张 玲霞. 乙型肝炎病毒X蛋白与去唾液酸糖蛋白受体2突变体相互作用的研究. 世界华人消化杂志. 2003;11:1126-1130. [DOI] |
| 10. | 游 晶, 庄 林, 唐 宝璋, 杨 惠, 杨 微波, 李 武, 张 宏丽, 张 艳梅, 张 禄, 严 绍明. 干扰素联合胸腺肽治疗慢性乙型肝炎. 世界华人消化杂志. 2001;9:388-391. [DOI] |
| 12. | 段 国荣, 聂 青和, 周 永兴, 王 全楚, 田 长印, 刘 拉羊, 薛 红安. 胸腺肽alpha1对慢性乙型肝炎患者免疫系统的影响. 世界华人消化杂志. 2003;11:701-704. [DOI] |
| 13. | Kao JH, Chen PJ, Lai MY, Chen DS. Genotypes and clinical phenotypes of hepatitis B virus in patients with chronic hepatitis B virus infection. J Clin Microbiol. 2002;40:1207-1209. [PubMed] [DOI] |
| 14. | Kao JH, Chen PJ, Lai MY, Chen DS. Hepatitis B genotypes correlate with clinical outcomes in patients with chronic hepatitis B. Gastroenterology. 2000;118:554-559. [PubMed] [DOI] |
| 15. | Kao JH. Hepatitis B viral genotypes: clinical relevance and molecular characteristics. J Gastroenterol Hepatol. 2002;17:643-650. [PubMed] [DOI] |
| 16. | Tsubota A, Arase Y, Ren F, Tanaka H, Ikeda K, Kumada H. Genotype may correlate with liver carcinogenesis and tumor characteristics in cirrhotic patients infected with hepatitis B virus subtype adw. J Med Virol. 2001;65:257-265. [PubMed] [DOI] |
| 17. | Lindh M, Andersson AS, Gusdal A. Genotypes, nt 1858 variants, and geographic origin of hepatitis B virus large-scale analysis using a new genotyping method. J Infect Dis. 1997;175:1285-1293. [PubMed] [DOI] |
| 18. | Norder H, Hammas B, Lee SD, Bile K, Couroucé AM, Mushahwar IK, Magnius LO. Genetic relatedness of hepatitis B viral strains of diverse geographical origin and natural variations in the primary structure of the surface antigen. J Gen Virol. 1993;74:1341-1348. [PubMed] [DOI] |
| 19. | Borchani-Chabchoub I, Gargouri A, Mokdad-Gargouri R. Genotyping of Tunisian hepatitis B virus isolates based on the sequencing of preS2 and S regions. Microbes Infect. 2000;2:607-612. [PubMed] [DOI] |
| 21. | 王 永忠, 周 国平, 李 夏亭, 周 志武, 周 胜生, 阮 丽花, 陈 敏, 邓 为群. 乙型肝炎病毒基因分型及临床应用研究. 中华实验和临床病毒学杂志. 2002;16:367-369. |
| 22. | Lee CM, Chen CH, Lu SN, Tung HD, Chou WJ, Wang JH, Chen TM, Hung CH, Huang CC, Chen WJ. Prevalence and clinical implications of hepatitis B virus genotypes in southern Taiwan. Scand J Gastroenterol. 2003;38:95-101. [PubMed] [DOI] |
| 23. | Kato H, Ruzibakiev R, Yuldasheva N, Hegay T, Kurbanov F, Achundjanov B, Tuichiev L, Usuda S, Ueda R, Mizokami M. Hepatitis B virus genotypes in Uzbekistan and validity of two different systems for genotyping. J Med Virol. 2002;67:477-483. [PubMed] [DOI] |
| 24. | Li KS, Yamashiro T, Sumie A, Terao H, Mifune K, Nishizono A. Hepatitis B virus harboring nucleotide deletions in the core promoter region and genotype B correlate with low viral replication activity in anti-HBe positive carriers. J Clin Virol. 2001;23:97-106. [PubMed] [DOI] |
| 25. | De Castro L, Araujo NM, Sabino RR, Alvarenga F, Yoshida CF, Gomes SA. Nosocomial spread of hepatitis B virus in two hemodialysis units, investigated by restriction fragment length polymorphism analysis. Eur J Clin Microbiol Infect Dis. 2000;19:531-537. [PubMed] [DOI] |
| 28. | 王 虹, 万 成松, 王 省良, 彭 华国. 采用PCR微板核酸杂交ELISA技术进行 HBV DNA基因分型的研究. 中华微生物学和免疫学杂志. 2001;21:234-236. |
| 30. | Naito H, Hayashi S, Abe K. Rapid and specific genotyping system for hepatitis B virus corresponding to six major genotypes by PCR using type-specific primers. J Clin Microbiol. 2001;39:362-364. [PubMed] [DOI] |