修回日期: 2004-10-13
接受日期: 2004-10-20
在线出版日期: 2004-12-15
目的: 观察肝部分切除大鼠肠源性内毒素血症的动态变化与肝再生的关系.
方法: 随机将Wistar大鼠分为正常对照组(NC)、假手术组(SO)和肝大部切除组(PH), 测定NC组及SO, PH组术后6, 12, 24, 36, 48, 72, 120, 168 h血浆ET浓度, 同时动态观察残余肝组织的再生情况.
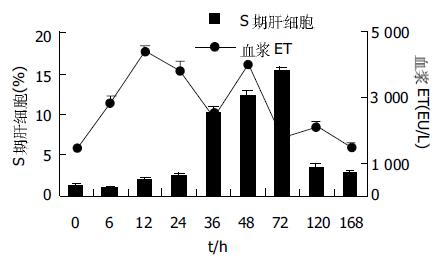
结果: PH组大鼠血浆ET浓度在PH后6-72 h升高, 期间出现2次峰值, 第1次在PH后12 h, 第2次在PH后48 h, 明显高于NC组及SO组对应时间点(P<0.01), 72 h后迅速下降至NC组水平. PH后残余肝质量、肝再生率均出现明显的动态变化, 但分别与血浆内毒素水平的变化趋势比较, 相关系数分别为-0.408(P>0.05), -0.167(P>0.05); PH后再生肝组织DNA合成S期肝细胞的数量、PCNA的标记指数均出现显著动态改变, 但分别与血浆ET水平的变化趋势比较, 相关系数分别为0.062(P>0.05), 0.058(P>0.05). NC, SO肝组织中上述反映肝再生的指标改变不明显.
结论: PH后残余肝再生全程中IETM的变化与肝再生程度的变化无关, 提示IETM对肝再生程度没有产生直接影响, 但不能否定因IETM所引起细胞因子的释放而导致对肝再生的影响作用.
引文著录: 许翠萍, 韩德五, 张杨, 赵元昌, 尹镭. 肝部分切除大鼠肠源性内毒素血症与肝再生的关系. 世界华人消化杂志 2004; 12(12): 2817-2821
Revised: October 13, 2004
Accepted: October 20, 2004
Published online: December 15, 2004
AIM: To investigate the dynamic changes and the relationship between intestinal endotoxemia (IETM) and liver regeneration after partial hepatectomy (PH) in rats.
METHODS: Wistar rats were randomly divided into three groups: normal control (NC) group, sham operation (SO) group and PH group. Levels of endotoxin (ET) in blood were measured in rats of each group 6, 12, 24, 36, 48, 72, 120 and 168 h after PH, respectively. Liver regeneration was evaluated by different methods.
RESULTS: Plasma endotoxin level was increased in PH group during 6-72 h after PH, and the levels appeared at 12 and 48 h were significantly higher than those at the corresponding time point in NC and SO groups (12 h: P = 0.002 < 0.01 vs NC, SO; 48 h: P = 0.002 < 0.01 vs NC, P = 0.000 < 0.01 vs SO). However, ET returned to normal level after 72 h. After PH, the weight of remnant liver, the rate of liver regeneration, the percent of S phase liver cells and the index of PCNA in liver were increased significantly, but there was no relationship between these data and plasma ET. In NC and SO groups, liver regeneration showed no significant difference between the different time points.
CONCLUSION: There is no relationship between IETM and liver regeneration after PH, suggesting that IETM has no direct effects on liver regeneration.
- Citation: Xu CP, Han DW, Zhang Y, Zhao YC, Yin L. Relationship between intestinal endotoxemia and liver regeneration after partial hepatectomy in rats. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2817-2821
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2817.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2817
大鼠肝部分切除(partial hepatectomy, PH)后伴随肠源性内毒素血症(intestinal endotoxemia, IETM)的产生并影响残余肝组织的再生[1-3], 对IETM在PH后的动态变化以及与残余肝组织再生的关系目前未见系统研究报道. 肝再生是肝损伤或PH后肝脏修复的必经过程, 有多种方法可用于肝再生状态的观察, 但各有优缺点[4], 目前还没有公认的金标准. 为弥补方法学的不足, 我们以大鼠PH后残余肝组织再生为研究模型, 通过测量再生肝质量, 计算残肝再生率, 测定S期肝细胞含量, 检测增生细胞核抗原(PCNA)表达的方法, 从不同侧面反映肝再生的情况, 旨在探讨IETM与PH后残余肝组织再生状态的关系, 衡量IETM在肝再生过程中的作用.
健康♂Wistar大鼠120只, 体质量200±20g, 由山西医科大学实验动物中心提供. 动物经适应性饲养1 wk后随机分为3组. Ⅰ正常对照(normal contrast, NC)组8只, 不施加任何处理因素; Ⅱ假手术(sham operation, SO)组48只, 于腹部正中施加3 cm切口暴露腹腔, 摆动肝脏左叶与中叶, 关闭腹腔; Ⅲ手术(PH)组64只, 依据Higgins创建的经典方法, 腹部正中切口进入腹腔, 轻轻挤出肝脏的左叶和中叶于肝蒂部结扎, 于结扎点远端切除肝脏的左叶和中叶(切除量约占全肝的68-70%), 称被切除肝质量, 关闭腹腔.
动物经10 g/L戊巴比妥钠(30 mg/kg)ip麻醉, SO及PH均在上午08:00-10:00进行. 术前动物禁食12 h但不限水, 术时严格无菌操作, 术后保温并自由进食、水, 观察NC动物(0 h)与术后6, 12, 24, 36, 48, 72, 120, 168 h, 每个时相点保证至少6只大鼠存活. 在不同预定时相点经腹主动脉无菌抽血留血浆-20 ℃保存备检. 切除全肝并称肝湿质量, 于肝右叶取部分组织以40 g/L中性甲醛固定, 石蜡包埋, 4 μm切片, 供免疫组织化学检测. 同时取肝右叶部分组织用0.5 g/L胶原酶消化, 制作单细胞悬液, 悬于-20 ℃, 700 mL/L乙醇固定, -4 ℃保存, 供(流式细胞术)FCM检测. 血浆ET检测使用可定量检测微量内毒素的鲎试剂盒(上海伊华). FCM检测使用FAC S Calibur型流式细胞仪(美国Becton Dickinson), 用碘化丙啶(PI)定量DNA荧光染色法染色, 鸡红细胞作标准样品, 调整仪器的CV值在5%以内, 每份样品检测30 000个细胞, 计数活细胞总数, S期(DNA合成期)肝细胞数, 求出每例样本S期肝细胞百分含量(S期肝细胞数/活细胞总数). 肝组织增生细胞核抗原(PCNA)检测用鼠抗PCNA mAb(PC10, IgG2a), 即用型SABC免疫组化染色试剂盒、DAB显色试剂盒(武汉博士德公司). 石蜡包埋肝组织4 μm切片, 切片常规脱蜡至水, 15 mL/L H2O2封闭内源性过氧化物酶, 室温30 min, 蒸馏水振洗2 min×3, 10 mmol/L枸橼酸盐缓冲液(pH 6.0)煮沸20 min, 冷却后PBS(pH 7.2-7.6)振洗2 min×3, 滴加正常山羊血清封闭液, 室温20 min, 甩去多余液体后加入鼠抗PCNA mAb(1:50), 湿盒中4 ℃孵育过夜. PBS振洗2 min×3; 加生物素标记羊抗鼠抗体, 湿盒中室温30 min, PBS振洗2 min×3; 加预先混合的SABC复合物, 室温30 min, PBS振洗2 min×3; 加临时配制的DAB显色液, 显微镜下观察显色, 苏木素轻度衬染, 梯度酒精脱水, 二甲苯透明, 树胶封片.实验结果判定: PCNA阳性染色呈棕黄色颗粒, 同时设置空白对照(以PBS代替第1抗体与第2抗体)、阳性对照(以己知有PCNA表达的大鼠肝组织石蜡切片). 染色结果由两个独立的观察者使用奥林巴斯光学显微镜报告. 结果判定标准为PCNA在肝细胞核呈界限清楚的棕色反应为阳性, 阳性结果分级标准为随机记录10个高倍(200×)视野中, 每个视野记数100个肝细胞, 按下列公式计算PCNA的指数: PCNA标记指数 = 染色阳性细胞数×100%/全部肝细胞数.
统计学处理 实验结果以mean±SD表示, 采用SPSS软件包(11.0版), 进行t检验, 方差分析, 相关和回归分析, 以P<0.05认为差异有显著性.
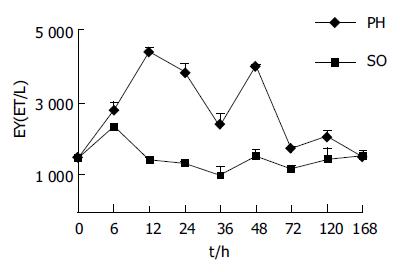
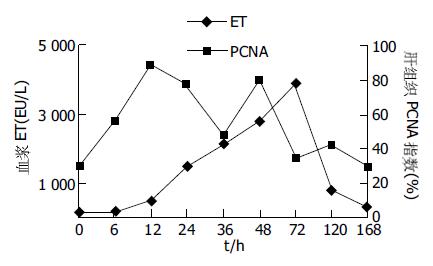
SO组术后6 h达到峰值, 与NC组比较, 差异无显著性(P>0.05). PH组在术后6 h明显升高, 与NC组比较(P<0.05), 与SO组对应时相点比较(P>0.05); 术后12 h达到峰值4432±249 EU/L, 与NC组及SO组相应时相点比较(P<0.01); 术后24、36 h血浆ET水平有下降趋势, 但均高于NC组及与SO组相应时间点(P<0.05); 术后48 h再次出现峰值4024±425 EU/L, 12、24 h数值比较(P>0.05); 与NC及与SO组相应时间点比较(P<0.01); 术后72-168 h血浆ET水平迅速下降, 与NC及与SO组相应时间点比较(P>0.05, 图1).
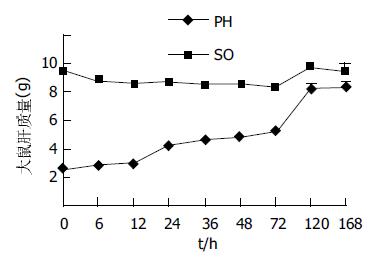
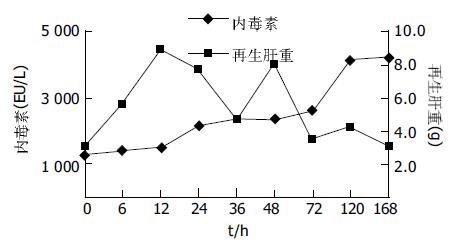
SO, PH组肝质量随时间延长逐渐增加. PH术后在不同时相点的肝质量与PH时的残余肝质量比较, PH后6、12 h差异无显著性, 残肝质量增加幅度较慢; PH后24、36、48 h差异有显著性(P<0.05), 残肝质量增加幅度加快; PH 48 h以后, 残肝体积开始明显增加, 72、120、168 h有非常显著性差异(P<0.01), 残肝质量增加幅度明显加快, 168 h时残肝质量达(8.42±0.75 g), 接近SO组相应时相点的肝脏质量(9.44±1.30 g), 术后168 h PH组与SO组肝脏质量比较差异无显著性. SO组在全部观察时相点肝脏质量变化不大, 组内两两比较(P>0.05). 两组均为肝湿质量.PH组残肝质量的变化与血浆ET水平变化特征的相关分析, r = -0.408(P>0.05, 图2, 3).
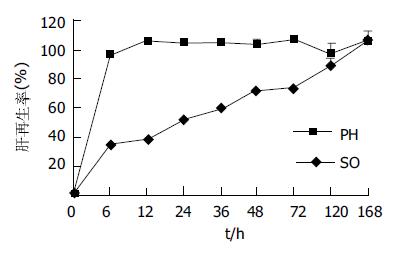
将正常组8只大鼠称体, 切除全肝称量, 全肝质量为(8.10±0.76 g). 再切除左叶和中叶称量, 被切除肝质量为(5.52±0.65 g), 得出PH组预切除的肝左叶和中叶占全肝质量(69.2±1.2%). 同时求得肝脏质量(Y)与体质量(X)间函数变化关系Y = 0.088X-8.635, 称取制模时切除的肝组织质量及术后再生肝质量, 观察残肝再生率的演变. 将已建立肝再生模型对照组SD大鼠行SO时的大鼠体质量(X)代入上式中求得相应之肝质量. 残肝再生过程中在不同时相点的再生率 = S/E×100, 其中S、E分别代表动物处死时每克体质量的肝质量和术前每克体质量的肝质量, E可用被切除肝叶质量/肝切除率推算.本实验中NC组大鼠肝切除率为(69.2±1.2%). PH组的肝再生率随时间的延长出现增高趋势, SO组肝脏质量的变化幅度较小. PH组肝再生率变化与血浆ET变化特征的相关分析r = -0.167, P>0.05, 图4).
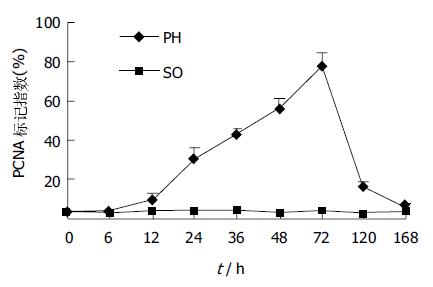
SO组各时相点与NC组比较均无显著性差异. PH组术后较术前明显增加(P<0.05, P<0.01), 24、48、72 h 3次达峰. 残肝体积和质量的增加速度也相应呈现3个加速期, 第1加速期出现在术后24 h, 第2加速期在术后48 h, 第3加速期持续到术后72 h. 肝组织S期肝细胞百分含量与血浆ET变化特征与的相关分析, r = 0.062, P>0.05, 图5).
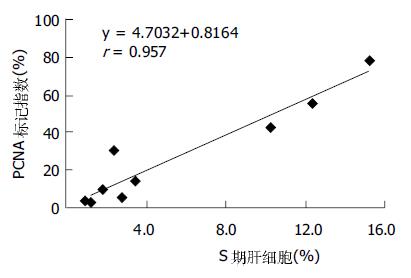
SO组各时相点与NC组比较均无显著性差异. PH组术后12 h即开始增加, 24 h明显增加, 72 h达到高峰, 标记指数近79%, 此后逐渐下降, 至7 d接近术前水平, 但与NC组比较(P<0.05). SO、PH组对应时相点比较, 自12-120 h, 差异均有显著性(P<0.05, P<0.01), PCNA标记指数与肝组织S期细胞百分含量相关分析r = 0.957, P<0.01. PH组PCNA标记指数与血浆ET水平的动态变化相关分析, r = 0.058, P>0.05, 图6-9).
近年来, IETM在慢性肝病发生发展中的作用越来越受到关注, 韩德五et al[5-9]认为IETM是肝功能衰竭发生的物质基础. 肝组织的再生功能与肝功能衰竭的发生有密切的关系, 目前有关ET与肝再生关系的系统研究大多基于外源性给予被研究动物LPS[10-11]. 对肠源性内毒素与肝再生关系的系统研究未见报道. 我们通过建立大鼠PH模型, 检测血浆ET变化情况与衡量肝再生相关指标的改变, 评价PH后IETM与残余肝组织再生程度的关系, 旨在明确肠源性内毒素对肝再生的影响, 为延缓慢性肝病时肝功能衰竭的发生提供理论依据. 结果表明, PH组血浆ET水平在PH后6-72 h升高, 期间出现2次峰值, 第1次在PH后12 h, 第2次在PH后48 h, 分别与NC及SO组相应时相点比较(P<0.01), 72 h后迅速下降至NC组水平.
残肝质量变化是较直观、简单的方法, 但准确性不高.肝再生率排除了肝再生过程中体质量变化的影响, 能比较准确地反映肝再生情况. 本实验PH后肝脏质量的变化大致可以分为3个快速增长时期, 即24-48 h, 48-72 h, 72-168 h, 而且48 h后, 残肝的质量增长加速, 72 h后增长最为显著. PH后残肝再生率随时间的延长也显示增高趋势, 与肝脏质量的变化趋势相似.PH后残肝质量变化、肝再生率变化均出现增高趋势, 但分别与血浆内毒素水平的变化趋势经直线相关回归分析, 相关系数分别为-0.408(P>0.05), -0.167(P>0.05), 提示血浆ET水平的变化与肝脏质量、体积的增长变化无关.
PCNA是与细胞增生密切相关的核内酸性蛋白质, 存在并合成于核内, 静止细胞中PCNA含量很少, 增生细胞和转化细胞中其含量发生明显变化, 大部分G0-G1期细胞无明显的PCNA表达, G1晚期其表达度增加, S期达到高峰, G2-M期下降, 其含量和表达强弱的变化与DNA合成及DNA复制的活跃程度是一致的, 同时这个变化与再生肝组织DNA合成S期肝细胞的数量变化一致, 因此, PCNA是评价肝脏再生的一个客观指标. 本实验中再生肝细胞DNA合成S期肝细胞的数量变化以24, 48, 72 h变化最明显, 残肝组织PCNA的标记指数也是在这3个时间点变化最显著, 二者的动态变化具高度显著相关正(r = 0.957, P<0.01). 这些事实说明肝细胞的再生在24-72 h之内是DNA合成最活跃的时期, 也反映了DNA合成的活跃程度. 而72 h-1 wk时, 残肝体积增长迅速, 质量明显增加, 1 wk时基本上已恢复到术前水平, 这说明肝细胞的再生在这一时期内, 以细胞的分裂增生为主. 但将再生肝组织DNA合成S期肝细胞的数量变化、再生肝组织PCNA的标记指数变化分别与血浆ET水平的变化经直线相关与回归分析, 显示均无相关关系(r = 0.062, r = 0.058; P>0.05). PH后IETM的动态变化与残肝再生的程度及肝细胞增生的活跃程度不存在相关关系, 提示PH后IETM的变化没有对肝再生程度产生直接影响. 但由于肝再生是多阶段、多因素参与的精确、有序的调节过程, 且肝细胞增生与肝再生微环境密切相关. 故本实验结果并不能否认因IETM所引起KC的激活、细胞因子的释放而导致的对肝再生的影响作用[12].
编辑: N/A
| 1. | Cornell RP, Liljequist BL, Bartizal KF. Depressed liver regeneration after partial hepatectomy of germ-free, athymic and lipopolysaccharide-resistant mice. Hepatology. 1990;11:916-922. [PubMed] [DOI] |
| 2. | Alexandris IH, Assimakopoulos SF, Vagianos CE, Patsoukis N, Georgiou C, Nikolopoulou V, Scopa CD. Oxidative state in intestine and liver after partial hepatectomy in rats. Effect of bombesin and neurotensin. Clin Biochem. 2004;37:350-356. [PubMed] [DOI] |
| 3. | Houdijk AP, Meijer C, Cuesta MA, Meyer S, Van Leeuwen PA. Perioperative anti-endotoxin strategies. Scand J Gastroenterol Suppl. 1997;222:93-97. [PubMed] [DOI] |
| 4. | Assy N, Minuk GY. Liver regeneration: methods for monitoring and their applications. J Hepatol. 1997;26:945-952. [DOI] |
| 8. | Han DW. Intestinal endotoxemia as a pathogenetic mechanism in liver failure. World J Gastroenterol. 2002;8:961-965. [PubMed] [DOI] |
| 10. | Akita K, Okuno M, Enya M, Imai S, Moriwaki H, Kawada N, Suzuki Y, Kojima S. Impaired liver regeneration in mice by lipopolysaccharide via TNF-alpha/kallikrein-mediated activation of latent TGF-beta. Gastroenterology. 2002;123:352-364. [PubMed] [DOI] |
| 11. | Sakaguchi T, Nakamura S, Suzuki S, Oda T, Ichiyama A, Baba S, Okamoto T. Participation of platelet-activating factor in the lipopolysaccharide-induced liver injury in partially hepatectomized rats. Hepatology. 1999;30:959-967. [PubMed] [DOI] |
| 12. | Straatsburg IH, Boermeester MA, Houdijk AP, Frederiks WM, Wesdorp RI, Van Leeuwen PA, Van Noorden CJ. Endotoxin- and cytokine-mediated effects on liver cell proliferation and lipid metabolism after partial hepatectomy: a study with recombinant N-terminal bactericidal/permeability-increasing protein and interleukin-1 receptor antagonist. J Pathol. 1996;179:100-105. [PubMed] [DOI] |