修回日期: 2004-09-13
接受日期: 2004-09-30
在线出版日期: 2004-12-15
目的: 筛选乙型肝炎病毒(HBV)前-前-S抗原基因启动子的结合蛋白.
方法: 应用噬菌体表面展示技术, 以HBV前-前-S抗原基因启动子的聚合酶链反应产物作为固相筛选分子, 对噬菌体人肝细胞cDNA文库进行4轮"黏附-洗脱-扩增"的筛选过程, 经噬斑的PCR扩增后, 构建克隆载体, 并对所筛选克隆进行DNA测序和生物信息学分析.
结果: 噬菌体经富集后, 从随机筛选的43个克隆中得到20个与HBV前-前-S抗原基因启动子特异结合的阳性克隆, 包括人类SMG-1的磷脂酰肌醇3相关激酶激酶、28 S核糖体、单倍型As2A线粒体、组氨酰-tRNA合成酶、脂肪醛脱氢酶、桥粒相关蛋白、MAX相互作用蛋白1等17个已知功能基因及3个未知功能基因.
结论: 用噬菌体人肝细胞cDNA文库筛选得到HBV前-前-S抗原基因启动子的结合蛋白基因, 为进一步研究HBV发病机制创造了新的途径.
引文著录: 黄燕萍, 成军, 张树林, 杨艳杰, 高学松, 钟彦伟, 杨瑗, 白桂芹, 蔺淑梅. 噬菌体展示技术筛选HBV前-前-S抗原基因启动子结合蛋白基因. 世界华人消化杂志 2004; 12(12): 2801-2804
Revised: September 13, 2004
Accepted: September 30, 2004
Published online: December 15, 2004
AIM: To screen the binding protein gene of hepatitis B virus pre-pre-s promoter using phage display technique.
METHODS: Taking HBV pre-pre-S promoter as a solidified selective molecule, the phage-human liver cDNA library was biopanned and the positive clones were selected. The positive plaques were amplified and then cloned into pGEM-Teasy vector. The selected positive plaques were analyzed using bioinformatics and DNA sequencing.
RESULTS: Twenty positive clones were obtained, which included 17 clones with known function and 3 with unknown function.
CONCLUSION: The binding protein genes of HBV pre-pre-s promoter can be obtained by phage display technique, which may be helpful for further study of the pathogenesis of HBV infection.
- Citation: Huang YP, Cheng J, Zhang SL, Yang YJ, Gao XS, Zhong YW, Yang Y, Bai GQ, Lin SM. Screening of binding protein of hepatitis B virus pre-pre-s promoter by phage display technique. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2801-2804
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2801.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2801
乙型肝炎病毒(HBV)感染是一个全球性健康问题[1]. 虽然部分慢性乙型肝炎患者对干扰素、核苷类似物拉米夫定等治疗有一定的疗效[2], 但目前仍无确切有效的治疗方案, 其主要原因是对HBV DNA复制的生物学机制不十分清楚. HBV是一个很小的包膜蛋白, 其基因组结构精密, 约有3 200个碱基对(bp). 前-S1, 前-S2和表面抗原主蛋白按照同一开放读框(in frame)顺序进行翻译. 董菁et al[3]发现在前-S1上游存在新的ORF, 命名为前-前-S基因, 并在已克隆的HBV基因组得到证实, 且在甘人宝et al、Mukaldeet al, Okamoto et al报告的HBV基因组序列中均存在前-前-S区[4], 杨倩et al[5]又确定了前-前-S基因启动子的序列和活性鉴定. 我们采用HBV前-前-S基因启动子作为固相靶分子, 用噬菌体表面展示的人肝cDNA文库来筛选特异的HBV前-前-S基因启动子结合蛋白, 以探讨HBV前-前-S在HBV感染发病机制中的作用.
T7 Select人肝细胞cDNA文库、受体菌BLT5615(Novagen公司); 质粒pGEM-T easy(Promega公司); Taq酶、琼脂糖、dNTP、T4连接酶、RNA酶、玻璃奶DNA回收试剂盒(博大科技)、EcoR1、BamH1、Mlu1、Xho1(宝生物公司). 热循环仪、凝胶成像仪、大肠杆菌DH5α为本研究中心保存. 将新鲜BLT5615克隆接种于LB/Amp 3 mL, 37 ℃过夜. 在LB/Amp3 mL内加入振瑶细菌30 μL, 将细菌浓度摇至A600 = 0.5, 加入0.1 mol/L IPTG 30 μL诱导, 37 ℃再振瑶30 min后加入噬菌体文库5 μL. 37 ℃振瑶1-2 h观察至细菌裂解, 停摇. 8 000 g, 离心10 min, 将上清液移至无菌Eppendorf(Ep)管中. 4 ℃保存.
1.2.1 HBV前-前-S启动子扩增和生物筛选: 根据我室HBV DNA基因组序列确定前-前-S基因的转录起始点, 选取其上游277 bp, 设计并合成引物, 在上下游引物的5'端分别加上Mlu1和Xho1位点序列, 并且以生物素标记, 上游引物P1: 5'-ACG CGT CTC GGG AAT CTC AAT GTT AG-3', 下游引物P2: 5'-CTC GAG CCG GAT AAT AGG GTT TAA TGC C-3', 由上海博亚生物技术有限公司合成. 在0.2 μL Ep管中依次加入10×缓冲液(含20 mmol/L MgCl2)2.5 μL, 无菌水17.3 μL 2 mmol/L dNTP2 μL, 10 μmol/L P1和P2各1 μL, HBV基因组为模板1 μL, Taq酶(5MU/L)0.2 μL. 于PE 9600 PCR仪中扩增. 扩增条件: 94 ℃变性50 s, 52 ℃退火50 s, 72℃延伸50 s, 循环35次. 10 g/L琼脂糖凝胶电泳鉴定扩增结果, 玻璃奶回收DNA片段. 生物筛选链亲和素15 μL(1 g/L)包被微孔板, 4 ℃过夜. 1×TBS洗涤, 加入回收的前-前-S启动子DNA 100 μL, 4 ℃过夜. 1×TBST(5 g/L Tween-20)洗涤2遍, 加入文库扩增裂解液110 μL, 4 ℃过夜. 1×TBST洗涤5遍, 加入T7洗脱缓冲液100 μL, 室温孵育20 min, 将洗脱液移至另一无菌管中. 将洗脱噬菌体10 μL加入对数生长期的BLT5615细菌培养液3 mL中, 37 ℃振摇培养, 看到细菌裂解时停摇. 10 000 g离心10 min, 取上清液1 mL移到新的Ep管, 4 ℃保存, 待下一轮筛选时用. 每轮筛选后均作噬斑分析. 以同样步骤筛选4轮.
1.2.2 噬斑PCR扩增及克隆载体的构建鉴定: 用Tip头刮取第4轮筛选后的阳性噬斑, 并以阳性噬斑对细菌的裂解上清液(噬菌体DNA)作为模板, 进行噬斑PCR扩增. T7 Select上游引物P3: 5'-GGA GCT GTC GTA TTC CAG TC-3'; P4下游引物P4: 5'-AAC CCC TCA AGA CCC GTT TA-3'. 扩增条件: 94 ℃变性50 s, 50 ℃退火1 min, 72 ℃延伸1 min, 循环35次. 10 g/L琼脂糖凝胶电泳鉴定扩增结果, 玻璃奶回收DNA片段. 将纯化的PCR产物连接到pGEM-Teasy载体后, 转化到用氯化钙法制备的大肠杆菌DH5α感受态细胞, 在铺有IPTG/X-gal的氨苄西林平板上进行蓝白斑菌落筛选, 挑取白色菌落用碱裂解法提取质粒, 进行酶切鉴定. 选择经酶切鉴定阳性的相应克隆送检测序, 序列测定由上海博亚生物公司完成. 测序结果在GenBank数据库中进行同源序列比较, 并进行分析.
以固相化的HBV前-前-S启动子DNA片段作为支持分子, 对肝细胞cDNA文库进行4轮"黏附-洗脱-扩增"的筛选. 第4轮与第1轮相比富集了1.8倍(富集倍数 = 第4轮产出率/第1轮产出率, 表1).
| 筛选次数 | 噬菌体数 | 产出率(%) | |
| 投入 | 捕获 | ||
| 第1轮 | 2.9×109 | 3.0×1010 | 10 |
| 第2轮 | 3.0×109 | 2.0×1010 | 7 |
| 第3轮 | 2.0×109 | 1.1×1010 | 6 |
| 第4轮 | 1.1×109 | 2.0×1010 | 18 |
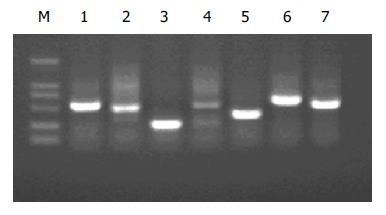
经过4轮筛选, 随机挑取43个噬斑为模板, 用T7 Select引物进行PCR扩增, PCR产物用10 g/L琼脂糖凝胶电泳. 结果显示所筛选到的肝细胞文库中大小不等的基因片段(图1).
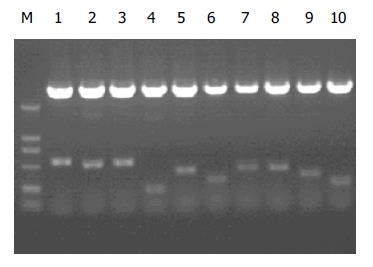
经过4轮筛选及噬斑PCR扩增鉴定, 获得了20个阳性克隆, 将PCR产物连接到pGEM-T easy载体上, 从LB/Amp平板中随机挑取白色菌落, 摇菌过夜扩增重组子DNA, 酚/氯仿抽提和10 g/L琼脂糖凝胶电泳初筛. 将重组子用EcoR1酶切, 10 g/L琼脂糖凝胶电泳显示切出3 000 bp和大小不等的片段(图2), 证明重组子带有不同大小的目的DNA片段.
挑选43个克隆测序, 测序结果与GenBank数据库进行初步比较, 筛选出20个与HBV前-前-S抗原基因启动子特异结合蛋白, 包括人类SMG-1样的磷脂酰肌醇3相关激酶激酶、28S核糖体、单倍型As2A线粒体、组氨酰-tRNA合成酶、脂肪醛脱氢酶、桥粒相关蛋白、MAX相互作用蛋白1等17个已知功能基因及3个未知功能基因, 同源性为96-100%(表2).
| 序号 | 已知的同源序列编码蛋白 | 相同克隆数 | 同源性(%) |
| 1 | 人类SMG-1样的磷脂酰肌醇3相关激酶激酶 | 5 | 98-100 |
| 2 | 人类核孔复合体相互作用蛋白 | 5 | 97-99 |
| 3 | 人类28S核糖体 | 1 | 99 |
| 4 | 人类单倍型As2A线粒体 | 2 | 100 |
| 5 | 人类组氨酰-tRNA合成酶 | 1 | 100 |
| 6 | 人类脂肪醛脱氢酶(ALDH10) | 1 | 99 |
| 7 | 人类桥粒相关蛋白 | 1 | 98 |
| 8 | 人类MAX相互作用蛋白1 | 1 | 99 |
| 9 | 人类未知功能基因 | 3 | 96-100 |
| 10 | 无法分析的序列 | 23 |
乙型肝炎病毒(HBV)是一种DNA病毒, 在其生活周期中存在着独特的DNA-RNA-DNA的复制过程, 感染肝细胞后, 在肝细胞中完成复制和表达的生活周期, 肝细胞中的一些调节蛋白与调节基因序列结合后, 可对其生活周期进行调节, 翻译而成的蛋白不仅完成病毒颗粒自身的装配, 而且在肝细胞中可产生一系列的生物学效应. 肝炎病毒蛋白、肝炎病毒调节基因序列通过蛋白与蛋白、DNA与蛋白之间的结合, 对肝细胞基因组表达谱调节, 影响肝细胞正常的代谢和信号转导途径, 进而影响肝细胞的细胞周期[6-7]、细胞凋亡[8-9]、细胞的恶性转化等过程[10-11]. 噬菌体展示技术[12]是1980年代中期发明的一项新技术, 可以展示真正表达的蛋白质或多肽片段, 在噬菌体表面可保持筛选蛋白折叠后的空间结构, 该系统可模拟细胞编码蛋白的真实情况. 我们应用噬菌体展示技术从肝细胞cDNA文库中筛选到了几种不同的HBV前-前S抗原基因启动子的特异结合蛋白.
核孔复合体(NPC)是一种巨大的蛋白复合物, 他插在核外膜的双层膜中, 他作为一种装配的可溶性渠道起作用, 是允许与NPC成分作用的转运受体进出的选择性通道. 不同可溶性转运受体可以识别许多转入或转出细胞核的转运物质, 并携带载物到达各自的目标物. 所有的核转运因子可以双向通过NPC, 这是通过与富含苯丙氨酸和甘氨酸的NPC成分特定的相互作用完成的. 核质转运通过NPC转移定位, 具有高度选择性并非常迅速. 输入蛋白或输出蛋白介导的转运所需要的能量来源只能由RanGTP周期提供, 他可通过调节底物接合和释放反应来进行定向转移. 由于核糖体亚基的复杂生物合成性, 对核糖体从核中转出的分析一直很难, 通过系列研究表明40 S转出要求RanGTP酶周期及核孔蛋白; 几种核孔蛋白的突变及Ran周期的成员突变禁止60 S转运; 60 S成熟化与核释放以及转运到细胞质有紧密联系. 核孔复合体相互作用蛋白(NPIP), 由免疫荧光显微术证实定位于核膜, 与核孔P62共区域化[13-15]. 通过噬菌体展示技术筛选到的HBV前-前S启动子的结合蛋白NPIP, 是否能提示HBV感染后, 影响肝细胞核孔复合体功能, 影响核糖体的成熟, 从而影响肝细胞蛋白的合成及功能.
值得注意的是我们还筛选到HBV前-前S启动子的另一个结合蛋白是磷脂酰肌醇3激酶相关激酶(PIKK)与信号转导密切相关. 信号转导是指外部的信号通过细胞膜上的受体蛋白传到细胞内部, 并激发出诸如离子通透性、细胞形状或其他细胞功能改变的应答过程. PIKK家族是细胞周期的主要调节剂[16]. 磷脂酰肌醇3激酶(PI3K)是细胞内信号转导系统的一条通道, 是肌醇磷脂信使系统的重要组成部分, 介于细胞受体与第二信使之间的信号转导途径, 在细胞生物学功能中起到重要作用. PI3K通过将第二信使前体磷酸化而转导信息, 所产生的第二信使可能参与细胞代谢、生长分化、基因表达、细胞调亡等过程. 外源性蛋白如病毒蛋白可通过PI3K途径导致细胞调亡或癌变, 有研究发现PI3K激活丝/苏氨酸激酶-Akt, 并可能级联放大下游抑癌基因表达达到抑制细胞凋亡目的[17-20]. 磷脂酰肌醇3激酶作为胰岛素信号转导中的关键酶, 在调节糖代谢中起重要作用[21-23]. 2型糖尿病和胰岛素抵抗(IR)患者中, PI3K的含量和活性均降低, 并存在对胰岛素刺激的反应缺陷. T、B细胞活化过程中涉及到多种磷脂酰肌醇的产生及其调节, 不同种的磷脂酰肌醇可分别激活下游的信号蛋白, 使得信号逐级传递, 通过信号蛋白激活T、B细胞内的多种酶活化途径, 最终导致T、B细胞的增生、活化, 合成并发挥其生物学功能[21,24-26]. 肝慢性损伤及炎症反应时, 常伴有多种可影响不同靶细胞的可溶性物质被激活, 如血小板源性生长因子(platelet-derived growth factor, PDGF)及其受体(PDGF receptor, PDGF-R)的表达常可增强. PI3K参与细胞内PDGF信号转导, 活化的PDGF-R可使PI3K内的酪氨酸残基磷酸化, 从而促进HSC增生及趋化, PI3K下游效应分子有蛋白激酶C、40S核糖体蛋白S6激酶等[27], PI3K可催化磷脂酰肌醇-4, 5-二磷酸之D3位磷酸化, 其产物磷脂酰肌醇-3, 4, 5-三磷酸可激活PKC基因, 而后者可激活Ras, 而Ras/MAPK通路与PDGF诱导HSC增生及移动有关.
我们通过噬菌体展示技术筛选到的部分HBV前-前-S启动子基因结合蛋白为阐明HBV感染的慢性化和肝细胞癌形成的机制、并发症的发生机制以及机体免疫功能改变提供了新的研究方向和思路.
编辑: N/A
| 1. | Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. J Viral Hepat. 2004;11:97-107. [PubMed] [DOI] |
| 2. | Ciancio A, Smedile A, Rizzetto M, Lagget M, Gerin J, Korba B. Identification of HBV DNA sequences that are predictive of response to lamivudine therapy. Hepatology. 2004;39:64-73. [PubMed] [DOI] |
| 4. | 杨 倩, 成 军, 董 菁, 张 树林. 乙型肝炎病毒基因组新基因的研究及意义. 胃肠病学和肝病学杂志. 2004;13:72-75. |
| 5. | 杨 倩, 董 菁, 成 军, 刘 妍, 洪 源, 王 建军, 张 树林. 乙型肝炎病毒基因组中前-前-S-编码基因启动子序列的确定及转录活性的鉴定. 解放军医学杂志. 2003;28:761-762. |
| 13. | Allen NP, Patel SS, Huang L, Chalkley RJ, Burlingame A, Lutzmann M, Hurt EC, Rexach M. Deciphering networks of protein interactions at the nuclear pore complex. Mol Cell Proteomics. 2002;1:930-946. [PubMed] [DOI] |
| 14. | Johnson ME, Viggiano L, Bailey JA, Abdul-Rauf M, Goodwin G, Rocchi M, Eichler EE. Positive selection of a gene family during the emergence of humans and African apes. Nature. 2001;413:514-519. [PubMed] [DOI] |
| 15. | Ben-Efraim I, Gerace L. Gradient of increasing affinity of importin beta for nucleoporins along the pathway of nuclear import. J Cell Biol. 2001;152:411-417. [PubMed] [DOI] |
| 16. | Mita MM, Mita A, Rowinsky EK. The molecular target of rapamycin (mTOR) as a therapeutic target against cancer. Cancer Biol Ther. 2003;2:169-177. [DOI] |
| 17. | Matsuoka M, Igisu H. Cadmium induces phosphorylation of p53 at serine 15 in MCF-7 cells. Biochem Biophys Res Commun. 2001;282:1120-1125. [PubMed] [DOI] |
| 18. | Yamashita A, Ohnishi T, Kashima I, Taya Y, Ohno S. Human SMG-1, a novel phosphatidylinositol 3-kinase-related protein kinase, associates with components of the mRNA surveillance complex and is involved in the regulation of nonsense-mediated mRNA decay. Genes Dev. 2001;15:2215-2228. [PubMed] [DOI] |
| 19. | Rogoff HA, Pickering MT, Debatis ME, Jones S, Kowalik TF. E2F1 induces phosphorylation of p53 that is coincident with p53 accumulation and apoptosis. Mol Cell Biol. 2002;22:5308-5318. [PubMed] [DOI] |
| 20. | Jackowski S, Voelker DR, Rock CO. Inositol metabolism and cell growth in a Chinese hamster ovary cell myo-inositol auxotroph. J Biol Chem. 1988;263:16830-16836. [PubMed] |
| 21. | Katso R, Okkenhaug K, Ahmadi K, White S, Timms J, Waterfield MD. Cellular function of phosphoinositide 3-kinases: implications for development, homeostasis, and cancer. Annu Rev Cell Dev Biol. 2001;17:615-675. [PubMed] [DOI] |
| 22. | Kossila M, Pihlajamaki J, Karkkainen P, Miettinen R, Kekalainen P, Vauhkonen L, Yla-Herttuala S, Laakso M. Promoter polymorphisms -359T/C and -303A/G of the catalytic subunit p110beta gene of human phosphatidylinositol 3-kinase are not associated with insulin secretion or insulin sensitivity in finnish subjects. Diabetes Care. 2003;26:179-182. [DOI] |
| 23. | Frauwirth KA, Riley JL, Harris MH, Parry RV, Rathmell JC, Plas DR, Elstrom RL, June CH, Thompson CB. The CD28 signaling pathway regulates glucose metabolism. Immunity. 2002;16:769-777. [DOI] |
| 24. | Koyasu S. The role of PI3K in immune cells. Nat Immunol. 2003;4:313-319. [PubMed] [DOI] |
| 25. | Okkenhaug K, Vanhaesebroeck B. PI3K-signalling in B- and T-cells: insights from gene-targeted mice. Biochem Soc Trans. 2003;31:270-274. [PubMed] [DOI] |
| 26. | Inabe K, Ishiai M, Scharenberg AM, Freshney N, Downward J, Kurosaki T. Vav3 modulates B cell receptor responses by regulating phosphoinositide 3-kinase activation. J Exp Med. 2002;195:189-200. [PubMed] [DOI] |
| 27. | 董 菁, 成 军. 磷脂酰肌醇3激酶信号转导系统与肝炎病毒. 胃肠病学和肝病学杂志. 2003;12:217-219. |