修回日期: 2004-07-09
接受日期: 2004-08-05
在线出版日期: 2004-10-15
目的: 观察慢性应激大鼠结肠黏膜一氧化氮(nitric oxide, NO)的含量变化, 探讨NO在慢性应激肠黏膜损伤中的作用及意义.
方法: 采用慢性束缚应激模型. Wistar大鼠30只, 随机分为对照组、应激组、应激+氨基胍组. 应激组和应激+氨基胍组大鼠每天置于束缚笼内2 h. 氨基胍组腹腔注射氨基胍150 mg/kg, 持续14 d处死动物. 化学比色法测定肠黏膜组织NO、诱导型NO合成酶(inducible nitric oxide synthase, iNOS)的含量, 组织切片观察肠黏膜炎性细胞浸润情况, 电镜观察结肠上皮细胞超微结构的变化.
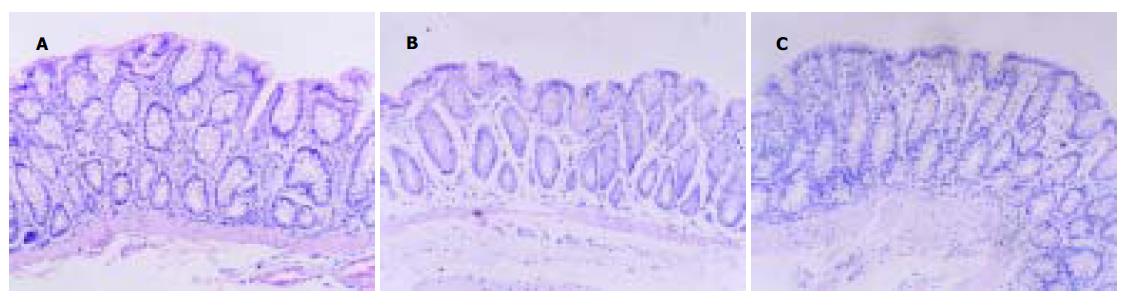
结果: 应激组结肠黏膜中NO、iNOS含量高于对照组(NO: 47.5±7.9 vs 32.3±4.7 mmol/g, P <0.01; iNOS 6.7±1.0 vs 4.0±0.6 nkat/g, P <0.01), 中性粒细胞、单核细胞数目增加(N:70±12 vs 30±6/mm2P <0.01; M:52±9 vs 26±8/mm2, P <0.01), 并出现上皮细胞线粒体肿胀、细胞间紧密连接间隙加大等超微结构的变化. 氨基胍组结肠黏膜NO、iNOS含量低于应激组(NO: 27.7 ±12.4 vs 47.8±7.9 mmol/g, P <0.05; iNOS3.8±0.8 vs 6.7±1.0 nkat/g, P <0.01), 炎性细胞浸润及超微结构的变化较轻.
结论: 慢性应激大鼠结肠黏膜NO含量增加, 可能参与了应激诱导的肠黏膜损伤. 氨基胍对应激诱导的肠黏膜损伤起保护作用.
引文著录: 仝巧云, 罗和生, 陈敏. 慢性应激大鼠结肠黏膜NO含量变化的意义. 世界华人消化杂志 2004; 12(10): 2345-2348
Revised: July 9, 2004
Accepted: August 5, 2004
Published online: October 15, 2004
AIM: To investigate the changes of nitric oxide (NO) in the colonic mucosa of rats submitted to chronic stress and to study the mechanism of chronic stress damage to colonic mucosa.
METHODS: Thirty Wistar rats were randomly divided into control group (n = 10), stress group (n = 10), stress and injection aminoguanidine group (n = 10). The latter two groups were submitted to immobilization stress 2 h/d for 14 days. The numbers of the inflammatory cells and ultrastructural damage of colon epithelial cells were observed under light and electron microscopes respectively. The concentration of NO and iNOS were measured by chemical methods.
RESULTS: The concentrations of NO and iNOS in colonic mucosa of stress group were higher than those in control group (NO: 47.5±7.9vs 32.3±4.7 mmol/g, P <0.01; iNOS: 6.7±1.0 vs 4.0±0.6 nkat/g, P <0.01). More neutrophils and mononuclear cells were observed in the stress groupthan in the control group (N: 70±12 vs 30±6 /mm2, P <0.01; M: 52±9 vs 26±8 /mm2, P <0.01). The damage of mitochondria and loosened tight junction were seen in stress group. have concentration of NO and iNOS concentrations were lower in Aminoguanidine group than those in stress group (NO: 27.7±12.4 vs 47.8±7.9 mmol/g, P <0.05; iNOS3.8±0.8 vs 6.7±1.0 nkat/g, P <0.01). Infiltration of inflammatory cells and ultrastructural damage of colon epithelial cells were slighter in aminoguanidine group than those in stress group.
CONCLUSION: Chronic stress brought damages to colonic mucosa and nitric oxide might play an important role in these damages while aminoguanidine protected stress-induced colonic mucosa damaged.
- Citation: Tong QY, Luo HS, Chen M. Changes of nitric oxide in colonic mucosa of rats submitted to chronic stress. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2345-2348
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2345.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2345
慢性应激和紧张焦虑、抑郁等精神心理反应与胃肠道疾病关系密切[1-2]. 新近的研究表明: 慢性应激引起肠黏膜屏障的损伤, 可能是应激诱发肠道炎症性疾病的基础[3-4]. 一氧化氮(NO)是参与肠黏膜屏障损伤的一个重要的递质[5], 其在慢性应激大鼠肠黏膜中含量变化及与肠黏膜损伤的关系尚未见文献报道. 我们采用慢性束缚应激模型[4], 观察大鼠肠黏膜组织NO含量变化及与上皮组织学变化的关系.
清洁级健康成年Wistar大鼠(200±20 g)30只, 由湖北省预防医学科学院实验动物中心提供, 雌雄不限. 随机分为对照组10只; 应激组10只; 应激+氨基胍组10只. NO、iNOS试剂盒(南京建成生物技术研究所), 氨基胍(Sigma公司), 其他为国产分析纯.低温离心机, 恒温水浴箱, 721型分光光度计, 日立H-600透射电镜, 普通光学显微镜.
将应激组及应激+氨基胍组大鼠置于特制的圆柱状束缚笼内(长14-16 cm, 内径3.5-4 cm, 根据体型大小适当调整), 限制活动, 每天2 h. 对照组动物自由活动. 每天在08: 00-10: 00间进行实验, 连续14 d. 氨基胍组每日ip 氨基胍150 mg/kg, 分2次, 应激前1次, 应激结束12 h后再注射1次. 最后1次应激结束后4 h, 200 g/L乌拉坦溶液1 mL ip麻醉, 腹中线切口取结肠组织.石蜡切片常规HE染色, 用16D目镜测微网(面积为0.1 024 mm2)在普通光镜100倍放大下计数肠黏膜炎性细胞数, 每张切片计数10个网格取平均值. 结果以每mm2含有的炎性细胞数表示. 组织取材后, 立即放入25 g/L戊二醛溶液固定15 min, 再切成1 mm×4 mm, 放回固定液固定3 h, 蒸馏水冲洗, 置于磷酸盐缓冲液过夜. 次日四氧化锇酸固定, 梯度酒精脱水, 丙酮脱水, Epox812树脂包埋, 超薄切片, 醋酸铀, 枸橼酸铅染色, 电镜观察. 动物处死后, 用电子天平称取结肠组织300-400 mg, 按质量(g)/体积(mL)比1:9加生理盐水, 制备成100 g/L组织匀浆, 一式两份. 一份经高速低温离心机4 000 r/min离心10 min, 取上清液50 mL测iNOS酶活力, 以nkat/g表示; 另取50 mL上清液, 再加9倍生理盐水制备10 g/L组织匀浆, 测定组织蛋白含量(考马斯亮兰法). 另一份为1 000 r/min离心5 min, 取上清液500 mL通过硝酸还原酶法测定NO含量, 结果以 mmol/g表示. 离心后的上清液置于-20 ℃冰箱中保存待测, 按试剂盒说明书步骤进行.
统计学处理 采用SPSS10.0统计软件进行数据分析, 结果以mean±SD表示, 组间比较采用t检验, 以P <0.05为有统计学意义.
应激组见肠黏膜固有层炎性细胞浸润(图1A), 以中性粒细胞、单核细胞为主, 中性粒细胞平均为70±12 /mm2, 单核细胞平均为52±9 /mm2, 均明显多于对照组(图1B)(30±6, 26±8 /mm2, P <0.01); 使用氨基胍组中性粒细胞和单核细胞分别为32±6, 27±4 /mm2与对照组比较无显著差异(P >0.05)(图1C), 与应激组比较差异具有显著性(P <0.01).
应激组明显高于对照组(47.5±7.9 vs 32.3±4.7 mmol/g, P <0.01); 使用氨基胍组NO平均为(27.7±12.4mmol/g), 与对照组比较无显著差异(P >0.05). 与应激组比较差异具有显著性(P <0.05). iNOS的活性应激组也明显高于对照组(6.7±1.0 vs 4.0±0.6 nkat/g, P <0.01), 使用氨基胍组与对照组比较无显著差异(3.8±0.8 vs 4.0±0.6 nkat/g, P >0.05). 与应激组比较差异具有显著性(P <0.01).
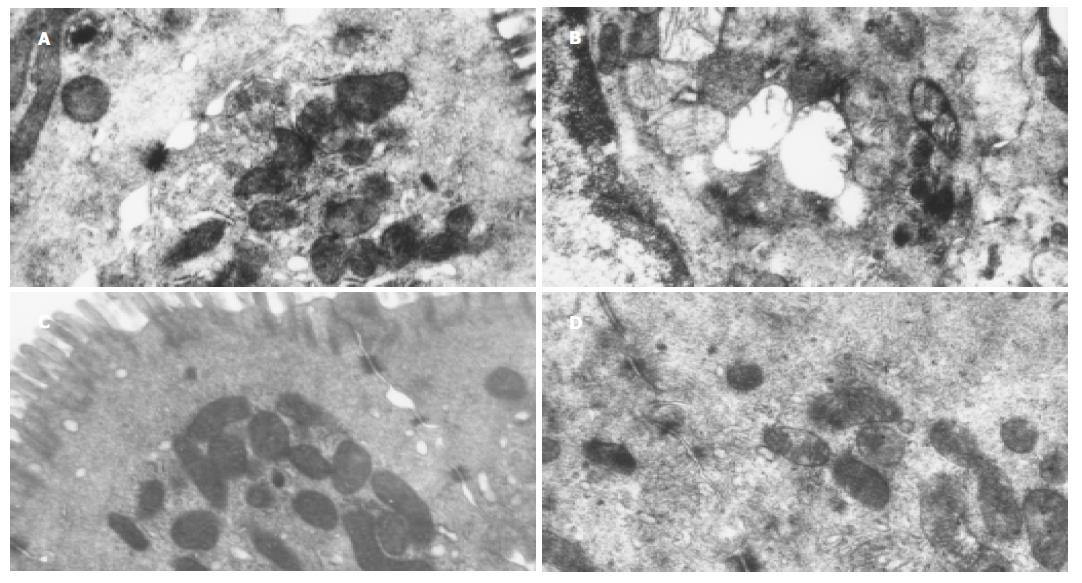
慢性应激指的是焦虑、抑郁、躯体不适或其他形式的行为变化, 常指人们日常工作和生活中所面临的各种压力. 临床和实验研究表明, 慢性应激在炎症性肠道疾病的发生和症状加重中起重要作用[6-7], 除通过影响胃肠激素分泌起作用外[8-9], 是否存在其他其机制一直是人们感兴趣的问题. 新近研究表明, 慢性应激能造成正常个体肠黏膜屏障的损伤[3-4,10]从而为肠道疾病的发生提供了可能. NO是体内一个重要的信息分子, 参与了许多炎症性疾病的发生并与屏障系统的损伤密切相关[11-13], 并与慢性应激导致的心、肝、脑细胞损伤有关[14-17], 其是否参与慢性应激时肠黏膜的损伤尚未见文献报道. 我们采用慢性束缚应激模型[4]限制了大鼠活动而未造成生理上的创伤, 可以模拟人类日常生活应激. 实验结果表明, 经14 d束缚应激大鼠肠黏膜出现炎性细胞浸润, 尽管只是轻度的炎症, 但与对照组比较仍有显著性差异. 电镜观察肠上皮细胞发现线粒体肿胀、嵴减少、消失, 线粒体空泡变性及细胞间连接松散、微绒毛稀疏、脱落等改变. 同时结肠组织NO含量增高、iNOS活性增加, 提示NO产物增加可能与慢性应激肠黏膜损伤有关.
NO在病理情况下主要由活化的诱导型一氧化氮合酶(iNOS)合成. 在肠上皮细胞[18]、肠黏膜下炎性细胞[19-21]如中性粒细胞、单核细胞、 肥大细胞、巨噬细胞均含有丰富的iNOS. iNOS的活化与缺氧、低PH、细胞因子、内毒素刺激有关[23]. 已经发现慢性束缚应激时结肠黏膜组织及血浆中有几种iNOS的诱导剂如IFN-γ[3,21]、IL-6[22]等活性增高, 从而使iNOS活化. 慢性应激诱导的细菌黏附、移位、以及增高的内毒素[22,24]也有可能参与了iNOS的活化. 活化的iNOS产生大量NO, 参与炎症细胞的趋化作用[25-26], 启动肠黏膜炎症反应. 在应激源未解除, 刺激因素持续存在情况下, NO与聚集的炎症细胞交互作用, 使炎症反应逐步放大, 导致肠黏膜炎症的持续和加重[26]. Joan et al[3]在5 d的慢性应激中未发现肠黏膜的炎症反应, 而延长应激时间达10 d时, 肠黏膜出现炎症反应, 证明了这个观点. 我们使用iNOS抑制剂抑制NO产生, 肠黏膜炎症细胞浸润减轻, 进一步证实NO参与了慢性应激肠黏膜炎症反应过程. 慢性应激时上皮超微结构的损伤也与NO含量增高、氮自由基生成有关. NO与氧生成过氧化亚硝酸阴离子ONOO-, ONOO-可诱导线粒体膜通道开放, 使线粒体去极化和肿胀, 释放内容物, 空泡变性[27]. 同时, 还直接影响NA+-K+-ATP酶的活性, 从而减少ATP的生成[23], 致细胞能量衰竭而凋亡. ONOO-尚可诱导脂质过氧化[14,27]导致线粒体膜和细胞膜的损伤. 实验研究还表明, NO能抑制细胞间连接相关蛋白ZO-1, ZO-2, ZO-3的表达, 使细胞间连接变得松散, 渗透性增加[28]. 对于慢性应激大鼠, 肠黏膜NO含量增加、上皮渗透性的增加有利于大分子抗原物质的摄入, 诱发肠黏膜炎症反应. 本实验中应激组出现线粒体的病变和细胞间连接的变化, 使用iNOS抑制剂后上述病变减轻, 证明NO参与了慢性应激导致的线粒体病变和上皮渗透性的变化.
氨基胍作为选择性的iNOS抑制剂[29-30], 选择性地抑制iNOS 活化, 而不影响其他型NO合酶的活性, 因而既抑制了iNOS活化生成过量NO造成的上皮细胞损伤, 又能够保留正常情况下少量NO的生理功能. 氨基胍还具有抗脂质过氧化的作用[14], 这对于提高细胞抗氧化应激能力也是有益的. 本实验中使用氨基胍组肠黏膜组织NO含量减低, 组织损伤情况较轻, 证明氨基胍抑制NO生成, 减轻了应激诱导的肠黏膜损伤. 因此, 本实验结果表明, 慢性应激能够造成肠黏膜的损伤, NO参与了这一过程. 氨基胍对应激诱导的肠黏膜损伤具有保护作用, 有可能用于应激状态下的肠黏膜保护治疗.
| 1. | Collins SM. Stress and the Gastrointestinal Tract IV. Modulation of intestinal inflammation by stress: basic mechanisms and clinical relevance. Am J Physiol Gastrointest Liver Physiol. 2001;280:G315-G318. [PubMed] |
| 2. | Levenstein S, Prantera C, Varvo V, Scribano ML, Andreoli A, Luzi C, Arcà M, Berto E, Milite G, Marcheggiano A. Stress and exacerbation in ulcerative colitis: a prospective study of patients enrolled in remission. Am J Gastroenterol. 2000;95:1213-1220. [PubMed] [DOI] |
| 3. | Söderholm JD, Yang PC, Ceponis P, Vohra A, Riddell R, Sherman PM, Perdue MH. Chronic stress induces mast cell-dependent bacterial adherence and initiates mucosal inflammation in rat intestine. Gastroenterology. 2002;123:1099-1108. [PubMed] [DOI] |
| 4. | Ferrier L, Mazelin L, Cenac N, Desreumaux P, Janin A, Emilie D, Colombel JF, Garcia-Villar R, Fioramonti J, Bueno L. Stress-induced disruption of colonic epithelial barrier: role of interferon-gamma and myosin light chain kinase in mice. Gastroenterology. 2003;125:795-804. [PubMed] [DOI] |
| 6. | Guthrie E, Jackson J, Shaffer J, Thompson D, Tomenson B, Creed F. Psychological disorder and severity of inflammatory bowel disease predict health-related quality of life in ulcerative colitis and Crohn's disease. Am J Gastroenterol. 2002;97:1994-1999. [PubMed] [DOI] |
| 7. | Gómez-Gil E, Vidal A, Panés J, Jaén J, Peri JM, Fernández-Egea E, Piqué JM. [Relationship between patient's subjective stress perception and the course of inflammatory bowel disease]. Gastroenterol Hepatol. 2003;26:411-416. [PubMed] |
| 10. | Barreau F, Ferrier L, Fioramonti J, Bueno L. Neonatal maternal deprivation triggers long term alterations in colonic epithelial barrier and mucosal immunity in rats. Gut. 2004;53:501-506. [PubMed] [DOI] |
| 11. | Cho CH. Current roles of nitric oxide in gastrointestinal disorders. J Physiol Paris. 2001;95:253-256. [DOI] |
| 13. | Shah V, Lyford G, Gores G, Farrugia G. Nitric oxide in gastrointestinal health and disease. Gastroenterology. 2004;126:903-913. [PubMed] [DOI] |
| 14. | Madrigal JL, Olivenza R, Moro MA, Lizasoain I, Lorenzo P, Rodrigo J, Leza JC. Glutathione depletion, lipid peroxidation and mitochondrial dysfunction are induced by chronic stress in rat brain. Neuropsychopharmacology. 2001;24:420-429. [PubMed] [DOI] |
| 15. | Li JM, Kong LD, Wang YM, Cheng CH, Zhang WY, Tan WZ. Behavioral and biochemical studies on chronic mild stress models in rats treated with a Chinese traditional prescription Banxia-houpu decoction. Life Sci. 2003;74:55-73. [PubMed] [DOI] |
| 16. | 尹 艳茹. 应激性大鼠不同组织中NO浓度的变化与血压的关系. 中国临床药理学与治疗学. 2004;9:223-225. |
| 17. | Olivenza R, Moro MA, Lizasoain I, Lorenzo P, Fernández AP, Rodrigo J, Boscá L, Leza JC. Chronic stress induces the expression of inducible nitric oxide synthase in rat brain cortex. J Neurochem. 2000;74:785-791. [PubMed] [DOI] |
| 18. | Perner A, Andresen L, Normark M, Rask-Madsen J. Constitutive expression of inducible nitric oxide synthase in the normal human colonic epithelium. Scand J Gastroenterol. 2002;37:944-948. [PubMed] [DOI] |
| 19. | Bidri M, Féger F, Varadaradjalou S, Ben Hamouda N, Guillosson JJ, Arock M. Mast cells as a source and target for nitric oxide. Int Immunopharmacol. 2001;1:1543-1558. [PubMed] [DOI] |
| 20. | Santos J, Yang PC, Söderholm JD, Benjamin M, Perdue MH. Role of mast cells in chronic stress induced colonic epithelial barrier dysfunction in the rat. Gut. 2001;48:630-636. [PubMed] [DOI] |
| 21. | Gilchrist M, Savoie M, Nohara O, Wills FL, Wallace JL, Befus AD. Nitric oxide synthase and nitric oxide production in in vivo-derived mast cells. J Leukoc Biol. 2002;71:618-624. [PubMed] |
| 22. | Witthöft T, Eckmann L, Kim JM, Kagnoff MF. Enteroinvasive bacteria directly activate expression of iNOS and NO production in human colon epithelial cells. Am J Physiol. 1998;275:G564-G571. [PubMed] |
| 23. | Taché Y, Perdue MH. Role of peripheral CRF signalling pathways in stress-related alterations of gut motility and mucosal function. Neurogastroenterol Motil. 2004;16 Suppl 1:137-142. [PubMed] [DOI] |
| 24. | Kleinert H, Schwarz PM, Förstermann U. Regulation of the expression of inducible nitric oxide synthase. Biol Chem. 2003;384:1343-1364. [PubMed] [DOI] |
| 25. | Beck PL, Xavier R, Wong J, Ezedi I, Mashimo H, Mizoguchi A, Mizoguchi E, Bhan AK, Podolsky DK. Paradoxical roles of different nitric oxide synthase isoforms in colonic injury. Am J Physiol Gastrointest Liver Physiol. 2004;286:G137-G147. [PubMed] [DOI] |
| 26. | Guzik TJ, Korbut R, Adamek-Guzik T. Nitric oxide and superoxide in inflammation and immune regulation. J Physiol Pharmacol. 2003;54:469-487. [PubMed] |
| 27. | Vieira H, Kroemer G. Mitochondria as targets of apoptosis regulation by nitric oxide. IUBMB Life. 2003;55:613-616. [PubMed] [DOI] |
| 28. | Han X, Fink MP, Uchiyama T, Yang R, Delude RL. Increased iNOS activity is essential for pulmonary epithelial tight junction dysfunction in endotoxemic mice. Am J Physiol Lung Cell Mol Physiol. 2004;286:L259-L267. [PubMed] [DOI] |
| 29. | Sun GB, Huang ZH, Sun YG, Yang WY. Intervention with nitric oxide synthase inhibitors for traumatic shock in rats. Diyi Junyi Daxue Xuebao. 2003;23:306-309. [PubMed] |
| 30. | Zhang GL, Wang YH, Teng HL, Lin ZB. Effects of aminoguanidine on nitric oxide production induced by inflammatory cytokines and endotoxin in cultured rat hepatocytes. World J Gastroenterol. 2001;7:331-334. [PubMed] [DOI] |