修回日期: 2004-09-09
接受日期: 2004-09-30
在线出版日期: 2004-10-15
目的: 构建乙型肝炎病毒包膜大蛋白的酵母表达载体, 研究其自激活作用.
方法: 用多聚酶链反应(PCR)法扩增HBV包膜大蛋白(LHBs), 前-S1蛋白(pre-S1), 前-S2蛋白(pre-S2)及主蛋白(SHBs)的编码基因, 并在其5'端引入EcoR I/BamH I内切酶位点, 分别连接入酵母表达载体pGBKT7中, 构建酵母表达质粒, 转化酵母细胞AH109并在其内表达, 然后分别铺于含有X-a-半乳糖的营养缺陷型培养基SD/-Trp和SD/-Trp-His-Ade上进行自激活验证(蓝/白筛选).
结果: 成功克隆出编码各种HBV包膜蛋白的基因, 构建表达载体并在酵母细胞中表达, 转化了pGBKT7-LHBs和pGBKT7-preS1的AH109酵母细胞在两种营养缺陷型培养基上均可正常生长, 并且可以产生a-半乳糖苷酶从而在铺有X-a-半乳糖的培养基上呈现蓝色, 而转化了pGBKT7-preS2和pGBKT7-SHBs的细胞只能在SD/-Trp的培养基上生长, 且没有变蓝.
结论: LHBs可以作为反式激活子发挥作用, 代替GAL4蛋白的激活域来激活GAL4上游激活序列(GAL UAS)和TATA盒, 从而激活了下游报告基因(ADE2, HIS3, MEL1和LacZ)的表达, 并且其自激活作用来自于前-S1结构域.
引文著录: 纪冬, 成军, 陆荫英, 董菁, 郭江, 刘妍. 乙型肝炎病毒包膜大蛋白的自激活. 世界华人消化杂志 2004; 12(10): 2321-2324
Revised: September 9, 2004
Accepted: September 30, 2004
Published online: October 15, 2004
AIM: To construct the yeast expression vector of hepatitis B virus large surface protein (LHBs), and to study its autonomous activation.
METHODS: The Matchmaker GAL4 two-hybrid technique was used. The LHBs, pre-S1, pre-S2 and SHBs genes were amplified by polymerase chain reaction (PCR) with respective primers. The amplified PCR fragments were then subcloned into the EcoR I/BamH I sites (5'ands) of pGBKT7 vector to obtain the expression vectors including pGBKT7(-)-LHBs, pGBKT7(-)-preS1, pGBKT7(-)-preS2 and pGBKT7(-)-SHBs. This vectors were identifed by PCR and digestion of EcoR I/BamH I. After the constructed vectors were transformed into yeast AH109, the yeast cells were plated on synthetic dropout nutrient medium (SD/-Trp and SD/-Trp-His-Ade) containing x-a-gal for testing their autonomous activation.
RESULTS: The yeast expression vectors were constructed. The yeast cells transformed with pGBKT7-LHB and pGBKT7-preS1 vectors could grow well on both of the media. However, cells transformed with pGBKT7-preS2 and pGBKT7-SHBs vectors could only grow on the SD/-Trp medium.
CONCLUSION: The LHBs functions as a transcriptional transactivator, and serves as the functional GAL4 activation domain (AD) to activate transcription of reporter genes (ADE2, HIS3, MEL1 and LacZ). The autonomous activation of LHBs roots in its pre-S1 domain.
- Citation: Ji D, Cheng J, Lu YY, Dong J, Guo J, Liu Y. Autonomous activation of hepatitis B virus large surface protein. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2321-2324
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2321.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2321
乙型肝炎病毒(HBV)是一种嗜肝部分双链DNA病毒[1-4], 不仅引起急、慢性病毒性肝炎[5-6], 而且与肝纤维化(LF)、肝细胞癌(HCC)的发生发展密切相关[7-9]. HBV DNA的基因组具有4个主要的开放读码框架(ORF), 分别命名为S、C、P、X区, 其中S区通过三个框架(in-frame)启始密码子(ATG)分为三个结构区: 前-S1, 前-S2和S结构域, 从这三个ATG开始编码产生三种大小不等的包膜蛋白[10-12]: 主蛋白(SHBs), 中蛋白(MHBs: 前-S2+S)和大蛋白(LHBs: 前-S1+前-S2+S)[13-15]. LHBs在肝细胞内表达最少, 但对于HBV在细胞内的持续感染及细胞生长状态都有着重要的影响, 介导HBV对于肝细胞的黏附, 病毒颗粒的装配、释放, 超螺旋DNA扩增的调节及转录的反式激活, 参与了机体内广泛的信导途径[16]. 我们运用酵母双杂交系统3的DNA结合域(BD)融合载体pGBKT7构建了LHBs及其组成部分前-S1, 前-S2和SHBs的酵母表达质粒, 转化酵母单倍体细胞AH109后进行自激活的研究, 为进一步阐明HBV包膜蛋白的多重作用及HBV致病机制而提供理论基础[17-19].
工具酶、Tag DNA 聚合酶、T4 DNA 连接酶及限制性内切酶均购自Takara公司; 中间载体pGEM-T购自Promega公司, 玻璃奶纯化试剂盒购自博大公司, 大肠杆菌(DH5a)本室保存; 酿酒酵母AH109酵母株、DNA-BD载体pGBKT7、酵母培养基(SD/-Trp、SD/-Trp/-His/-Ade), X-a-半乳糖苷(gal)、酵母蛋白提取试剂盒等购自Clontech公司, 半硫酸腺苷、醋酸锂及其他试剂均购自Sigma公司; 抗c-myc单克隆抗体本室自制, 由购自ATCC的1-9E10.2杂交瘤产生; 引物合成及DNA测序由上海博亚公司完成.
根据董菁et al[20-23]发表的adr亚型HBV的基因序列, 分别设计LHBs, 前-S1, 前-S2和SHBs编码区的上游和下游引物(表1), 同时在引物两端引入EcoR I/BamH I内切酶位点.使用反应体系25 mL, 以G376-7(GenBank号: AF384371)质粒为模板, 放入PE9600 PCR 仪中扩增. 9 g/L琼脂糖凝胶电泳鉴定扩增结果. PCR产物将经玻璃奶回收后, 与pGEM-T 载体及T4 DNA连接酶混全, 在16 ℃连接过夜, 随后转化入用氯化钙法制备的大肠杆菌DH5a感受态细胞, 在铺有IPTG及X-gal 的氨苄青霉素琼脂糖(LB)平板上进行蓝白菌落筛选, 挑取阳性菌落用碱裂解法提取质粒DNA 进行酶切鉴定及测序正确. 之后亚克隆至pGBKT7 载体中, 转化DH5a感受态, 接种于卡那霉素LB 平板上, 随机挑取平板上生长的菌落, 碱裂解法抽提质粒DNA, 双酶切及PCR鉴定所得质粒正确, 分别命名为pGBKT7-LHBs, pGBKT7-preS1, pGBKT7-preS2, pGBKT7-SHBs. 酵母细胞中的表达, 用醋酸锂法转化, 按Clontech 公司操作手册进行, 转化后铺板于SD/ -Trp进行筛选. 挑取2-3 mm 大小的菌落过夜培养后, 提取酵母蛋白质, 操作步骤按Clontech 公司试剂盒说明书进行. 表达产物的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE) 和Western 免疫印迹分析均按常规方法进行.将构建好的LHBs, 前-S1, 前-S2和SHBs酵母表达载体用醋酸锂法转入单倍体酵母细胞AH109, 室温放置4 h后平铺于含有X-a-gal的SD/-Trp和SD/-Trp-His-Ade的培养基上, 30 ℃, 生长3-7 d验证自激活.
| 目的基因 | 引物 | 片段大小 |
| LHBs | 5'GAATTC AGC ATG GGA GGT TGG TCT TC 3' | |
| 5'GGATCC TCA AAT GTA TAC CCA AAG AC 3' | 1 218 bp | |
| 前-S1 | 5'GAATTC AGC ATG GGA GGT TGG TCT TC 3' | |
| 5'GGATCC TTA GGC CTG AGG ATG ACT G 3' | 375 bp | |
| 前-S2 | 5'GAATTC ATG CAG TGG AAC TCC ACC 3' | |
| 5'GGATCC TTA GTT CGG TGC AGG GTC 3' | 180 bp | |
| SHBs | 5'GAATTC ATG GAG AAC ACA ACA TCA GG 3' | 693 bp |
| 5'GGATCC TCA AAT GTA TAC CCA AAG AC 3' |
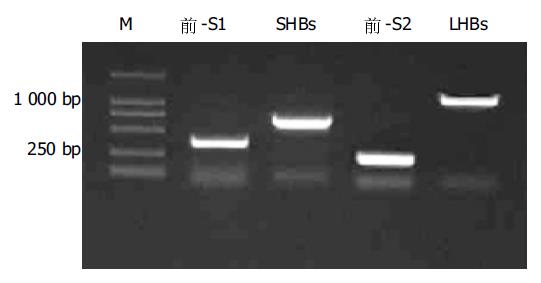
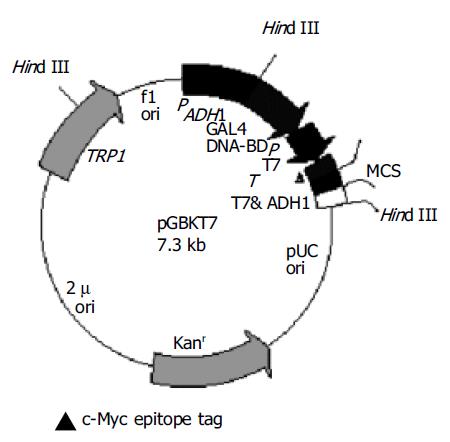
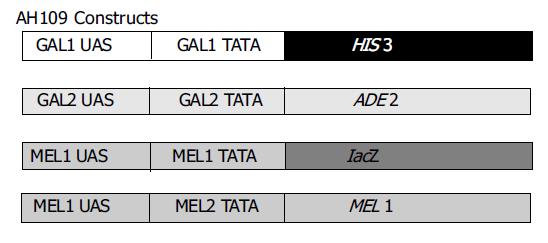
利用自行设计的引物成功克隆出LHBs, 前-S1, 前-S2和SHBs基因(图1), 连接pGEM-T载体后EcoRI/BamH I双酶切鉴定, 与预期片段符合后, 回收酶切产物连接到用相同酶所切的pGBKT7载体中.再次酶切鉴定结果正确. (图2)为DNA-BD载体pGBKT7结构图. (图3)为单倍体酵母细胞AH109报告基因结构图.
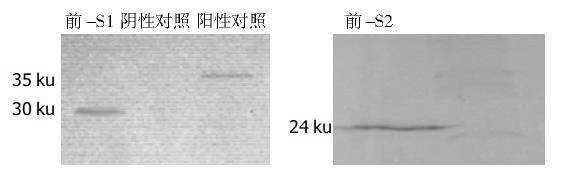
提取转化pGBKT7-preS1和pGBKT7-preS2质粒的酵母蛋白质, 进行SDS-PAGE和Western 免疫印迹分析. 结果显示对照无表达而转化了pGBKT7-preS1和 pGBKT7-preS2的Western 印迹分析可见明显目的条带且无杂带(图4).
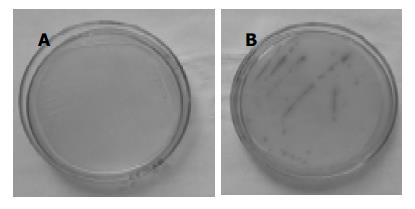
转化了pGBKT7-LHBs和pGBKT7-preS1质粒的酵母细胞可以在含有x-a-gal的SD/-Trp和SD/-Trp-His-Ade的培养基上生长, 并呈现蓝色, 而转化了另外两种质粒的酵母细胞只在含有x-a-gal的SD/-Trp的培养基上生长(表2), 并且无蓝色菌落(图5).
| 转化质粒 | SD/-Trp | SD/-Trp-Ade-His | 克隆颜色 |
| pGBKT7-LHBs | + | + | 蓝 |
| pGBKT7-preS1 | + | + | 蓝 |
| pGBKT7-preS2 | + | - | 白 |
| pGBKT7-SHBs | + | - | 白 |
酵母双杂交系统是近年来新发展起来的一种分析真核细胞中蛋白/蛋白相互作用的有效的基因分析方法, 他的产生为研究蛋白在体内生理情况下的相互作用提供了一种新的遗传学方法[24-26]. 酵母双杂交系统通过将两个推定有相互作用的蛋白X和Y分别融合到一酵母转录激活因子的BD和AD上, X与Y的相互作用重构了激活因子, 从而导致下游报告基因的转录, 产生容易探测到的表型.我们选用的是Clontech公司的MATCHMAKER酵母双杂交系统-3, 单倍体细胞AH109株带有4种报告基因分别为HIS3(组氨酸), ADE2(腺苷), MEL1(a-半乳糖苷酶)和LacZ(b-半乳糖苷酶), 加上两种载体中分别带有的TRP1(色氨酸)和LEU2(亮氨酸), 使得筛选后阳性菌落能在缺乏上述4种氨基酸营养的培养板上生长. 而且MEL1基因表达的a-半乳糖苷酶为分泌型蛋白, 可以在固相培养基中直接与X-a-gal底物相互作用, 显示为蓝色, 相对于检测b-半乳糖苷酶来说操作得到了极大的简化.该系统由于增加了报告基因的种类, 使筛选结果阳性率达到95%[27-30].
LHBs蛋白由400个氨基酸残基组成, 由前-S1, 前-S2和主S结构域组成, 其中主S完全重叠于HBV DNA多聚酶的逆转录酶区, 前-S1/前-S2区位于HBV DNA多聚酶的分隔区(spacer)内. LHBs是公认的反式激活因子[31-33], 其前-S1, 前-S2结构域均具有反式激活功能. 前-S2结构域可以与蛋白激酶C(PKC)a/b结合, 发生磷酸化反应触发了PKC依赖的c-Raf-1/MPKKK(丝裂原激活蛋白激酶激酶激酶)信号转导系统, 从而激活转录因子, 如激活蛋白-1(AP-1), 细胞核因子-kB(NF-kB), AP-2、血清应答因子(SRF), Sp1和c-myc, c-fos启动子, 参与病毒感染后的炎症反应和肝细胞癌的发生[34-36], 根据致癌两步模型: 起始/促进, 前-S2具有的肿瘤启动子样的功能: 具有关键性突变(起始)的细胞可以被阳性选择出来(促进), 这个过程也许可以用来解释HCC发展过程中潜伏期长的原因. 最近的研究表明前-S1蛋白也具有反式激活作用. Sell et al运用转基因小鼠来研究前-S1蛋白的功能, 过度表达的前-S1蛋白引起了持久的炎症, 从而导致了DNA损伤. Hildt et al也报道了前-S1的一小部分具有反式激活作用.HBV所致的HCC细胞表现了转化生长因子α(TGF-α)表达的上调, 但原因尚不清楚, Ono et al研究说明了前-S1具有反式激活区域, 并且上调了HCC HuH6细胞系的TGF-α约2倍, 说明前-S1蛋白对于TGF-α的反式激活在肝癌发病机制中具有关键性作用.Kim et al将不同长度的前-S1结构域与GAL4蛋白的DNA结合域相连接, 转化酵母细胞后表达融合蛋白, 检测报告基因lacZ的b-半乳糖苷酶活性; 将GAL4-前-S1基因构建入哺乳细胞表达载体pREP8中, 与GAL4反应性的氯霉素乙酰转移酶(CAT)报告载体G5E1bCAT共转染HepG2细胞, 检测CAT吸光度值, 这两各方法均显示出GAL4-前-S1(aa 1-90)融合蛋白具有强烈的反式激活作用, 进一步的缺失突变分析及氨基酸序列分析显示了在21-56处的片段中正如许多酸性激活因子一样富含天冬氨酸, 而在57-90之间没有酸性氨基酸残基, 认为前-S1(aa 21-56)是反式激活必需的片段, 而疏水区(aa 57-90)的结构可以增强反式激活作用. 前-S1富含脯氨酸, 可以形成一个框架协助其自身折叠为独特的结构与转录因子相互作用. 总之, 21到56残基包括了病毒中和表位以及肝细胞受体结合位点, 这个片段具有多种功能.整合的病毒DNA发生了许多变化, 整合的前-S1区基因可以与许多宿主转录因子编码基因重组, 从而产生新的基因编码功能性的反式激活因子.
我们将LHBs蛋白进行分段研究, 将LHBs, 前-S1, 前-S2, SHBs基因构建入DNA-BD载体pGBKT7中, 转化AH109细胞表达融合蛋白, 并进行诱饵蛋白的自激活实验. 结果显示LHBs和前-S1具有自激活作用, 而前-S2及SHBs无此作用, 说明LHBs蛋白的自激活作用主要来自于其前-S1域, 这与以前的研究结果相一致, 也对Kim et al的研究进行了拓展, 对于LHBs功能的多样性、复杂性有了更加深入的理解, 从而为HBV的病毒学研究, HBV感染相关性疾病的诊断、治疗措施等方面提供了线索.
| 1. | Huy TT, Abe K. Molecular epidemiology of hepatitis B and C virus infections in Asia. Pediatr Int. 2004;46:223-230. [PubMed] [DOI] |
| 2. | Li J, Ou JH. Differential regulation of hepatitis B virus gene expression by the Sp1 transcription factor. J Virol. 2001;75:8400-8406. [PubMed] [DOI] |
| 3. | Liu ZW, Han QY, Zhang N, Kang W. Sequential changes of serum ferritin levels and their clinical significance in lamivudine-treated patients with chronic viral hepatitis B. World J Gastroenterol. 2004;10:972-976. [PubMed] |
| 4. | Doitsh G, Shaul Y. Enhancer I predominance in hepatitis B virus gene expression. Mol Cell Biol. 2004;24:1799-1808. [PubMed] [DOI] |
| 5. | Su GG, Pan KH, Zhao NF, Fang SH, Yang DH, Zhou Y. Efficacy and safety of lamivudine treatment for chronic hepatitis B in pregnancy. World J Gastroenterol. 2004;10:910-912. [PubMed] |
| 6. | Assogba BD, Paik NW, Rho HM. Transcriptional activation of gammaherpesviral oncogene promoters by the hepatitis B viral X protein (HBx). DNA Cell Biol. 2004;23:141-148. [PubMed] [DOI] |
| 7. | Chen CH, Chen YY, Chen GH, Yang SS, Tang HS, Lin HH, Lin DY, Lo SK, Du JM, Chang TT. Hepatitis B virus transmission and hepatocarcinogenesis: a 9 year retrospective cohort of 13676 relatives with hepatocellular carcinoma. J Hepatol. 2004;40:653-659. [PubMed] [DOI] |
| 8. | Sung VM, Lai MM. Murine retroviral pseudotype virus containing hepatitis B virus large and small surface antigens confers specific tropism for primary human hepatocytes: a potential liver-specific targeting system. J Virol. 2002;76:912-917. [PubMed] [DOI] |
| 9. | 纪 冬, 成 军, 王 建军, 董 菁, 郭 江, 刘 妍, 杨 倩, 党 晓燕, 王 春花. 应用抑制性消减杂交技术克隆乙型肝炎病毒前-S1蛋白反式激活的相关基因. 胃肠病学和肝病学杂志. 2004;13:3-8. |
| 10. | 纪 冬, 成 军, 郭 江, 王 建军, 刘 妍, 杨 倩, 王 春花, 党 晓燕. 乙型肝炎病毒前-S1蛋白反式激活蛋白1基因的克隆化研究. 胃肠病学和肝病学杂志. 2004;13:9-12. |
| 11. | Kondo J, Shimomura H, Fujioka S, Iwasaki Y, Takagi S, Ohnishi Y, Tsuji H, Sakaguchi K, Yamamoto K, Tsuji T. Mutations in the hepatitis B virus preS2 region and abrogated receptor activity for polymerized human albumin. Acta Med Okayama. 2002;56:193-198. [PubMed] |
| 12. | Zuckerman JN, Zuckerman AJ. Mutations of the surface protein of hepatitis B virus. Antiviral Res. 2003;60:75-78. [PubMed] [DOI] |
| 13. | Paran N, Cooper A, Shaul Y. Interaction of hepatitis B virus with cells. Rev Med Virol. 2003;13:137-143. [PubMed] [DOI] |
| 14. | Stöckl L, Berting A, Malkowski B, Foerste R, Hofschneider PH, Hildt E. Integrity of c-Raf-1/MEK signal transduction cascade is essential for hepatitis B virus gene expression. Oncogene. 2003;22:2604-2610. [PubMed] [DOI] |
| 15. | Foo NC, Ahn BY, Ma X, Hyun W, Yen TS. Cellular vacuolization and apoptosis induced by hepatitis B virus large surface protein. Hepatology. 2002;36:1400-1407. [PubMed] [DOI] |
| 16. | Hartmann-Stühler C, Prange R. Hepatitis B virus large envelope protein interacts with gamma2-adaptin, a clathrin adaptor-related protein. J Virol. 2001;75:5343-5351. [PubMed] [DOI] |
| 18. | 邵 清, 成 军, 白 雪帆, 王 琳, 张 健, 梁 耀东, 刘 敏, 李 强. 酵母双杂交技术筛选白细胞中HCV NS3蛋白结合蛋白基因. 世界华人消化杂志. 2003;11:1897-1900. [DOI] |
| 19. | 刘 敏, 成 军, 张 树林, 王 琳, 邵 清, 张 健, 梁 耀东. 应用酵母双杂交技术筛选白细胞cDNA文库与NS5ATP1结合蛋白基因. 世界华人消化杂志. 2004;12:836-839[DOI: 10.11569/wcjd.v12.i17.1737]20 王琳, 李克, 成军, 陆荫英, 张健, 陈天艳, 洪源, 刘妍, 王刚, 钟彦伟. 酵母双杂交技术筛选HcbP6结合的肝细胞蛋白编码基因. 世界华人消化杂志 2003;11:385-388. [DOI] |
| 26. | Wang XZ, Jiang XR, Chen XC, Chen ZX, Li D, Lin JY, Tao QM. Seek protein which can interact with hepatitis B virus X protein from human liver cDNA library by yeast two-hybrid system. World J Gastroenterol. 2002;8:95-98. [PubMed] [DOI] |
| 27. | Nagpal S, Ghosn CR, Chandraratna RA. Identification of nuclear receptor interacting proteins using yeast two-hybrid technology. Applications to drug discovery. Methods Mol Biol. 2001;176:359-376. [PubMed] |
| 28. | Serebriiskii IG, Toby GG, Finley RL Jr, Golemis EA. Genomic analysis utilizing the yeast two-hybrid system. Methods Mol Biol. 2001;175:415-454. [PubMed] [DOI] |
| 29. | Gietz RD, Woods RA. Screening for protein-protein interactions in the yeast two-hybrid system. Methods Mol Biol. 2002;185:471-486. [PubMed] |
| 30. | Robek MD, Boyd BS, Wieland SF, Chisari FV. Signal transduction pathways that inhibit hepatitis B virus replication. Proc Natl Acad Sci USA. 2004;101:1743-1747. [PubMed] [DOI] |
| 31. | Cho EW, Park JH, Yoo OJ, Kim KL. Translocation and accumulation of exogeneous hepatitis B virus preS surface proteins in the cell nucleus. J Cell Sci. 2001;114:1115-1123. [PubMed] |
| 32. | Guo SP, Wang WL, Zhai YQ, Zhao YL. Expression of nuclear factor-kappa B in hepatocellular carcinoma and its relation with the X protein of hepatitis B virus. World J Gastroenterol. 2001;7:340-344. [PubMed] [DOI] |