修回日期: 2003-07-20
接受日期: 2003-08-18
在线出版日期: 2004-01-15
目的: 探索食管癌淋巴结微转移的基因诊断方法并评价其预后意义.
方法: 应用逆转录聚合酶链式反应法(RT-PCR), 对63例食管鳞癌患者手术后病理诊断阴性的区域淋巴结(pN0)进行进步研究, 检测其Mucin1 (myc1)基因mRNA表达, 对淋巴结微转移进行基因诊断. 对患者随访, 应用x2检验比较患者的生存差别; 采用Logistic多因素回归分析, 判定独立的预后因素.
结果: 淋巴结微转移基因诊断的特异度为100%(30/30); 淋巴结微转移基因诊断的灵敏度为90%(27/30). 366枚pN0淋巴结中, 22例患者 (34.9%)的30枚淋巴结(8.2%)检测到myc1 基因mRNA的表达, 诊断为淋巴结微转移. 淋巴结微转移者3a生存率为54.5%(12/22), 无转移者3 a生存率为80.5%(33/41), 两组相比较差别显著(P<0.01). 多因素回归分析结果显示, T3肿瘤(P<0.05, OR = 7.17) 淋巴结微转移(P<0.05, OR = 3.71)是独立的预后因素.
结论: 应用RT-PCR法检测食管癌区域淋巴结中myc1基因mRNA的表达, 可以诊断淋巴结微转移; 淋巴结微转移与pN0患者预后不良有关.
引文著录: 王洲, 刘相燕, 刘凡英, 陈景寒. 食管癌淋巴结微转移的诊断及预后的前瞻性研究. 世界华人消化杂志 2004; 12(1): 121-124
Revised: July 20, 2003
Accepted: August 18, 2003
Published online: January 15, 2004
AIM: To investigate genetically diagnostic method of lymph node micrometastasis in patients with esophageal cancer and to evaluate its prognostic significance
METHODS: Using assays of reverse transcriptase-polymerase chain reaction (RT-PCR), three hundred and sixty-six regional lymph nodes obtained from sixty-three patients with squamous cell cancer of the esophagus without invasion confirmed by routine histopathologic analysis (pN0) were studied to further detect mRNA for Mucin1 (myc1) gene and determine micrometastasis. All the patients were followed up. Survival difference was compared by x2 test. Logistic regressive analysis was performed to determined independent prognostic factors.
RESULTS: Specificity of genetic diagnosis for lymph node micrometastasis was 100% (30/30); Sensitivity of genetic diagnosis for lymph node micrometastasis was 97% (27/30). myc1 mRNA was identified in thirty lymph nodes (8.2%) from twenty-two patients (34.9%). Lymph node microme-tastasis was diagnosed in these patients. Survival rate at 3-year in patients with nodal micrometastasis (54.5%) was lower than that in patients without nodal micrometastasis (80.5%) (P < 0.01). In logistic analysis nodal micrometastasis (P < 0.05, OR = 3.71) and T3 tumor (P < 0.05, OR = 7.17) were independent prognostic factors.
CONCLUSION: Nodal micrometastasis can be genetically diagnosed by the detection of expression of myc1 mRNA in lymph node of patients with pN0 esophageal carcinoma; Poorer prognosis after radical surgery in the patients may be correlated with nodal micrometastasis.
- Citation: Wang Z, Liu XY, Liu FY, Chen JH. Lymph node micrometastasis in patients with esophageal cancer: diagnosis and a prospective study of impact on prognosis. Shijie Huaren Xiaohua Zazhi 2004; 12(1): 121-124
- URL: https://www.wjgnet.com/1009-3079/full/v12/i1/121.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i1.121
食管癌在我国常见[1-4]. 区域淋巴结转移 (N1) 是食管癌重要的不利预后因素, 手术后5年生存率约10%, 多数患者死于手术后肿瘤转移复发; 无淋巴结转移(N0)的食管癌患者, 根治切除后5 a生存率可达70%, 但也仍有部分患者发生肿瘤的早期转移复发[5-8]. N0食管癌患者(I-IIA期), 手术后肿瘤的早期转移复发可能与常规病理检查漏诊的淋巴结微转移有关[9-11]. 粘蛋白1 (Mucin1, myc1)基因是上皮组织特异性标志物, 在上皮组织及起源于上皮组织的恶性肿瘤中有广泛表达, 但是正常淋巴结中无该基因的表达[12-15,18], 如果在食管癌患者的区域淋巴结中检测到MUC1基因的表达, 就可以诊断为淋巴结转移癌[12]. 我们应用逆转录聚合酶链反应法(RT-PCR), 检测病理阴性的食管癌区域淋巴结中myc1基因mRNA的表达, 诊断食管癌淋巴结微转移并对其预后意义进行探讨.
我院胸外科1999-01/2000-01根治切除后病理诊断为无淋巴结转移(pN0)的食管鳞癌患者63例, 男48例, 女15例, 年龄47-71(平均58±5岁)(表1). TNM分期依照AJCC1997年标准[5]. 食管癌根治性切除采用Ivor-Lewis术式, 即右胸及上腹部切口, 食管大部切除. 依照食管癌淋巴结分布图[5]清扫区域淋巴结, 右胸顶部食管-胃吻合器(美国强生公司)机械法吻合. 本组病例手术后病理检查食管上、下断端无残留癌. 共清扫区域淋巴结366枚, 将摘除之淋巴结沿长轴切开, 标号后随机选取一半送常规病理检查, 另一半用锡箔纸包裹后浸入液氮中1 min速冻, 然后置于-80 ℃冰箱内保存, 用于RT-PCR. 对照组淋巴结取自本科同期手术治疗的食管疾病患者, 其中阴性对照组为食管良性病变的食管旁淋巴结30枚, 阳性对照组为食管鳞癌术后病理诊断淋巴结转移癌的区域淋巴结15枚, 癌组织标本15个. 本组患者无严重的围手术期并发症, 手术后对患者随访3 a, 随访率100%, 本组病例未经手术后辅助放、化疗. 每年对患者至少进行两次复查, 监测有否手术后肿瘤复发或转移. 复查包括全面体检、上消化道造影检查、胸部CT扫描、腹部超声检查, 必要时纤维食管镜检查. 记录肿瘤复发或转移的部位和时间, 死于肿瘤复发或转移的患者纳入预后分析中.
| 临床特征 | n | 3年生存(%) |
| 性别 | ||
| 男 | 43 | 31 (72.1) |
| 女 | 20 | 14 (70) |
| 肿瘤位置 | ||
| 胸下段 | 25 | 19 (76) |
| 胸中段 | 38 | 34 (89.5) |
| 病变长度 | ||
| <3 cm | 8 | 7 (12.8) |
| 3-5 cm | 23 | 17 (73.9) |
| >5 cm | 32 | 21 (65.6) |
| TNM分期 | ||
| I (T1) | 11 | 9 (81.8) |
| IIA(T2) | 35 | 29 (82.9) |
| IIIA(T3) | 17 | 7 (41.2) |
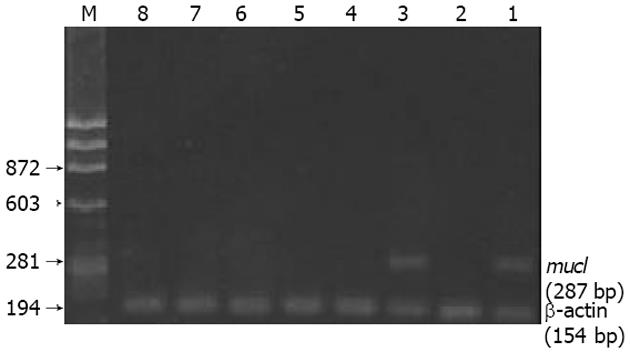
淋巴结微转移的诊断方法参照相关的报道[12,13]: 按TRIzol试剂(GIBCOBRL公司)说明书, 提取每枚淋巴结标本的总RNA; 使用RT-PCR试剂盒(Takara shuzo公司), 按操作说明将其反转录成cNDA, 然后在下列条件下进行PCR: 94 ℃ 2 min, 50 ℃ 1 min, 72 ℃ 1.5 min, 共30次循环; PCR产物电泳, 应用数码凝胶图像分析系统记录结果, 在287 bp处显带者为myc1基因mRNA阳性(选用的myc1基因上、下游引物可以扩增287 bp的cDNA片段), 诊断为淋巴结微转移. PCR阳性产物提纯, 由宝生物工程(大连)有限公司完成cDNA测序.
统计学处理 应用x2检验比较有、无淋巴结微转移患者的生存差别, P<0.05为有显著差别; 应用SPSS10.0软件进行Logistic多因素回归分析, 判定独立的预后因素.
阳性对照组的15枚淋巴结中, 12枚检测到了myc1基因mRNA的表达. 15个癌组织标本均为myc1基因mRNA阳性. 对myc1基因mRNA阳性电泳标本测序, 结果显示该287 bp的cDNA片段与人类MUC1基因100%同源. 阴性对照组的30枚淋巴结均无myc1基因mRNA的表达. 以病理诊断作为"金标准", 基因诊断的灵敏度为90%(27/30), 特异度为100%(30/30). 基因诊断的特异度高表明, 对myc1基因mRNA阳性淋巴结, 提示有淋巴结转移癌存在.
实验组63例患者的366枚淋巴结中, 22例患者(34.9%)的30枚淋巴结(8.2%)检测到myc1基因mRNA的表达, 诊断为淋巴结微转移. 根据基因诊断分期, 这些患者的TNM分期由Ⅰ-ⅡA期上调为ⅡB-Ⅲ期. PCR产物凝胶电泳照片见图1, myc1基因mRNA阳性患者临床资料见表2.
| 编号 | 肿瘤位置 | pTNM分期 | 阳性淋巴结站1 | 基因再分期 | 预后 |
| 1 | 胸下段 | I (T1) | 8M | IIB | 健在 |
| 2 | 胸下段 | I (T1) | 8L | IIB | 健在 |
| 3 | 胸下段 | I (T1) | 8M | IIB | 健在 |
| 4 | 胸下段 | I (T1) | 8M, 17 | IIB | 死亡 |
| 5 | 胸中段 | IIA (T2) | 8L (2枚) | IIB | 死亡 |
| 6 | 胸中段 | IIA (T2) | 8M, 8L | IIB | 死亡 |
| 7 | 胸中段 | IIA (T2) | 8L | IIB | 健在 |
| 8 | 胸下段 | IIA (T2) | 8M | IIB | 死亡 |
| 9 | 胸中段 | IIA (T2) | 8L | IIB | 死亡 |
| 10 | 胸中段 | IIA (T2) | 8M | IIB | 死亡 |
| 11 | 胸中段 | IIA (T2) | 8M, 8L | IIB | 健在 |
| 12 | 胸中段 | IIA (T2) | 8L | IIB | 死亡 |
| 13 | 胸中段 | IIA (T2) | 8L | IIB | 健在 |
| 14 | 胸中段 | IIA (T2) | 8L | IIB | 健在 |
| 15 | 胸下段 | IIA (T2) | 8L, 17(2枚) | IIB | 健在 |
| 16 | 胸中段 | IIA (T3) | 8L | III | 死亡 |
| 17 | 胸中段 | IIA (T3) | 8M, 7 | III | 健在 |
| 18 | 胸下段 | IIA (T3) | 8M | III | 健在 |
| 19 | 胸中段 | IIA (T3) | 17 | III | 健在 |
| 20 | 胸中段 | IIA (T3) | 8M | III | 健在 |
| 21 | 胸下段 | IIA (T3) | 8M(2枚) | III | 死亡 |
| 22 | 胸中段 | IIA (T3) | 8M | III | 死亡 |
手术后3 a随访期内, 63患者中有22例发生肿瘤复发或转移(34.9%), 其中的18例患者随访终结时死亡, 3 a生存率为71.4%. 18例的死亡患者中, 淋巴结微转移者占10例, 无微转移者占8例. 有淋巴结微转移患者的3 a生存率为54.5%(12/22), 无转移者3 a生存率为80.5%(33/41), 两组相比较差别非常显著(x2 = 4.72, P<0.01). 对年龄(连续变量)、性别、肿瘤位置、病变长度、肿瘤T分期及有无淋巴结微转移进行Logistic多因素回归分析(表3), 结果显示肿瘤的T分期和淋巴结微转移是pN0食管鳞癌患者独立的预后因素(P<0.05), 患者的3 a死亡率随T分期增加和淋巴结隐匿性微转移的发生而增高. T3患者死亡的概率是T1患者的7.1倍(OR = 7.175); 淋巴结隐匿性微转移患者死亡的概率是无转移患者的3.7倍(OR = 3.716).
| 预后因素 | 回归系数 | S.E. | Wald统计量 | P值 | OR值 | 95%CI |
| 肿瘤T分期: T3 vs T1 | 1.971 | 0.970 | 4.130 | 0.042 | 7.175 | 1.073-47.990 |
| 淋巴结微转移: 有 vs 无 | 1.313 | 0.648 | 4.102 | 0.043 | 3.716 | 1.043-13.234 |
pN0(Ⅰ-ⅡA期)食管癌患者, 虽然病变比较局限、无淋巴结转移, 但是手术切除后, 也仍然有部分患者发生肿瘤转移、复发. Raja et al[9]研究发现, pN0食管癌患者根治性切除手术后, 肿瘤的转移、复发率可高达30-50%. 目前, HE染色常规病理检查是诊断淋巴结转移癌的标准方法, 临床通常仅对淋巴结标本的一张或几张切片进行病理检查, 这种做法对淋巴结微小转移病灶的漏诊高达20%[16]. 常规病理检查漏诊的微小转移病灶称为淋巴结微转移[17], 淋巴结微转移导致了对TNM分期的低估. 许多研究认为, pN0食管癌患者根治性切除手术后, 肿瘤的早期转移、复发可能与淋巴结微转移有关[9-11]. 淋巴结标本连续切片及免疫组化检查可降低淋巴结微转移的漏诊率[17-18], 提高TNM分期的准确性. 但是, 对淋巴结进行连续切片病理检查, 工作烦琐、费时、费力, 一般情况下在日常工作中不能常规应用. 近年来, 有一些应用分子生物学技术诊断淋巴结微转移的研究报道, 与连续切片和免疫组化方法相比较, 具有更高的灵敏度[9-10,17].
myc1基因是一种上皮组织特异性标志物, 位于染色体1q21-24, 编码上皮组织细胞膜上粘蛋白的核心蛋白, 起源于胚胎前肠的大部分胃肠道组织和食管鳞状上皮, 均有myc1基因的表达, 但正常的淋巴结组织中则无该基因的表达[12-13,15,18]. 起源于鳞状上皮的食管鳞癌亦保留myc1基因的表达[14], 如果在食管癌患者的区域淋巴结中检测到myc1基因的表达, 就可以诊断为淋巴结转移癌[12]. Salerno et al[18]应用RT-PCR方法检测myc1基因mRNA表达, 诊断非小细胞肺癌淋巴结微转移, 显示出该方法具有较高的灵敏度, 107个细胞中混有1个myc1基因阳性细胞即可检测到myc1 基因mRNA的表达.
我们通过对照组的myc1 基因mRNA检测, 显示了该方法诊断食管癌淋巴结转移有较高的特异度, 30枚阴性对照淋巴结中均无myc1 基因mRNA的表达, 这表明对myc1 基因mRNA阳性淋巴结, 临床上可以诊断为淋巴结转移癌. 但是, 在以病理结果作为"金标准"时, 诊断灵敏度不理想, 阳性对照组标本在中, 3个淋巴结标本未能检测到myc1基因 mRNA的表达. 分析其原因可能与取材方法有关. 因为由于病理检查的要求, 实验只能对淋巴结部分取材, 进行RT-PCR检查, 由于转移病灶较小, 检测的半枚淋巴结中可能并未包括转移癌病灶在内. 本组中有22例患者的30枚淋巴结检测到myc1基因mRNA的表达, 诊断为淋巴结微转移, 这些患者的TNM分期由Ⅰ-ⅡA期上调为ⅡB~Ⅲ期. 随访统计结果表明, 有淋巴结微转移者3 a生存率低于无转移的患者. 本组病例均为T3以内的患者, 肿瘤未侵及其他器官, 施行了肿瘤及胸部食管大部切除、胸及腹部淋巴结清扫, 手术后病理检查上、下断端无残留癌, 基本达到了根治切除的目标; 而且, 为了排除其他与预后相关的混杂因素对统计分析的影响, 例如手术方式、手术后的辅助治疗等, 增加可比性, 我们采用前瞻性研究来控制混杂因素, 减少了偏倚, 研究结果更具客观性. Logistic多因素回归分析结果亦显示, 淋巴结微转移是独立的预后因素, 淋巴结微转移患者死亡的概率是无转移患者的3.7倍. 因此, 我们初步认为, 根治切除后的pN0食管癌, 患者预后不良与淋巴结微转移有关. 我们同意Hosch et al[11] 的观点, 淋巴结微转移是食管癌的独立预后因素, 建议食管癌TNM分期系统中要包括淋巴结微转移这一要素.
编辑: N/A
| 2. | He YT, Hou J, Qiao CY, Chen ZF, Song GH, Li SS, Meng FS, Jin HX, Chen C. An analysis of esophageal cancer incidence in Cixian county from 1974 to 1996. World J Gastroenterol. 2003;9:209-213. [PubMed] [DOI] |
| 5. | Korst RJ, Rusch VW, Venkatraman E, Bains MS, Burt ME, Downey RJ, Ginsberg RJ. Proposed revision of the staging classification for esophageal cancer. J Thorac Cardiovasc Surg. 1998;115:660-670. [PubMed] [DOI] |
| 6. | Visbal AL, Allen MS, Miller DL, Deschamps C, Trastek VF, Pairplero PC. Ivor Lewis esophagogastrectomy for esophageal cancer. Ann Thorac Surg. 2001;71:1803-1808. [PubMed] [DOI] |
| 7. | Rice TW, Blackstone EH, Adelstein DJ, Zuccaro G Jr, Vargo JJ, Goldblum JR, Rybicki LA, Murthy SC, Decamp MM. N1 esophageal carcinoma: the importance of staging and downstaging. J Thorac Cardiovasc Surg. 2001;121:454-464. [PubMed] [DOI] |
| 8. | Eloubeidi MA, Desmond R, Arguedas MR, Reed CE, Wilcox CM. Prognostic factors for the survival of patients with esophageal carcinoma in the U.S. : the importance of tumor length and lymph node status. Cancer. 2002;95:1434-1443. [PubMed] [DOI] |
| 9. | Raja S, Luketich JD, Kelly LA, Gooding WE, Finkelstein SD, Godfrey TE. Rapid, quantitative reverse transcriptase-polymerase chain reaction: application to intraoperative molecular detection of occult metastases in esophageal cancer. J Thorac Cardiovasc Surg. 2002;123:475-482. [PubMed] [DOI] |
| 10. | Godfrey TE, Raja S, Finkelstein SD, Gooding WE, Kelly LA, Luketich JD. Prognostic value of quantitative reverse transcription-polymerase chain reaction in lymph node-negative esophageal cancer patients. Clin Cancer Res. 2001;7:4041-4048. [PubMed] |
| 11. | Hosch S, Kraus J, Scheunemann P, Izbicki JR, Schneider C, Schumacher U, Witter K, Speicher MR, Pantel K. Malignant potential and cytogenetic characteristics of occult disseminated tumor cells in esophageal cancer. Cancer Res. 2000;60:6836-6840. [PubMed] |
| 13. | Wang Z, Yin H, Zhang L, Lan X, Li H. Gene diagnosis and prognosis of mediastinal lymph node occult micrometastasis in non-small cell lung carcinoma. Zhonghua Zhongliu Zazhi. 2002;24:247-249. [PubMed] |
| 14. | Song ZB, Gao SS, Yi XN, Li YJ, Wang QM, Zhuang ZH, Wang LD. Expression of MUC1 in esophageal squamous-cell carcinoma and its relationship with prognosis of patients from Linzhou city, a high incidence area of northern China. World J Gastroenterol. 2003;9:404-407. [PubMed] [DOI] |
| 17. | Jiao X, Krasna MJ. Clinical significance of micrometastasis in lung and esophageal cancer: a new paradigm in thoracic oncology. Ann Thorac Surg. 2002;74:278-284. [PubMed] [DOI] |