修回日期: 2002-10-20
接受日期: 2002-11-16
在线出版日期: 2003-08-15
探讨牛磺酸脱氧胆酸(TDCA)诱导HepG2细胞凋亡的分子机制.
应用HE染色、电镜和DNA电泳对细胞凋亡定性; 应用流式细胞仪对细胞凋亡定量; 检测TDCA诱导HepG2细胞凋亡过程中, 线粒体细胞色素C释放及凋亡特异性蛋白酶Caspase-3、8、9活性的变化.
TDCA 400 μmol/L孵育12 h可诱导显著HepG2细胞凋亡, 凋亡率为50.4±2.20%; TDCA诱导HepG2细胞凋亡过程中, 线粒体细胞色素C释放呈时间依赖性增加, 同时伴有Caspase-9, 3蛋白酶活性显著增高, Caspase-8活性仅轻度增高.
启动线粒体细胞色素C释放及随后激活Caspase-9途径, 可能是TDCA诱导HepG2细胞凋亡的主要机制.
引文著录: 李光明, 谢青, 周霞秋, 俞红, 郭清, 廖丹, 李定国. 牛磺酸脱氧胆酸损伤线粒体诱导HepG2细胞凋亡. 世界华人消化杂志 2003; 11(8): 1148-1151
Revised: October 20, 2002
Accepted: November 16, 2002
Published online: August 15, 2003
To investigate the molecular mechanism of HepG2 cell apoptosis induced by Taurodeoxycholic acid (TDCA).
Morphologic evaluations of apoptosis were performed by HE staining and electro-microscope. DNA fragment was detected by electrophoresis on 1.5% agarose gel. Apoptosis rate was measured by flow cytometry using PI probe. After incubation of HepG2 cell with TDCA, the release of cytochrome C from mitochondria into cytosol was determined by Western blot analysis, and the activitives of Caspase-8, 9, 3 were evaluated by chrolometry.
Incubation of HepG2 cells with 400 μmol/L TDCA for 12 h induced significant cell apoptosis. Flow cytometry analysis showed that apoptosis rate was 50.4±2.2% following TDCA incubation. The release of cytochrome C from mitochondria to cytosol in a time-dependent pattern was demonstrated during the development of apoptosis with subsequent activation of Caspase-9 and 3 obviously, while the activation of Caspase-8 was slightly involved in this apoptotic pathway.
TDCA can induce cell apoptosis mainly through initiating the release of cytochrome C from mitochondria to cytosol and the subsequent activation of procaspase-9.
- Citation: Li GM, Xie Q, Zhou XQ, Yu H, Guo Q, Liao D, Li DG. Taurodeoxycholic acid induced apoptosis via mitochondrial injury in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2003; 11(8): 1148-1151
- URL: https://www.wjgnet.com/1009-3079/full/v11/i8/1148.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i8.1148
胆汁淤积是一种常见的病理过程, 可由肝内外胆管狭窄、阻塞, 胆汁酸分泌模式改变及长期胃肠外营养等多种原因引起. 疏水性胆汁酸在肝内积聚一直被认为是胆汁淤积性肝病患者肝损伤的主要原因[1]. 疏水性胆汁酸具有"去垢性", 可引起肝细胞坏死. 然而, 大量肝活检资料发现, 在大多数胆汁淤积症中, 明显的肝细胞坏死并不多见[1-5]. 近来报道, 在胆汁淤积性肝病中, 存在明显的肝细胞凋亡现象[6-9]. 疏水性胆汁酸诱导肝细胞凋亡的确切机制尚未完全阐明, 牛磺酸脱氧胆酸(TDCA)是一种生理性疏水性胆汁酸, 胆汁淤积时其在肝内浓度显著增高. 我们从分子水平探讨了TDCA诱导HepG2细胞凋亡的机制.
HepG2细胞购自中科院上海细胞研究所. RPMI 1640培养基购自GIBCO公司, 培养板和培养皿为Nunclon公司产品, 牛磺酸脱氧胆酸(Taurodeoxycholic acid; TDCA)和蛋白酶K均为Sigma公司产品, 小鼠细胞色素C单克隆抗体购自Pharmingen 公司, Caspase-9分析试剂盒购自Chemicon International Inc; Caspase-3 分析试剂盒购自Medical Biological Laboratories CO, LTD (MBL); Caspase-8分析试剂盒购自Clontech Laboratories Inc; 胰蛋白酶, RNA酶和羊抗小鼠免疫球蛋白购自深圳晶美生物公司, 新生小牛血清购于杭州四季青公司.
HepG2细胞用RPMI1640培养基(每1000 mL含RPMI1640培养基干粉10.4 g, Hepes 3.57 g, NaHCO3 2.0-2.2 g, 青霉素0.0625 g, 链霉素0.1 g) 置37 °C, 5% CO2培养箱 (NAPCO Series 5400 CO2培养箱)培养, 细胞贴壁85-90%时, 用EDTA-胰酶(每1000 ml含EDTANa2 0.2 g, Trypsin 2.5 g, NaCl 8 g, KCl 0.4 g, NaHCO3 0.58 g, Dextrose1g)消化, 以台盼兰拒染试验测定细胞活率, 细胞活率90%以上, 进行传代. 以不同剂量TDCA与HepG2细胞孵育, 发现TDCA 400 μmol/L孵育12 h可诱导显著HepG2细胞凋亡. 将消化的HepG2细胞接种到预先置有无菌盖玻片3.5 cm培养皿中, 6 h细胞贴壁后, 换新鲜培养液并加入TDCA, 浓度为400 μmol/L, 孵育12 h, 弃培养皿上清液, 以PBS漂洗一次后, 加40 g/L甲醛1 mL固定30 min, 然后取盖玻片进行脱水、染色, 透明、封片观察细胞形态变化. 将待检10 cm培养皿中培养基弃掉, 加入电镜固定液覆盖培养皿底, 放4 °C固定4 h, 再将细胞刮下, 1500 r/min, 离心10 min, 送检. 将培养细胞消化、离心、转移到1.5 mL eppendof管, 加细胞裂解液450 μL (10 mmol/L Tris-HCl, pH 8.0; 10 mmol/L NaCl, 10 mmol/L EDTA, 100 mg/L蛋白酶K, 10 g/L SDS), 混匀, 置37 °C水浴箱过夜, 以等体积苯酚氯仿抽提. 加1/10体积3 mol/L醋酸钠, 2倍体积冰无水乙醇沉淀DNA, 置-20 °C, 2 h, 再以14000 r/min, 4 °C, 离心20 min, 弃上清, 加含RNA酶TE(RNase终浓度为20 mg/L) 50 μL溶解DNA, 取样品10 μL于15 g/L琼脂糖凝胶电泳(75 V, 1 h)紫外灯下观察, 并拍照. 贴壁细胞经胰酶消化后, 以1 500 r/min, 离心5 min, 弃上清, 加入PBS悬浮洗涤一次, 离心, 弃上清, 加柠檬酸固定液2 mL, 室温静置30 min, 进行碘化丙啶染色, 流式细胞仪检测细胞凋亡. 收集TDCA诱导6, 9, 12 h三个时间点的待检细胞2×106悬浮于100 μL预冷细胞裂解液中, 冰上孵育10 min, 13000 r/min, 离心5 min. 将上清液(含胞质抽提物)转移到另一个洁净1.5 mL 离心管, 置于冰上. 按说明书在标准比色管中依次加入反应缓冲液、双蒸水、胞质抽提物, 最后加入底物. 置37 °C恒温箱孵育2 h. 比色计中读出Caspase-9和Caspase-3检测样本在405 nm的数值; Caspase-8在505 nm的数值. 收集2×106待检细胞加冷PBS 2 mL于细胞沉淀, 混匀, 2000 r/min , 离心10 min, 弃上清, 加入含蛋白酶抑制剂的三倍体积的细胞胞溶质抽提缓冲液(Sucrose 250 mmol/L; HEPES (pH 7.5) 20 mmol/L; KCl 10 mmol/L; MgCl2 1.5 mmol/L; EDTA 1 mmol/L; EGTA 1 mmol/L; Dithiothreitol 1 mmol/L), 冰上孵育30 min, 玻璃匀浆器匀浆, 匀浆液用750 g, 4 °C, 离心10 min, 吸取上清液, 以4°C, 12000 g离心30 min, 收集上清液于另一无菌塑料离心管. 用BCA检测法测定标本中蛋白质含量. 取20 μg蛋白质于12% SDS-聚丙烯酰胺凝胶电泳, 1 h后, 转移到硝酸纤维素薄膜上, 加入含50 g/L低脂奶粉的PBST(磷酸缓冲液+1 g/L 吐温-20)封闭液20 mL室温下振荡2 h. 再将膜放入另一干净容器内, 加入含5%低脂奶粉的小鼠抗细胞色素C单克隆抗体(1:1000)的新鲜孵育液, 4 °C轻轻振荡过夜, 弃一抗孵育液, 用PBST室温下漂洗, 将膜再转移到另一干净容器内, 加入含辣根过氧化酶标记的抗免疫球蛋白(1:2000)封闭液, 室温下振荡孵育2 h, 取膜, 以PBST室温下漂洗. 最后用增强化学发光法显示检测蛋白质条带.
统计学处理 以mean±SD表示, 使用Statpal软件包分析.
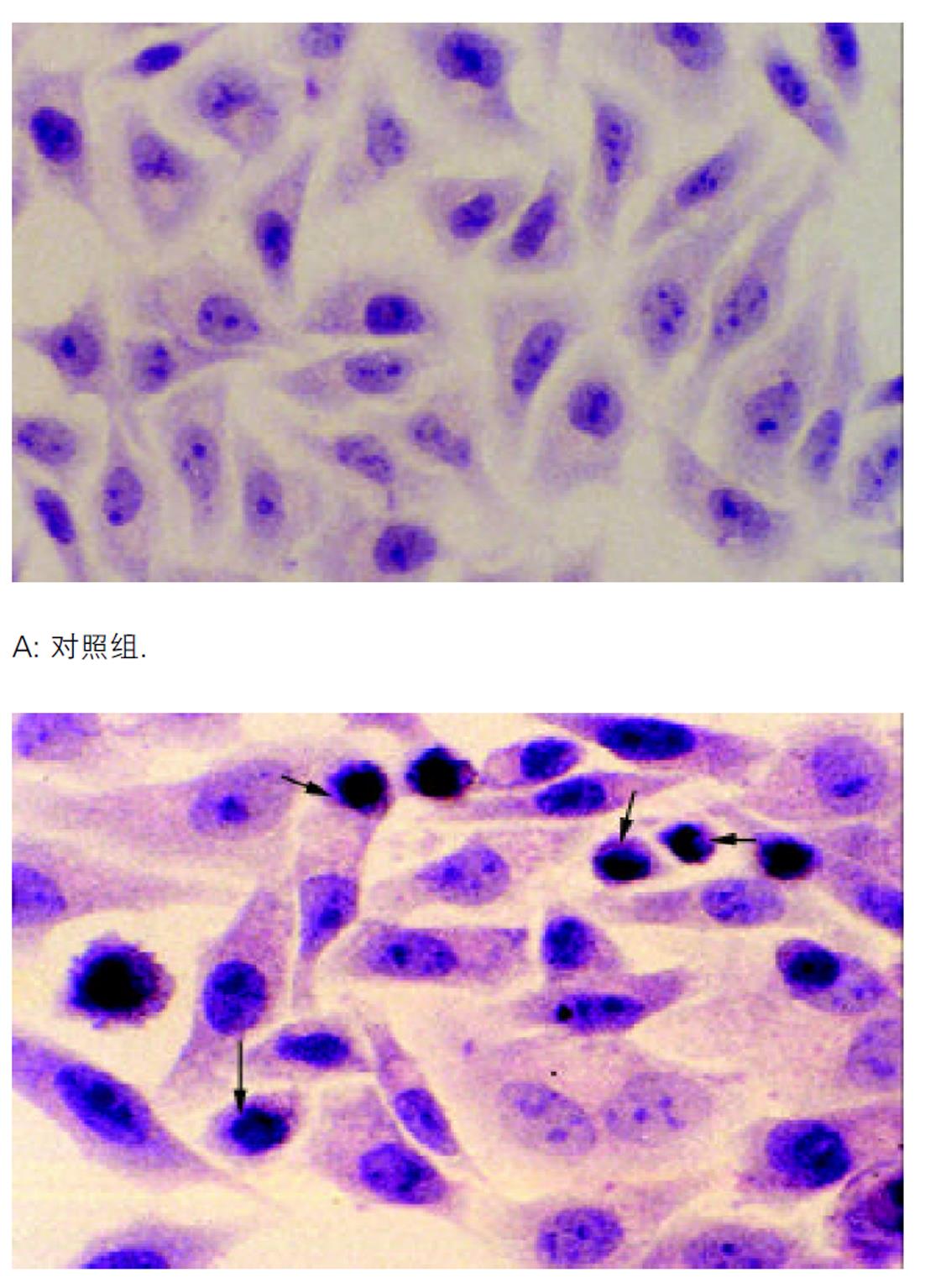
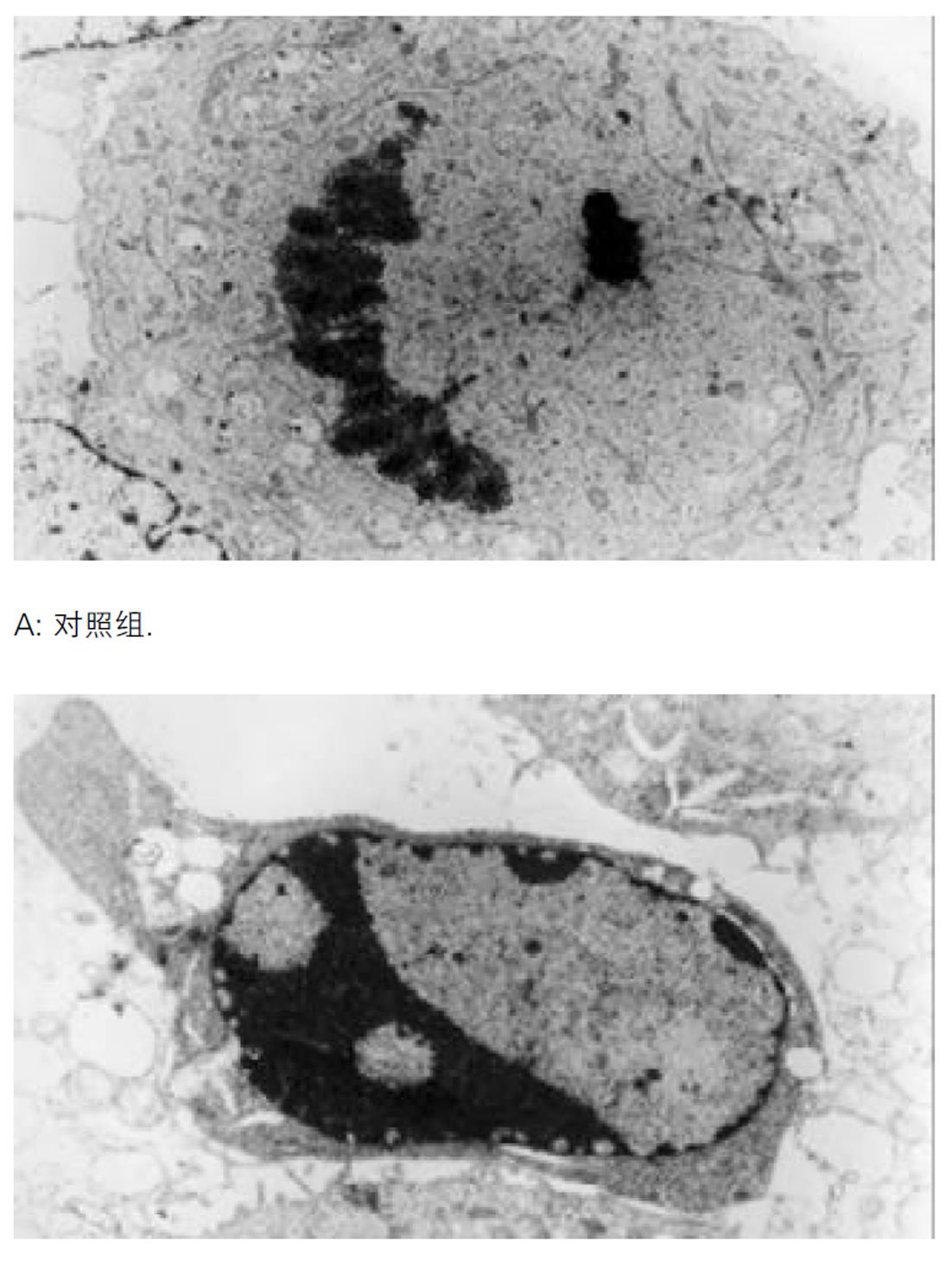
细胞爬片固定后经HE染色显示, TDCA 400 μmol/L孵育12 h, 可见明显的凋亡细胞(图1). 电镜主要是对细胞核进行观察, 从亚细胞结构上证实细胞凋亡的存在, 核致密化是凋亡最具特征性的变化, TDCA 400 μmol/L孵育12 h, 可见典型的凋亡细胞核改变(图2). TDCA 400 μmol/L与HepG2细胞孵育12 h可诱导显著的细胞凋亡, 流式细胞仪检测细胞凋亡率为50.4±2.2% , 与对照组(2.1±0.2%) 相比具有显著性差异(t = 36.1, P = 0.0 008).
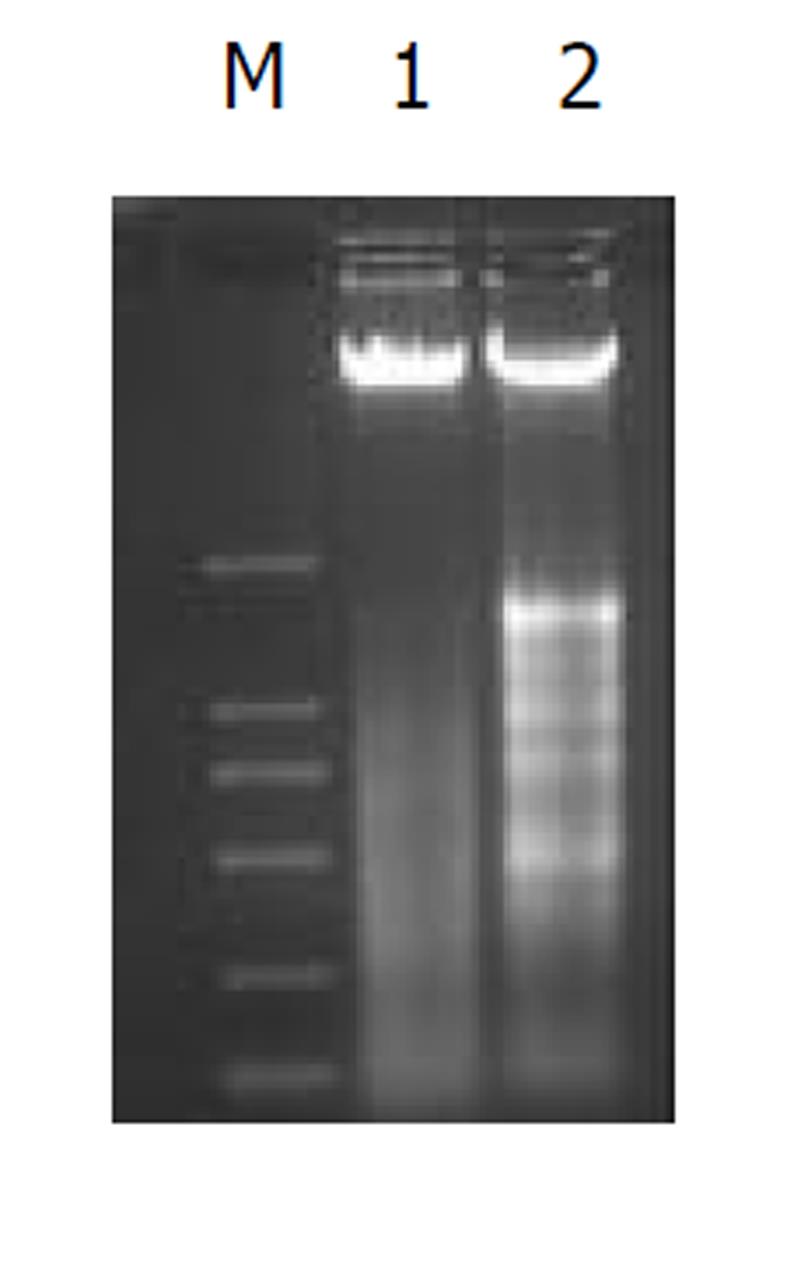
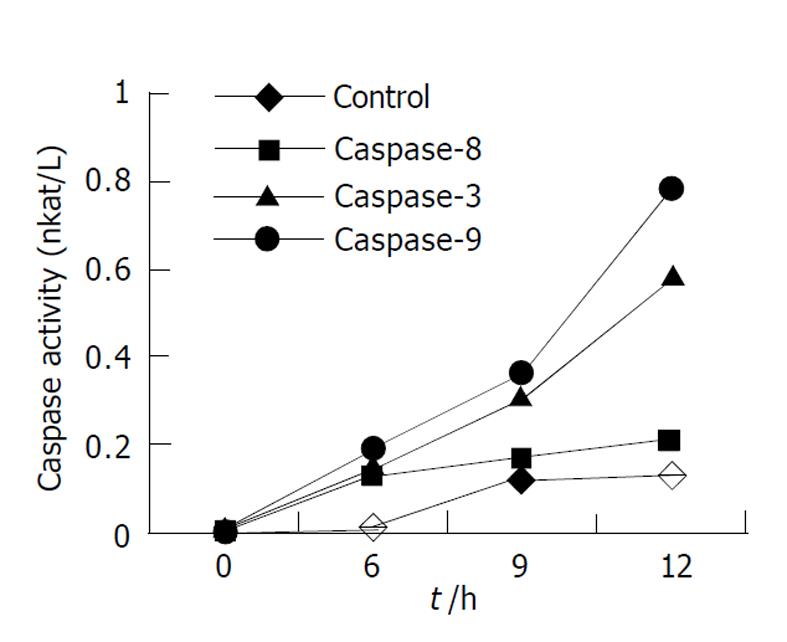
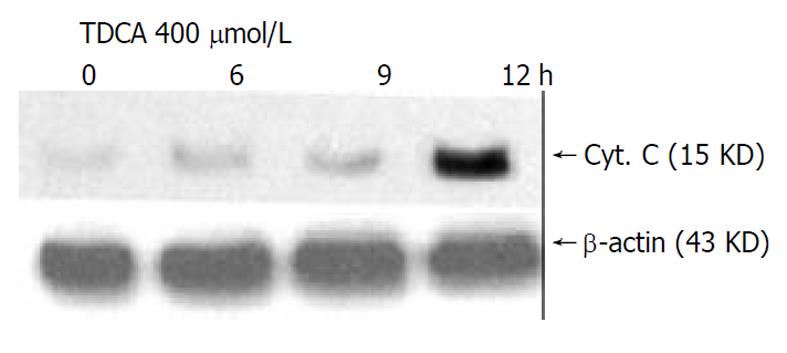
DNA Ladder是凋亡在生化方面最重要、也是最具特征性的表现之一. 细胞经TDCA 400 μmol/L孵育12 h, 通过凝胶电泳证实有明显的DNA Ladder(图3). 在TDCA诱导HepG2细胞凋亡过程中, Caspase-8、Caspase-9、Caspase-3蛋白酶活性呈时间依赖性增高, 以Caspase-9和Caspase-3增高显著, 12 h活性最高(t 9 = 13.0, P = 0.0 059; t 3 = 16.88, P = 0.0 035), 与对照相比, Caspase-8活性仅轻度增高(t = 1.94, P = 0.1917, 图4). 在TDCA诱导HepG2细胞凋亡过程中, 采用免疫印迹法在细胞胞质内检测到细胞色素C, 并且发现线粒体释放细胞色素C呈时间依赖性增加, 12h最明显(图5).
大量研究表明疏水性胆汁酸在体内外均可诱导肝细胞凋亡, 且诱导细胞凋亡的浓度明显低于其引起细胞坏死的浓度. 事实上, 在大多数胆汁淤积症中, 疏水性胆汁酸诱导肝细胞凋亡比其引起肝细胞坏死更多见[4,9-12]. 凋亡是一种细胞死亡方式, 我们从形态学及生化学方面证实TDCA 400 umol/L与HepG2细胞孵育12 h可诱导显著的细胞凋亡[13], 表现为细胞皱缩、变圆、贴壁不牢固, 核染色质致密、边聚、凋亡小体形成及DNA凝胶电泳呈现凋亡所特有的DNA Ladder; 经流式细胞仪检测凋亡率为50.4%.
细胞色素C释放被认为是凋亡过程中的关键事件[14-18]. 线粒体细胞色素C可通过调控细胞能量代谢决定受刺激细胞是发生凋亡还是坏死. 细胞色素C从线粒体易位到胞质是凋亡特异性蛋白酶procaspase-9活化的前提[19-21]. 在TDCA诱导HepG2细胞凋亡过程中, 我们应用免疫印迹法检测到有细胞色素C从线粒体释放到胞质, 且发现线粒体细胞色素C释放呈时间依赖性增加, 12 h最明显, 与细胞凋亡在12h显著增高一致; 表明TDCA诱导HepG2细胞凋亡与线粒体细胞色素C释放显著相关, 提示胆汁淤积性肝病中, 肝细胞损伤可能与疏水性胆汁酸损伤线粒体膜, 引起细胞色素C释放介导肝细胞凋亡有关.
Caspase是一类半胱氨酸天冬氨酸特异蛋白酶, 目前已发现14种, 分启动Caspase, 如Caspase-8, 9, 和效应Caspase, 如Caspase-3, 7两类; 分别参与凋亡的启动和执行过程, 他们的活化是凋亡过程中的关键事件. 不同的细胞凋亡途径, 可活化不同的启动Caspase[22-30]. Caspase-8主要参与死亡受体(TNF、FasL)介导细胞凋亡的途径[31-33], 而Caspase-9主要参与由一些凋亡诱导剂诱导线粒体损伤介导细胞凋亡的途径[34-38]. 在TDCA诱导HepG2细胞凋亡过程中, 我们检测了三种Caspase蛋白酶活性, 三种Caspase蛋白酶活性均呈时间依赖性增高, 其中以Caspase-9和Caspase-3蛋白酶活性升高显著, Caspase-8活性仅轻度增高. 表明TDCA诱导HepG2细胞凋亡可能主要是与通过损伤线粒体, 释放细胞色素C, 从而活化Caspase-9途径启动的Caspase级联反应有关. TDCA诱导HepG2细胞凋亡可能不依赖Caspase-8的活化.
| 2. | Floreani A, Guido M, Bortolami M, Della Zentil G, Venturi C, Pennelli N, Naccarato R. Relationship between apoptosis, tumour necrosis factor, and cell proliferation in chronic cholestasis. Dig Liver Dis. 2001;33:570-575. [DOI] |
| 4. | Kaplowitz N. Cell death at the millennium. Implications for liver diseases. Clin Liver Dis. 2000;4:1-23. [DOI] |
| 6. | Rodrigues CM, Steer CJ. Bile acids and hepatocyte apoptosis: living/leaving life in the Fas lane. Gastroenterology. 1999;117:732-736. [DOI] |
| 9. | Kumar D, Tandon RK. Use of ursodeoxycholic acid in liver diseases. J Gastroenterol Hepatol. 2001;16:3-14. [PubMed] [DOI] |
| 10. | Rodrigues CM, Steer CJ. The therapeutic effects of ursodeoxycholic acid as an anti-apoptotic agent. Expert Opin Investig Drugs. 2001;10:1243-1253. [PubMed] [DOI] |
| 11. | Marzioni M, Glaser SS, Alpini G, LeSage GD. Role of apoptosis in development of primary biliary cirrhosis. Dig Liver Dis. 2001;33:531-533. [DOI] |
| 12. | Yerushalmi B, Dahl R, Devereaux MW, Gumpricht E, Sokol RJ. Bile acid-induced rat hepatocyte apoptosis is inhibited by antioxidants and blockers of the mitochondrial permeability transition. Hepatology. 2001;33:616-626. [PubMed] [DOI] |
| 14. | Chen Q, Gong B, Almasan A. Distinct stages of cytochrome c release from mitochondria: evidence for a feedback amplification loop linking caspase activation to mitochondrial dysfunction in genotoxic stress induced apoptosis. Cell Death Differ. 2000;7:227-233. [PubMed] [DOI] |
| 15. | Jiang S, Cai J, Wallace DC, Jones DP. Cytochrome c-mediated apoptosis in cell lacking mitochondrial DNA. Signaling pathway involving release and caspase 3 activation is conserved. J Biol Chem. 1999;274:29905-29911. [DOI] |
| 16. | Finucane DM, Bossy-Wetzel E, Waterhouse NJ, Cotter TG, Green DR. Bax-induced caspase activation and apoptosis via cytochrome c release from mitochondrial is inhibitable by Bcl-xL. J Bio Chem. 1999;274:2225-2333. [DOI] |
| 17. | Nakagawa I, Nakata M, Kawabata S, Hamada S. Cytochrome c-mediated caspase-9 activation triggers apoptosis in Streptococcus pyogenes-infected epithelial cells. Cell Microbiol. 2001;3:395-405. [DOI] |
| 18. | Gastman BR, Yin XM, Johnson DE, Wieckowski E, Wang GQ, Watkins SC, Rabinowich H. Tumor-induced apoptosis of T cells: amplification by a mitochondrial cascade. Cancer Res. 2000;15:6811-56817. |
| 19. | Gottlieb RA. Role of mitochondria in apoptosis. Crit Rev Eukaryot Gene Expr. 2000;10:231-239. [DOI] |
| 20. | Rocha S, Soengas MS, Lowe SW, Glanzmann C, Fabbro D, Winterhalter K, Bodis S, Pruschy M, Rocha S, Soengas MS. Protein kinase C inhibitor and irradiation-induced apoptosis: relevance of the cytochrome c-mediated caspase-9 death pathway. Cell Growth Differ. 2000;11:491-499. [PubMed] |
| 21. | Slee EA, Harte MT, Kluck RM, Wolf BB, Casiano CA, Newmeyer DD, Wang HG, Reed JC, Nicholson DW, Alnemri ES. Ordering the cytochrome c-initiated caspase cascade: hierarchical activation of caspases-2, -3, -6, -7, -8, and -10 in a caspase-9-dependent manner. J Cell Biol. 1999;144:281-292. [DOI] |
| 23. | Sun XM, MacFarlane M, Zhuang J, Wolf BB, Green DR, Cohen GM. Distinct caspase cascader are initiated in receptor-mediated and chemical-induced apoptosis. J Biol Chem. 1999;274:5053-5060. [DOI] |
| 24. | Bossy-Wetzel E, Green DR. Caspases induce cytochrome c release from mitochondria by activating cytosolic factors. J Biol Chem. 1999;274:17484-17490. [DOI] |
| 25. | Xie Q, Khaoustov VI, Chung CC, Sohn J, Krishnan B, Lewis DE, Yoffe B. Effect of tauroursodeoxycholic acid on endoplasmic reticulum stress-induced caspase-12 activation. Hepatology. 2002;36:592-601. [DOI] |
| 26. | Nakagawa T, Zhu H, Morishima N, Li E, Xu J, Yankner BA, Yuan J. Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-beta. Nature. 2000;403:98-103. [PubMed] [DOI] |
| 28. | Oyadomari S, Araki E, Mori M. Endoplasmic reticulum stress-mediated apoptosis in pancreatic beta-cells. Apoptosis. 2002;7:335-345. [DOI] |
| 30. | Kaufmann SH, Hengartner MO. Programmed cell death: alive and well in the new millennium. Trends Cell Biol. 2001;11:526-534. [DOI] |
| 31. | Kruidering M, Evan GI. Caspase-8 in apoptosis: the beginning of "the end". IUBMB Life. 2000;50:85-90. [DOI] |
| 33. | Stennicke HR, Jurgensmeier JM, Shin H, Deveraux Q, Wolf BB, Yang X, Zhou Q, Ellerby HM, Ellerby LM, Bredesen D. Pro-caspase-3 is a major physiologic target of caspase-8. J Biol Chem. 1998;273:27084-27090. [DOI] |
| 34. | Jiang X, Wang X. Cytochrome c promotes caspase-9 activation by inducing nucleotide binding to Apaf-1. J Biol Chem. 2000;275:31199-31203. [DOI] |
| 35. | Reed JC, Kroemer G. Mechanisms of mitochondrial membrane permeabilization. Cell Death Differ. 2000;7:1145. [PubMed] [DOI] |
| 36. | Rodrigues CM, Fan G, Ma X, Kren BT, Steer CJ. A novel role for ursodeoxycholic acid in inhibiting apoptosis by modulating mitochondrial membrane perturbation. J Clin Invest. 1998;101:2790-2799. [PubMed] [DOI] |
| 37. | Rodrigues CM, Ma X, Linehan-Stieers C, Fan C, Kren BT, Steer CJ. Ursodeoxycholic acid prevents cytochrome C release in apoptosis by inhibiting mitochondrial membrane depolarization and channel formation. Cell Death Different. 1999;6:842-854. [DOI] |