修回日期: 2003-03-20
接受日期: 2003-04-16
在线出版日期: 2003-08-15
乙型肝炎病毒(HBV)的感染, 不仅引起急、慢性病毒性肝炎, 而且与肝纤维化、肝细胞癌的发生发展密切相关. 为深入研究HBV调节表达的机制, 我们应用噬菌体展示技术, 以HBV核心启动子DNA片段为固相支持物, 筛选肝细胞cDNA文库, 获得HBV核心启动子的肝细胞结合蛋白-羧肽酶N(CPN). CPN是一种从多肽和蛋白质C-端氨基酸残基分离的血浆金属蛋白酶, 他在调节激肽和过敏毒素的生物活性上起关键作用. CPN是分子量280 kD的四聚体, 包含两个50 KD酶性亚单位和两个83 kD调节亚单位. HBV核心启动子产生两个3.5 kb RNA: 前-核心和前基因组RNA. 前-核心RNA编码前-核心蛋白和e抗原, 前基因组RNA不仅作为mRNA编码核心蛋白和聚合酶蛋白, 而且与病毒蛋白一起包埋入核衣壳, 作为模板逆转录. 前基因组RNA的表达调控在病毒复制周期中起着关键作用. 核心启动子分为两部分: 基本核心启动子和核心上游调节元件(CURS), 其上游为负性调节元件(NER, 1616-1621 nt). CPD在体内与HBV核心启动子结合的作用还不清楚, 我们分别构建HBV核心启动子及羧肽酶N的重组载体, 通过脂质体转染NIH 3T3细胞, 研究CPN对核心启动子的调节表达.
根据HBV核心启动子及羧肽酶N的序列设计引物, 在核心启动子的引物两端引入Mlu I和Nhe I的酶切位点, 在羧肽酶N的引物两端引入EcoR I和BamH I的酶切位点. 用聚合酶链反应(PCR)的方法分别扩增HBV核心启动子和羧肽酶N基因, 克隆到pGEM-Teasy载体上. 核心启动子经Mlu I和Nhe I双酶切回收连接到同样酶切的pCAT载体上, 羧肽酶N经EcoR I和BamH I双酶切回收连接到同样酶切的pcDNA3.1(-)质粒上, 构建HBV核心启动子的报告载体及羧肽酶N的真核表达载体, 脂质体法瞬时转染NIH 3T3细胞.
HBV核心启动子和羧肽酶N(CPN)的PCR产物经1%琼脂糖电泳鉴定与预期大小符合, 分别为206 bp和580 bp. 重组载体经双酶切鉴定后, 证明HBV核心启动子的报告载体及羧肽酶N (CPN)的真核表达载体构建成功. 脂质体法瞬时转染NIH 3T3细胞48 h后, 用ELISA法检测β-gal的表达, 显示核心启动子在羧肽酶N(CPN)的影响下, 其活性有大约5-6倍的增加. 通过体内实验证明羧肽酶N(CPN)可以上调HBV核心启动子的表达.
HBV核心启动子结合蛋白羧肽酶N (CPN)与HBV核心启动子共转染细胞, 明显调节HBV核心启动子的表达, 为进一步研究HBV复制的分子生物学机制提供了新的理论基础.
引文著录: 张忠东, 成军, 钟彦伟, 杨倩, 王业东, 董菁, 杨艳杰, 张树林. 羧肽酶N调节乙型肝炎病毒核心启动子表达活性的研究. 世界华人消化杂志 2003; 11(8): 1131-1134
Revised: March 20, 2003
Accepted: April 16, 2003
Published online: August 15, 2003
Infection of hepatitis B virus (HBV) causes acute and chronic hepatitis and is closely associated with the development of cirrhosis and hepatocellular carcinoma (HCC). Molecular biological studies have considerably advanced our understanding of how the HBV genome operates, providing important new clues to the natural history of HBV-related diseases and, potentially, new therapeutical avenues. The HBV genome consists of 3.2 kb of circular DNA encoding four overlapping reading frames driven by promoter and enhancer elements. The HBV core promoter has been especially targeted for detailed molecular analysis, for its pivotal role in the hepatotropism and early life cycle of HBV. The core promoter can be divided into two elements: the basal core promoter (BCP) and the core upstream regulatory sequence (CURS). We previously had used phage display to screen the human liver cDNA library. A binding-protein of HBV core promoter, homologous with carboxypeptidase N (CPN), has been identified. Carboxypeptidase N is a plasma metalloprotease that cleaves basic amino acid residues from the C terminal of peptides and proteins. The enzyme plays a central role in regulating the biologic activity of peptides such as kinas and anaphylatoxins. The aim of this study was to observe the effect of carboxypeptidase N on HBV core promoter expression, to construct recombinant plasmid for transfection into cell and to investigate the role of carboxypeptidase in replication and expression of HBV DNA.
PCR was performed to amplify the gene of HBV core promoter from the plasmid pCP10 containing the whole fragment of HBV. The core promoter region was amplified using the following primers: sense, 5'-ACG CGT CCA AGG TCT TAC ATA AG-3', and antisense, 5'-GCT AGC ATG ATT AGG CAG AGG TG-3', (spanning the HBV nucleotides 1643 nt to 1849 nt). Subcloning and sequencing of PCR products were performed by using the TA cloning kits. After MluI and NheI digestion the sizes of the inserts were determined by agarose gel electrophoresis. The fragments were introduced into the restriction sites MluI and NheI of the multiple cloning sites of the pCAT basic (without any promoter) or promoter reporter. Equally, PCR was performed to amplify the gene of carboxypeptidase N, using the following primers: sense, 5'-GAA TTC ATG CTC GGG GAT CCG AAT TC-3', and antisense, 5'-GGA TCC TCA AGA CCC GTT TAG AGG CC-3'. After EcoR Iand BamH Idigestion, the PCR fragments were cloned into the restriction sites EcoR Iand BamH Iof the multiple cloning sites of the pcDNA3.1(-). Murine fibroblast cell NIH 3T3 were in Dulbecco's modified Eagle's medium supplemented with 10% fetal bovine serum under 5% CO2 at 37 °C. DNA transfection by the liposomes method was performed. For analysis, the cells were harvested 48 h after transfection. Transfection efficiency was routinely checked by cotrans-fecting 0.2 μg of pCAT as an internal standard.
HBV core promoter gene was successfully cloned into pCAT named pCAT-CP. Carboxypeptidase N gene was successfully cloned into pcDNA3.1 (-) named pcDNA3.1(-)-CPN. The recombined vectors were transferred into NIH 3T3 cell simultaneously to measure the expression of CAT. The results showed that the HBV core promoter of expression was upregulated 5-6 fold by the expression of carboxypeptidase N.
Our findings suggest that carboxypeptidase N could bind HBV core promoter in vivo, and upregulate the expression of HBV core promoter, which pave the way for further studying the regulatory mechanism of HBV DNA.
- Citation: Zhang ZD, Cheng J, Zhong YW, Yang Q, Wang YD, Dong J, Yang YJ, Zhang SL. Cloning and characterization of a human hepatocyte protein, carboxypeptidase N, which binds and activates core promoter of hepatitis B virus. Shijie Huaren Xiaohua Zazhi 2003; 11(8): 1131-1134
- URL: https://www.wjgnet.com/1009-3079/full/v11/i8/1131.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i8.1131
乙型肝炎病毒(HBV)的感染, 不仅引起急、慢性病毒性肝炎, 而且与肝纤维化、肝细胞癌的发生发展密切相关[1,2]. 但是, 目前除了部分慢性乙型肝炎患者对干扰素α(IFNα), 或部分患者对于核苷类似物拉米夫定的治疗有部分应答之外, 还缺乏确切有效的治疗方法[3,4]. 其原因是对HBV DNA复制的分子生物学机制还不十分清楚.
我们利用噬菌体展示技术, 以DNA为固相支持分子, 筛选人肝细胞cDNA文库, 获得了和HBV核心启动子结合的肝细胞蛋白-羧肽酶N(CPN), 在国内外首次进行了以噬菌体展示技术筛选启动子的结合蛋白的研究. 为深入研究其和HBV核心启动子结合的机制及功能, 我们分别构建报告载体和表达载体, 进行共转染细胞, 阐明二者相互作用的意义, 为进一步研究HBV复制的分子生物学机制提供了新的理论基础.
质粒pGEM-Teasy和pcDNA3.1(-)(Promega公司), Taq酶、琼脂糖、dNTP、T4 DNA连接酶、RNA酶、玻璃奶DNA回收试剂盒(博大科技), EcoR I、BamH I、Mlu I、Nhe I(购置宝生物公司), 热循环仪、凝胶成像仪、酶联黏附读数仪、大肠杆菌DH5α、pCP10质粒为本实验室保存.
1.2.1 HBV核心启动子的扩增和克隆 根据HBV ayw的基因序列, 用Vector NT I软件设计引物, 在编码区的上游和下游分别设计合成一对寡核苷酸引物, P1: 5'-ACG CGT CCA AGG TCT TAC ATA AG-3', P2: 5'-GCT AGC ATG ATT AGG CAG AGG TG-3', 在引物5'端分别引入Mlu I和Nhe I位点, 由赛百盛公司合成.
1.2.2 羧肽酶的扩增和克隆 根据羧肽酶N cDNA序列, 包含从ATG至TAA为止的全编码区, 用Vector NTI软件设计引物. 引物由上海博亚公司合成. P1: 5'-GAA TTC ATG CTC GGG GAT CCG AAT TC-3'在5'-端引入EcoR I酶切位点, P2: 5'-GGA TCC TCA AGA CCC GTT TAG AGG CC-3'在5'-端引入BamH I酶切位点.
1.2.3 重组报告载体pCAT-CP的构建与鉴定 将HBV 核心启动子PCR纯化产物与pGEM-Teasy载体混合, 在16 °C条件下用T4 DNA连接酶连接过夜, 随后转化用氯化钙法制备的大肠杆菌DH5α感受态细胞, 在铺有IPTG/X-gal的氨苄西林平板上进行蓝白斑菌落筛选, 挑取白色菌落用碱裂解法提取质粒, 进行酶切鉴定. 此质粒及pCAT Basic均用Mlu I和Nhe I双酶切, 回收相应的酶切片段, 在16 °C条件下用T4 DNA连接酶连接过夜, 随后转化用氯化钙法制备的大肠杆菌DH5α感受态细胞, 随机挑选在LB/Amp平板上生长的菌落, 碱裂解法提取质粒, 进行Mlu I和Nhe I双酶切鉴定.
1.2.4 重组表达载体pcDNA3.1(-)-CPN的构建与鉴定 将噬斑的PCR纯化产物与pGEM-Teasy载体混合, 在16 °C条件下用T4 DNA连接酶连接过夜, 随后转化用氯化钙法制备的大肠杆菌DH5α感受态细胞, 在铺有IPTG/X-gal的氨苄西林平板上进行蓝白斑菌落筛选, 挑取白色菌落用碱裂解法提取质粒, 进行酶切鉴定. 此质粒及载体pcDNA3.1(-)均用EcoR I和BamH I双酶切, 回收相应的酶切片段, 在16 °C条件下用T4 DNA连接酶连接过夜, 随后转化用氯化钙法制备的大肠杆菌DH5α感受态细胞, 随机挑选在LB/Amp平板上生长的菌落, 碱裂解法提取质粒, 进行EcoR I和BamH I双酶切鉴定.
1.2.5 转染细胞 分别用磁珠法提取质粒, 将pCAT basic、pCAT+pcDNA3.1(-)、pCAT-CP和pCAT-CP+ pcDNA3.1(-)-CPN通过脂质体瞬时共转染NIH 3T3细胞, 用ELISA法检测氯霉素乙酰转移酶(CAT)的表达, 研究pcDNA3.1(-)-CPN对 pCAT-CP的功能影响.
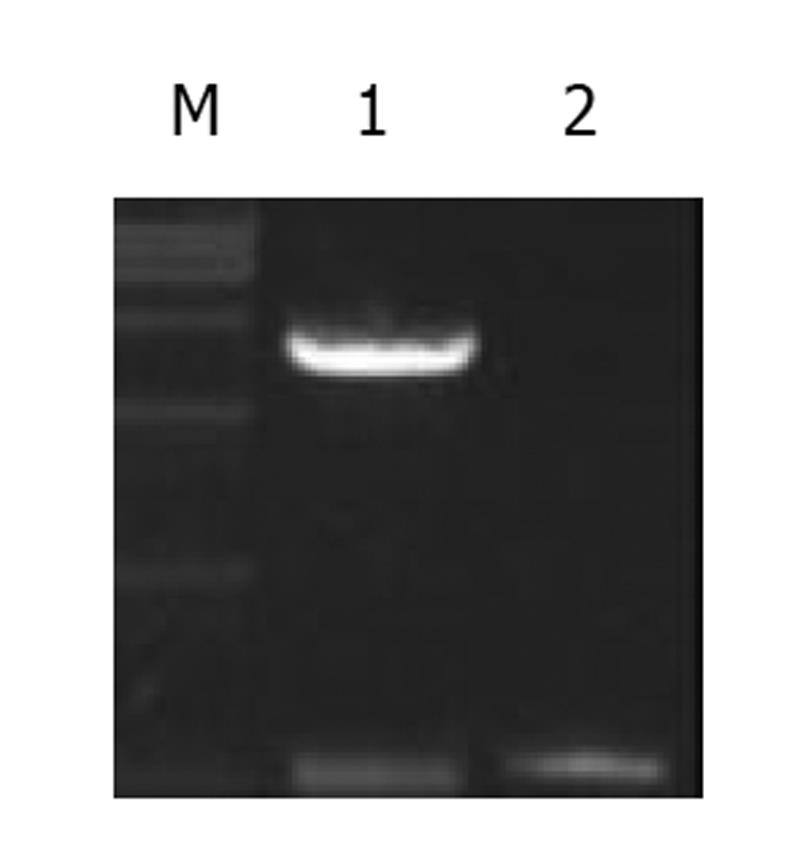
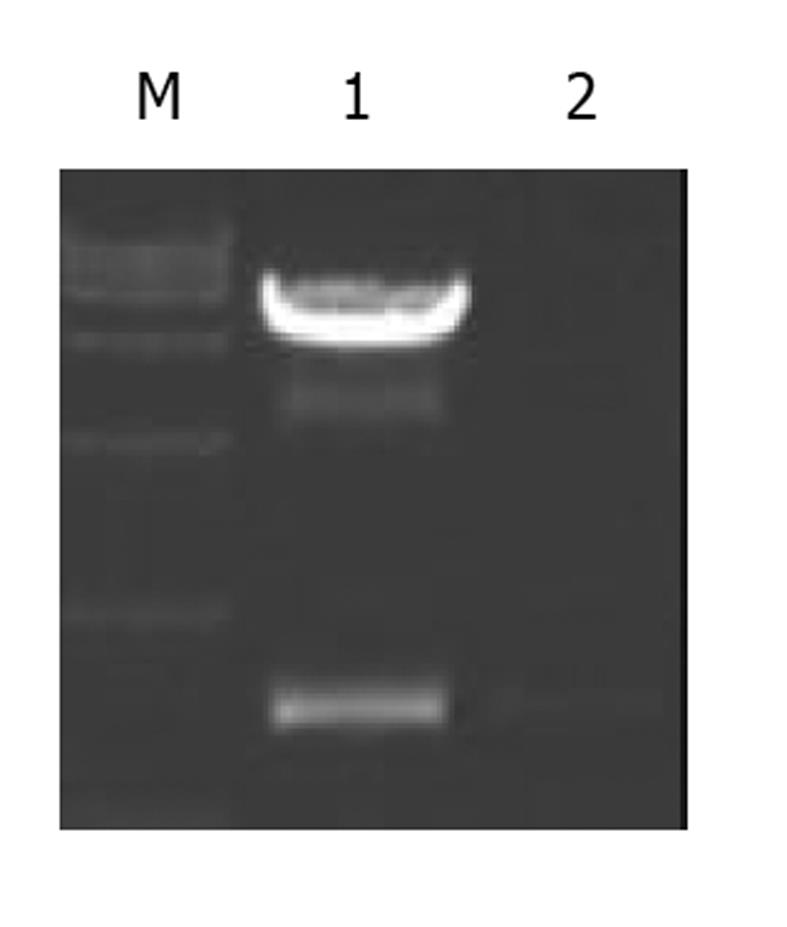
利用自行设计的引物P1/P2成功扩增出HBV核心启动子基因片段, PCR产物经1%琼脂糖凝胶电泳分析扩增片段约为206 bp, 与预期大小符合, 且无非特异扩增现象. 用双酶切所得片段, 连接到用相同的MluI和NheI所切的pCAT中经酶切鉴定结果正确. 表明pCAT-CP质粒构建成功(图1).
利用自行设计的引物P3/P4成功扩增出羧肽酶N基因片段, PCR产物经1%琼脂糖凝胶电泳分析扩增片段约为580 bp, 与预期大小符合, 且无非特异扩增现象. 用双酶切所得片段, 连接到用相同的EcoR I和BamH I所切的pcDNA3.1(-)中经酶切鉴定结果正确. 表明pcDNA3.1(-)-CPN质粒构建成功(图2).
用脂质体法转染NIH 3T3细胞, 脂质体用量6 μl. 培养48 h后, 进行ELISA检测. 氯霉素乙酰转移酶(CAT)的表达见表1, pCAT-CP实验组酶的表达是pCAT的3倍, 而pcDNA3.1(-)-CPN+pCAT-CP实验CAT的表达是pCAT-CP的近6倍, 证明CPN对HBV核心启动子有激活作用.
| 质粒 | CAT值 |
| pCAT | 0.007 |
| pCAT-CP+pcDNA3.1(-) | 0.094 |
| pCAT-CP | 0.023 |
| pCAT-CP+pcDNA3.1(-)-CPN | 0.130 |
肝炎病毒感染所引起的一系列肝脏疾病, 发病机制非常复杂, 涉及到肝炎病毒与肝细胞大分子之间的复杂的相互作用[1-3]. 乙型肝炎病毒是一种严重危害人类健康的致病因子. HBV的感染除引起急慢性乙型肝炎和肝硬化外, 还与肝癌的发生有密切关系[4-7]. HBV属嗜肝DNA病毒, 其基因组为3.2 kb部分双链的环状DNA. 他的复制需要一个RNA中间物-前基因组RNA, 经过反转录产生新的DNA分子[8-10]. HBV基因组的功能单位十分密集, 高度压缩, 重复利用. 目前已确定有四个主要的开放阅读框架, 分别负责编码核心抗原(pre-C/C)、核酸聚合酶(P)、表面抗原(pre-S/S)和X蛋白(X). 这些基因的表达受到顺式元件-启动子和增强子的调控[11-13]. 目前在HBV基因组已发现并鉴定的顺式元件有四个启动子(C、X、SPI、SPII)、两个增强子(EnhI和EnhII)和糖皮质激素应答元件. 由于病毒的复制是病毒致病机制的重要环节, 病毒基因的表达与调控又是病毒复制研究的核心问题. 另外, 虽然HBV感染具有相对泛嗜性的特点, 但是却主要在肝细胞中进行复制, 引起肝脏的病变, 因而推测肝细胞中存在肝细胞特有的蛋白质因子与DNA结合, 控制HBV DNA复制表达. 因此通过研究与HBV基因的表达调控结合的肝细胞特异性蛋白质因子, 对于了解HBV的致病机制、HBV与肝癌的关系以及对乙型肝炎和肝癌的预防和治疗均有重要意义.
核心启动子产生两个3.5 kb RNA: 前-核心和前基因组RNA. 前-核心RNA编码前核心蛋白和e抗原, 前基因组RNA不仅作为mRNA编码核心和聚合酶蛋白, 而且与病毒蛋白一起包埋入核衣壳, 作为模板逆转录. 前基因组RNA的表达调控在病毒复制周期中起着关键作用. 核心启动子分为两部分: 基本核心启动子和核心上游调节元件(CURS), 其上游为负性调节元件(NER, 1616-1621 nt), CURS能激活邻近下游的BCP.
真核细胞的基因表达调节虽然发生在多个水平上, 但是主要的还是转录水平和转录后水平上进行调节. 基因表达的调节又分为顺式(cis)调节和反式(trans)调节. 与转录活性有关的启动子结合的转录因子蛋白的结合与调节尤其重要[14]. Wolcke et al [15]应用噬菌体表面展示技术对DNA甲基转移酶M. TaqI识别的DNA序列的结合蛋白进行了筛选. Cicchini et al [16]以高度分化的以高度分化的MMH E14小鼠肝细胞癌细胞细作为来源构建了噬菌体cDNA表面展示文库, 研究DNA-蛋白之间的相互作用. 以肝脏中富有的转录因子蛋白肝细胞核因子1α(HNF1α)基因启动子DNA作为固相基质进行筛选, 以确定与之结合的蛋白序列.
在国内外我们首次利用噬菌体展示技术[17-28], 以DNA为固相分子, 筛选肝细胞文库, 研究启动子结合蛋白. 获得了与HBV核心启动子结合的蛋白, 经同源性比较确定该蛋白与羧肽酶N(CPN)高度同源, 同源性为99%. CPN是由两个50 kD小亚单位和两个83 kD大亚单位组成的锌指样金属蛋白酶[29], 小亚单位包含蛋白酶的酶活性, 而糖基化的亚单位保护酶避免降解及从血流中滤过, 亚单位通过非共价键形成四聚体. CPN由肝脏产生, 进入血流的激肽[30]、血管舒张素[30]、血小板因子[31]这些有生物活性的多肽, 能被CPN分离其羧基末端的精氨酸和赖氨酸残基, 也可分离补体C3a和C5a羧基末端的精氨酸[30]. 补体级联反应产生的C3a和C5a能诱导平滑肌舒张、血管舒张和白细胞趋化, 以及肥大细胞释放组胺, CPN极大地减少C3a和C5a的生物学活性. CPN基因5'-端的结构分析显示有与肝特异表达相关的转录因子结合位点, 对应三种不同蛋白的9个转录因子结合位点位于转录起始位点上游916 bp. 这三种蛋白分别是肝细胞核因子5(HNF-5)、AP-2和CCAAT/增强子结合蛋白(C/EBP). HNF-5是肝特异转录因子, 在5'-端有7个识别位点. AP-2在非肝组织表达, 作为抑制子. C/EBP存在于肝和脂肪组织. 这些研究表明CPN局限于肝脏[2], 而Sato et al [31]认为不仅在肝脏, 而且胃、肺、肠、脾、肾也有表达. 而我们的结果与此不完全一致, 为阐明二者结合的意义, 我们分别成功构建了HBV核心启动子的报告载体和羧肽酶的表达载体, 将二者共转染NIH 3T3细胞, 证明在体内羧肽酶N可以明显调节HBV核心启动子的表达. 此项实验结果为研究影响HBV复制机制开辟了新的思路和途径. 我们准备进一步研究二者在体外的结合特性.
| 3. | Lee WM. Hepatitis B virus infection. N Engl J Med. 1997;337:1733-1745. [PubMed] |
| 4. | Yuh CH, Chang YL, Ting LP. Transcriptional regulation of prEcoRe and pregenomic RNAs of hepatitis B virus. J Virol. 1992;66:4073-4084. [PubMed] |
| 5. | Beasley RP, Hwang LY, Lin CC, Chien CS. Hepatocellular carcinoma and hepatitis B virus. A prospective study of 22 707 men in Taiwan. Lancet. 1981;21:1129-1133. [DOI] |
| 6. | Wright TL, Lau JY. Clinical aspects of hepatitis B virus infection. Lancet. 1993;342:1340-1344. [DOI] |
| 8. | Ganem D, Varmus HE. The molecular biology of the hepatitis B viruses. Annu Rev Biochem. 1987;56:651-693. [PubMed] [DOI] |
| 9. | Gerlich WH, Robinson WS. Hepatitis B virus contains protein attached to the 5 terminus of its complete DNA strand. Cell. 1980;21:801-809. [DOI] |
| 10. | Robinson WS, Miller RH, Marion PL. Hepadnaviruses and retroviruses share genome homology and features of replication. Hepatology. 1987;7:64S-73S. [PubMed] [DOI] |
| 11. | Nassal M, Schaller H. Hepatitis B virus replication. Trends Microbiol. 1993;1:221-228. [DOI] |
| 12. | Kaneko S, Miller RH. X-region-specific transcript in mammalian hepatitis B virus-infected liver. J Virol. 1988;62:3979-3984. [PubMed] |
| 13. | Siddiqui A, Jameel S, Mapoles J. Expression of the hepatitis B virus X gene in mammalian cells. Proc Natl Acad Sci USA. 1987;84:2513-2517. [DOI] |
| 15. | Wolcke J, Weinhold E. A DNA-binding peptide from a phage display library. Nucleosides Nucleotides Nucleic Acids. 2001;20:1239-1242. [PubMed] [DOI] |
| 16. | Cicchini C, Ansuini H, Amicone L, Alonzi T, Nicosia A, Cortese R, Tripodi M, Luzzago A. Searching for DNA-protein interactions by Lambda phage display. J Mol Biol. 2002;322:697-706. [DOI] |
| 17. | Smith GP. Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science. 1985;228:1315-1317. [DOI] |
| 18. | Parmley SF, Smith GP. Antibody-selectable filamentous fd phage vectors: affinity purification of target genes. Gene. 1988;73:305-318. [DOI] |
| 19. | McCafferty J, Griffiths AD, Winter G, Chiswell DJ. Phage antibodies: filamentous phage displaying antibody variable domains. Nature. 1990;348:552-554. [PubMed] [DOI] |
| 21. | 成 军, 钟 彦伟, 施 双双, 倪 勤, 夏 小兵, 王 刚, 刘 友昭, 王 琳, 刘 妍, 杨 继珍. 乙型肝炎病毒表面抗原人源单链可变区抗体基因的克隆与鉴定. 肝脏. 2000;5:130-133. |
| 24. | 钟 彦伟, 成 军, 王 刚, 田 小军, 陈 新华, 李 莉, 陈 菊梅, 张 玲霞. 乙型肝炎病毒核心抗原人源单链可变区抗体的筛选与鉴定. 中国公共卫生. 2002;18:153-154. |
| 25. | Levin Y, Skidgel RA, Erdos EG. Isolation and characterization of the subunits of human plasma carboxypeptidase N (kininase I). Proc Natl Acad Sci USA. 1982;79:4618-4622. [DOI] |
| 26. | Belew M, Gerdin B, Lindeberg G, Porath J, Saldeen T, Wallin R. Structure-activity relationships of vasoactive peptides derived from fibrin or fibrinogen degraded by plasmin. Biochim Biophys Acta. 1980;621:169-178. [DOI] |
| 27. | Bokisch VA, Muller-Eberhard HJ. Anaphylatoxin inactivator of human plasma: its isolation and characterization as a carboxypeptidase. J Clin Invest. 1970;49:2427-2436. [PubMed] [DOI] |
| 28. | Grange T, Roux J, Rigaud G, Pictet R. Cell-type specific activity of two glucocorticoid responsive units of rat tyrosine aminotransferase gene is associated with multiple binding sites for C/EBP and a novel liver-specific nuclear factor. Nucleic Acids Res. 1991;19:131-139. [DOI] |
| 29. | Li L, Liao WS. An upstream repressor element that contributes to hepatocyte-specific expression of the rat serum amyloid A1 gene. Biochem Biophys Res Commun. 1999;264:395-403. [PubMed] [DOI] |
| 30. | Ren Y, Reddy SA, Liao WS. Purification and identification of a tissue-specific repressor involved in serum amyloid A1 gene expression. J Biol Chem. 1999;274:37154-37160. [DOI] |