修回日期: 2025-03-19
接受日期: 2025-03-25
在线出版日期: 2025-03-28
本研究基于网络药理学和分子对接技术, 探讨胃复春胶囊治疗结直肠癌的作用机制. 研究假设胃复春中的活性成分(如猫眼草酚D、齐墩果酸、川陈皮素等)通过调控SRC、AKT1、TP53等核心靶点, 影响脂质代谢、神经活性配体与受体的相互作用等通路, 从而发挥抗肿瘤作用.
本研究旨在分析胃复春胶囊对结直肠癌的治疗机制.
利用中药系统药理学数据库(TCMSP)、Swiss Target Prediction数据库等工具, 以及参考现有学术成果, 选取胃复春胶囊中的关键成分及其潜在作用目标. 利用Gene Cards、DisGeNET、Drug Bank、TTD及PharmGkb等数据库搜集与结直肠癌相关的目标信息, 并运用Cytoscape软件建立成分-靶点-疾病的交互网络. 研究还包括建立和分析蛋白质间相互作用网络(protein-protein interaction networks, PPI), 以及通过Metascape进行基因本体分析(Gene Ontology, GO)及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路富集分析. 使用Pymol 2.4.0对有效活性成分和靶点进行分子对接, 并将其可视化.
识别出38种活性成分和647个潜在靶点, 其中活性成分与疾病靶点共有545个. 构建了一至三级及核心目标的PPI网络, 识别核心靶点包括SRC、AKT1、TP53等. GO功能富集分析涵盖了多个条目, KEGG通路富集分析主要涉及血脂与动脉粥样硬化、神经活性配体与受体的相互作用等. 分子对接结果显示, 这些活性成分与核心靶点之间存在高亲和力.
胃复春胶囊通过猫眼草酚D(chrysosplenol D)、齐墩果酸(oleanolic acid)、川陈皮素(nobiletin)、熊果酸(ursolic acid)等活性成分, 针对SRC, AKT1, TP53等靶点, 通过调控血脂与动脉粥样硬化、神经活性配体与受体的相互作用等机制, 对结直肠癌具有潜在治疗作用.
核心提要: 本研究通过网络药理学和分子对接技术, 揭示了胃复春胶囊治疗结直肠癌的多靶点、多通路作用机制. 研究发现, 胃复春中的猫眼草酚D、齐墩果酸、川陈皮素等活性成分, 通过调控SRC、AKT1、TP53等核心靶点, 影响脂质代谢、神经活性配体-受体相互作用等关键通路, 发挥抗肿瘤作用. 分子对接证实了活性成分与靶点的高亲和力, 为胃复春在结直肠癌治疗中的应用提供了理论依据.
引文著录: 杨依, 赵婷婷, 刘志红. 胃复春治疗结直肠癌作用机制的网络药理学研究及分子对接. 世界华人消化杂志 2025; 33(3): 225-234
Revised: March 19, 2025
Accepted: March 25, 2025
Published online: March 28, 2025
This study employed network pharmacology and molecular docking to explore the mechanism of Weifuchun capsules in treating colorectal cancer. We hypothesized that active components in Weifuchun (chrysosplenol D, oleanolic acid, and nobiletin) regulate core targets like SRC, AKT1, and TP53, affecting pathways such as lipid metabolism and neuroactive ligand-receptor interactions, thereby exerting anti-tumor effects.
To analyze the mechanisms of Weifuchun capsules in the treatment of colorectal cancer.
To identify the key components and their potential targets of Weifuchun capsule, the Traditional Chinese Medicine Systems Pharmacology Database (TCMSP) and Swiss Target Prediction database were utilized, along with the existing academic literature. Targets related to colorectal cancer were collected from databases including GeneCards, DisGeNET, DrugBank, TTD, and PharmGKB. The component-target-disease interaction network was constructed using Cytoscape software. The study also involved the establishment and analysis of protein-protein interaction networks (PPI), as well as Gene Ontology (GO) functional and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway enrichment analyses conducted via Metascape. Molecular docking of active components and targets was performed using Pymol 2.4.0, and the results were visualized.
A total of 38 active components and 647 potential targets were identified, with 545 shared targets between the active components and the disease. PPI networks were constructed at primary, secondary, and tertiary levels, as well as for core targets, identifying key targets such as SRC, AKT1, and TP53. GO functional enrichment analysis covered multiple categories, while KEGG pathway enrichment analysis primarily involved lipid metabolism and atherosclerosis, as well as neuroactive ligand-receptor interactions. Molecular docking results demonstrated high binding affinity between the active components and the core targets.
Weifuchun capsules exert potential therapeutic effects on colorectal cancer through active components such as chrysosplenol D, oleanolic acid, nobiletin, and ursolic acid. These components target key proteins including SRC, AKT1, and TP53, and modulate processes such as lipid metabolism and atherosclerosis, as well as neuroactive ligand-receptor interactions.
- Citation: Yang Y, Zhao TT, Liu ZH. Network pharmacology and molecular docking analysis of mechanism of action of Weifuchun in treatment of colorectal cancer. Shijie Huaren Xiaohua Zazhi 2025; 33(3): 225-234
- URL: https://www.wjgnet.com/1009-3079/full/v33/i3/225.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i3.225
结直肠癌(colorectal cancer, CRC)是全球范围内最常见的消化道恶性肿瘤之一, 其发病率和死亡率在近年来持续上升[1]. 流行病学研究显示, 结直肠癌的发生与遗传因素、饮食习惯、生活方式以及环境因素密切相关. 随着人口老龄化和生活方式的变化, 结直肠癌的患病人数预计将进一步增加. 在传统中医药领域, 胃复春作为一种中药复方, 已被广泛用于治疗多种胃部疾病, 如胃溃疡、慢性胃炎、抗幽门螺杆菌等[2]. 近年来, 科研人员开始关注胃复春在抗胃肠道肿瘤领域的潜在应用, 结直肠癌作为下消化道肿瘤与胃癌的治疗具有多种重叠治疗的靶点. 胃复春含有多种生物活性成分, 如猫眼草酚D和槲皮素, 这些成分被认为可以通过影响细胞周期、抑制炎症反应、调节免疫系统等多种机制, 对消化道肿瘤细胞产生抑制作用[3]. 目前, 关于胃复春治疗结直肠癌的研究还处于初步阶段, 研究主要集中在其活性成分的筛选、作用机制的探索以及临床应用的可能性. 通过现代药理学方法, 结合传统中医理论, 并评估其作为辅助治疗手段的有效性和安全性. 从现有研究结果看, 胃复春有望成为结直肠癌综合治疗策略中的一个重要组成部分. 为此, 本研究采用网络药理学和分子对接技术预测胃复春胶囊治疗结直肠癌的活性靶点、信号通路及分子基础, 探讨其治疗结直肠癌的作用机制, 为其临床使用和深入开发提供理论支持.
1.1.1 胃复春活性成分及其作用靶点的获得: 通过访问中药系统药理学数据库及分析平台(TCMSP, http://tcmspw.com/tcmsp.php/), 对人参和枳壳这两种传统中药中的化学成分进行了详细查询. 选取标准为口服生物利用度(OB)不低于30%, 以及类药性(DL)不低于0.18, 以此标准筛选出了有效的化合物及其相应的作用目标. 此外, 参考香茶菜相关文献进行活性成分补充[3-5]. 接下来, 利用Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/)进一步预测了这些文献中提及的活性化合物可能的作用目标, 并排除了重复的目标. 最后, 通过Uniprot数据库(http://www.Uniprot.org/)完成了对这些作用目标的基因名称的转换.
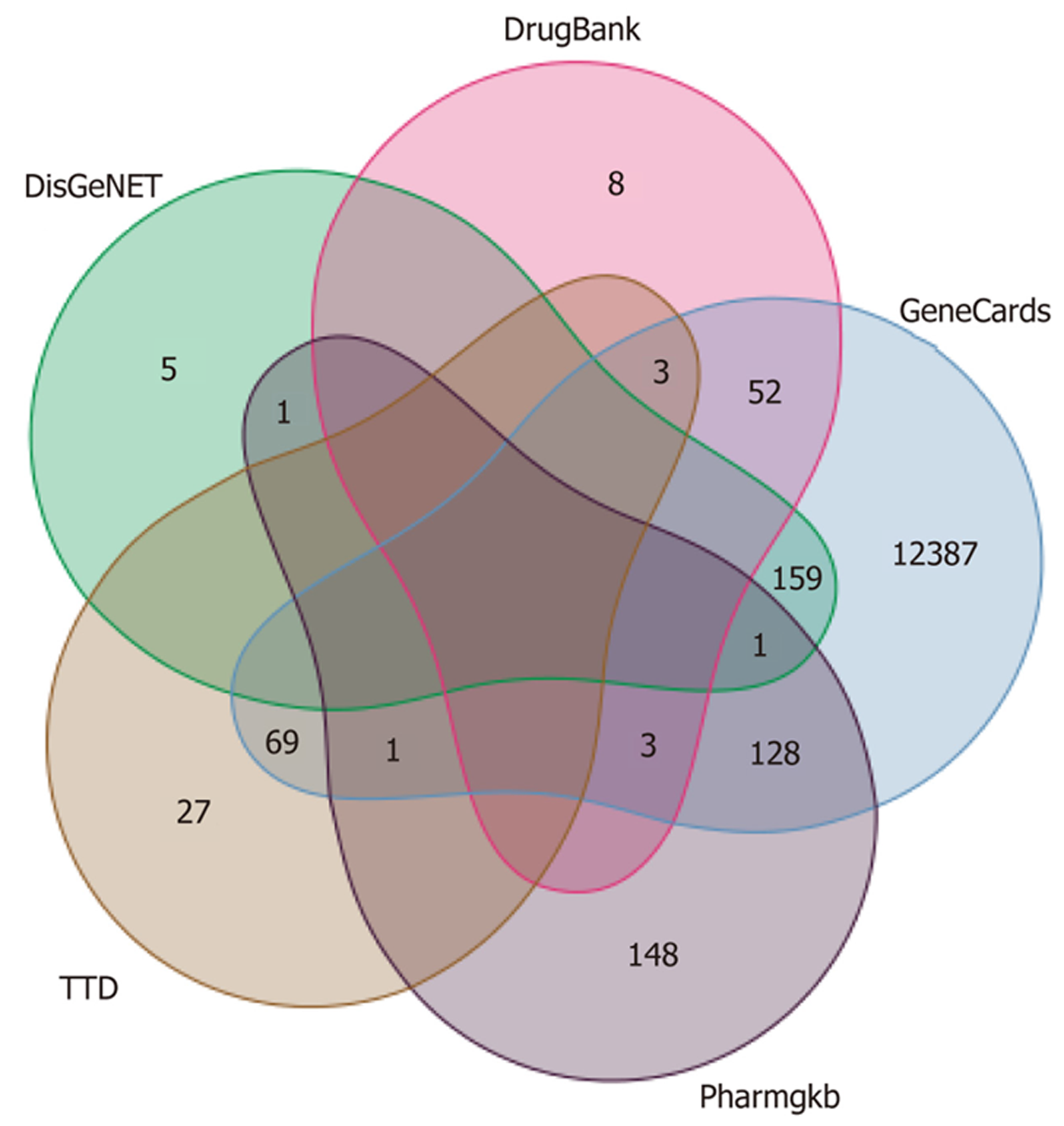
1.1.2 结直肠癌相关靶点的获得: 通过Gene Cards数据库(https://www.genecards.org/), DisGeNET数据库(https://www.disgenet.org/), Drug Bank数据库(https://go.drugbank.com/), TTD数据库(https://db.idrblab.net/ttd/)和PharmGkb数据库(https://www.pharmgkb.org/)检索结直肠癌的相关靶点, 以关键词"colorectal cancer"进行检索, 获得结直肠癌的潜在作用靶点, 合并检索结果后删除重复值, 即结直肠癌相关靶点.
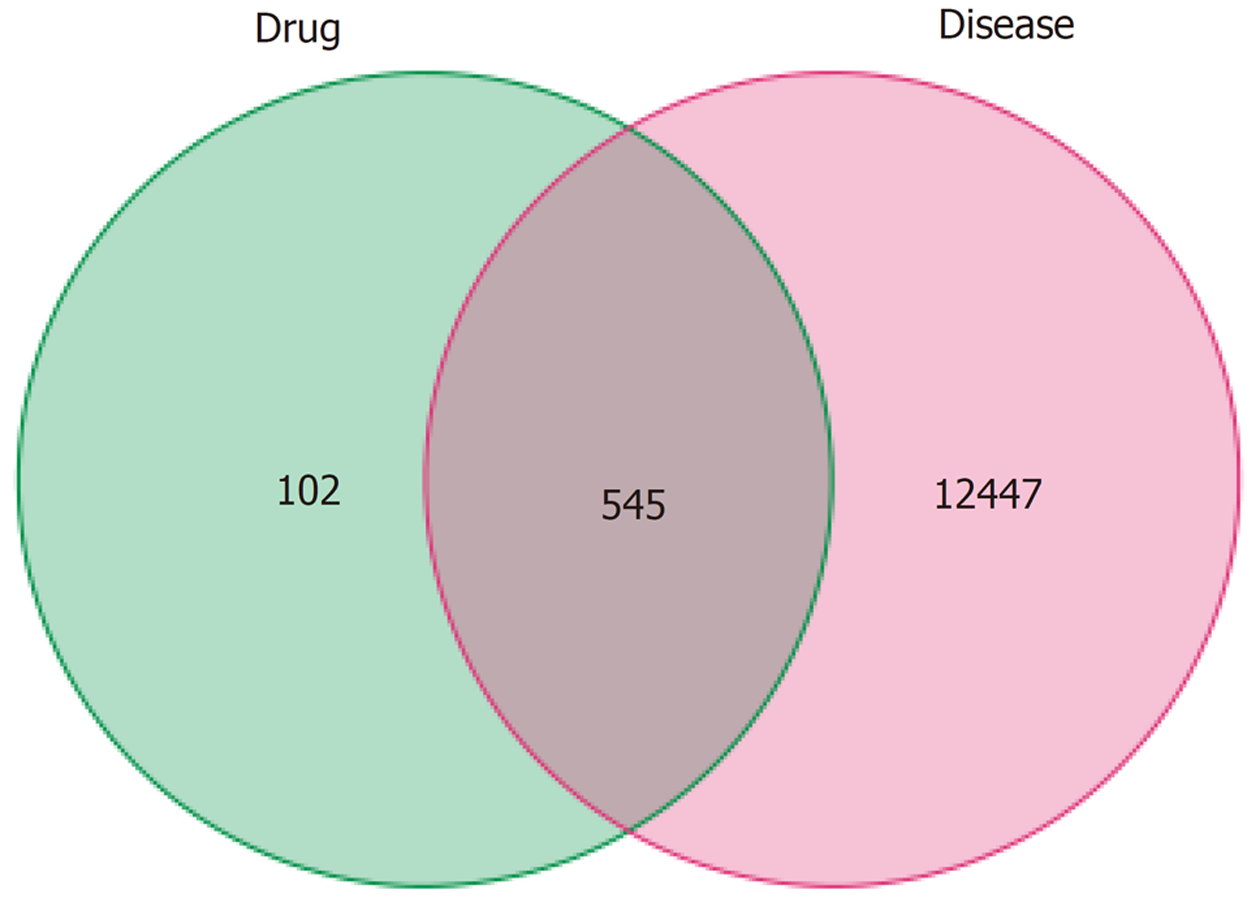
1.2.1 胃复春-结直肠癌交集靶点获取: 将胃复春中活性成分的靶点和结直肠癌的靶点取交集共靶点, 导入R 4.3.1软件制作Venn图, 得到胃复春-结直肠癌的交集靶点.
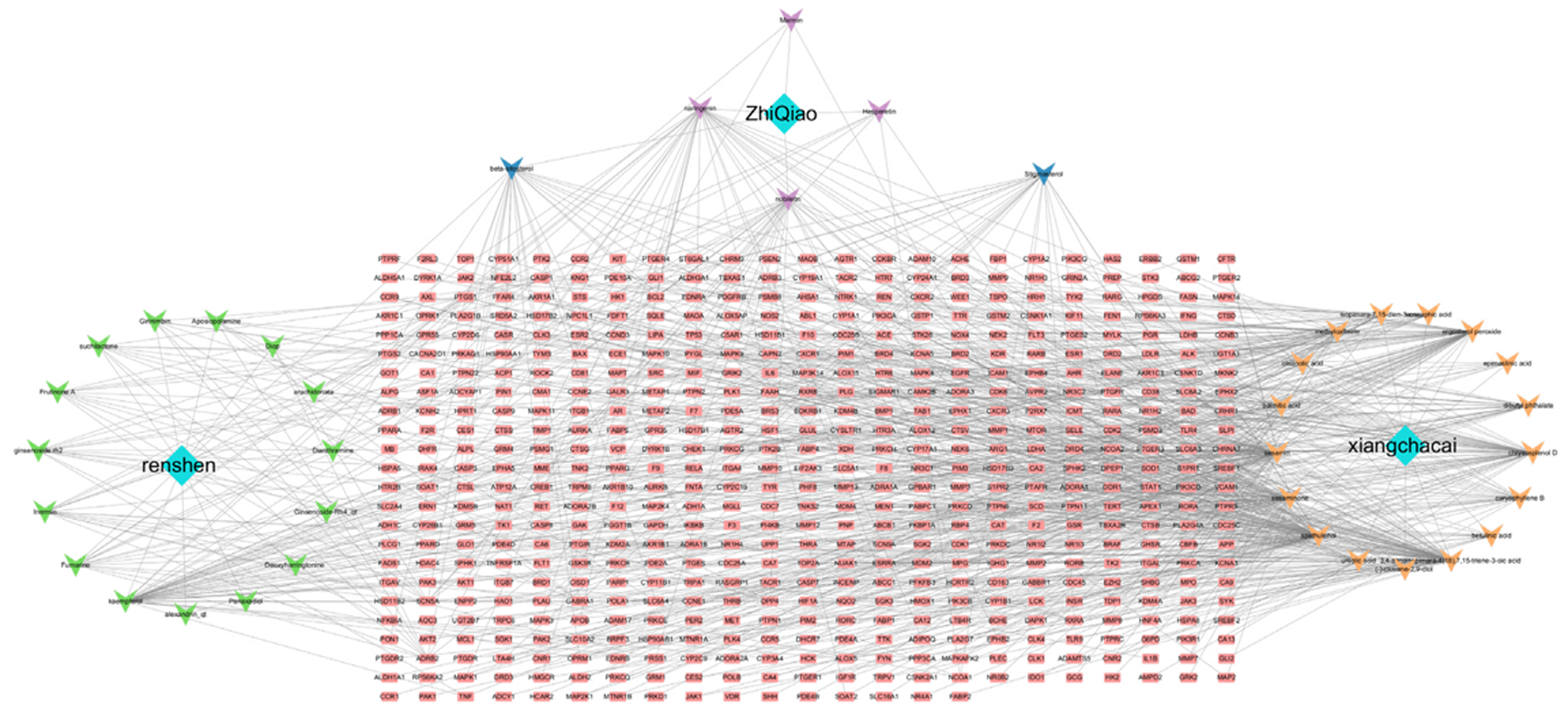
1.2.2 药物-成分-疾病-靶点网络图: 导入药物的关键活性分子、潜在作用靶点、相关疾病名称以及药物与疾病交叉作用的目标到Cytoscape 3.10.1软件, 以此建立一个复杂的"药物-成分-疾病-作用目标"关联图谱. 通过选用"Tools-Analyze Network"功能对图谱进行深入的功能性探析, 图中的节点象征着胃复春药物及其有效成分、涉及的结肠癌及作用靶点, 而连线则描绘了胃复春与其成分、成分与CRC、CRC与作用靶点间的互动关系.
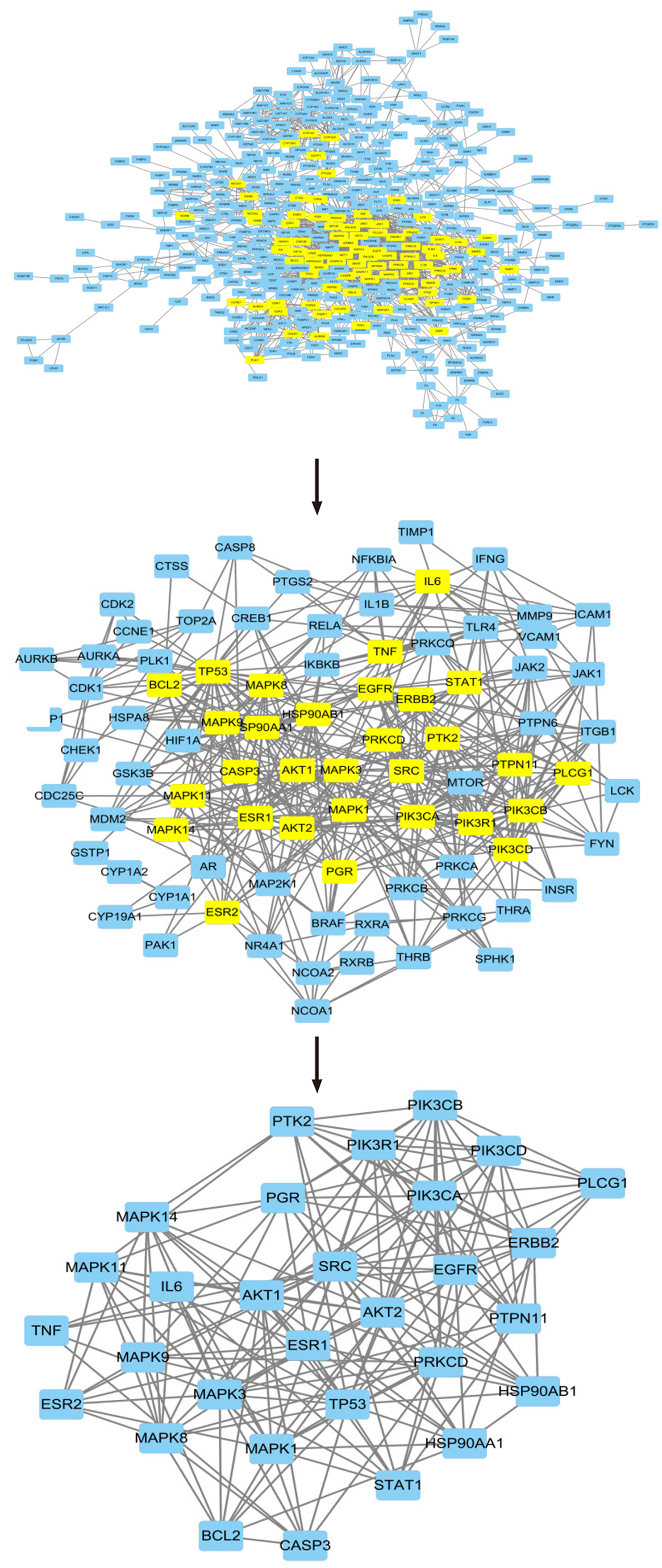
1.2.3 PPI网络图构建及核心靶点筛选: 将胃复春治疗结直肠癌的交集靶点导入至String(http://string-db.org)在线平台, 将物种限定为"Homo sapiens", 取最高置信度0.900, 获得靶蛋白之间的互作关系, 得到蛋白质间相互作用网络图(protein-protein interaction networks, PPI). 利用Cytoscape 3.10.1软件绘制PPI网络图. 使用CytoNCA推算拓扑参数分析, 根据Betweenness Centrality(中心度值)、Closeness Centrality(紧密中心度值)、Degree centrality(节点连接度值)、Eigenvector Centrality(特征向量中心性)、LAC、Network来筛选核心靶蛋白.
1.2.3 胃复春-结直肠癌交集靶点的富集分析: 导入胃复春与结直肠癌共有的靶点到R 4.3.1软件, 以创建基因功能(Gene Ontology, GO)、京都基因与基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析. 通过在R环境中安装并运行来自Bioconductor(http://www.bioconductor.org/)的开源生物信息学软件包, 如clusterProfiler、Stringi和Pathview, 执行GO和KEGG的功能富集分析, 随后借助微生信平台展示这些分析的可视化结果. GO分析涵盖三个维度: 生物过程(biological process, BP)、分子功能(molecular function, MF)以及细胞组分(cellular component, CC)对药物针对疾病目标蛋白的基因功能角色进行细致解读; 而KEGG分析侧重于揭示药物干预疾病的关键生物通路.
1.2.4 胃复春-结直肠癌交集靶点分子对接: 对拓扑学参数得分较高的大型和小型分子实施分子对接操作. 蛋白质的三维结构资料来源于RCSB数据库(https://www.rcsb.org/). 小分子的信息则由pubchem数据库提供. 初始步骤包括利用AutodockTools1,2进行蛋白质的去水和加氢处理, 以及为受体结构的对接做准备. 同时, 应用Open Babel和Autodock软件对小分子库执行分割和其他预处理操作. 利用Autodock软件完成分子对接后, 最终将对接成果通过pymol软件展现, 实现对接效果的直观呈现.
网络共收集活性成分38个, 其中人参15个, 香茶菜17个, 枳壳6个. 汇总得活性成分潜在靶点647个. 成分-靶点-疾病网络图有586个节点和906条线(见图1). 节点度较大的5个活性成分分别为3,4-secoisopimara-4(18),7,15-triene-3-oic acid, 芝麻素(sesamin), 桉油烯醇(spathulenol), 猫眼草酚D(chrysosplenol D), 过氧化麦角固醇(ergosterol peroxide), 面积越大的成分参与的生物功能越多, 在结直肠癌的治疗中发挥的作用越大.
通过Gene Cards、DisGeNET、Drug Bank数据库、TTD数据库和PharmGkb数据库检索结直肠癌的相关靶点, 以关键词"colorectal cancer"进行检索, 共获得结直肠癌活性靶点12992个(见图2). 韦恩图发现545个共有靶点(见图3).
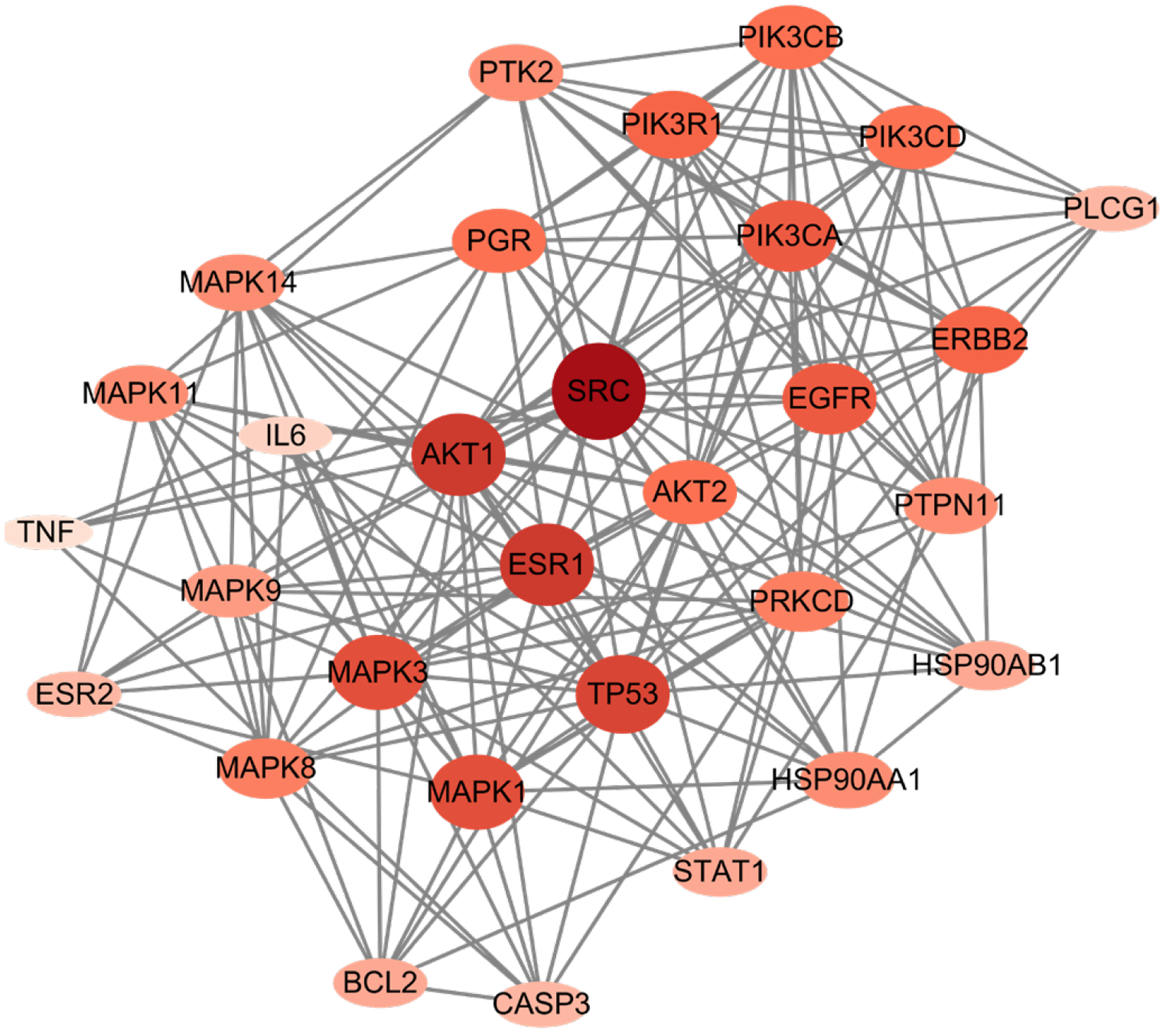
依次可得含433个节点、1578条线的一级PPI网络, 含86个节点、503条线的二级PPI网络, 含30个节点、184条线的三级PPI网络, 含30个节点、184条线的核心靶点PPI网络. 筛选流程见图4, 节点度加权优化后核心靶点PPI网络见图5. 其中SRC, AKT1, TP53, MAPK3, EGFR, ESR1, MAPK1, PRKCD, MAPK8, AKT2在PPI中发挥的作用较大.
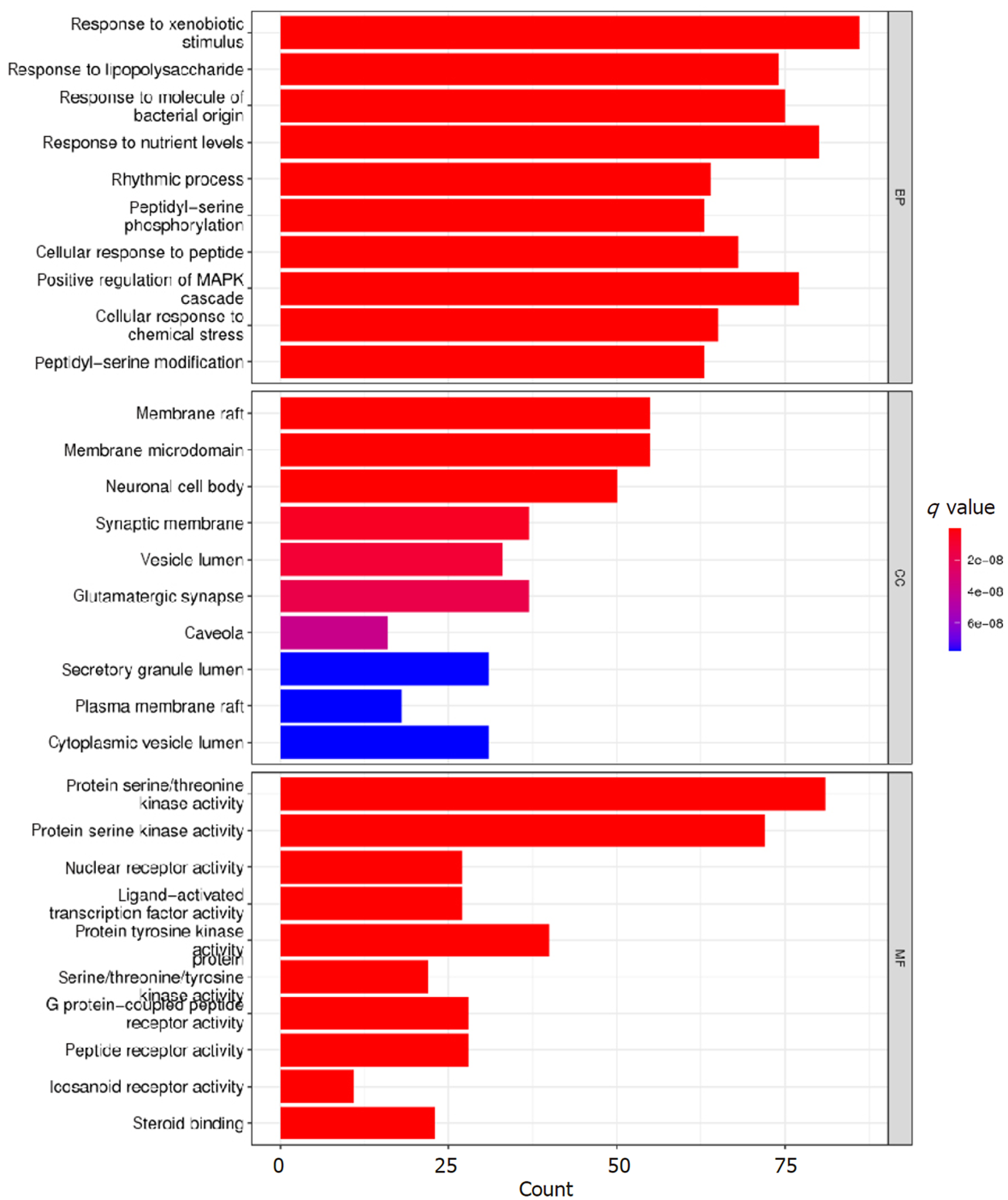
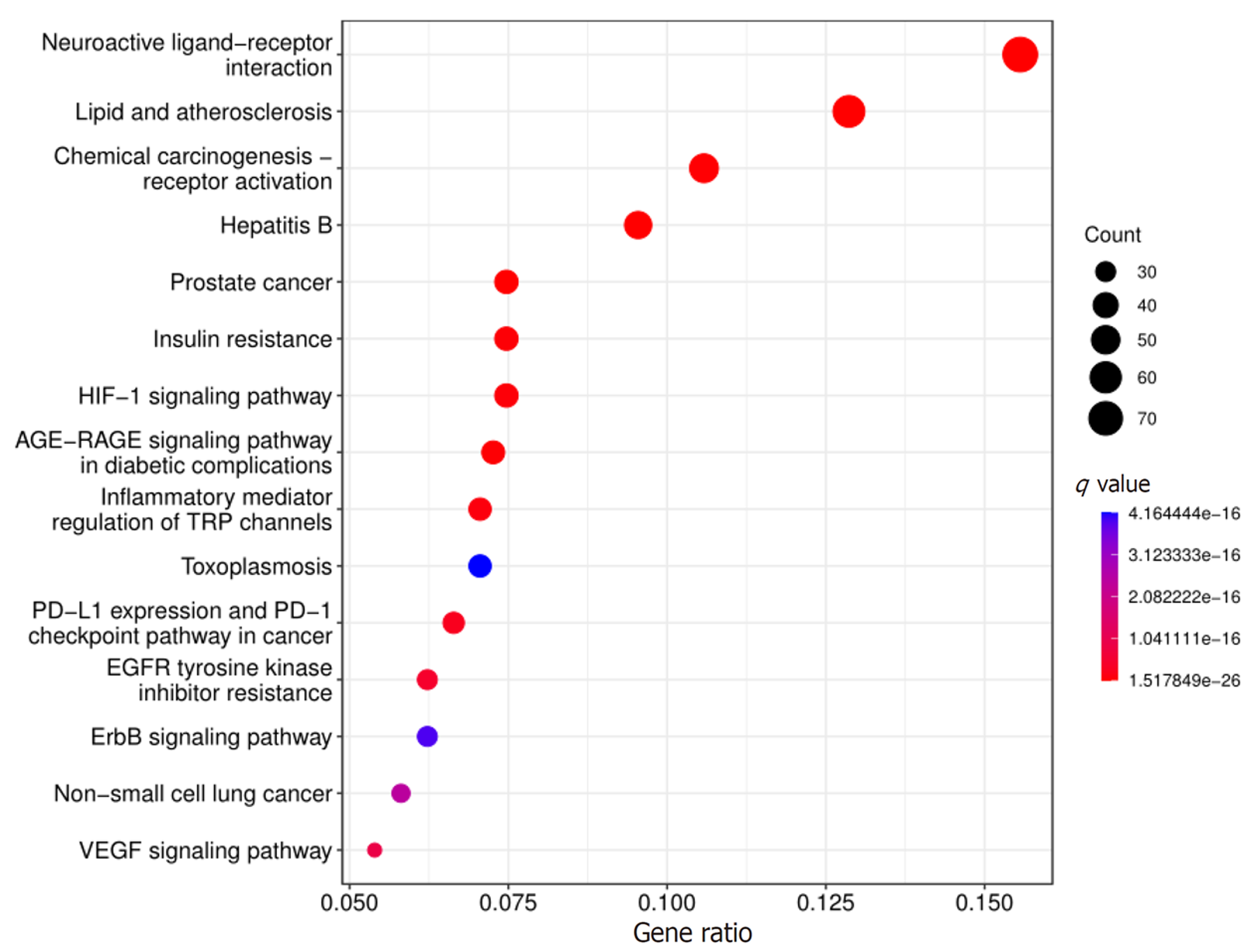
在GO功能富集分析方面, GO-BP类别覆盖了2216种不同的项目, 这些项目包括响应异种生物刺激、脂多糖反应、细菌性分子反应、对营养状态的反应和节律性过程等(见图6); GO-CC分类涵盖了67种项目, 包括细胞膜的特定区域如膜筏和膜微区, 以及神经元细胞体(见图6); 而GO-MF类别则包含了157种项目, 涉及的功能活性包括蛋白质丝氨酸/苏氨酸激酶活性、蛋白质丝氨酸激酶活性、核受体活性和蛋白质酪氨酸激酶活化剂的活性(见图6). 在KEGG路径富集分析中, 共有192条路径被识别为包含潜在作用靶点, 这些路径涉及到脂质代谢与动脉粥样硬化、神经活性配体与受体间的相互作用、前列腺癌、乙型肝炎以及化学致癌-受体激活等过程(见图7), 这揭示了这些路径与多种癌症及细胞的异常增殖和表达异常相关联.
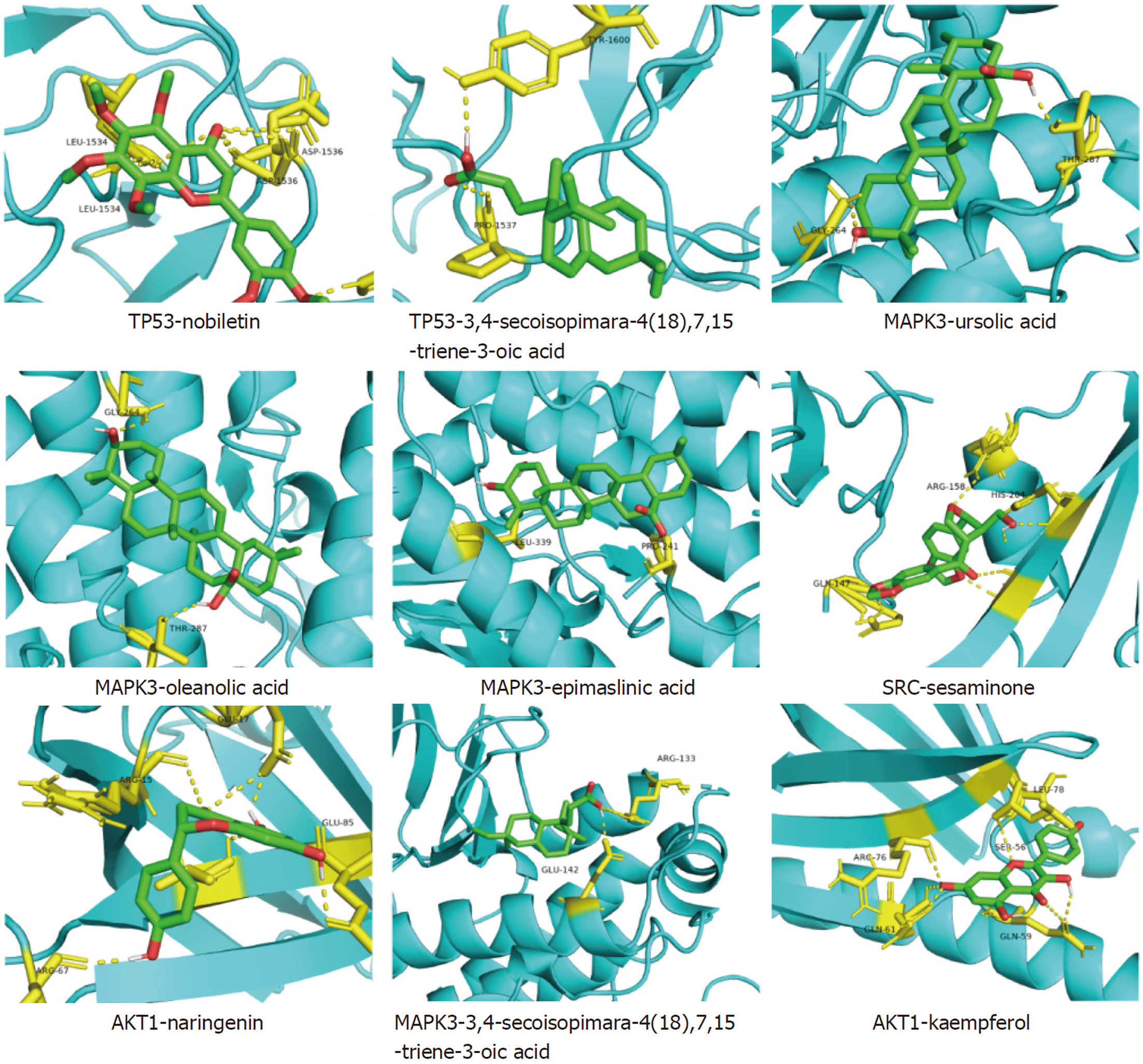
最终确定了SRC, AKT1, TP53, MAPK3, EGFR这五个关键作用目标作为蛋白质接收体, 并选择了与之相匹配的12种小分子化合物作为配体进行分子对接实验. 在对接过程中, 配体与受体之间的氢键关系通过黄色的虚线进行了示意, 并且标明了相连接的蛋白质残基的名称. 分子对接实验中表现最佳的九组配体-受体相互作用效果列在了表1中, 具体的对接效果展示于图8.
| 核心靶点 | 受体PDB编号 | 成分 | 小分子配体 | 结合能 |
| SRC | 1a07 | XCC | chrysosplenol D | -6.69 |
| 1a07 | XCC | sesaminone | -8.1 | |
| AKT1 | 1h10 | RS | kaempferol | -6.71 |
| 1h10 | ZQ | naringenin | -6.73 | |
| 1h10 | XCC | chrysosplenol D | -6.35 | |
| TP53 | 2g3r | ZQ | nobiletin | -8.79 |
| 2g3r | XCC | 3,4-secoisopimara-4(18),7,15-triene-3-oic acid | -8.6 | |
| MAPK3 | 7nrb | ZQ | naringenin | -6.4 |
| 7nrb | XCC | 3,4-secoisopimara-4(18),7,15-triene-3-oic acid | -6.73 | |
| 7nrb | XCC | Ursolic acid | -8.53 | |
| 7nrb | XCC | Oleanolic acid | -8.46 | |
| 7nrb | XCC | Epimaslinic acid | -8.15 | |
| 7nrb | XCC | (-)-clovane-2,9-diol | -6.39 | |
| EGFR | 1m14 | XCC | sesamin | -5.8 |
| 1m14 | XCC | Chrysosplenol D | -4.34 | |
| 1m14 | XCC | methylcaffeate | -3.16 | |
| 1m14 | XCC | (-)-clovane-2,9-diol | -4.53 |
本研究中借助网络药理学联合分子对接的方法, 建立成分-靶点-疾病网络, 探究胃复春胶囊治疗结直肠癌的靶点通路关系, 并通过分子对接技术, 进一步在分子-蛋白互作层面模拟其结合活性. 本研究中经数据库筛选和靶点预测, 最终得到活性成分38个, 与结直肠癌相关靶点545个, 主要核心活性成分为胃复春胶囊中的3,4-secoisopimara-4(18),7,15-triene-3-oic acid、猫眼草酚D(chrysosplenol D)、齐墩果酸(oleanolic acid)、川陈皮素(nobiletin)和熊果酸(ursolic acid). 这些化合物具备多方面的生物活性, 包括抗菌和消炎作用、促进组织愈合、阻止血小板凝集、保护血管内皮细胞、缓解微血管内皮的功能障碍及其损害, 并助于损伤组织的黏膜修复和再生[6]. 特别是, 如川陈皮素等成分, 被发现有助于胃肠道的动力、抑制癌细胞的扩散、具有抗炎和抗菌效果[7]. 这些发现证实了胃复春中关键活性成分在抗CRC方面的潜在效用.
经GO功能和KEGG通路富集分析, 胃复春胶囊治疗结直肠癌时活性成分与膜筏、膜微区、神经细胞体等作用, 经异生物刺激的反应、对脂多糖的反应、对细菌性分子的反应、对营养水平的反应、律动过程等与蛋白丝氨酸/苏氨酸激酶活化、蛋白丝氨酸激酶活化、核受体活化、蛋白酪氨酸激酶激活剂结合, 通过脂类与动脉粥样硬化、神经活性配体与受体的相互作用以及前列腺癌、乙型肝炎、化学致癌-受体激活等通路发挥疗效. SRC是一种非受体型酪氨酸激酶, 通过多种激酶通路[包括丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、磷脂酰肌醇3-激酶/蛋白激酶B/雷帕霉素机制靶点、Janus激酶/信号转导和转录激活因子3、伪足富集非典型激酶1以及Ras同源家族成员/Rho相关卷曲螺旋蛋白激酶等]参与调控胚胎发展与细胞增长, 并在下游信号传递中起到关键作用, 影响癌细胞的增殖、新血管形成、移动、侵入及扩散[8]. 在结直肠癌患者体内, SRC的表达显著增加, 与肿瘤的扩散及患者的生存预期紧密关联[9]. 胃复春中的有效成分能够通过阻断GF-RTK及TGF-TGFR途径[10], 抑制MAPK信号通道的激活, 降低HRAS、SRC等关键通路靶点的表达, 从而抑制由甘草脱氧胆酸引发的癌前细胞和腺癌细胞的增殖[11]. TP53基因在结直肠癌的发生中是最频繁遭遇突变的基因之一. 该基因扮演着关键的抗癌角色, 负责编码p53这一肿瘤抑制蛋白. 当细胞遭受DNA损伤、缺氧状态、营养不足或是癌症相关信号的挑战时, p53蛋白能够激活, 导致细胞周期停滞、细胞进入衰老状态或发生程序性死亡. TP53基因的突变被视为判断Ⅱ/Ⅲ期结直肠癌手术后是否会发生复发或转移的重要指标[12]. 胃复春中的活性化合物通过降低p53蛋白的表达来抑制或逆转细胞的癌变过程, 阻止细胞异常增长, 并促进其向成熟状态的分化, 从而保持细胞增殖与死亡之间的平衡[13].
因为网络药理学的途径依赖于系统生物学的大规模数据分析以推测其潜在的作用机制, 各种算法和模型的差异可能会影响这种预测的精确度. 因此, 本项研究还存在局限性, 未来的工作需要通过动物实验进一步验证.
综上所述, 本研究结果可预测, 胃复春胶囊在结直肠癌的治疗中, 以3,4-secoisopimara-4(18),7,15-triene-3-oic acid、猫眼草酚D(chrysosplenol D)、齐墩果酸(oleanolic acid)、川陈皮素(nobiletin)和熊果酸(ursolic acid)等多种活性成分, 针对SRC, AKT1, TP53等目标, 通过调控血脂与动脉粥样硬化、神经活性配体与受体的相互作用等机制, 对结直肠癌具有潜在治疗作用.
结直肠癌是全球高发的消化道恶性肿瘤, 传统中药胃复春在胃肠道疾病治疗中广泛应用. 近年来, 其抗肿瘤潜力备受关注. 本研究结合网络药理学和分子对接技术, 系统探索胃复春治疗结直肠癌的多成分、多靶点作用机制, 为其临床应用提供科学依据.
结直肠癌的治疗手段有限, 且传统化疗副作用较大. 胃复春作为中药复方, 具有多成分、多靶点的特点, 可能为结直肠癌提供新的治疗策略. 本研究旨在揭示其活性成分及作用机制, 为开发安全有效的抗肿瘤药物奠定基础.
本研究旨在通过网络药理学和分子对接技术, 系统分析胃复春胶囊中的活性成分及其作用靶点, 揭示其治疗结直肠癌的潜在分子机制, 为胃复春的临床应用和进一步开发提供理论支持.
利用TCMSP和Swiss Target Prediction数据库筛选胃复春的活性成分及潜在靶点. 通过GeneCards、DisGeNET等数据库获取结直肠癌相关靶点, 构建成分-靶点-疾病网络. 使用Cytoscape构建蛋白质相互作用网络(protein-protein interaction networks, PPI), 筛选核心靶点. 通过Metascape进行基因功能(Gene Ontology, GO)和京都基因与基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路富集分析, 揭示关键生物学过程和信号通路. 运用Pymol 2.4.0进行分子对接, 验证活性成分与靶点的结合能力.
筛选出38种活性成分和647个潜在靶点, 其中545个为胃复春与结直肠癌共有靶点. 构建了PPI网络, 识别出SRC、AKT1、TP53等核心靶点. GO功能富集分析揭示了脂质代谢、细胞增殖等关键生物过程; KEGG通路分析表明胃复春通过调控神经活性配体-受体相互作用等通路发挥作用. 分子对接结果显示, 猫眼草酚D、齐墩果酸等活性成分与核心靶点具有高亲和力, 验证了其潜在治疗作用.
胃复春胶囊通过猫眼草酚D、齐墩果酸、川陈皮素等活性成分, 靶向SRC、AKT1、TP53等核心蛋白, 调控脂质代谢、神经活性配体-受体相互作用等关键通路, 发挥抗结直肠癌作用. 分子对接验证了活性成分与靶点的高亲和力, 为胃复春的临床应用提供了理论依据.
本研究为胃复春治疗结直肠癌提供了多靶点、多通路的机制解释, 未来可通过体外实验和动物模型进一步验证其抗肿瘤效果及安全性. 此外, 基于网络药理学的发现, 可优化胃复春的配方, 开发新型抗结直肠癌药物, 推动中医药现代化和国际化发展.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7-30. [PubMed] [DOI] |
| 2. | Wang H, Wu R, Xie D, Ding L, Lv X, Bian Y, Chen X, Nisma Lena BA, Wang S, Li K, Chen W, Ye G, Sun M. A Combined Phytochemistry and Network Pharmacology Approach to Reveal the Effective Substances and Mechanisms of Wei-Fu-Chun Tablet in the Treatment of Precancerous Lesions of Gastric Cancer. Front Pharmacol. 2020;11:558471. [PubMed] [DOI] |
| 4. | 潘 海春, 陈 琳慧, 汪 玲羽. 基于GEO芯片联合网络药理学探讨胃复春治疗胃低级别上皮内瘤变机制. 中国中医药图书情报杂志. 2023;47:32-39. [DOI] |
| 5. | 杨 恒, 杨 家越, 代 耀, 赵 艳玲, 马 骁, 曾 进浩. 基于Meta分析桥接网络药理学的胃复春治疗消化性溃疡疗效评价及潜在作用机制研究. 中草药. 2021;52:6625-6636. [DOI] |
| 7. | Wang Y, Chen Y, Zhang H, Chen J, Cao J, Chen Q, Li X, Sun C. Polymethoxyflavones from citrus inhibited gastric cancer cell proliferation through inducing apoptosis by upregulating RARβ, both in vitro and in vivo. Food Chem Toxicol. 2020;146:111811. [PubMed] [DOI] |
| 8. | Teli G, Pal R, Maji L, Sengupta S, Raghavendra NM, Matada GSP. Medicinal Chemistry Perspectives on Recent Advances in Src Kinase Inhibitors as a Potential Target for the Development of Anticancer Agents: Biological Profile, Selectivity, Structure-Activity Relationship. Chem Biodivers. 2023;20:e202300515. [PubMed] [DOI] |
| 9. | Jin W. Regulation of Src Family Kinases during Colorectal Cancer Development and Its Clinical Implications. Cancers (Basel). 2020;12:1339. [PubMed] [DOI] |
| 10. | Jaiswal K, Lopez-Guzman C, Souza RF, Spechler SJ, Sarosi GA. Bile salt exposure increases proliferation through p38 and ERK MAPK pathways in a non-neoplastic Barrett's cell line. Am J Physiol Gastrointest Liver Physiol. 2006;290:G335-G342. [PubMed] [DOI] |
| 11. | Sankoda N, Tanabe W, Tanaka A, Shibata H, Woltjen K, Chiba T, Haga H, Sakai Y, Mandai M, Yamamoto T, Yamada Y, Uemoto S, Kawaguchi Y. Epithelial expression of Gata4 and Sox2 regulates specification of the squamous-columnar junction via MAPK/ERK signaling in mice. Nat Commun. 2021;12:560. [PubMed] [DOI] |
| 12. | 黄 莉锋, 黄 健, 范 玉芳, 陈 月苗, 姜 威, 包 迎红, 蔡 小平. TP53及相关临床病理特征与Ⅱ/Ⅲ期结直肠癌的生存预后分析. 结直肠肛门外科. 2023;29:227-233. [DOI] |
| 13. | Unger Z, Molnár B, Prónai L, Szaleczky E, Zágoni T, Tulassay Z. Mutant p53 expression and apoptotic activity of Helicobacter pylori positive and negative gastritis in correlation with the presence of intestinal metaplasia. Eur J Gastroenterol Hepatol. 2003;15:389-393. [PubMed] [DOI] |