修回日期: 2025-01-06
接受日期: 2025-03-16
在线出版日期: 2025-03-28
乳腺癌发病率呈上升趋势, 转移仍是主要难题. 二甲双胍展现出抗癌作用, 但其机制尚不明确. miR-34a是一种抑癌微小核糖核酸. 本研究探究二甲双胍与miR-34a在乳腺癌中的关联, 旨在阐明二甲双胍的抗癌机制.
研究二甲双胍通过下调miR-34a的表达对乳腺癌细胞增殖及肝转移的影响.
通过脂质体转染的方法构建miR-34a过表达和阴性对照(negative control, NC)组, 转染空病毒载体. 通过实时定量聚合酶链式反应检测MDA-MB-231和T-47-D细胞株中miR-34a的表达, 确定稳定转染的细胞株. 给予二甲双胍(0、5、10和20) mM进行处理. 噻唑蓝法检测乳腺癌细胞增殖. 凋亡实验测定乳腺癌细胞的凋亡情况的影响. 划痕实验及Transwell法检测细胞的迁移侵袭能力. 同时给予小鼠鼠鼷部接种TA2乳腺癌细胞. 接种肿瘤后第4天给予小鼠5 mM、10 mM和20 mM二甲双胍灌胃, 分别接种后18 d和30 d观察小鼠移植瘤的生长情况及肝和脾转移情况. 蛋白质印记技术检测细胞株和瘤组织中miR-34a的表达及E-钙粘蛋白(E-cadherin)、波形蛋白(Vimentin)的表达化.
二甲双胍对MDA-MB-231和T-47-D细胞的增殖、迁移和侵袭均有明显的抑制作用(P<0.05); 且二甲双胍能够明显促进E-cadherin蛋白表达, 抑制Vimentin蛋白表达(P<0.05), 并随着二甲双胍作用浓度的增加, miR-34a的表达量随之升高(P<0.05); 相较于NC, 转染Pre-miR-34a后, 细胞中miR-34a表达增加(P<0.05), 转染质粒miR-34a inhibitor后, 细胞中miR-34a表达下降(P<0.05). 相较于未加药低表达株, 将浓度为10 mM的二甲双胍作用于miR-34a低表达的细胞株后, 细胞株中miR-34a的含量明显升高(P<0.05), 相较于NC组, 高表达miR-34a组细胞生长最慢, 低表达miR-34a组生长最快, 从第3 d开始差异存在统计学意义(P<0.05); 高表达组迁移和侵袭至下室的细胞数明显减少(P<0.05), 低表达组则明显增加(P<0.05), 而经二甲双胍处理后的低表达组迁移侵袭至下室的细胞数介于两者之间, 且明显低于低表达组(P<0.05); 高表达miR-34a细胞株中E-cadherin蛋白表达量增多、Vimentin蛋白表达量下降, 低表达miR-34a细胞株中E-cadherin蛋白表达量降低、Vimentin蛋白表达量增加, 而经二甲双胍10 mM作用于低表达细胞之后, E-cadherin蛋白表达量在低表达细胞基础上有所增加, Vimentin蛋白表达量则有所降低(P<0.05); 实验组小鼠肿瘤体积明显小于对照组(P<0.05)实验组与对照组肝脏转移率差异有统计学意义(P<0.05), 而脾脏转移率差异无统计学意义; 实验组小鼠肿瘤组织中miR-34a的表达高于对照组(P<0.05). 肿瘤组织中E-cadherin蛋白表达量增多、Vimentin蛋白表达量下降(P<0.05).
二甲双胍可能下调miR-34a的表达抑制乳腺癌细胞的增殖、侵袭和迁移能力, 并能抑制小鼠乳腺癌肝脾的转移.
核心提要: 研究发现二甲双胍或可抗癌, 但其机制不明. 本文通过细胞和动物实验, 证实二甲双胍可能通过上调miR-34a水平, 影响E-cadherin和Vimentin表达, 抑制乳腺癌细胞增殖、侵袭和迁移, 以及小鼠乳腺癌肝脾转移.
引文著录: 王旨, 徐锡枫, 徐杰伟, 孔来法. 二甲双胍通过上调miR-34a抑制乳腺癌细胞增殖及肝转移作用的研究. 世界华人消化杂志 2025; 33(3): 215-224
Revised: January 6, 2025
Accepted: March 16, 2025
Published online: March 28, 2025
The incidence of breast cancer is on the rise, and metastasis remains a major challenge. Metformin has demonstrated anti-cancer effects, yet its mechanism remains unclear. miR-34a is a tumor-suppressing microRNA. This study explored the relationship between metformin and miR-34a in breast cancer, aiming to clarify the anti-cancer mechanism of metformin.
To study the effect of metformin on breast cancer cell proliferation and liver metastasis and to explore the possible mechanism involved.
Breast cancer cells were transfected with pre-miR-34a or empty virus vector (negative control [NC] group) using the liposome transfection method. Real-time PCR was used to detect the expression of miR-34a in MDA-MB-231 and T-47-D cell lines, and the stably transfected cell lines were determined. Metformin (0, 5, 10, and 20 mM) was then administered. Breast cancer cell proliferation was detected by MTT assay. Apoptosis assay was used to determine the apoptosis in breast cancer cells. The invasive ability of cells was detected by scratch test and Transwell cell assay. Meanwhile, TA2 breast cancer cells were inoculated into the inguinal region of mice. On day 4 after tumor cell inoculation, mice were given metformin at 5 mM, 10 mM, and 20 mM by intragastric administration. The growth of tumors and liver and spleen metastases were observed at 18 and 30 days after tumor cell inoculation. Western blotting was used to detect the expression of miR-34a and the expression of E-cadherin and Vimentin in cell lines and tumor tissues.
Metformin significantly inhibited the proliferation, migration, and invasion of MDA-MB-231 and T-47-D cells (P < 0.05), and significantly promoted the expression of E-cadherin protein and inhibited the expression of Vimentin protein (P < 0.05). With the increase of metformin concentration, the expression of miR-34a increased (P < 0.05). Compared with the NC group, the expression of miR-34a was increased after transfection with pre-miR-34a (P < 0.05), and decreased after transfection with miR-34a inhibitor (P < 0.05). Compared with untreated breast cancer cells with low expression of miR-34A, the content of miR-34a was significantly increased after treatment with metformin at a concentration of 10 mM (P < 0.05). Compared with the NC group, cells with high expression of miR-34a grew slowest, while those with low expression of miR-34a grew fastest; the difference began to exhibit a statistically significant difference from day 3 (P < 0.05). The number of cells migrating and invading into the lower compartment in the high expression group was significantly decreased (P < 0.05), while that of the low expression group was significantly increased (P < 0.05). The number of cells migrating and invading into the lower compartment in the low expression group after metformin treatment was in the middle and significantly lower than that in the low expression group (P < 0.05). The expression of E-cadherin increased and Vimentin decreased in cells with high expression of miR-34a, but showed opposite trends in cells with low expression of miR-34a. After treatment with metformin at 10 mM, the expression of E-cadherin increased and Vimentin decreased in cells with low expression of miR-34a (P < 0.05). The tumor volume in the experimental group was significantly smaller than that in the control group (P < 0.05). There was a significant difference in the liver metastasis rate between the experimental group and the control group (P < 0.05), but there was no significant difference in the spleen metastasis rate (P > 0.05). The expression of miR-34a in tumor tissues of experimental mice was higher than that of the control group (P < 0.05). The expression of E-cadherin protein was increased and Vimentin protein was decreased in tumor tissues (P < 0.05).
Metformin may down-regulate the expression of miR-34a to inhibit the proliferation, invasion, and migration of breast cancer cells, as well as the liver and spleen metastasis of breast cancer in mice.
- Citation: Wang Z, Xu XF, Xu JW, Kong LF. Metformin suppresses breast cancer cell proliferation and liver metastasis by up-regulating miR-34a. Shijie Huaren Xiaohua Zazhi 2025; 33(3): 215-224
- URL: https://www.wjgnet.com/1009-3079/full/v33/i3/215.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i3.215
随着社会的发展及女性社会压力的增大, 乳腺癌的发病率具有明显增长趋势, 已成为中国女性发病率第一的恶性肿瘤, 其死亡率在过去30年上升了90%, 且发病高峰年龄已由50岁-60岁下降至40岁-50岁, 即具有年轻化的趋势, 严重威胁女性生命健康安全[1]. 当前, 虽然以手术为主, 辅以放化疗和生物治疗的综合性疗法已使乳腺癌的五年生存率提高至70%, 但仍然有超过30%晚期患者死于复发和转移, 其中远处转移以及肝转移是导致乳腺癌治疗失败的主要原因, 严重影响患者预后[2]. 因而阐明乳腺癌的侵袭转移机制并探寻有效药物意义重大.
二甲双胍作为一种经典的口服降糖药物, 可有效降低血糖含量. 研究发现, 糖尿病患者接受二甲双胍治疗后, 胰腺癌、乳腺癌、肝癌、结直肠癌等癌症发病率及癌症死亡率显著降低, 意味着二甲双胍具有一定的抗肿瘤作用, 利于减少糖尿病患者罹患恶性肿瘤的风险[3]. 另有研究显示[4], 乳腺癌患者在采取二甲双胍辅助化疗后, 病理完全缓解率显著提升, 且对化疗药物的敏感性亦显著增加, 预示着二甲双胍可以改善乳腺癌患者的预后. 此外, 还有研究发现[5], 二甲双胍能够抑制宫颈癌、胃癌及卵巢癌等多种癌细胞的生长. 当前关于二甲双胍抗癌作用的确切机制尚未完全阐明, 但普遍认为与调控微小核糖核酸(micro ribonucleic acid, miRNA)的表达有关.
miRNA是一类非编码小RNA, 亦是许多生物过程的关键调控因子, 可通过靶向结合多个信使核糖核酸的3' UTR位点影响细胞的功能, 如细胞增殖、分化、凋亡. 研究发现, miRNA在多种肿瘤中表达异常, 并参与肿瘤的形成、发展、生长和转移. 汤轶等[6]的研究显示, 二甲双胍可通过阻断Janus激酶/转录激活蛋白信号通路抑制宫颈癌细胞的上皮-间质转化(epithelial-mesenchymal transiti-ons, EMT). EMT是肿瘤转移的关键环节, 该过程可减少细胞间的黏附性, 可抑制上皮钙黏蛋白(E-cadherin)的表达和强化波形蛋白(Vimentin)表达, 导致细胞获得更强的运动、侵袭迁移能力. miR-34基因族的成员在多种类型癌症中被证实是抑制EMT的关键基因. miR-34a作为miR-34家族的重要成员之一, 参与了肿瘤生长和转移的调控[7]. 据此, 本研究重点探讨二甲双胍与miR-34a抗癌作用之间的关系, 旨在为二甲双胍的抑瘤作用提供实验依据.
1.1.1 细胞株: 人乳腺癌MDA-MB-231、T-47-D体外细胞系均购自上海肃攀生物科技有限公司.
1.1.2 主要试剂及仪器设备: 达尔伯克氏基础培养基(dulbecco's modified eagle medium, DMEM)培养液购自Gibco; 双抗(青霉素-链霉素溶液)购自上海铭博生物科技有限公司; 二甲双胍粉末购自美国Sigma公司; 胎牛血清购自上海吉泰依科赛生物科技有限公司; 二甲基亚砜购自Sigma公司; miR-34a质粒购自美国Dharmacon公司; SYBR Prefect Ex TaqⅡTM(Perfect Real Time)购自宝生物工程大连有限公司; β-肌动蛋白(β-actin)鼠多克隆抗体、山羊抗兔二抗购自北京百奥莱博科技有限公司; E-cadherin、Vimentin单克隆抗体购自武汉博士德生物工程有限公司; 蛋白质印记(Western blotting, WB)一抗/二抗稀释液购自上海如吉生物科技发展有限公司; BCA蛋白浓度测定试剂盒购自上海索宝生物科技有限公司; Western Bright Quantum增强型化学发光底物购自环亚生物科技有限公司; 细胞计数套件-8(cell counting kit-8, CCK-8)试剂盒购自武汉默沙克生物科技有限公司; 细胞凋亡检测试剂盒购自日本MBL公司; Transwell小室购自北京明阳科华生物科技有限公司; Trizol Reagent购自上海玉博生物科技有限公司. 聚合酶链式反应(polymerase chain reaction, PCR)扩增仪购自杭州朗基科学仪器有限公司; 荧光定量PCR仪购自ABI西安天隆科技有限公司.
1.2.1 细胞培养: 将乳腺癌MDA-MB-231、T-47-D细胞培养在37 ℃、5%二氧化碳全湿度培养箱中, DMEM培养基为10%FBS+青霉素100 U/mL+链霉素100 mg/mL.
1.2.2 CCK-8实验: 制备MDA-MB-231、T-47-D细胞悬液, 计数分别以8000个/孔、1.5万个/孔铺入96孔板中. 在48 h取出96孔板, 加入CCK-8检测试剂, 培养1 h后采用酶标仪测450 nM波长处的吸光度(optical density, OD)值, 取OD值在1左右的细胞数. 取消化对数生长期的细胞, 弃培养皿中原培养液, 磷酸盐缓冲液(phosphate buffer saline, PBS)洗两遍, 吸弃, 用胰酶消化液处理后, 吸弃, 加入培养液终止消化. 吹下贴壁细胞收集细胞悬液, 以二甲双胍6个作用浓度(0、2.5、5、10、15、20) mM, 每个浓度4个副孔, 与所需的细胞悬液和培养液混匀, 加入96孔板中. 在二甲双胍分别作用4个作用时间(12、24、36、48) h后, 加入CCK-8, 每孔100 μL, 并加入一个不含细胞的空白对照组. 放入培养箱1 h后, 检测450 nM波长处的OD值. 细胞相对增值率按照公式: (加药孔-空白孔)/(对照组-空白孔)×100%计算, 确定药物作用的最佳浓度与时间. 采用CCK-8检测转染后的MDA-MB-231细胞的增殖能力. 转染细胞分为MOCK组、NC组、高表达组和低表达组, 每组5个副孔, 分别检测[0(细胞贴壁时间)、1、2、3、4、5] d的各组孔内的吸光度. 根据检测出来的吸光度减去空白孔的结果, 绘制生长曲线.
1.2.3 Transwell小室迁移实验: 取六孔板中不同浓度二甲双胍(0、5、20) mM作用48 h的细胞, 使细胞分散成单个细胞. 冲池计数, 用基础培养基配制每组含有2.5×104个MDA-MB-231细胞的细胞悬液200 μL. 将细胞悬液加入上室, 标记好日期和分组, 在培养箱中培养24 h后, 取出小室, 放入含有4%多聚甲醛的孔中固定15 min后, 转移至含结晶紫染色液的孔中固定15 min, 切下小室基底膜, 拍照计数. 相对迁移率计算公式为: (二甲双胍处理组细胞数/空白对照组细胞数)×100%.
1.2.4 划痕实验: 取消化对数生长期的细胞, 收集细胞悬液, 按T-47-D细胞5×105个/孔, 铺入12孔板中, 并放入培养箱中待其贴壁. 镜下观察已贴壁的细胞, 待其分布均匀后划痕. 将培养基换成含浓度为(0、5、10、20) mM二甲双胍的2% FBS培养基, 作用48 h后, 换成不含二甲双胍的2% FBS培养基. 因T-47-D细胞迁移能力弱, 在加药作用后的(0、24、48、72、96) h拍照记录. 按照公式迁移闭合率 = (迁移距离/划痕距离)×100%, 以此反应细胞迁移能力.
1.2.5 凋亡实验: 收集二甲双胍不同浓度(0、5、10、20) mM作用48 h的细胞和相同条件下未被二甲双胍作用的细胞. 收集培养皿中原培养液, PBS洗两遍, 吸弃, 用胰酶消化液处理后, 吸弃, 加入收集的原培养液终止消化. 吹下贴壁细胞收集细胞悬液, 离心弃掉培养液, 加入PBS 1重悬细胞, 离心, 重复用PBS洗一遍. 转染后的细胞凋亡实验收集细胞步骤同上. 按照Buffer:APC:PI = 100:1:1比例配制处理组细胞所需的染料, 每管细胞50 μL, 对照组只需加入50 μL的Buffer. 重悬细胞, 轻轻吹打使其成单个, 4 ℃, 染色15 min. 每管加入150 μL的Buffer终止染色, 1 h内采取流式细胞检测, 统计分析凋亡率.
1.2.6 WB检测: 取对数生长期细胞(MDA-MB-231、T-47-D), 收集细胞悬液, 取一六孔板每孔加入2 mL培养液, 将细胞悬液加入孔内, MDA-MB-231细胞80 μL/孔, T-47-D细胞100 μL/孔, 放入培养箱内培养. 待六孔板细胞贴壁后, 给予二甲双胍处理48h, 分组为(0、5、10、20) mmol四个浓度组. 药物作用48h后收集细胞, 加入(40-60) μL裂解液, 混匀后加入细胞沉淀中, 重悬细胞. 置于冰上裂解15 min, 提取总蛋白备用. 4 ℃, 12500 rpm条件下离心处理15 min, 使用容量瓶转移上清液, 使用Bio-Rad蛋白分析试剂盒测定蛋白浓度. 使用聚丙烯酰胺凝胶(10%分离, 4%积层)电泳总蛋白, 再将其转移至聚偏二氟乙烯膜, 加封闭液稀释后室温摇床孵育1 h. 4 ℃冰箱过夜, 添加一抗、洗脱, 添加二抗(1:2000)孵育1 h. 使用化学发光法显影成像, 获得蛋白条带, 以GAPDH为内参照, 使用软件进行处理, 获得目标条带与参照条带的密度的比值.
1.2.7 实时定量PCR(real-time quantitative PCR, RT-PCR)检测细胞内miR-34a的表达量: Trizol法提取细胞总RNA、合成cDNA, 进行RT-PCR检测. miR-34a引物序列: 上游5'-CCCACATTTCCTTCTTATCAACAG-3', 下游5'-TGGCAGTGTCTTAGCTGGTTGTG-3', 退火温度60 ℃. 内参照为U6. miR-34a相对表达量采用2-△△Ct法计算, 其中△△Ct = △Ct(样本)-△Ct(内参). 实验重复3次.
1.2.8 MDA-MB-231细胞的转染并建立稳定细胞株: 取消化对数生长期的MDA-MB-231细胞, PBS洗两遍, 吸弃, 经胰酶消化液处理后, 吸弃, 加入培养液终止消化. 吹下贴壁细胞收集细胞悬液, 均匀铺入6孔板中, 镜下观察贴壁后的密度, 达70%-80%, 且细胞分布均匀后开始转染. 取6个EP管, 每管加入100 μL DMED基础培养基, 再取其中3管加入4 μL lipofectamin 2000试剂, 另外3管分别加入pre-miR-34a, anti-miR-34a和NC质粒, 各4 μL, 混匀后, 静置5 min. 将静置后的lipofectamin 2000试剂与质粒混合, 室温静置20 min, 使其成为DNA/lipofectamin 2000复合物. 将6孔板内培养基换成无血清DMEM基础培养基, 每孔1 mL, 将上述混合液加入对应孔中, 混合均匀后放入培养箱中. 6 h后弃掉六孔板中培养基, 换成含10% FBS完全培养基, 继续培养. 转染后24 h, 荧光显微镜下拍照, 观察转染效率. 通过脂质体转染的方式在乳腺癌MDA-MB-231细胞中构建过表达和低表达miR-34a的细胞株, 分为4组: 过表达miR-34a组(Pre-miR-34a)、低表达miR-34a组(miR-34a inhibitor)、无义序列组(NC)和未处理组(MOCK).
1.3.1 实验动物来源: 6-8周龄正常成年TA2雌鼠60只, 体重(22-25) g, 清洁级, 购自购自重庆医科大学实验动物中心.
1.3.2 TA2小鼠肝脾高转移乳腺癌移植瘤模型的制备: 在无菌环境下, 剪碎高肝脾转移的TA2小鼠乳腺癌组织, 钼网中研磨, 加入生理盐水将瘤细胞浓度稀释至1×105/mL时接种于小鼠的鼠鼷部, 0.2 mL/只.
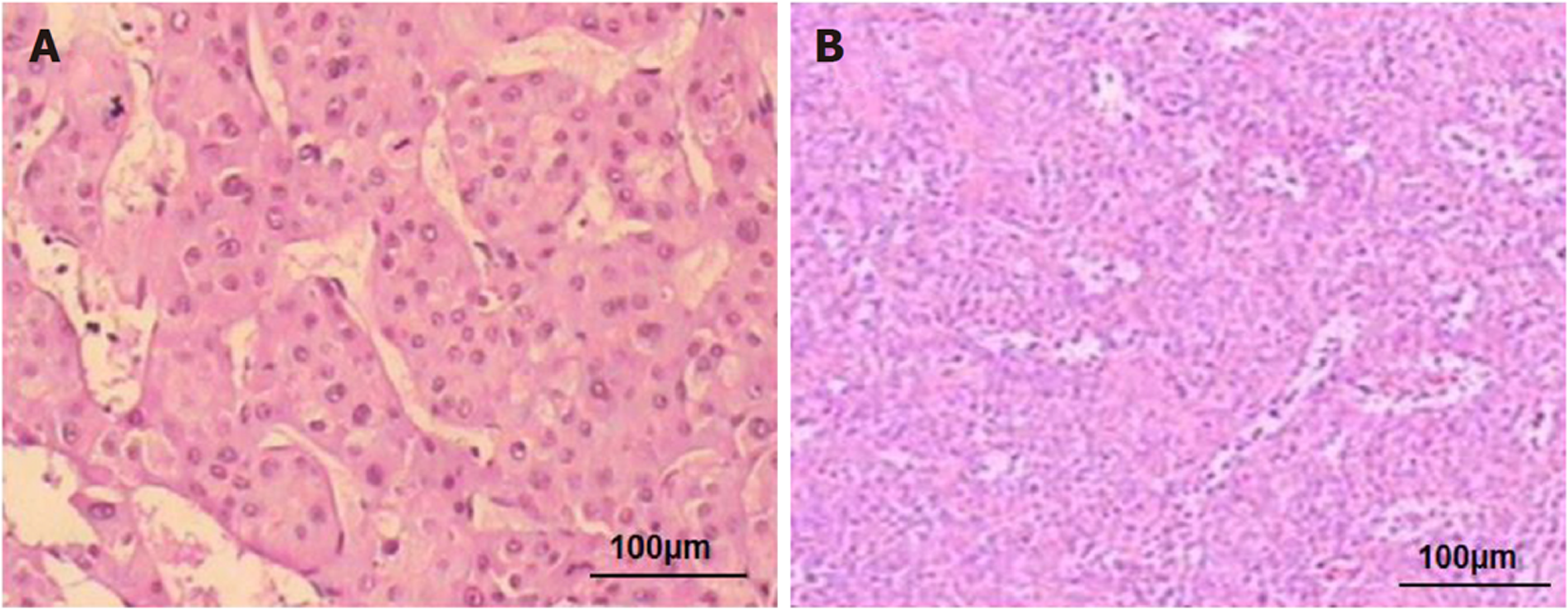
1.3.3 动物分组、给药及标本的收集: 将小鼠随机分为实验组与对照组, 每组各20只. 接种肿瘤后第4 d开始给药, 根据药物处理浓度不同依次分为对照组(0.9%生理盐水)、低剂量组(二甲双胍处理浓度为125 mg/kg)、高剂量组(二甲双胍处理浓度为250 mg/kg), 两天一次, 腹腔注射给药, 分笼饲养, 确保饲养环境一致, 经过人与动物药量换算, 其中低剂量为为二甲双胍正常使用剂,每6 d测一次瘤体积, 用游标卡测量肿瘤的长径(a)与短径(b), 根据公式: V = (a×b2)/2计算瘤体体积, 并绘制呈瘤生长曲线. 接种肿瘤后18 d、30 d, 用颈椎脱臼法各处死10只小鼠, 收集小鼠移植瘤、肝和脾组织, 新鲜组织用于提取RNA, 剩余组织采用10%福尔马林固定, 石蜡包埋, 常规切片, 用于苏木素-伊红(HE)染色, 见图1. 实验后期部分小鼠因肝脾转移而死亡, 最终收集到的标本为MET250组18例、MET125组17例、对照组16例.
1.3.4 HE染色法检测肝脾转移: HE染色, 显微镜下观察肿瘤组织坏死、转移情况, 统计小鼠肝、脾转移例数.
1.3.5 RT-PCR探针法检测瘤组织中miR-34a的表达量: 将解冻好的肿瘤组织用匀浆机破碎, 每管加入Trizol 1 mL, 剩余步骤与上述提取细胞总RNA中步骤相同.
1.3.6 Western bolt法检测肿瘤组织中E-cadherin、Vimentin蛋白的表达量: 将肿瘤组织用匀浆机破碎, 其余步骤同上述提取细胞总蛋白步骤相同.
统计学处理 本次研究所得数据使用SPSS 19.0统计学软件分析, 计量资料用(mean±SD)表示, 采用独立样本t检验, 计数资料用[n(%)]表示, 采用χ2检验, P<0.05表示有统计学意义.
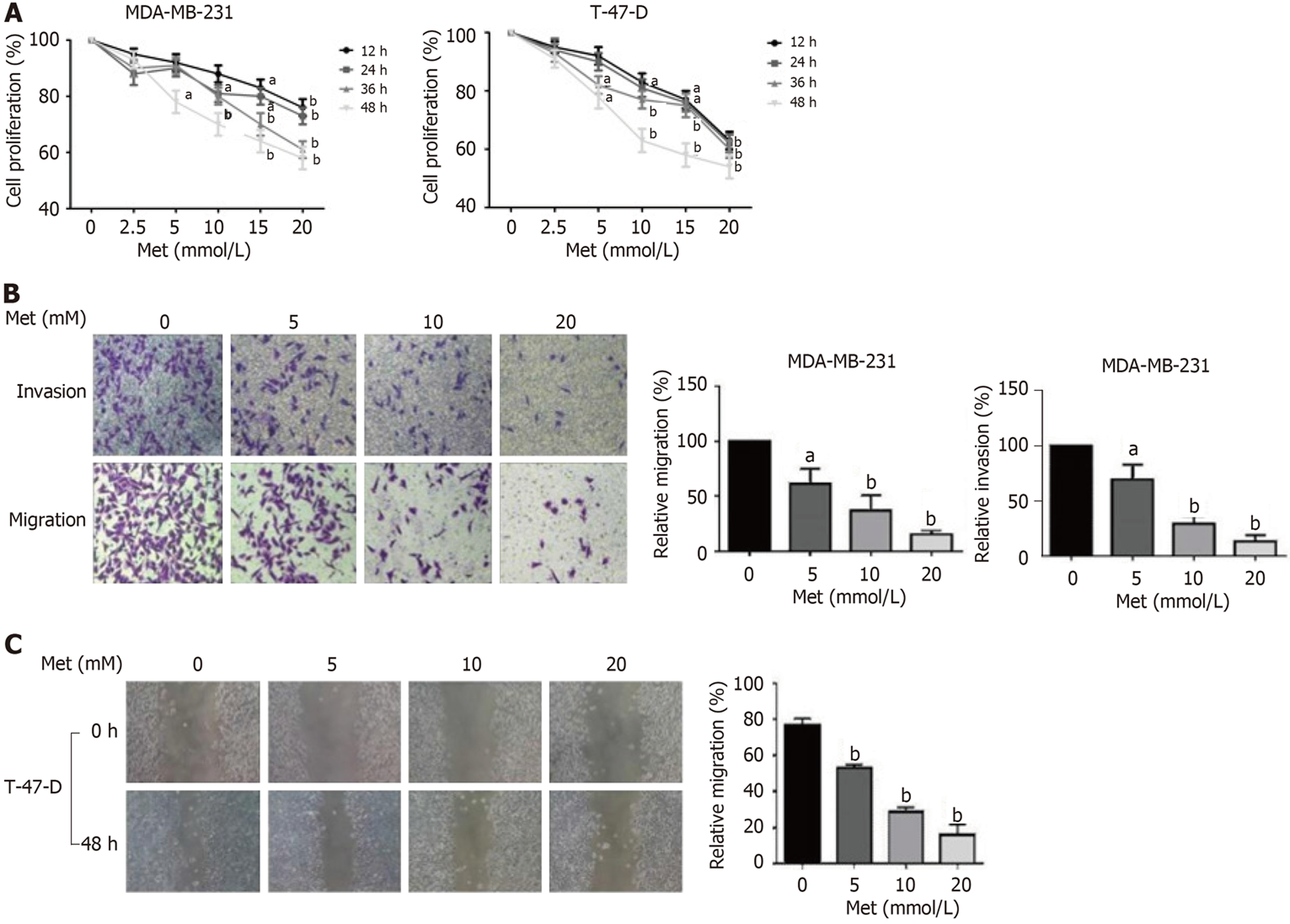
根据二甲双胍的药代动力学设定作用浓度和作用时间. 二甲双胍(2.5、5、10、15、20) mM对MDA-MB-231和T-47-D细胞的增殖均有明显的抑制作用, 且具有浓度与时间的依赖性(见图2A). 最后选择二甲双胍作用时间为48 h, 作用浓度为(5、10和20) mM作为后续实验的时间及剂量. 因MDA-MB-231细胞易贴壁, 迁移侵袭能力强, 故采取Transwell小室实验检测其迁移侵袭能力. 而T-47-D细胞难贴壁且迁移能力弱, 因而采取划痕实验检测其迁移能力. 在浓度为(5、10和20) mM的二甲双胍作用48 h后, MDA-MB-231细胞的迁移和侵袭能力得以明显抑制, 且抑制作用呈浓度依赖性(P<0.05, 见图2B). 随着二甲双胍作用浓度的增加, T-47-D细胞的迁移能力逐渐减弱(P<0.05, 见图2C).
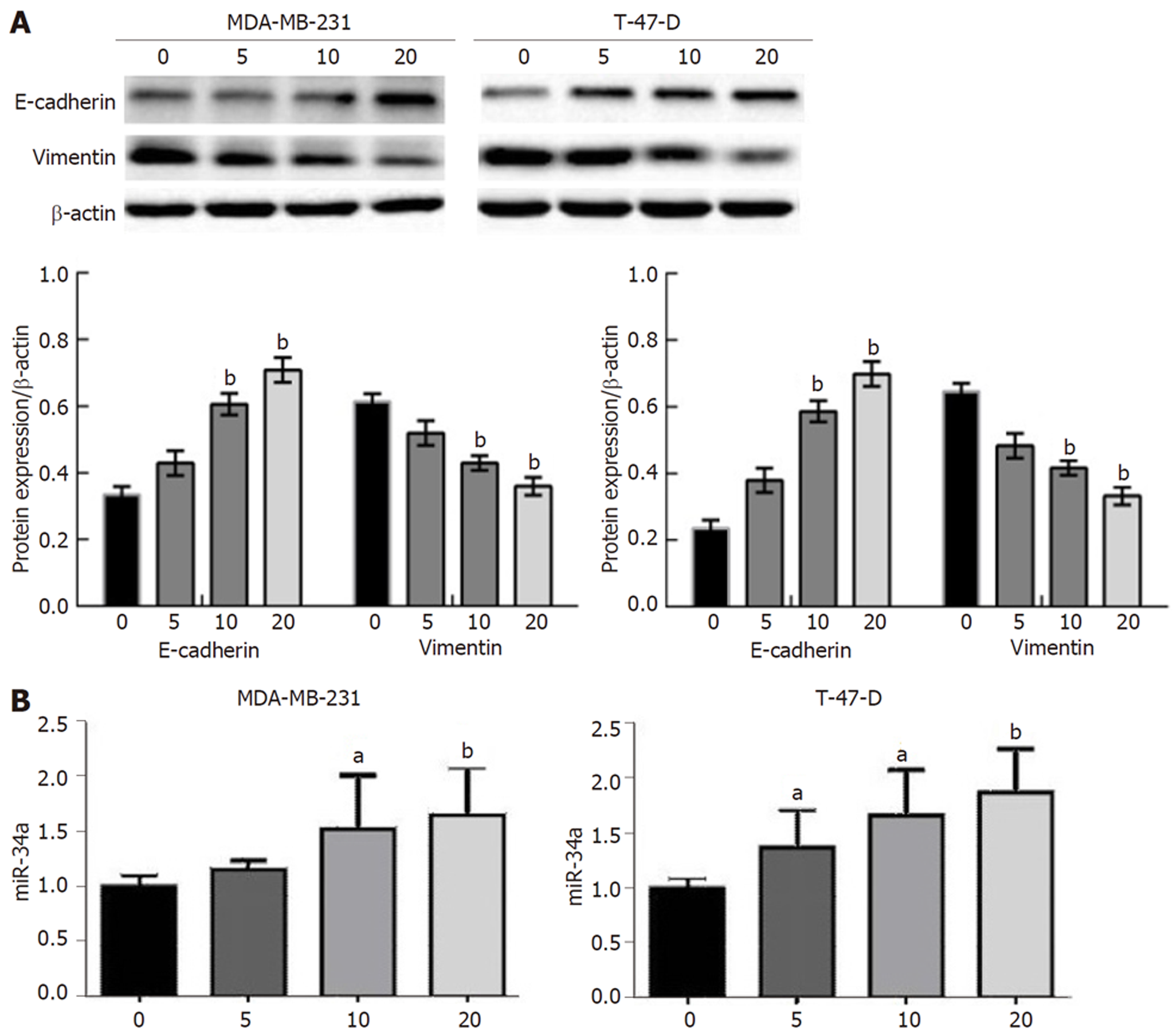
二甲双胍能够明显促进E-cadherin蛋白表达, 抑制Vimentin蛋白表达(P<0.05). 且在作用浓度为20 mM时对MDA-MB-231细胞的蛋白调控作用最明显(P<0.05, 见图3A). 且随着二甲双胍作用浓度的增加, MDA-MB-231细胞和T-47-D细胞内miR-34a的表达量随之升高(P<0.05, 见图3B).
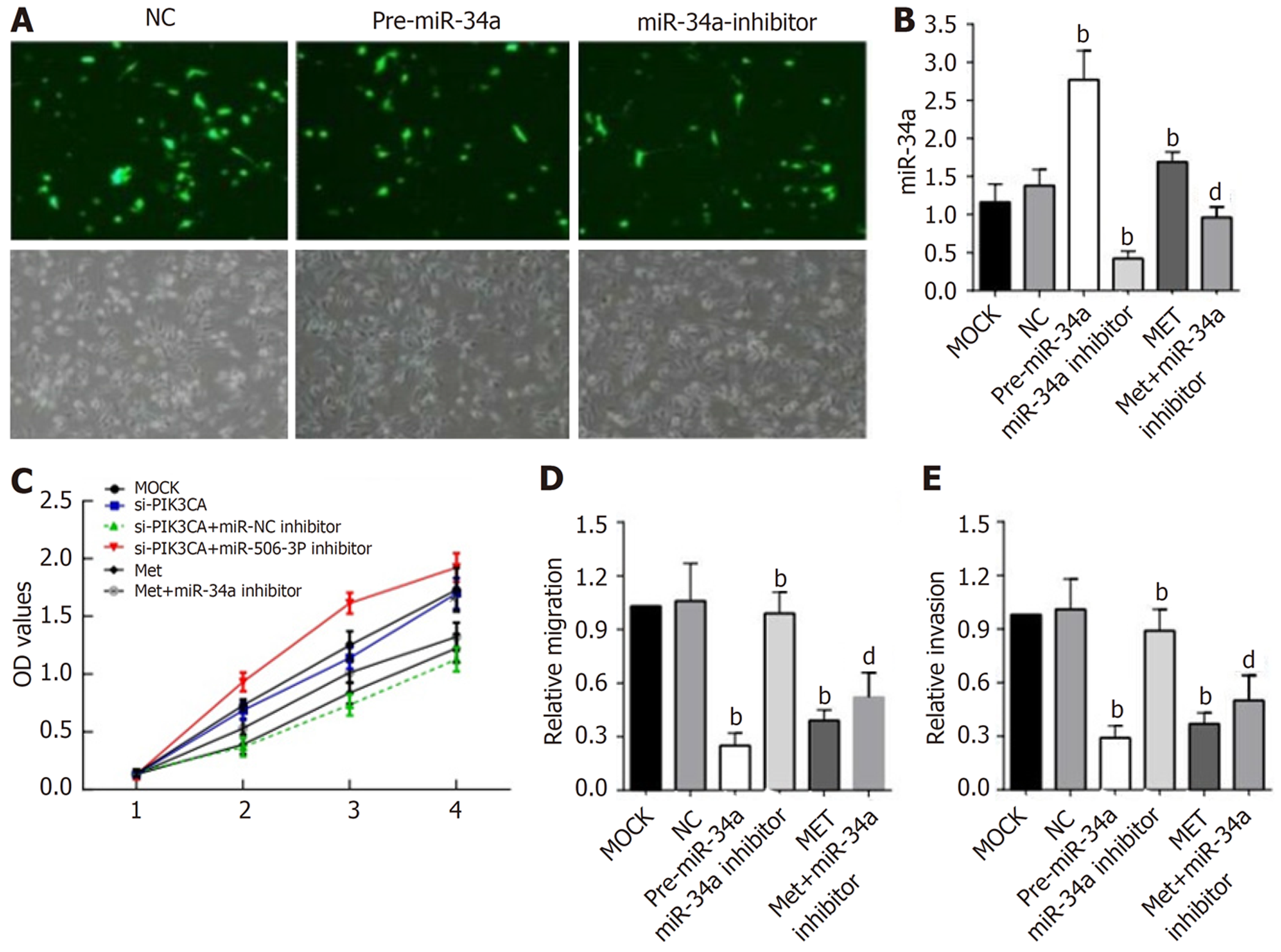
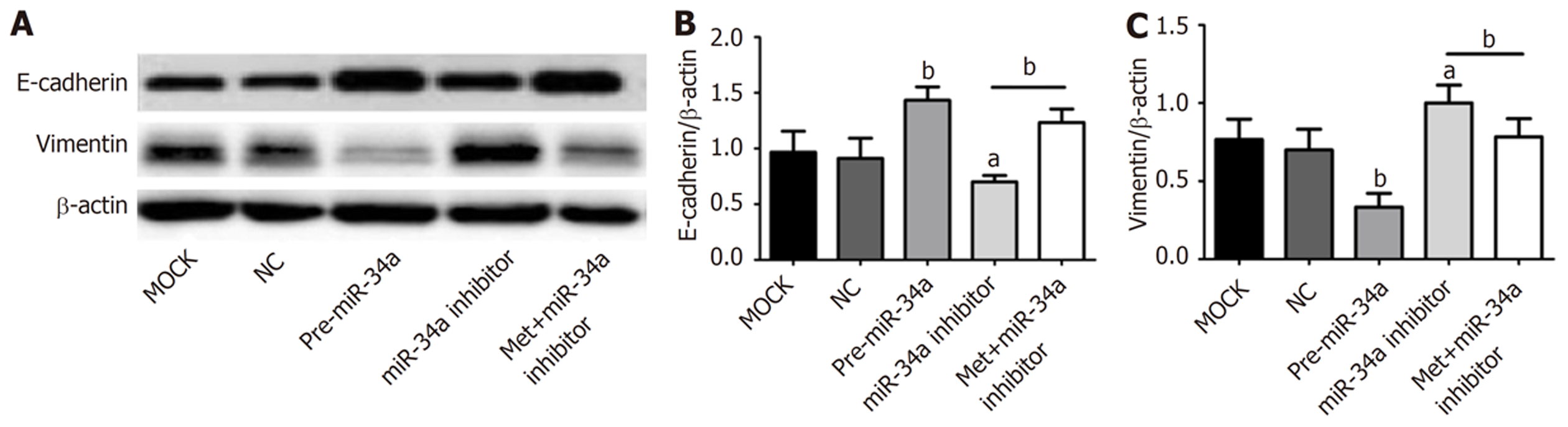
通过脂质体转染的方式在乳腺癌MDA-MB-231细胞中构建低表达miR-34a的细胞株, 在质粒转染24 h后, 在荧光显微镜下检测细胞的转染效率(图4A)后, 观察其对乳腺癌细胞增殖、迁移及侵袭的影响. 相较于NC, 转染Pre-miR-34a后, 细胞中miR-34a表达增加(P<0.05), 转染质粒miR-34a inhibitor后, 细胞中miR-34a表达下降(P<0.05, 见图4B). 相较于NC组, 高表达miR-34a组细胞生长最慢, 低表达miR-34a组生长最快, 从第3 d开始差异存在统计学意义(P<0.05, 见图4C). 而高表达组迁移和侵袭至下室的细胞数明显减少(P<0.05), 低表达组则明显增加(P<0.05)(见图4D和E).
相较于未加药低表达株, 将浓度为10 mM的二甲双胍作用于miR-34a低表达的细胞株48 h后, miR-34a低表达的细胞株中miR-34a的含量明显升高(P<0.05, 见图4B). 而经二甲双胍处理后的低表达组细胞增值率及迁移侵袭至下室的细胞数介于两者之间(P<0.05, 见图4D和E).
高表达miR-34a细胞株中E-cadherin蛋白表达量增多、Vimentin蛋白表达量下降, 低表达miR-34a细胞株中E-cadherin蛋白表达量降低、Vimentin蛋白表达量增加, 而经二甲双胍10 mM作用于低表达细胞之后, E-cadherin蛋白表达量在低表达细胞基础上有所增加, Vimentin蛋白表达量则有所降低(P<0.05, 见图5).
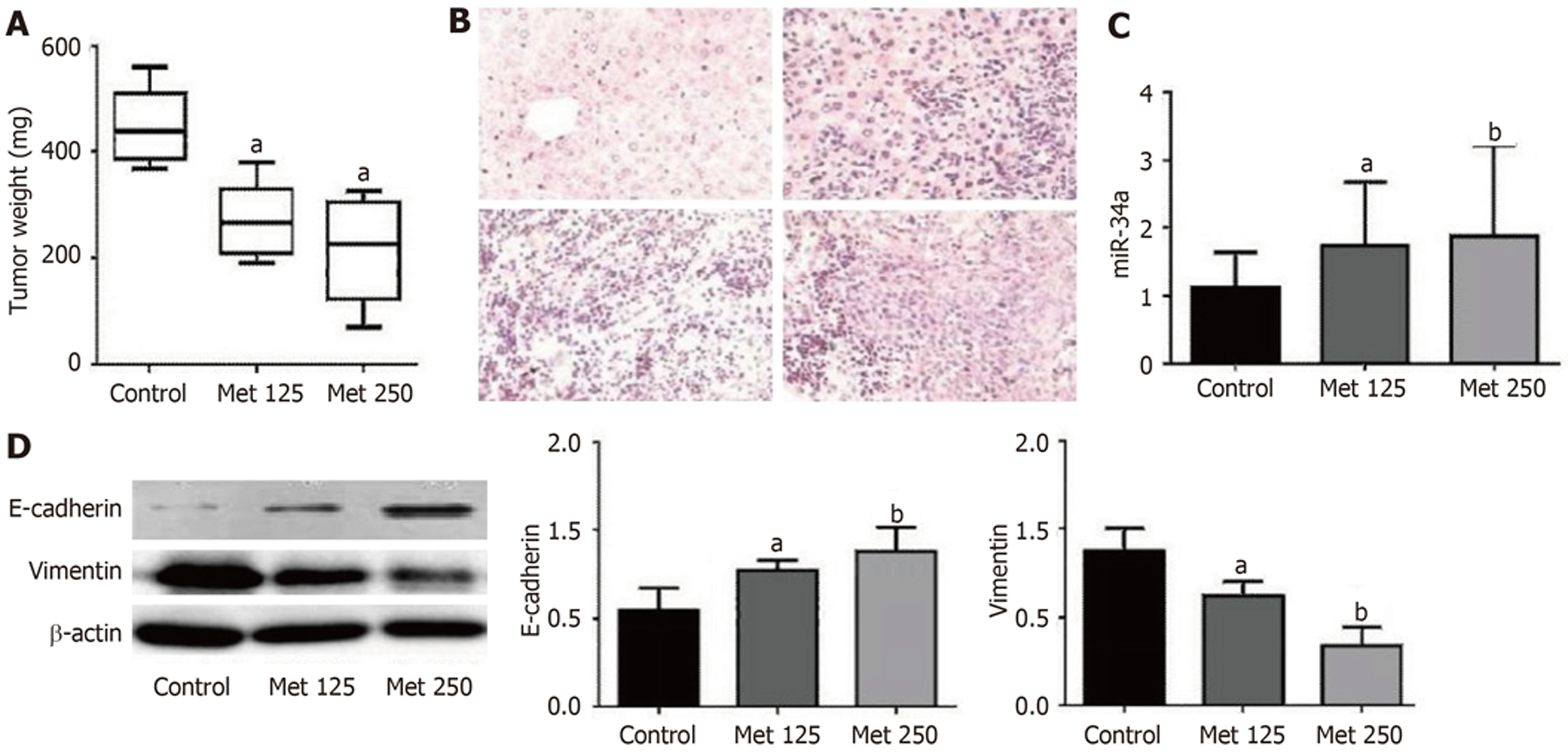
在给予二甲双胍处理后, 处死小鼠, 剥离瘤组织, 并称量瘤体肿瘤, 二甲双胍治疗组瘤体肿瘤明显低于对照组(P<0.05, 见图6A). HE染色后显微镜下观察发现, 实验组肿瘤细胞变性坏死面积为10%-30%, 明显高于对照组. 对照组小鼠肝、脾转移率均为93.75%(见图6B). MET125组小鼠肝转移率为47.06%、脾转移率为88.24%. MET250组小鼠肝转移率为27.78%、脾转移率为77.78%. 实验组与对照组肝脏转移率差异有统计学意义(P<0.05), 而脾脏转移率差异无统计学意义(见表1). 同时, 在实验组肿瘤组织中miR-34a的表达高于对照组(P<0.05, 见图6C). 肿瘤组织中E-cadherin蛋白表达量增多(P<0.05)、Vimentin蛋白表达量下降(P<0.05, 见图6D), 与体外细胞水平检测结果一致.
| 组别 | 例数 | 肝脏 | χ2 | P值 | 脾脏 | χ2 | P值 | ||
| Transfer | Not transfer | Transfer | Not transfer | ||||||
| MET250 group | 18 | 5(27.78) | 13(72.22) | 14(77.78) | 4(22.22) | ||||
| MET125 group | 17 | 9(47.06) | 8(52.94) | 15.190 | 0.001 | 15(88.24) | 2(11.76) | 2.941 | 0.230 |
| Control group | 16 | 15(93.75) | 1(6.25) | 15(93.75) | 1(6.25) | ||||
90%左右的乳腺癌导致的死亡伴随复发和转移, 其中远处转移以及肝转移最常见[8,9]. 研究发现, 二甲双胍在多种癌症中被证实有抑癌作用. 李仁锋等[10]发现, 二甲双胍可通过抑制缺氧诱导因子-1α/血管内皮生长因子途径抑制低氧诱导胆囊癌GBC-SD细胞转移. 徐萍等[11]的研究表明, 二甲双胍可通过激活PTEN的表达, 抑制磷脂酰肌醇3-激酶/蛋白激酶/哺乳动物雷帕霉素靶蛋白通路, 而抑制人胰腺癌Panc-1细胞的增殖能力, 引起G2/M细胞周期阻滞, 同时诱导胰腺癌细胞的凋亡. 本研究结果显示, 二甲双胍可以抑制乳腺癌MDA-MB-231与T-47-D细胞的增殖、迁移侵袭能力, 说明二甲双胍具有抗癌作用, 与上述结论相符合. 但二甲双胍的抗癌作用机制目前尚未清楚. 既往研究认为二甲双胍抗癌作用是通过激活磷酸腺苷活化的蛋白激酶/哺乳动物雷帕霉素靶蛋白通路, 抑制抗炎通路核因子激活的B细胞κ-轻链增强复合物、影响细胞周期和凋亡以及阻碍肿瘤内血管生成等多个通路来实现的[12]. 而随着临床的深入研究, 越来越多证据表明miRNA的表达在其中发挥了重要作用[13].
miR-34a是一类广泛存在于肺以外组织中, 且高度保守的miRNA. 研究显示, miR-34a在子宫内膜癌、乳腺癌、肝癌、结直肠癌等多种恶性肿瘤组织中呈低表达[14]. 李颖等[15]证实, 微小miR-34a与肝癌组织临床分期及恶性程度存在密切关联. 王传卓等[16]证实, miR-34a可对人结肠癌SW480细胞的增殖、迁移产生明显抑制作用, 且可诱导细胞凋亡, 抑制裸鼠皮下移植瘤生长. 李梅等[17]研究证实, 过表达miR-34a可对食管癌细胞的增殖发挥抑制作用, 且可促进其凋亡. 上述研究均证明, miR-34a发挥着抑癌基因的作用. 本研究中通过体外生物学功能实验, 应用CCK8法、划痕实验及Transwell侵袭实验证实, miR-34a对 MDA-MB-231细胞的增殖、迁移和侵袭具有显著的抑制作用, 通过干扰MDA-MB-231细胞中miR-34a的表达可以促进以上生物学功能. 而对miR-34a低表达的细胞株给予二甲双胍作用后, 相较于未加药的细胞株, 细胞中miR-34a的含量有所增加, 生物学功能被抑制. 证明了miR-34a对乳腺癌细胞生物学功能的抑制作用, 且二甲双胍能够增加乳腺癌细胞和肿瘤组织中miR-34a的表达, 并验证了miR-34a参与二甲双胍的抗癌作用. 本研究通过建立TA2小鼠肝脾高转移乳腺癌移植瘤模型发现, 实验组肿瘤体积明显小于对照组, 实验组的肝脏转移率显著低于对照组, 且镜下实验组脾脏转移灶面积小, 而对照组脾转移灶呈片状分布, 说明二甲双胍可以抑制乳腺癌模型小鼠肿瘤的生长, 且能够明显抑制TA2小鼠乳腺癌肝脾转移.
EMT主要是指具有极性的上皮细胞在特定环境下丧失上皮特性, 转化为移动、侵袭、抗凋亡能力更强的间质细胞特性的生物学现象, 是肿瘤细胞发生侵袭和转移过程的重要的生物学行为[18,19]. Vimentin是一种Ⅲ型中间丝蛋白, EMT期间, Vimentin的表达上调. 癌细胞在转移过程中常出现EMT等特征, 而Vimentin蛋白会通过改变细胞形状和运动来促成EMT. 从分子生物学角度出发, miR-34a能够通过抑制Vimentin表达, 影响肿瘤的EMT, 主要表现为上皮细胞标志物E-cadherin表达下调, 间质细胞标志物Vimentin表达上调. 最新研究发现[20], miR-34a参与调控乳腺癌、膀胱癌、卵巢癌等EMT过程从而影响肿瘤的侵袭转移. 本研究利用生物学软件进行miR-34a的靶基因预测发现, E-cadherin与Vimentin是miR-34a直接的作用靶点, 进一步经Western Blot实验证明, miR-34a可以促进MDA-MB-231细胞中E-cadherin蛋白表达、抑制Vimentin蛋白表达.
本研究存在一定的不足, 因在细胞实验中已进行了相应的通路调节的演绎, 在动物实验中更多的关注了在二甲双胍不同剂量中对相关基因蛋白表达的影响, 未对上调miR-34a是Met的作用机制这一考量进行进一步的论证, 我们拟在下一步的研究中开展进一步的观察. 综上所述, 二甲双胍可能通过miR-34a抑制乳腺癌MDA-MB-231细胞的增殖、侵袭和迁移能力, 并能抑制小鼠乳腺癌肝脾的转移, 其机制可能通过上调肿瘤组织中miR-34a的水平, 影响E-cadherin和Vimentin的表达来实现的. 二甲双胍是临床成熟用药, 且不良反应少, 此研究为二甲双胍抑瘤作用提供了实验依据.
乳腺癌发病率攀升且趋于年轻化, 远处转移尤其是肝转移严重影响患者预后, 成为治疗难题. 二甲双胍虽展现抗癌潜力, 但机制不明, 而miR-34a作为抑癌微小核糖核酸, 与肿瘤生长和转移调控相关, 在此背景下开展本研究.
鉴于乳腺癌的严峻现状及二甲双胍抗癌机制的未知, 为探寻有效治疗乳腺癌的方法, 深入研究二甲双胍与miR-34a在乳腺癌中的关联, 为二甲双胍的抑瘤作用提供关键实验依据, 极具紧迫性和必要性.
本研究的主要目标是探讨二甲双胍通过调控miR-34a对乳腺癌细胞增殖、迁移和侵袭能力的影响, 并进一步研究其对乳腺癌肝转移的抑制作用. 通过细胞实验和动物模型实验, 验证二甲双胍是否通过上调miR-34a的表达来抑制乳腺癌细胞的生物学功能, 并探讨其潜在的分子机制.
本研究采用体外细胞实验和体内动物模型实验相结合的方法. 首先, 通过脂质体转染技术构建miR-34a过表达和阴性对照(NC)细胞株, 利用实时定量PCR检测miR-34a的表达水平. 随后, 使用不同浓度的二甲双胍处理乳腺癌MDA-MB-231和T-47-D细胞, 通过细胞计数套件-8实验、划痕实验和Transwell小室实验分别评估细胞的增殖、迁移和侵袭能力. 此外, 通过Western Blot检测上皮钙黏蛋白(E-cadherin)和强化波形蛋白(Vimentin)的表达变化. 在动物实验中, 建立TA2小鼠乳腺癌肝脾转移模型, 观察二甲双胍对肿瘤生长和转移的影响.
二甲双胍抑制乳腺癌细胞增殖、迁移和侵袭, 促进E-cadherin蛋白表达, 抑制Vimentin蛋白表达, 提升miR-34a表达量; 转染影响miR-34a表达进而改变细胞生长和转移能力, 二甲双胍能干预低表达株中miR-34a含量及细胞生物学行为; 动物实验中, 二甲双胍抑制小鼠乳腺肿瘤生长和肝转移, 改变相关基因和蛋白表达.
二甲双胍可能通过上调miR-34a水平, 影响E-cadherin和Vimentin表达, 抑制乳腺癌MDA-MB-231细胞的增殖、侵袭和迁移能力, 以及小鼠乳腺癌肝脾的转移, 为二甲双胍用于乳腺癌治疗提供了有力实验依据.
本研究为二甲双胍在乳腺癌治疗中的应用提供了新的视角. 未来的研究可以进一步探索二甲双胍与miR-34a之间的相互作用机制, 并评估其在临床治疗中的潜在应用价值. 此外, 结合其他抗癌药物的联合治疗方案, 有望进一步提高乳腺癌的治疗效果, 改善患者的预后.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Katsura C, Ogunmwonyi I, Kankam HK, Saha S. Breast cancer: presentation, investigation and management. B. r J Hosp Med (Lond). 2022;83:1-7. [PubMed] [DOI] |
| 2. | Wilkinson L, Gathani T. Understanding breast cancer as a global health concern. Br J Radiol. 2022;95:20211033. [PubMed] [DOI] |
| 3. | LaMoia TE, Shulman GI. Cellular and Molecular Mechanisms of Metformin Action. Endocr Rev. 2021;42:77-96. [PubMed] [DOI] |
| 4. | Bashraheel SS, Kheraldine H, Khalaf S, Moustafa AA. Metformin and HER2-positive breast cancer: Mechanisms and therapeutic implications. Biomed Pharmacother. 2023;162:114676. [PubMed] [DOI] |
| 5. | Pernicova I, Korbonits M. Metformin--mode of action and clinical implications for diabetes and cancer. Nat Rev Endocrinol. 2014;10:143-156. [PubMed] [DOI] |
| 7. | Li S, Wei X, He J, Cao Q, Du D, Zhan X, Zeng Y, Yuan S, Sun L. The comprehensive landscape of miR-34a in cancer research. Cancer Metastasis Rev. 2021;40:925-948. [PubMed] [DOI] |
| 8. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 9. | Reynolds IS, Cromwell PM, Walshe JM, Crown J, Maguire D, Geoghegan J, Swan N, Hoti E. Hepatic resection for breast cancer related liver metastases: A single institution experience. Scand J Surg. 2022;111:14574969221088685. [PubMed] [DOI] |
| 10. | 李 仁锋, 叶 健文, 齐 蕾, 陆 旭, 周 闯, 赵 龙栓, 翟 文龙. 低氧诱导因子-1α在胆囊癌组织中的表达及其在二甲双胍抑制胆囊癌转移中的作用. 中华肝胆外科杂志. 2017;23:383-388. [DOI] |
| 12. | Chomanicova N, Gazova A, Adamickova A, Valaskova S, Kyselovic J. The role of AMPK/mTOR signaling pathway in anticancer activity of metformin. Physiol Res. 2021;70:501-508. [PubMed] [DOI] |
| 13. | Zhang S, Zhang R, Qiao P, Ma X, Lu R, Wang F, Li C, E L, Liu H. Metformin-Induced MicroRNA-34a-3p Downregulation Alleviates Senescence in Human Dental Pulp Stem Cells by Targeting CAB39 through the AMPK/mTOR Signaling Pathway. Stem Cells Int. 2021;2021:6616240. [PubMed] [DOI] |
| 14. | Liu C, Rokavec M, Huang Z, Hermeking H. Curcumin activates a ROS/KEAP1/NRF2/miR-34a/b/c cascade to suppress colorectal cancer metastasis. Cell Death Differ. 2023;30:1771-1785. [PubMed] [DOI] |
| 16. | 王 传卓, 辛 鹤, 刘 波, 刘 兆玉. miR-34a对人结肠癌SW480细胞增殖、凋亡、细胞周期及皮下移植瘤生长的影响. 实用医学杂志. 2018;34:2648-2652. [DOI] |
| 18. | Gundamaraju R, Lu W, Paul MK, Jha NK, Gupta PK, Ojha S, Chattopadhyay I, Rao PV, Ghavami S. Autophagy and EMT in cancer and metastasis: Who controls whom? Biochim Biophys Acta Mol Basis Dis. 2022;1868:166431. [PubMed] [DOI] |
| 19. | Lampropoulou DI, Papadimitriou M, Papadimitriou C, Filippou D, Kourlaba G, Aravantinos G, Gazouli M. The Role of EMT-Related lncRNAs in Ovarian Cancer. Int J Mol Sci. 2023;24:10079. [PubMed] [DOI] |