修回日期: 2025-02-03
接受日期: 2025-02-20
在线出版日期: 2025-02-28
结直肠癌是全球范围内常见的消化系统恶性肿瘤之一, 其发病率和死亡率均位居各类疾病的前列. 尽管结直肠癌的诊断和治疗技术在近年来取得了一定的进展, 现有的诊断手段和治疗方法仍然存在诸多局限, 严重影响了结直肠癌的早期发现、精确诊断和个性化治疗. 随着分子生物学研究的深入, 非编码RNA(non-coding RNA, ncRNA)在结直肠癌的发生、发展和预后评估中越来越受到重视. 本文总结了一些结直肠癌与不同类型ncRNA表达相关的研究, 并从中挑选了部分有望作为新的肠道肿瘤诊断指标的ncRNA. 新的生物指标的出现将有助于结直肠癌早期诊断, 提早发现甚至预防肠道癌症的发生.
核心提要: 结直肠癌是全球范围内发病率和死亡率均居高位的常见消化系统恶性肿瘤. 近年来, 尽管其诊断与治疗技术取得了一定进展, 但现有手段仍存在诸多局限, 难以实现早期精准诊断及个性化治疗. 随着分子生物学研究的不断深入, 非编码RNA(non-coding RNA, ncRNA)在结直肠癌的发生、发展及预后评估中的重要作用日益凸显. 本文综述了结直肠癌与不同类型ncRNA表达的相关研究, 并筛选出部分具有潜力作为新的肠道肿瘤诊断标志物的ncRNA, 有望为结直肠癌的早期诊断及预防提供新的思路和依据.
引文著录: 周锦航, 蔡成, 周晓峰, 许丹. 非编码RNA在结直肠癌中的研究进展及其在早期诊断中的应用. 世界华人消化杂志 2025; 33(2): 96-105
Revised: February 3, 2025
Accepted: February 20, 2025
Published online: February 28, 2025
Colorectal cancer is one of the common malignant tumors in the digestive system worldwide, with its incidence and mortality rates ranking high among various diseases. Although certain advancements have been achieved in the diagnosis and treatment techniques of colorectal cancer in recent years, the existing diagnostic means and treatment methods still present numerous limitations, significantly influencing the early detection, precise diagnosis, and individualized treatment of colorectal cancer. With the in-depth research of molecular biology, non-coding RNAs (ncRNAs) have gained increasing attention in the development and prognosis evaluation of colorectal cancer. This paper summarizes some studies related to the expression of different types of ncRNAs in colorectal cancer and selects a portion of ncRNAs that are expected to serve as new diagnostic indicators for this malignancy. The emergence of new biological indicators will contribute to the early diagnosis of colorectal cancer, facilitating its early detection and even prevention.
- Citation: Zhou JH, Cai C, Zhou XF, Xu D. Progress in research of non-coding RNAs in colorectal cancer and their application in early diagnosis. Shijie Huaren Xiaohua Zazhi 2025; 33(2): 96-105
- URL: https://www.wjgnet.com/1009-3079/full/v33/i2/96.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i2.96
结直肠癌是全球范围内发病率和死亡率较高的癌症之一, 尤其好发于工业化和现代化进程加速的地区, 现已成为一种严峻的公共卫生问题[1]. 肠癌主要发生在结肠和直肠, 根据发病部位可分为结肠癌和直肠癌, 其临床常见的组织学特征为腺癌[2]. 根据最新世界卫生组织的数据统计, 结直肠癌在全球癌症中的发病率排名第三, 仅次于肺癌和乳腺癌[3]. 每年全球约有200万人被诊断为结直肠癌, 约80万人死于该病. 尽管结直肠癌的发病率在全球范围内呈上升趋势. 此外, 结直肠癌的死亡率同样较高, 尤其是在发病晚期, 由于缺乏有效的早期筛查和早期诊断, 大多数病例在被发现时已经进入中晚期, 导致治愈率较低. 因此, 寻找新的结直肠癌肿瘤标志物现已成为研究热点.
人类基因组计划发现, 人类基因组仅有75%被转录, 而编码蛋白质的基因只占整个基因组的2%左右, 这提示转录组中存在大量的、功能未知的非编码RNA(non-coding RNA, ncRNA). 近年来, 科学家们发现了一系列不同种类的ncRNA, 包括长链非编码RNA(long non-coding RNA, lncRNA)、微小RNA(microRNA, miRNA)以及环状RNA(circular RNA, circRNA)等[4]. 这些ncRNA在转录、转录后加工和蛋白质翻译等多个水平调控基因表达, 在发育、分化和新陈代谢等多种基本生物学过程中发挥着重要作用. 多项研究表明了ncRNA在多种癌症(如乳腺癌、非小细胞肺癌和结直肠癌等)的发生、发展中扮演着重要角色[5]. 因此, 本文主要论述各类ncRNA在消化道上皮细胞中的生物学功能, 以进一步探明结直肠肿瘤发生机制, 并重点关注可用于结直肠癌早期诊断检测指标的潜在分子标志物.
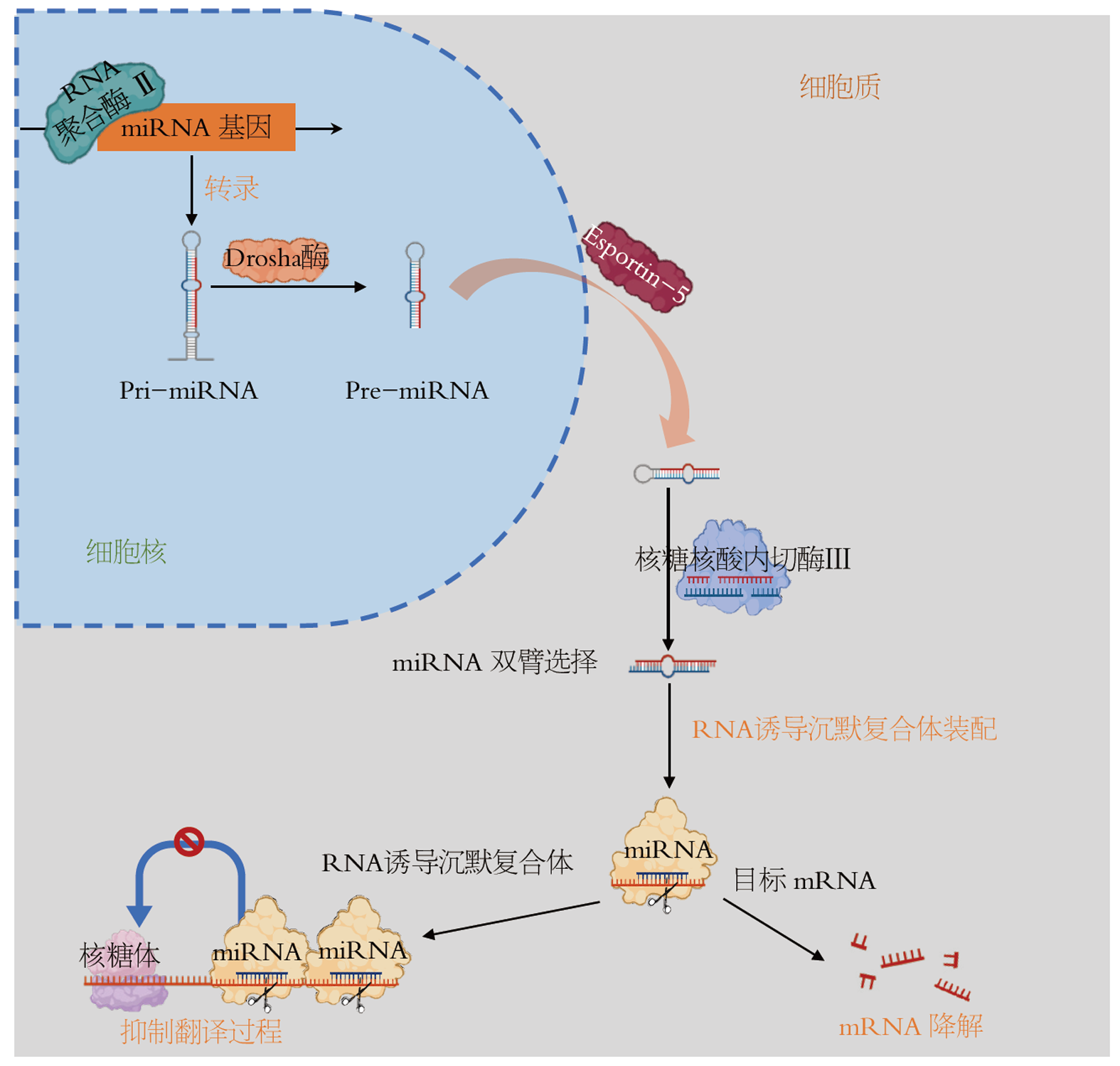
miRNA是一类长度为20-23个核苷酸的小分子内源性单链RNA, 最初于1993年被发现[6]. 其在细胞内的主要功能是通过与靶基因的信使RNA(messenger RNA, mRNA)的3'非翻译区(3'UTR)结合, 负向调控基因的表达, 从而影响基因的翻译过程或引起mRNA降解. miRNA参与了多种重要的生物学过程, 包括细胞增殖、分化、凋亡、代谢、免疫反应等[7]. 在肿瘤生物学中, miRNA的异常表达通常与肿瘤的发生、发展、转移及预后密切相关.
miRNA通过与目标mRNA结合形成复合物, 进而抑制其表达. miRNA可通过多种机制发挥其调控功能, 主要包括mRNA降解、翻译抑制和转录调控(图1): (1)miRNA通过与靶mRNA的3'UTR结合, 促使靶mRNA的去稳定化, 从而导致mRNA的降解, 这一过程降低靶基因的表达水平[8]; (2)miRNA可以通过与mRNA的3'UTR结合, 阻碍翻译因子与mRNA的结合, 抑制蛋白质的合成, 进而减少靶基因的蛋白质产物[9]. 这种翻译抑制作用是miRNA调控基因表达的主要途径之一; (3)某些miRNA还能够通过与染色质调控因子相互作用, 调节基因的转录活性, 从而在基因表达的更早阶段进行调控[10]. 这些调控机制使得miRNA能够参与细胞内多种生物过程, 如细胞增殖、凋亡、分化和迁移等, 广泛影响癌症等疾病的发生和发展. 现有大量研究表明, 在乳腺癌、鼻咽癌以及结直肠癌等肿瘤中, miRNA的异常表达不仅影响癌细胞的增殖、转移和分化, 还可通过这些调控机制在肿瘤细胞的免疫逃逸以及其对于药物敏感性中发挥着重要作用[11].
miRNA的表达变化与结直肠癌的发生和发展密切相关, 其异常表达不仅参与了肿瘤的起始和进展, 还在肿瘤的分期、预后以及治疗反应中发挥重要作用.
在结直肠癌组织中, 某些miRNA表现出显著的上调. 例如, miR-21被广泛认为是肠癌中的原癌基因miRNA, 其高表达与患者的肿瘤恶性程度增加、远处转移风险升高以及不良预后显著相关. 有研究证实miR-21可以靶向沉默甲基胞嘧啶双加氧酶1[12]、同源性磷酸酶-张力蛋白[13]和基质金属蛋白酶抑制剂[14]等多种抑癌基因的表达, 从而导致细胞周期调控紊乱, 促进癌细胞异常增殖, 同时抑制细胞凋亡, 增强肿瘤细胞侵袭力. miR-92a也被证实是结直肠癌中常见的"促癌miRNA". Chen等[15]发现miR-92a可直接靶向dickkopf WNT信号通路抑制因子3和Kruppel样转录因子4基因, 从而激活分泌型糖蛋白/β-连环蛋白(wingless-related integration/β-catenin, Wnt/β-catenin)信号通路, 促进肿瘤细胞增殖、迁移和侵袭, 参与癌症的发生过程. 此外, miR-92a在结直肠癌患者的血液和粪便中也表现出较高的表达水平, 提示其在早期筛查中的潜力, 特别是作为非侵入性液体活检标志物, 现已引起广泛关注[16]. Kanaan等[17]通过miRNA检测芯片技术分析发现, 与癌旁正常组织相比, miR-31在结直肠癌组织中的表达水平显著升高. miR31可通过调控上皮-间质转化(epithelial-mesenchymal transition, EMT)过程, 使肠上皮细胞失去极性, 继而促进癌细胞的迁移和侵袭. 高水平miR-135与患者较差的预后和更快的肿瘤进展相关, miR-135可以靶向调控细胞周期蛋白依赖性激酶抑制剂1B的表达, 促进细胞周期的进程, 从而加速结直肠癌细胞的增殖[18]. 上述miRNA均可通过靶向特定的肿瘤抑制基因, 导致这些基因的表达受到抑制, 从而促进肿瘤细胞的增殖、抗凋亡、侵袭和转移.
与此相对, 某些肿瘤抑制型miRNA, 在结直肠癌患者体内中通常表现为下调趋势. 这些miRNA通过调控细胞周期相关基因和促癌通路, 以维持细胞的正常增殖和凋亡平衡. 例如, miR-143通过抑制B淋巴细胞瘤-2的表达, 促进癌细胞凋亡, 抑制肿瘤生长[19]. 此外, miR-143还可以通过调控细胞周期蛋白D1(cyclin D1, CCND1)的表达, 影响细胞周期的进程, 从而抑制结直肠癌细胞的增殖[20]. Wu等[21]发现miR-126在结直肠癌病程中起肿瘤抑制因子的作用, 并且与肿瘤增殖、转移和患者预后呈负相关. miR-126通过靶向趋化因子C-X-C配体12调节巨噬细胞的募集, 并降低促炎细胞因子水平, 发挥抗肿瘤作用. 在结直肠癌前病变向癌转化过程中, miR-145的低表达会导致调控细胞周期相关基因调控平衡被打破, 双荧光素酶实验证实miR-145可直接结合EST转录因子mRNA的3'UTR, 使得结直肠癌细胞获得了更强的增殖能力和抗凋亡能力[22]. 综上所述, 这些肿瘤抑制miRNA的下调与结直肠癌的组织学分化差、肿瘤侵袭深度增加及淋巴结转移等病理特征有着密切相关.
值得注意的是, miRNA的表达模式在肿瘤发生的不同阶段、不同分子亚型及临床病理特征中存在显著差异, 这种差异性使得miRNA不仅能够用于结直肠癌的早期筛查, 还能够作为分期和分子分型的重要依据. 例如, miR-17在肠道肿瘤的早期阶段即可发生显著变化, 通过检测血清、血浆或粪便中的miR-17水平, 可以实现结直肠癌的早期诊断[23]. 此外, 随着疾病的进展和转移, miRNA的表达谱也会进一步发生改变, 如miR-155和miR-200家族成员在转移性结直肠癌患者体内中的上调, 与EMT及肿瘤细胞侵袭、转移密切相关[24]. 因此, miRNA的动态变化不仅可以反映肿瘤的生物学行为, 还为肿瘤的分期和转移监测提供了重要依据.
单一miRNA的检测可能存在一定的局限性, 因为不同患者之间的miRNA表达模式差异较大. 为了提高肠癌早期诊断的灵敏度和特异性, 越来越多的研究开始探索miRNA的联合检测. 例如, miR-21、miR-92a、miR-145等多种miRNA联合检测已被证明能够显著提高肠道肿瘤的早期诊断准确性. 通过对血液、粪便样本中的多种miRNA的联合检测, 可以实现对结直肠癌的敏感、特异诊断, 并且具有较高的临床应用潜力.
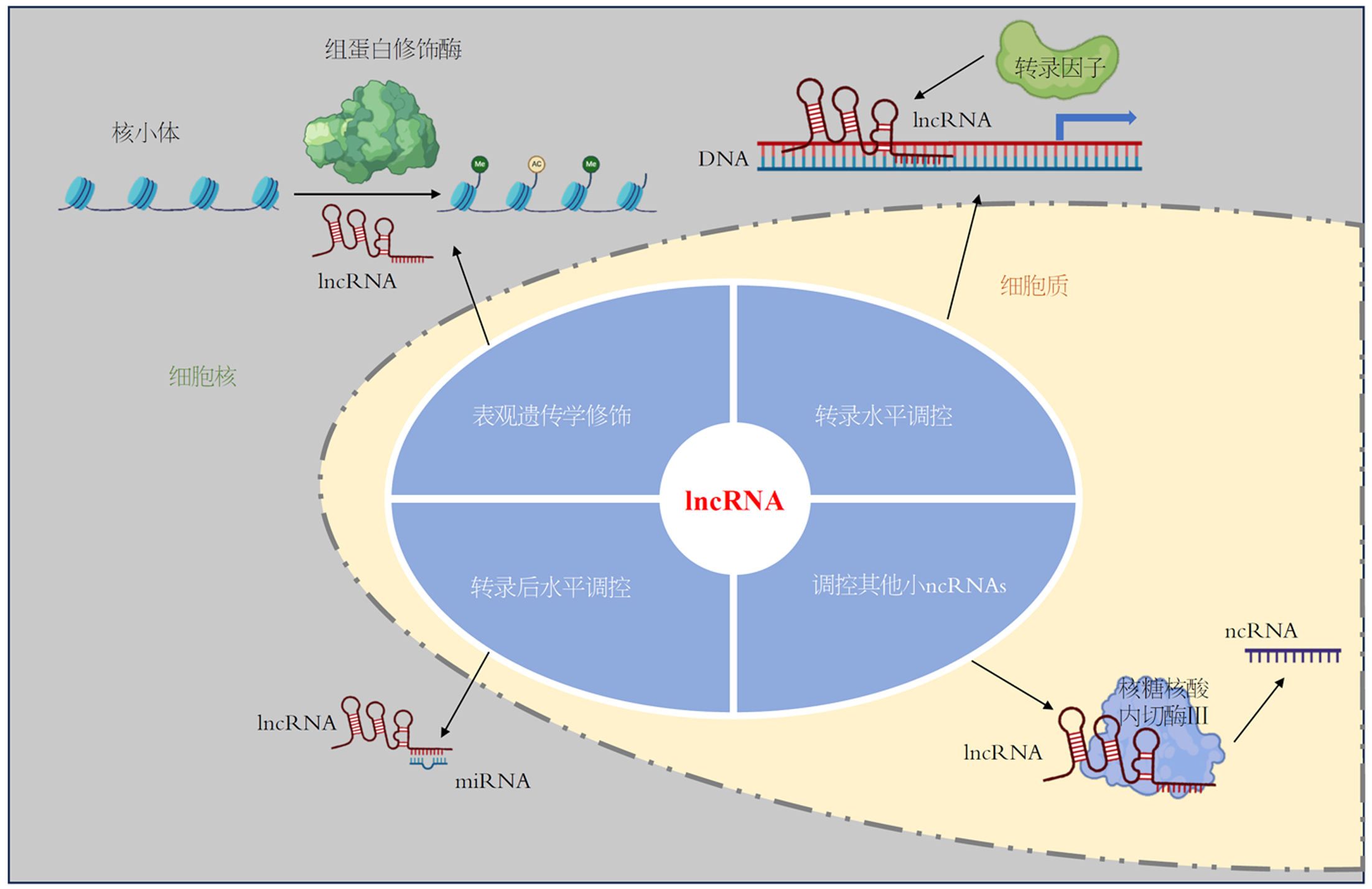
lncRNA是一类长度大于200个核苷酸的ncRNA, 主要由RNA聚合酶II(RNA polII)转录而成, 一般不存在编码潜力[25]. 与mRNA类似, lncRNA具有5'端帽子结构, 3'端聚腺苷酸化尾巴和多外显子区域. 目前对lncRNA的研究涉及多个物种, 包括原核生物和真核生物, 但与mRNA相比, 它们在不同物种之间的保守性较差. 它们通常具有更多的种属特异性, 并且通常表达较少, 因此, 较早被认为是转录噪声和无功能的. lncRNA在细胞核与细胞质中均可存在, 这与其在许多生物学过程中的重要作用一致, 这些作用包括基因转录和转录后水平修饰、基因组包装、维持细胞结构完整性、染色质重塑、改变蛋白质胞内定位等[26].
lncRNA根据其生物学功能可以分为四类(图2): (1)通过与特定转录因子或调控蛋白的相互作用, 调控目标基因的转录活性; (2)通过与其他ncRNA(如miRNA)竞争性结合, 在转录以及转录后水平调控基因表达; (3)还有一些lncRNA通过修饰染色质结构或影响转录后过程, 进一步调节基因表达; (4)部分lncRNA可以在细胞核与细胞质之间转运, 并在细胞质中被切割成其他ncRNA, 从而调控细胞内信号传导通路和代谢过程.
lncRNA在结直肠癌早期诊断中的潜力已经得到了广泛关注. 首先, 多个lncRNA在消化道癌症病程中的表达模式发生了显著变化, 这些变化与肠道癌症的早期发生、恶性转化以及肿瘤的侵袭和转移密切相关.
有研究证实, 多个lncRNA相较于癌旁组织, 其在结直肠癌组织中的表达普遍升高, 它们通过调控与肿瘤发生相关的基因, 推动癌细胞的增殖、迁移和转移. LncRNA HOX反义基因间RNA(HOX antisense intergenic RNA, HOTAIR)可通过与miR-214竞争性结合, 促进间质表皮转化因子唾液酸化修饰, 从而激活Janus激酶2/信号转导和转录激活因子3信号通路, 介导肠道肿瘤发生以及癌细胞远端转移[27]. 除此之外, lncRNA HOTAIR还被证实可作为蛋白支架促进多梳抑制复合体2与赖氨酸特异性组蛋白去甲基化酶1的结合, 调控组蛋白甲基化修饰水平, 维持消化道上皮癌细胞干性, 促进EMT[28]. LncRNA肺腺癌转移相关转录本1(metastasis associated in lung adenocarcinoma transcript 1, MALAT1)可作为预后危险因素降低结直肠癌患者的生存期, lncRNA MALAT1的过表达与肿瘤耐药性有关, 其能够增加结直肠癌细胞HT29对氧化苦参碱抗性并增强肿瘤细胞的侵袭能力[28]. 根据lncRNA芯片测序结果显示, lncRNA结肠癌相关转录因子1(colon cancer associated transcript 1, CCAT1)被证实在结直肠癌组织中高表达, 与结直肠癌组织分化程度, TNM分期和淋巴结转移高度相关. 一方面, lncRNA CCAT1可以通过激活Wnt/β-catenin信号通路, 促进肿瘤细胞的增殖. CCAT1能与β-catenin结合, 增强其稳定性, 进而促进下游靶基因(如CCND1等)的表达, 从而加速细胞周期进程, 促进肿瘤细胞增殖. 另一方面, lncRNA CCAT1可以通过抑制肿瘤蛋白p53(tumor protein p53, TP53)信号通路, 抑制肿瘤细胞的凋亡. LncRNA CCAT1能与TP53结合, 抑制其转录活性, 从而抑制凋亡相关基因的表达, 最终抑制肿瘤细胞的凋亡[29].
然而, lncRNA在结直肠癌中的调控作用不仅体现在早期诊断上, 还在肿瘤的分期、转移预测和治疗反应评估中发挥重要作用: lncRNA HOTAIR的高表达与CRC的远期转移相关, 而lncRNA MALAT1的表达则可以作为肿瘤细胞是否已经发生EMT的标志, 以预测肿瘤的侵袭性及转移潜力.
总的来说, lncRNA作为肠道肿瘤的早期诊断标志物, 具有诸多优势. 首先, lncRNA的表达模式在肠癌患者中具有较高的特异性, 因此可以作为有效的早期筛查工具. 其次, lncRNA通常在血液、粪便等体液中高表达, 检测方法相对简单且非侵入性. 随着液体活检技术的进步, 基于lncRNA的CRC早期诊断有望成为一种重要的辅助诊断手段. 然而, lncRNA作为结直肠癌生物标志物的应用仍面临一些挑战, 包括不同研究之间的人种差异性、验证标准的缺乏以及临床转化应用的可行性等. 因此, 未来需要更多的大规模临床研究, 以进一步验证lncRNA在结直肠癌早期诊断中的潜力, 并优化其应用方案.
circRNA是一种具有共价闭环结构的新型RNA, 早期被认为是规范和非规范RNA剪接中的罕见错误. 但是, 随着RNA深度测序技术和生物信息学的发展, 已在哺乳动物细胞中发现了大量circRNA. Memczak和Hansen等都在circRNA生物学功能研究方面取得了突破, 首先提出circRNA可以在基因表达和调控中充当miRNA的海绵, 并可以在转录后水平中发挥作用[30]. 之后circRNAs便引起公众的广泛关注, 并对其生物学特性, 功能以及在临床诊断和治疗中的应用进行了研究.
circRNA最显著的特点是其环状结构, 这种结构使其对核酸外切酶的降解具有高度抗性, 相比线性RNA稳定性更强. 环状结构没有5'帽子和3' polyA尾巴, 这使得circRNA在细胞中主要定位于细胞质中, 而一些特定类型的circRNA, 如外显子-内含子环状RNA和仅内含子来源的环状RNA, 则定位于细胞核内[31]. 这种稳定性使得circRNA在细胞内可以长时间存在并累积, 从而发挥其生物学功能.
circRNA主要通过前体RNA(pre-mRNA)的可变剪接加工产生, 这一过程被称为反向剪接. 反向剪接通常涉及下游剪接位点反向与上游剪接位点连接, 形成闭合环状结构的RNA分子. 反向剪接的机制包括内含子配对驱动环化、RNA结合蛋白驱动环化以及外显子跳读所形成的套索驱动环化等, 该过程收到多个顺式作用元件和反式剪接因子共同调控[32].
与传统的线性RNA相比, circRNA的表达通常具有组织特异性, 且在多种生理和病理过程中表现出不同的表达模式. 这些特性使circRNA成为一种潜在的生物标志物, 特别是在肿瘤早期诊断、预后评估及治疗监测等方面. 近年来, 越来越多的研究表明, circRNA在肠道肿瘤的发生和发展中发挥着重要作用, 且其作为结直肠癌早期诊断标志物的潜力逐渐被认识. 研究发现[33], circRNA在结直肠癌晚期患者的血液、粪便及组织样本中的表达水平与正常人群存在显著差异. 转录组分析在结直肠及和癌旁组织之间筛选得到了80个差异表达的circRNA, 包括33个上调和47个下调的circRNA. Circ3823和circRNA_0000392在结直肠癌组织和相关肠癌细胞系中均显著上调, 分子生物学实验证实circ3823可充当miR-30c-5p的海绵并调节其靶标-转录因子7表达, 从而增加MYC致癌因子和CCND1的表达并促进肿瘤发生[34]. 而circRNA_0000392可通过磷脂酰肌醇3-激酶/蛋白激酶B轴促进结直肠癌细胞的增殖和侵袭[35]. 上述结果均表明较高的circ3823和circRNA_0000392表达水平可以预测结直肠癌患者的不良预后.
除了充当miRNA海绵外, 某些具有RNA-蛋白相互作用位点的circRNA还可以发挥蛋白质海绵作用: circRHOBTB3可充当胚胎致死性异常视觉蛋白海绵并促进多聚嘧啶区结合蛋白mRNA稳定性, 从而发挥抑癌作用[36]. 研究证实结直肠癌组织中AMP依赖性蛋白激酶(AMP-activated protein kinase, AMPK)活化的增加与circACC1表达的升高有关, 并且circACC1已被证明可与AMPK的β和γ亚基形成复合物来稳定和增强AMPK激酶活性[37]. Circ_0008367可与AlkB同源物5(Alk B homolog 5, ALKBH5)直接结合, 并通过抑制ALKBH5介导的自噬显著促进索拉非尼诱导的结直肠癌细胞铁死亡[38].
综上所述, circRNA作为消化道肿瘤早期诊断标志物的研究正在快速发展, 许多circRNA在结直肠癌的发生、发展及转移过程中发挥重要作用. 其在血液、粪便等体液中的稳定性使其成为非侵入性、敏感性较高的早期筛查标志物. 未来, 随着技术的不断进步和临床研究的深入, circRNA有望成为结直肠癌早期诊断、个体化治疗及预后评估的重要工具. 然而, 仍需要更多的临床研究和验证, 以确保circRNA在肠道肿瘤诊断中的实际应用价值.
PIWI相互作用RNA(PIWI-interacting RNA, piRNA)是一类长度在21-35 nt的ncRNA, piRNA是从哺乳类动物的生殖细胞中分离得到的[39]. piRNA通过与PIWI蛋白家族成员相结合形成复合物, 从而沉默靶基因以发挥调控作用. 许多研究表明, piRNA可通过调节细胞增殖、细胞凋亡和血管生成来调节肿瘤的病理过程. Chu等[40]发现piR-015551在CRC患者中表达显著增加, 且其表达水平与患者的临床病理特征(如肿瘤分期、转移情况等)密切相关. 对38对临床样本分析后, 发现piR-823的过表达与结直肠癌晚期患者较差的总生存期相关, 高表达piR-823的肿瘤患者对辅助化疗的反应不佳. 研究表明piR-823通过上调葡萄糖-6-磷酸脱氢酶的表达来抑制缺氧诱导因子-1α的泛素化, 并最终上调癌细胞的葡萄糖消耗并抑制细胞内活性氧的含量[41].
核仁小RNA(Small Nucleolar RNA, snoRNA)是一类广泛存在于真核生物细胞核仁的小分子非编码RNA, 长度在60-300 nt, 能与核仁核糖核蛋白结合形成核微小核糖核蛋白颗粒[42]. 在脊椎动物中, 编码snoRNA的基因主要存在于蛋白编码基因或非蛋白编码基因的内含子区域, 并且经过进一步的转录后加工处理形成成熟的snoRNA. 近几年, 随着测序技术的发展, 越来越多的数据表明snoRNA参与多种遗传性疾病、造血、代谢以及癌症的调控机制. SNORA56被证实在结直肠癌患者的血浆中表达显著提高, SNORA56位于角蛋白假尿苷合酶1基因的内含子区内, 长129 nt, 与结直肠癌预后相关. Xu的研究团队证实SNORA56通过介导28S rRNA的假尿苷化来促进谷氨酸-半胱氨酸连接酶翻译, 从而抑制细胞铁死亡并抑制肿瘤发展[43]. 有研究表明[44], SNORA28可直接调节结直肠癌细胞对放射治疗的敏感性, SNORA28可通过募集溴结构域蛋白4来增加白血病抑制因子受体(leukemia inhibitory factor receptor, LIFR)启动子中组蛋白H3K9乙酰化, 从而充当分子诱饵, 进而促进LIFR转录并激活Janus激酶1/信号转导和转录激活因子3通路.
转运RNA(transfer RNA, tRNA)是介导氨基酸与mRNA对应密码子配对的RNA分子, 通常由70至90个核苷酸组成. tRNA在翻译过程中发挥着关键作用, 负责将氨基酸运输到核糖体, 并按照mRNA的遗传密码合成蛋白质. tRNA衍生的片段有三种亚型: tRF-5、tRF-3和inter tRF[45]. tRF-5通常是由成熟tRNA的D环或臂区域或D环和反密码子环之间的手臂区域裂解形成的. tRF-3是由T环中的裂解产生的, 末端为三核苷酸CCA. Inter tRF, 也称为tRF-1, 起源于成熟tRNA的内部区域, 包括反密码子环以及D环和T环的一部分. 近年来的研究发现, tRNA不仅在蛋白质合成中起作用, 还可能参与基因表达调控、细胞周期控制及应激反应等生物学过程. Cheng等[46]通过对晚期结直肠癌患者的肿瘤组织及其癌旁组织, 晚期结直肠癌患者的血浆外泌体及正常健康人的血浆外泌体进行全转录组测序, 筛选出在组织与血浆外泌体中差异表达的tRFs, 接着使用独立样本进行验证, 确定候选tRFs-tRF-3022b. 细胞和动物实验表明, tRF-3022b能够促进结直肠癌的发生发展, tRF-3022b能够结合细胞因子半乳糖凝集素1和巨噬细胞迁移抑制因子, 调控肿瘤细胞增殖及M2巨噬细胞极化, 参与调控肿瘤微环境.
小核RNA(small nuclear RNA, snRNA)主要位于细胞核内, 是剪接复合物中的重要成分, 参与前体mRNA的剪接加工过程. snRNA与多个蛋白质相结合, 形snRNP参与剪接反应, 并调节RNA的加工和成熟[47]. snRNA不仅参与剪接, 还在RNA转运、表观遗传调控和细胞内信号转导等方面发挥作用. 研究表明[48], snRNA U1、U2等在结直肠癌患者的组织样本中呈现异常表达, 可能通过调控肿瘤相关基因的剪接和表达, 促进肠道肿瘤的发生和转移. 目前有关于snRNA的具体生物学功能还尚未明确, snRNA在细胞核内的功能改变可能影响细胞周期和增殖过程, 从而促进肿瘤的进展.
尽管结直肠癌的诊断和治疗技术在近年来取得了一定的进展, 现有的诊断手段和治疗方法仍然存在诸多局限, 严重影响了结直肠癌的早期发现、精确诊断和个性化治疗. 随着分子生物学研究的深入, ncRNA在结直肠癌的发生、发展和预后评估中越来越受到重视. 与现有诊断手段相比, 其因无创、稳定性好等优势广泛应用于结直肠癌早期诊断.
结直肠癌的早期诊断直接关系到患者的生存率. 结直肠癌的发展通常经历从腺瘤到癌症的漫长过程, 这一过程可能持续5至10年. 在此期间, 如果能够通过筛查早期发现病变, 患者的5年生存率可以超过95%, 甚至完全治愈. 然而, 一旦病情进展到晚期, 即便通过手术、化疗和放疗等综合治疗, 患者的5年生存率也不超过40%. 这种鲜明的对比充分显示了早期诊断的重要性. 据一项针对全球结直肠癌患者的调查显示, 早期诊断的患者平均生存时间比晚期诊断的患者延长了约7年.
其次, 早期诊断能够显著降低治疗成本和医疗资源的消耗. 早期结直肠癌通常可以通过内镜下微创手术进行治疗, 如内镜黏膜下剥离术, 这种治疗方法创伤小、恢复快、费用低. 而晚期结直肠癌则需要更为复杂和长期的治疗, 包括手术、化疗和放疗等, 不仅治疗费用高昂, 还占用大量的医疗资源. 据相关统计, 早期结直肠癌的治疗费用约为晚期治疗的30%至50%, 并且早期治疗的康复时间也明显缩短. 例如, 在美国, 早期结直肠癌的治疗费用平均为3万美元, 而晚期治疗费用则高达10万美元以上. 因此, 早期诊断不仅可以减轻患者的经济负担, 还能优化医疗资源的配置.
值得注意的是, 公众对结直肠癌早期筛查的意识亟待提高. 在我国, 大多数结直肠癌患者确诊时已是中晚期, 主要原因之一是缺乏定期筛查的意识. 欧美国家由于普及了结肠镜检查等筛查手段, 早期诊断率明显高于我国. 例如, 在美国, 结直肠癌的早期诊断率达到了60%以上, 而我国这一比例尚不足40%. 据统计, 在过去十年中, 美国通过普及结肠镜检查, 使结直肠癌的死亡率降低了约30%.
综上所述, 结直肠癌早期诊断的重要性不言而喻. 通过早期筛查和诊断, 不仅可以显著提高患者的生存率, 还能降低治疗成本和医疗资源消耗. 因此, 提高公众筛查意识, 普及结直肠癌早期诊断方法, 是结直肠癌防治工作的重中之重.
目前, 结直肠癌的主要诊断方法包括结肠镜检查、影像学检查和血液生物标志物检测等. 尽管这些手段在一定程度上能够帮助临床诊断, 但各自均存在不同的局限性, 特别是在早期筛查和精准诊断方面.
结肠镜检查是当前结直肠癌诊断的金标准, 可以直接观察结肠内部的病变, 能够有效地发现结肠癌及其前期病变如腺瘤[49]. 然而, 结肠镜检查具有一定的侵入性和不适感, 且患者依从性差, 部分患者可能因为心理因素或对疼痛的恐惧而回避检查. 此外, 结肠镜检查并不能完全避免误诊和漏诊的情况, 特别是在结肠癌的早期阶段, 病变较小或局限的病例可能被漏掉.
影像学检查, 包括电子计算机断层扫描(computed tomography, CT)、磁共振成像(magnetic resonance imaging, MRI)和正电子发射断层显像-电子计算机X射线断层扫描显像(positron emission tomography-computed tomography, PET-CT)等, 主要用于评估肿瘤的扩展情况和转移部位, 尽管这些方法能够提供较为直观的肿瘤信息, 但在早期癌症的发现方面, 其敏感度和特异性较差, 尤其是对于小型结肠癌的检测不够敏感[50]. CT和MRI对于一些局部病变的检测效果有限, 而PET-CT虽然在肿瘤筛查中具有较高的敏感性, 但其成本较高, 且并不适用于所有患者群体.
粪便隐血试验(fecal occult blood test, FOBT)是结直肠癌筛查中常用的非侵入性检测方法. 它通过检测粪便中的微量血液来推测肠道可能存在的病变. 尽管这种方法较为简便且无创, 但其灵敏度和特异性较低, 容易受到多种因素的干扰(如饮食、药物等), 且对于某些早期或微小的病变, FOBT的检测能力有限. 更为重要的是, FOBT无法区分肠道的良性病变和恶性肿瘤, 可能导致过多的假阳性和假阴性结果[51].
综上所述, 现有的结直肠癌诊断方法虽然在一定程度上能够辅助临床诊断, 但在灵敏度以及特异性等方面仍存在诸多不足. 因此, 需要不断探索和发展新的诊断技术和方法, 以提高诊断的准确性和早期发现率, 从而改善患者的治疗效果和生存质量.
ncRNA作为结直肠癌的生物标志物具有诸多优势: (1)稳定性和特异性. NcRNA(尤其是lncRNA和circRNA)因其分子结构的特殊性, 在体液中表现出较高的稳定性. circRNA的环状结构使其具有抵抗核糖核酸酶水解的能力, 从而在体液中表现出较高的稳定性. 相比之下, 线性RNA容易受到核糖核酸酶的水解, 稳定性较差. 而lncRNA由于其较长的序列和复杂的二级结构, 这使得它们在血液、尿液等生物样本中能够稳定存在, 便于检测. 这些特性使得ncRNA成为理想的癌症诊断标志物. 此外, 与传统的蛋白质标志物相比, 其能更准确地反映肿瘤的状态, 其组织特异性表达也使得诊断更具特异性. ncRNA在不同类型的组织和细胞中表达模式不同, 这种组织特异性表达使得ncRNA能够作为特定类型癌症的诊断标志物. 例如, miR-143只在腺瘤形成的早期阶段表达下调, 而不是在锯齿状病变进展期间表达下调, 这使得miR-143可作为肠道腺瘤特异性诊断标志物[52]. 这种组织特异性表达使得ncRNA在癌症诊断中具有较高的特异性和准确性; (2)敏感和早期诊断可能性. ncRNA在肠道肿瘤早期即可出现显著的表达变化, 这使得它们非常适合于结直肠癌的早期检测. 通过高灵敏度的检测方法, 如实时荧光定量核酸扩增检测系统, 可以在肠癌癌前病变阶段发现ncRNA的表达异常, 从而实现早期诊断.
ncRNA在结直肠癌早期诊断中的应用具有广泛的前景. 随着分子生物学技术和检测手段的不断发展, ncRNA有望成为消化道肿瘤早期诊断、预后评估和个体化治疗的重要工具. ncRNA不仅能够帮助检测肿瘤的生物学特征, 还能提供精准的分子信息, 推动精准医疗的发展. 然而, 尽管现有研究表明ncRNA具有巨大的潜力, 实际临床应用仍面临诸多挑战. 首先, ncRNA的检测方法尚未形成统一的标准, 未来需要建立更加标准化和规范化的操作流程, 以确保检测结果的准确性和可重复性. 其次, 单一的ncRNA可能不足以满足肠道肿瘤早期诊断的需要, 因此开展多种ncRNA联合检测, 并结合其他分子标志物, 提高灵敏度和特异性, 将成为未来研究的重要方向. 再者, 液体活检技术的优化和大规模的临床验证是推进ncRNA应用的关键步骤, 尤其是在提高液体活检中ncRNA检测的灵敏度和准确性方面, 仍需进一步探索.
综上所述, ncRNA检测技术在消化道肿瘤的早期诊断中具有较高的敏感性, 且能够与现有的传统检测方法相辅相成(表1), 以提高诊断的准确性和特异性.
| 检测方法 | 优点 | 缺点 |
| 结直肠镜 | 直观准确、创伤小恢复快、视野清晰操作精准、根治效果相当和适用范围广等 | 侵入性、局限性、并发症风险、繁琐的准备工作以及辐射风险等 |
| 影像检查 | 扫描速度快、覆盖范围广, 能够清晰显示肿瘤的位置、大小、浸润深度及远处转移情况, 有助于肿瘤分期和治疗方案的制定 | 对小病灶和化疗后病变的鉴别能力有限等 |
| 粪便隐血试验 | 简便快速、无痛性、成本低、敏感性高等 | 易受饮食和药物影响、特异性问题、无法定位出血部位、结果存在个体差异以及假阳性与假阴性等 |
| ncRNA液体活检 | 非侵入性、高敏感度和特异性、实时监测肿瘤进展和全面反映肿瘤异质性等 | 技术复杂性、标准化问题结果存在个体差异以及假阳性与假阴性等 |
结直肠癌的高发病率和高死亡率使其成为全球范围内亟需关注的重大公共卫生问题. 尤其是在中国, 随着经济发展和生活方式的变化, 结直肠癌的发病率呈现上升趋势, 如何有效进行早期筛查、早期诊断和治疗, 成为改善结直肠癌预后、减少死亡率的关键. 今年来, 随着分子生物学研究的深入以及相关技术手段的发展, 基于ncRNA检测的患者体液活检技术成为肿瘤诊断以及治疗的新热点. 其在早期诊断、预后评估和治疗反应监测中的潜力将为结直肠癌的个性化治疗提供新的思路, 弥补传统诊断手段的不足. 随着相关研究的深入, ncRNA有望成为结直肠癌精准医学中的重要组成部分, 推动结直肠癌诊疗水平的提高.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Dekker E, Tanis PJ, Vleugels JLA, Kasi PM, Wallace MB. Colorectal cancer. Lancet. 2019;394:1467-1480. [PubMed] [DOI] |
| 2. | Keum N, Giovannucci E. Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies. Nat Rev Gastroenterol Hepatol. 2019;16:713-732. [PubMed] [DOI] |
| 3. | Patel SG, Dominitz JA. Screening for Colorectal Cancer. Ann Intern Med. 2024;177:ITC49-ITC64. [PubMed] [DOI] |
| 4. | Nemeth K, Bayraktar R, Ferracin M, Calin GA. Non-coding RNAs in disease: from mechanisms to therapeutics. Nat Rev Genet. 2024;25:211-232. [PubMed] [DOI] |
| 5. | Chen B, Dragomir MP, Yang C, Li Q, Horst D, Calin GA. Targeting non-coding RNAs to overcome cancer therapy resistance. Signal Transduct Target Ther. 2022;7:121. [PubMed] [DOI] |
| 6. | Gebert LFR, MacRae IJ. Regulation of microRNA function in animals. Nat Rev Mol Cell Biol. 2019;20:21-37. [PubMed] [DOI] |
| 7. | Budakoti M, Panwar AS, Molpa D, Singh RK, Büsselberg D, Mishra AP, Coutinho HDM, Nigam M. Micro-RNA: The darkhorse of cancer. Cell Signal. 2021;83:109995. [PubMed] [DOI] |
| 8. | Shang R, Lee S, Senavirathne G, Lai EC. microRNAs in action: biogenesis, function and regulation. Nat Rev Genet. 2023;24:816-833. [PubMed] [DOI] |
| 9. | Kara G, Calin GA, Ozpolat B. RNAi-based therapeutics and tumor targeted delivery in cancer. Adv Drug Deliv Rev. 2022;182:114113. [PubMed] [DOI] |
| 10. | Fan Z, Wu C, Chen M, Jiang Y, Wu Y, Mao R, Fan Y. The generation of PD-L1 and PD-L2 in cancer cells: From nuclear chromatin reorganization to extracellular presentation. Acta Pharm Sin B. 2022;12:1041-1053. [PubMed] [DOI] |
| 11. | Menon A, Abd-Aziz N, Khalid K, Poh CL, Naidu R. miRNA: A Promising Therapeutic Target in Cancer. Int J Mol Sci. 2022;23:11502. [PubMed] [DOI] |
| 12. | Ma Y, Qin C, Li L, Miao R, Jing C, Cui X. MicroRNA-21 promotes cell proliferation by targeting tumor suppressor TET1 in colorectal cancer. Int J Clin Exp Pathol. 2018;11:1439-1445. [PubMed] |
| 13. | Wu Y, Song Y, Xiong Y, Wang X, Xu K, Han B, Bai Y, Li L, Zhang Y, Zhou L. MicroRNA-21 (Mir-21) Promotes Cell Growth and Invasion by Repressing Tumor Suppressor PTEN in Colorectal Cancer. Cell Physiol Biochem. 2017;43:945-958. [PubMed] [DOI] |
| 14. | Bullock MD, Pickard KM, Nielsen BS, Sayan AE, Jenei V, Mellone M, Mitter R, Primrose JN, Thomas GJ, Packham GK, Mirnezami AH. Pleiotropic actions of miR-21 highlight the critical role of deregulated stromal microRNAs during colorectal cancer progression. Cell Death Dis. 2013;4:e684. [PubMed] [DOI] |
| 15. | Chen E, Li Q, Wang H, Yang F, Min L, Yang J. MiR-92a promotes tumorigenesis of colorectal cancer, a transcriptomic and functional based study. Biomed Pharmacother. 2018;106:1370-1377. [PubMed] [DOI] |
| 16. | Choi HH, Cho YS, Choi JH, Kim HK, Kim SS, Chae HS. Stool-Based miR-92a and miR-144* as Noninvasive Biomarkers for Colorectal Cancer Screening. Oncology. 2019;97:173-179. [PubMed] [DOI] |
| 17. | Kanaan Z, Rai SN, Eichenberger MR, Roberts H, Keskey B, Pan J, Galandiuk S. Plasma miR-21: a potential diagnostic marker of colorectal cancer. Ann Surg. 2012;256:544-551. [PubMed] [DOI] |
| 18. | Li L, Wang A, Cai M, Tong M, Chen F, Huang L. Identification of stool miR-135b-5p as a non-invasive diaognostic biomarker in later tumor stage of colorectal cancer. Life Sci. 2020;260:118417. [PubMed] [DOI] |
| 19. | Karimi L, Zeinali T, Hosseinahli N, Mansoori B, Mohammadi A, Yousefi M, Asadi M, Sadreddini S, Baradaran B, Shanehbandi D. miRNA-143 replacement therapy harnesses the proliferation and migration of colorectal cancer cells in vitro. J Cell Physiol. 2019;234:21359-21368. [PubMed] [DOI] |
| 20. | Jahangiri B, Khalaj-Kondori M, Asadollahi E, Purrafee Dizaj L, Sadeghizadeh M. MSC-Derived exosomes suppress colorectal cancer cell proliferation and metastasis via miR-100/mTOR/miR-143 pathway. Int J Pharm. 2022;627:122214. [PubMed] [DOI] |
| 21. | Wu S, Yuan W, Luo W, Nie K, Wu X, Meng X, Shen Z, Wang X. miR-126 downregulates CXCL12 expression in intestinal epithelial cells to suppress the recruitment and function of macrophages and tumorigenesis in a murine model of colitis-associated colorectal cancer. Mol Oncol. 2022;16:3465-3489. [PubMed] [DOI] |
| 22. | Li S, Wu X, Xu Y, Wu S, Li Z, Chen R, Huang N, Zhu Z, Xu X. miR-145 suppresses colorectal cancer cell migration and invasion by targeting an ETS-related gene. Oncol Rep. 2016;36:1917-1926. [PubMed] [DOI] |
| 23. | Liu Z, Ji M, Jin F, Jiang F, Liu X. Expression and clinical significance of miR-17-5p in tumor tissues of patients with colorectal cancer. J Gastrointest Oncol. 2022;13:3067-3079. [PubMed] [DOI] |
| 24. | Saberinia A, Alinezhad A, Jafari F, Soltany S, Akhavan Sigari R. Oncogenic miRNAs and target therapies in colorectal cancer. Clin Chim Acta. 2020;508:77-91. [PubMed] [DOI] |
| 25. | Herman AB, Tsitsipatis D, Gorospe M. Integrated lncRNA function upon genomic and epigenomic regulation. Mol Cell. 2022;82:2252-2266. [PubMed] [DOI] |
| 26. | Tan YT, Lin JF, Li T, Li JJ, Xu RH, Ju HQ. LncRNA-mediated posttranslational modifications and reprogramming of energy metabolism in cancer. Cancer Commun (Lond). 2021;41:109-120. [PubMed] [DOI] |
| 27. | Liu B, Liu Q, Pan S, Huang Y, Qi Y, Li S, Xiao Y, Jia L. The HOTAIR/miR-214/ST6GAL1 crosstalk modulates colorectal cancer procession through mediating sialylated c-Met via JAK2/STAT3 cascade. J Exp Clin Cancer Res. 2019;38:455. [PubMed] [DOI] |
| 28. | Kogo R, Shimamura T, Mimori K, Kawahara K, Imoto S, Sudo T, Tanaka F, Shibata K, Suzuki A, Komune S, Miyano S, Mori M. Long noncoding RNA HOTAIR regulates polycomb-dependent chromatin modification and is associated with poor prognosis in colorectal cancers. Cancer Res. 2011;71:6320-6326. [PubMed] [DOI] |
| 29. | Wang H, Zhu Y, Chen H, Yang N, Wang X, Li B, Ying P, He H, Cai Y, Zhang M, Niu S, Li Y, Lu Z, Peng X, Zou D, Zhong R, Chang J, Dai M, Tian J, Miao X. Colorectal cancer risk variant rs7017386 modulates two oncogenic lncRNAs expression via ATF1-mediated long-range chromatin loop. Cancer Lett. 2021;518:140-151. [PubMed] [DOI] |
| 30. | Zhou WY, Cai ZR, Liu J, Wang DS, Ju HQ, Xu RH. Circular RNA: metabolism, functions and interactions with proteins. Mol Cancer. 2020;19:172. [PubMed] [DOI] |
| 31. | Zhu G, Chang X, Kang Y, Zhao X, Tang X, Ma C, Fu S. CircRNA: A novel potential strategy to treat thyroid cancer (Review). Int J Mol Med. 2021;48:201. [PubMed] [DOI] |
| 32. | Neumann DP, Goodall GJ, Gregory PA. Regulation of splicing and circularisation of RNA in epithelial mesenchymal plasticity. Semin Cell Dev Biol. 2018;75:50-60. [PubMed] [DOI] |
| 33. | Luo XJ, Zhao Q, Liu J, Zheng JB, Qiu MZ, Ju HQ, Xu RH. Novel Genetic and Epigenetic Biomarkers of Prognostic and Predictive Significance in Stage II/III Colorectal Cancer. Mol Ther. 2021;29:587-596. [PubMed] [DOI] |
| 34. | Guo Y, Guo Y, Chen C, Fan D, Wu X, Zhao L, Shao B, Sun Z, Ji Z. Circ3823 contributes to growth, metastasis and angiogenesis of colorectal cancer: involvement of miR-30c-5p/TCF7 axis. Mol Cancer. 2021;20:93. [PubMed] [DOI] |
| 35. | Xu H, Liu Y, Cheng P, Wang C, Liu Y, Zhou W, Xu Y, Ji G. CircRNA_0000392 promotes colorectal cancer progression through the miR-193a-5p/PIK3R3/AKT axis. J Exp Clin Cancer Res. 2020;39:283. [PubMed] [DOI] |
| 36. | Chen J, Wu Y, Luo X, Jin D, Zhou W, Ju Z, Wang D, Meng Q, Wang H, Fu X, Xu J, Song Z. Circular RNA circRHOBTB3 represses metastasis by regulating the HuR-mediated mRNA stability of PTBP1 in colorectal cancer. Theranostics. 2021;11:7507-7526. [PubMed] [DOI] |
| 37. | Li Q, Wang Y, Wu S, Zhou Z, Ding X, Shi R, Thorne RF, Zhang XD, Hu W, Wu M. CircACC1 Regulates Assembly and Activation of AMPK Complex under Metabolic Stress. Cell Metab. 2019;30:157-173.e7. [PubMed] [DOI] |
| 38. | Liu Z, Wang Q, Wang X, Xu Z, Wei X, Li J. Circular RNA cIARS regulates ferroptosis in HCC cells through interacting with RNA binding protein ALKBH5. Cell Death Discov. 2020;6:72. [PubMed] [DOI] |
| 39. | Wang X, Ramat A, Simonelig M, Liu MF. Emerging roles and functional mechanisms of PIWI-interacting RNAs. Nat Rev Mol Cell Biol. 2023;24:123-141. [PubMed] [DOI] |
| 40. | Chu H, Xia L, Qiu X, Gu D, Zhu L, Jin J, Hui G, Hua Q, Du M, Tong N, Chen J, Zhang Z, Wang M. Genetic variants in noncoding PIWI-interacting RNA and colorectal cancer risk. Cancer. 2015;121:2044-2052. [PubMed] [DOI] |
| 41. | Yin J, Jiang XY, Qi W, Ji CG, Xie XL, Zhang DX, Cui ZJ, Wang CK, Bai Y, Wang J, Jiang HQ. piR-823 contributes to colorectal tumorigenesis by enhancing the transcriptional activity of HSF1. Cancer Sci. 2017;108:1746-1756. [PubMed] [DOI] |
| 42. | Ramanathan M, Porter DF, Khavari PA. Methods to study RNA-protein interactions. Nat Methods. 2019;16:225-234. [PubMed] [DOI] |
| 43. | Xu C, Bian Z, Wang X, Niu N, Liu L, Xiao Y, Zhu J, Huang N, Zhang Y, Chen Y, Wu Q, Sun F, Zhu X, Pan Q. SNORA56-mediated pseudouridylation of 28 S rRNA inhibits ferroptosis and promotes colorectal cancer proliferation by enhancing GCLC translation. J Exp Clin Cancer Res. 2023;42:331. [PubMed] [DOI] |
| 44. | Liu X, Zhang H, Fan Y, Cai D, Lei R, Wang Q, Li Y, Shen L, Gu Y, Zhang Q, Qi Z, Wang Z. SNORA28 Promotes Proliferation and Radioresistance in Colorectal Cancer Cells through the STAT3 Pathway by Increasing H3K9 Acetylation in the LIFR Promoter. Adv Sci (Weinh). 2024;11:e2405332. [PubMed] [DOI] |
| 45. | Wang Y, Tao EW, Tan J, Gao QY, Chen YX, Fang JY. tRNA modifications: insights into their role in human cancers. Trends Cell Biol. 2023;33:1035-1048. [PubMed] [DOI] |
| 46. | Lu S, Wei X, Tao L, Dong D, Hu W, Zhang Q, Tao Y, Yu C, Sun D, Cheng H. A novel tRNA-derived fragment tRF-3022b modulates cell apoptosis and M2 macrophage polarization via binding to cytokines in colorectal cancer. J Hematol Oncol. 2022;15:176. [PubMed] [DOI] |
| 47. | Gonçalves M, Santos JI, Coutinho MF, Matos L, Alves S. Development of Engineered-U1 snRNA Therapies: Current Status. Int J Mol Sci. 2023;24. [PubMed] [DOI] |
| 48. | Xu T, Li X, Zhao W, Wang X, Jin L, Feng Z, Li H, Zhang M, Tian Y, Hu G, Yue Y, Dai X, Shan C, Zhang W, Zhang C, Zhang Y. SF3B3-regulated mTOR alternative splicing promotes colorectal cancer progression and metastasis. J Exp Clin Cancer Res. 2024;43:126. [PubMed] [DOI] |
| 52. | Ardila HJ, Sanabria-Salas MC, Meneses X, Rios R, Huertas-Salgado A, Serrano ML. Circulating miR-141-3p, miR-143-3p and miR-200c-3p are differentially expressed in colorectal cancer and advanced adenomas. Mol Clin Oncol. 2019;11:201-207. [PubMed] [DOI] |